Introducción
Este estudio fue originado por un caso que se presentó en el laboratorio de análisis químico instrumental, CROMMASS, de la Universidad Industrial de Santander, que desarrolla su labor científica enfocada en tres ejes misionales: docencia, investigación y extensión. Asesorías técnicas, servicios de análisis, la investigación científica básica y aplicada, son actividades inherentes de la universidad para la solución de diversos problemas técnicos, económicos y sociales, entre ellos, los relacionados con la salud pública. El Laboratorio desarrolla la investigación en las áreas de análisis ambiental, alimentos, toxicológico y del estudio de la calidad de productos de consumo humano, entre otras. Proteger al consumidor por medio del conocimiento científico sobre los productos que consume y garantizar el cumplimiento de su calidad, inocuidad y la debida transparencia en cuanto al contenido e identidad de sus ingredientes, comprende realizar varios estudios fisicoquímicos, microbiológicos, toxicológicos y sobre la composición química de sus ingredientes. Esta última se determina usando una combinación de diversas técnicas de preparación de la muestra y de su análisis instrumental.
En febrero del 2018 llegó al Laboratorio una solicitud de análisis de una ciudadana que indagaba sobre un producto comercial, denominado fitoterapéutico a base de flor seca de caléndula (Calendula officinalis) (PFC), según ella, adquirido en una farmacia local y recomendado por un médico especialista. El motivo para solicitar este análisis fue la reacción adversa que ella había experimentado (fuertes dolores de estómago y de cabeza, un malestar general e hinchazón), después de ingerir varias tabletas del PFC. La paciente tomaba este producto para aliviar dolores musculares y de articulaciones. En la caja del producto se anunciaba que este actuaba de manera 100% natural, contenía 150 mg de extracto seco de caléndula (Calendula officinalis) y que se podía tomar hasta tres tabletas diarias.
En Colombia, el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima), responsable de la vigilancia sanitaria de productos de tanto impacto en la salud pública como los alimentos, medicamentos e insumos, define un producto fitoterapéutico como “producto medicinal empacado y etiquetado, cuyas sustancias activas provienen del material de una planta medicinal o sus asociaciones, presentado en estado bruto o en forma farmacéutica, y que se utiliza con fines terapéuticos” 1.
La etiqueta del PFC indica que su uso fitoterapéutico es como anti-inflamatorio. Esta es una de muchas actividades biológicas que se atribuyen a la caléndula popularmente, lo que ha motivado investigaciones para verificarla con ensayos confiables y para hallar las sustancias responsables de esta actividad. Ésteres del faradiol, un triterpenoide, se han identificado como los compuestos activos más relevantes en el uso tópico del extracto de caléndula como anti-inflamatorio 2. Una combinación de técnicas cromatográficas ha permitido aislar con relativamente alta pureza (>96%) estas sustancias 3. Ukiya, et al. 4 identificaron varios triterpenos y flavonoles en el extracto de flores de caléndula y probaron su capacidad de inhibición de la inflamación causada en orejas de ratón, por el acetato de 12-O-tetradecanoilforbol. Los resultados mostraron que ocho triterpenos tipo oleanano fueron activos como anti-inflamatorios. Posteriormente, experimentos en los que se administró oralmente extracto de caléndula a ratones, mostraron que el mecanismo de la actividad anti-inflamatoria puede deberse a la inhibición de citoquinas proinflamatorias y de Cox-2 en el bazo de los ratones 5.
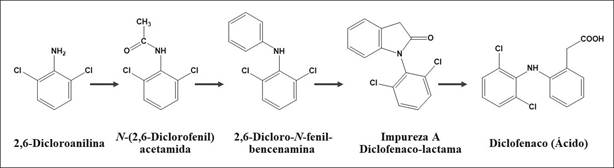
Se realizó, preliminarmente, una extracción con solvente de una tableta del PFC entregado, y el extracto obtenido se analizó por cromatografía de gases acoplada a espectrometría de masas (GC/MS). Los resultados mostraron sorpresivamente la presencia de diclofenaco (DCF) -un antiinflamatorio no esteroideo del grupo de los AINES 6, producto de síntesis 7-, junto con algunos de sus derivados e impurezas; para su identificación, inicialmente, se usó un patrón analítico de DCF. La presencia del DCF, un compuesto sintético, no fue advertida en la etiqueta de la caja del PFC.
A raíz de este hallazgo, surgió la pregunta de investigación: ¿Es la muestra de PFC traída a CROMMASS un caso particular, o también se encuentra DCF en otras muestras de este PFC disponibles regularmente en el comercio? Se decidió profundizar en la investigación y adquirir varias cajas de este producto en el mercado local para confirmar o descartar la presencia de diclofenaco. Se compraron ocho cajas del PFC en la ciudad de Bucaramanga (Colombia), en diferentes establecimientos (farmacias o droguerías) legalmente constituidos. Para determinaciones químicas se usó la combinación de varias técnicas de extracción y de análisis por cromatografía (TLC, GC, LC) y espectrometría de masas (MS). Los resultados confirmaron la presencia de DCF (ca. 40 - 42 mg por tableta) en todas las tabletas analizadas (> 70, ca. 30%), escogidas al azar de las ocho cajas del PFC de cuatro lotes diferentes de producción (2017 y 2018) indicados en sus etiquetas. En este trabajo, se describe la estrategia analítica empleada y los resultados obtenidos sobre el análisis del PFC comercializado en Bucaramanga (Colombia).
Materiales y métodos
Obtención del material de estudio. Ocho cajas con 30 tabletas en cada una del producto fitoterapéutico a base caléndula (Calendula officinalis) fueron adquiridas en febrero y marzo del 2018, en establecimientos comerciales legalmente constituidos. En la Tabla 1, aparecen los detalles de los productos adquiridos: cuatro de ellos, correspondían a tres lotes diferentes, según las etiquetas de la caja, y fueron fabricados, respectivamente, en marzo (1 caja), noviembre (1 caja) y diciembre (2 cajas) de 2017, mientras que otros cuatro productos comerciales pertenecían al mismo lote de producción de enero de 2018.
En la Tabla 1, aparecen los lugares comerciales identificados, según sus coordenadas geográficas (Google Earth), junto con la información sobre la hora y la fecha de cada adquisición. El traslado del producto fitoterapéutico al laboratorio y su ingreso siguieron las normas del SGC basadas en ISO 9001 e ISO/IEC 17025 8, en las recomendaciones de Buenas Prácticas de Laboratorio (GLP) 9 y los protocolos generales 10), (11 de la cadena de custodia (registros fotográficos y documentales) para salvaguardar la identidad y la integridad de las muestras antes de la extracción, durante su análisis y posterior almacenamiento. Un código interno del Laboratorio fue asignado a cada caja del PFC (Tabla 1). Todos los experimentos se llevaron a cabo -por lo menos- por duplicado, algunas extracciones de tabletas de la misma caja fueron realizadas por diferentes analistas y en diferentes días y meses, para confirmar la reproducibilidad de los análisis.
Tabla 1 Producto fitoterapéutico a base de caléndula (Calendula officinalis) adquirido en establecimientos comerciales de Bucaramanga (Colombia).
| N° | Código interno asignado al producto | Fecha de fabricación del producto | Hora y fecha de adquisición del producto | Coordenadas geográficas del lugar de adquisición |
|---|---|---|---|---|
| 1 | 1-01-F333-17 | Marzo 2017 | 10:00, 22 de febrero, 2018 | 7°06’58.6”N 73°06’40.0”W |
| 2 | 2-01-F460-17 | Noviembre 2017 | 11:40, 5 de marzo, 2018 | 7°07’38.6”N 73°06’47.2”W |
| 3 | 3-01-F463-17 | Diciembre 2017 | 10:58, 5 de marzo, 2018 | 7°08’03.3”N 73°07’04.2”W |
| 4 | 4-02-F463-17 | Diciembre 2017 | 11:18, 5 de marzo, 2018 | 7°07’41.5”N 73°06’47.7”W |
| 5 | 5-01-F500-18 | Enero 2018 | 11:14, 25 de febrero, 2018 | 7°08’01.6”N 73°07’24.8”W |
| 6 | 6-02-F500-18 | Enero 2018 | 11:54, 5 de marzo, 2018 | 7°07’18.8”N 73°06’43.6”W |
| 7 | 7-03-F500-18 | Enero 2018 | 11:30, 5 de marzo, 2018 | 7°07’40.3”N 73°06’52.9”W |
| 8 | 8-04-F500-18 | Enero 2018 | 11:51, 5 de marzo, 2018 | 7°07’18.5”N 73°06’43.4”W |
El procedimiento general siguió los pasos que se describen en la Figura 1. Se realizó la cromatografía en capa delgada (TLC) de las muestras (como técnica preliminar o de screening), cuyos resultados revelaron la presencia de DCF en el producto, pero requerían la confirmación. Los análisis de compuestos volátiles y volatilizables (50 °C) y de los extractos obtenidos con solventes orgánicos a partir tabletas pulverizadas del PFC se llevaron a cabo por diferentes técnicas: las fracciones volátiles y los extractos en CH2Cl2 se analizaron por GC/MS y los extractos, obtenidos con MeOH:H2O (1:1, v/v), por cromatografía líquida de alta eficiencia (HPLC) con detector de arreglo de diodos (DAD) y de ultra-alta eficiencia (UHPLC) con detector de masas de alta resolución (HRMS). Los analizadores de masas de tiempo de vuelo (HRTOF-MS) y Orbitrap, se usaron para medir masas exactas de iones-producto en los espectros MS y de moléculas protonadas (e.g., DCF y sus impurezas) para confirmar sus composiciones elementales. El material de referencia certificado (CRM) se usó para realizar calibraciones y para cuantificar DCF por HPLC-DAD y por UHPLC-ESI+-HRMS-Orbitrap.
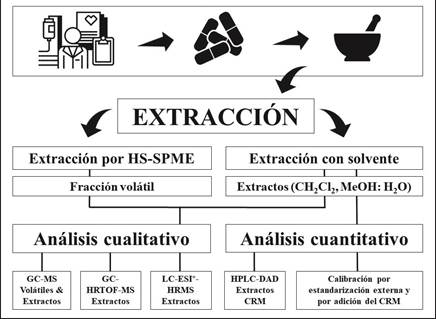
Figura 1 Esquema general de las etapas de la adquisición del producto fitoterapéutico a base de caléndula (Calendula officinalis), la preparación de la muestra, las extracciones (HS-SPME y con solventes orgánicos) y los análisis de fracciones volátiles y extractos por diferentes técnicas de cromatografía de gases (GC), líquida (LC) y espectrometría de masas de baja y alta resolución (MS y HRMS).
Análisis de compuestos volátiles por cromatografía de gases con detector de espectrometría de masas (GC/MS-I). La extracción de compuestos volátiles presentes en tabletas del PFC se llevó a cabo por la técnica SPME (SPME, Manual holder, lote 67628, Supelco Analytical, Bellefonte, PA, EE. UU.) en modo de extracción en espacio de cabeza (HS). Se tomó una tableta del PFC de cada lote (peso de tableta: 590 ± 29 mg, n = 16) y se homogeneizó en un mortero hasta pulverizar. El homogeneizado se transfirió inmediatamente a un frasco ámbar de 4 mL con tapa rosca y septum para el análisis por HS-SPME. Para alcanzar el equilibrio térmico, el frasco con la muestra se calentó a 50 °C en una plancha de calentamiento (HEI-STANDAR, Heidolph, Schwabach, Alemania) por 10 min, usando un soporte Manual SPME Sampling Stand de Supelco. Una fibra de SPME (Supelco Analytical, Bellefonte, PA, EE. UU., lote 96730), recubierta con PDMS-DVB (grosor, 65 μm) se expuso por 30 min al espacio de cabeza de la muestra a 50 °C. Después la fibra del dispositivo SPME -con compuestos adsorbidos- se introdujo al puerto de inyección del equipo GC-MS, en donde los analitos se desorbieron térmicamente durante 10 min. La inyección de la fibra SPME fue en modo manual, con la relación split 1:30, a 250 °C. Para cada nuevo experimento -antes de la extracción SPME-, la fibra se acondicionó, según las recomendaciones del fabricante.
El análisis de sustancias desorbidas térmicamente de la fibra SPME, se llevó a cabo en un cromatógrafo de gases GC AT 7890A (Agilent Technologies, Palo Alto, CA, EE. UU.), acoplado a un detector selectivo de masas (AT, MSD 5975C), operado en modo de barrido completo de radiofrecuencia (full scan) de un cuadrupolo (150 °C), en un intervalo de masas m/z 30 - 400 u. Las moléculas se ionizaron por impacto de electrones (EI) de 70 eV de energía promedio (corriente de electrones 35 µA), a 230 °C. Los componentes de la fracción volátil se separaron en una columna cromatográfica capilar de sílice fundida DB-WAX [poli (etilenglicol) (PEG)] de 60 m (L) x 0,25 mm (D.I.) x 0,25 μm (df) (J&W Scientific, Folsom, CA, EE. UU.). La temperatura de la columna se programó de 45 °C (6 min) a 80 °C @ 4 °C/min y, luego, hasta 230 °C @ 10 °C/min. La línea de transferencia se mantuvo a 230 °C. El gas de arrastre fue helio (99,995%, Linde, Bucaramanga, Colombia) y su flujo se mantuvo constante, a 1 mL min-1. El análisis por GC/MS se realizó usando el software MSD ChemStation (AT), versión E.02.00.1431.
Análisis de extractos por cromatografía de gases con detector de espectrometría de masas (GC/MS-II). Se analizaron dos grupos de muestras. (1) El primer grupo estuvo constituido por ocho muestras, obtenidas a partir de cinco tabletas, aleatoriamente seleccionadas de cada caja del PFC; las tabletas se homogeneizaron por pulverización en un mortero y se almacenaron en una bolsa sellable durante cuatro meses. (2) El segundo grupo fue conformado por ocho muestras de dos tabletas, escogidas al azar de cada caja del PFC, que se homogeneizaron y se analizaron inmediatamente después de su pulverización. Al homogeneizado de cada muestra, se le realizó una extracción sólido-líquido usando CH2Cl2 o MeOH:H2O (1:1 v/v) como solvente. La muestra pulverizada (25,2 ± 0,4 mg) se depositó en un tubo Eppendorf de 1 mL, y se adicionó el solvente orgánico (1 mL). El tubo Eppendorf con la mezcla se agitó (1800 rpm, 30 s), se llevó a ultrasonido (10 min) y se centrifugó por 5 min. Luego, se tomó el sobrenadante y se depositó en un frasco de cromatografía de 1,5 mL para su análisis por GC/MS.
Los análisis de los extractos obtenidos con solvente (CH2Cl2) del PFC, se llevaron a cabo en un cromatógrafo de gases GC AT 6890 Series Plus (Agilent Technologies, Palo Alto, CA, EE. UU.), acoplado a un detector selectivo de masas MSD (AT, MSD 5973), operado en modo de barrido completo de radiofrecuencia (full scan) en un cuadrupolo, en el rango de masas m/z 35 - 550 u, y también en modo SIM [monitoreo de ion(es) seleccionado(s)]; en ambos casos, se usó la ionización por impacto de electrones (EI, 70 eV, 35 µA, 250 °C). Para la detección de DCF por GC/ MS/SIM se seleccionaron tres iones característicos en m/z 295 (M+.), 242 [(M - H2O) - Cl)]+ y m/z 214 [(M - H2O) - Cl - CO)]+., separados por un filtro de masas cuadrupolar mantenido a 150 °C. Se usó una columna cromatográfica capilar de sílice fundida DB-5MS (J&W Scientific, Folsom, CA, EE. UU.) [5%-fenil-poli(metilsiloxano) (PDMS)] de 60 m (L) x 0,25 mm (D.I.) x 0,25 µm (df). El modo de inyección fue splitless; la temperatura del inyector se mantuvo a 250 °C, mientras que las temperaturas de la cámara de ionización y de la línea de transferencia, a 250 °C y a 280 °C, respectivamente; se usó helio (99,995%, Linde, Bucaramanga, Colombia) como gas de arrastre con un flujo volumétrico constante de 1 mL min-1; el volumen de inyección fue Viny = 2 µL. Entre cada muestra, se analizaban los blancos de dos solventes y el lavado de la jeringa del inyector fue profuso (siete veces con MeOH). El análisis por GC/ MS se realizó usando el software MSD ChemStation (AT), versión E.01.00.237.
Análisis de extractos por cromatografía líquida con detector de arreglo de diodos, HPLC-DAD, y de espectrometría de masas, LC/MS (UHPLC-ESI+HRMS-Orbitrap). 5 mg de la muestra de tabletas del PFC pulverizadas se depositaron en un tubo Eppendorf de 15 mL, y se agregó una solución MeOH:H2O (5 mL, 1:1 v/v). La mezcla se agitó (1800 rpm, 30 s), se llevó a ultrasonido (10 min) y se centrifugó por 5 min. Una alícuota de 15 µL del extracto se aforó a 5 mL con MeOH:H2O. A partir de la solución preparada, 200 µL fueron diluidos nuevamente con una solución MeOH:H2O (1 mL); el extracto diluido se pasó por filtro de PVDF (0,22 µm) antes de su análisis por HPLC. Cada muestra se preparó por duplicado para su análisis por LC/MS (UHPLC-ESI+-HRMS-Orbitrap).
Para el análisis por HPLC-DAD de extractos metanólicos de tabletas del PFC, se usó un cromatógrafo líquido HPLC Agilent Technologies 1260 Infinity (AT, Palo Alto, CA, EE. UU.) con detector UV-Vis de arreglo de diodos (DAD), a una longitud de onda de λ = 274 nm. La columna empleada en el análisis fue Kinetex (C18) (Phenomenex, Torrance, CA, EE. UU.) de 100 mm (L) x 4,6 mm (D.I.) x 2,6 µm (tamaño de partícula). La inyección se realizó en modo automático (Viny = 20 µL), el régimen fue isocrático bajo una relación de 50:50 [ácido fórmico (FA) al 0,5% (v/v) en agua:acetonitrilo] por 10 min, con un flujo de la fase móvil de 1 mL min1. Durante el análisis, la columna se mantuvo a 30 °C. El diclofenaco fue detectado a una longitud de onda λ = 274 nm, se usó una longitud de onda de referencia de λ = 380 (10) nm. Los datos obtenidos se analizaron con el software ChemStation Edition for LC & LC/MS Systems, Rev. C.01.05 [35] (Agilent Technologies, AT 2001 - 2013).
Los extractos de tabletas del PFC, obtenidos con MeOH:H2O, se analizaron en un cromatógrafo líquido de ultra-alta eficiencia (UHPLC), Dionex TM UltiMate TM 3000 (Thermo Scientific, Germering, Alemania), equipado con una unidad de desgasificación, una bomba binaria de gradiente, un inyector automático (automuestrador, a 10 °C) con bandejas de 120 viales y un compartimiento para albergar columna bajo control de temperatura (T = 30 °C). La separación cromatográfica se realizó en una columna Hypersil GOLD aQ (Thermo Scientific, Sunnyvale, CA, EE. UU.) de 100 mm (L) x 2,1 mm (D.I.) x 1,9 µm (tamaño de partícula) antecedida por una columna de guardia Accucore aQ Defender (Thermo Scientific, San Diego, CA, EE. UU.) de 10 mm (L) x 2,1 mm (D.I.) x 2,6 µm de tamaño de partícula. La fase móvil fue FA al 0,2% en agua (A) y FA al 0,2 % en MeOH (B). El flujo de la fase móvil fue 300 µL min-1 y el volumen de inyección Viny = 2 µL. La condición de gradiente fue 100% de A, que cambió linealmente en 8 min a 100% de B, se mantuvo durante 4 min, luego regresó a 100% de A en 1 min y se mantuvo durante 3 min. El cromatógrafo UHPLC estaba acoplado a un espectrómetro de masas de alta resolución Orbitrap TM (Exactive Plus, Thermo Scientific, Bremen, Alemania) con una fuente de ionización por electronebulización con calentamiento (HESI-II) a 350 °C, operada en modo de registro de iones positivos. El gas nitrógeno (N2 > 99%), usado como gas nebulizador, gas de cortina, gas auxiliar y gas de colisiones en la celda de disociación por colisiones activadas de alta energía (HCD), se obtuvo en el generador NM32LA (Peak Scientific, Escocia, Reino Unido). La temperatura del capilar fue 320 °C y el voltaje del nebulizador Vcap se fijó en +3,5 kV. La resolución del Orbitrap-MS en el modo de adquisición full scan (full MS) se estableció en 70000 (RFWHM, m/z 200 u). Los espectros MS se adquirieron en un intervalo de masas de m/z 80 - 1000 u. Las moléculas protonadas [M + H]+ se fragmentaron en una celda de disociación por colisiones activadas de alta energía (HCD) con diferentes voltajes mantenidos en 10, 20 o 30 V; se usó el nitrógeno N2 como gas de colisiones. La calibración del instrumento se realizaba semanalmente con una solución Pierce LTQ Velos ESI para iones positivos (Thermo Scientific, Rockford, IL, EE. UU.). La adquisición de datos se realizó en modos full MS y stepped-scan para cada voltaje en la celda HCD. Los datos obtenidos se procesaron utilizando un software Thermo XCalibur TM , versión 3.1.66.10 (Thermo Scientific, San José, CA, EE. UU.).
Identificación de sustancias. Para la identificación de las sustancias en las fracciones volátiles y en los extractos obtenidos del PFC, se usaron los siguientes cinco criterios: (1) comparación de los espectros MS experimentales (EI, 70 eV) con los de las bases de datos NIST-2017, Willey08 o Adams 12), (13, con un grado de coincidencia entre los espectros MS experimentales y los de las bases de datos superior al 90%; (2) estudio de patrones de fragmentación de sustancias en los espectros obtenidos por EI (70 eV) 14), (15), (16 y por ESI+, usando la celda HCD; (3) análisis elemental (determinación de masas exactas con un error de medición Δ ppm ≈ 1 de los iones-producto (GC/HRMS, LC/HRMS) y de las moléculas protonadas [M + H]+ (LC/HRMS), junto con el análisis de relaciones isotópicas de iones; (4) comparación de los tiempos de retención, tR, de sustancias en cromatogramas obtenidos por GC, HPLC-DAD o UHPLC/MS con los de los materiales de referencia disponibles, así como la determinación de los índices de retención lineales (LRI) para terpenos y su comparación con los de la literatura 12), (17), (18), (19), (20; para la determinación de los LRI se empleó una mezcla de parafinas lineales C8 - C40 adquiridas a AccuStandard, Inc. (New Haven, CT, EE. UU.); (5) uso de sustanciaspatrón (limoneno, carvona, anetol, hidrocarburos lineales, ácidos grasos y sus ésteres metílicos) y del material de referencia certificado (CRM) de DCF para su identificación confirmatoria y cuantificación.
Las masas exactas de los iones en los espectros MS de DCF y de sus análogos o impurezas se midieron en un cromatógrafo de gases GC AT 7890 B GC-System (AT, Palo Alto, CA, EE.UU.), acoplado a un MS de alta resolución HRMS LECO Pegasus GC-HRT 4D (Leco Corporation, Saint Joseph, MI, EE. UU.), provisto de un analizador de masas de tiempo de vuelo (HRTOFMS) con varios reflectrones y la resolución Rs = 40000. Se usó una columna cromatográfica capilar de sílice fundida HP-1 (AT, Palo Alto, CA, EE. UU.) de 100%PDMS de 100 m (L) x 0,25 mm (D.I.) x 0,25 µm (df). La inyección de muestras se realizó en modo split (1:30), a 250 °C, con un volumen de inyección Viny = 1 µL. Se usó helio como gas de arrastre (99,995%, Linde, Bucaramanga, Colombia) con un flujo volumétrico constante de 1 mL min-1. La cámara de ionización (EI, 70 eV) se mantuvo a 250 °C, el rango de masas fue m/z 30 - 400 u. El error de medición de masas de iones fue Δ ppm ≈ 1 o menor. Los datos se procesaron con el software ChromaTOF-HRT, versión 1.90.60 (Leco Corporation, Saint Joseph, MI, EE. UU.). En el espectrómetro de masas HRMS Orbitrap TM (Exactive Plus, Thermo Scientific, Bremen, Alemania) se midieron las masas exactas de las moléculas protonadas [M + H]+, los iones-aducto [M + Na]+ y los iones-producto de DCF y sus impurezas con un error de Δ ppm < 1,7.
Calibraciones, exactitud del método y cuantificación de diclofenaco. Inicialmente, para la cuantificación de DCF se usó un estándar analítico (Diclofenac Sodium Salt, ≥ 98,5%, contenido de agua ≤ 2%, lote N° BCBS5195V), adquirido a Sigma-Aldrich (SigmaAldrich, Saint Louis, MO, EE. UU.). Empero, la cuantificación final de diclofenaco en el PFC, se realizó con un material de referencia certificado (CRM) [Diclofenaco, CAS N°15307-79-6, Diclofenac Sodium, C14H10Cl2NO2Na, 99,24%, ISO Guide 34 Reference Material, pureza 99,24% (g/g), incertidumbre 0,50% (g/g), N° de lote G290008, fecha de expiración 21.11.2021], comprado a la empresa Dr. Ehrenstorfer, LGC Labor GmbH (Augsburgo, Alemania), que -por ser el CRM- tenía una pureza analítica más alta. Acetato de etilo, grado HPLC, FA y MeOH, grado LCMS, se compraron a Merck (Darmstadt, Alemania). Acetonitrilo y MeOH, ambos, grado HPLC, fueron adquiridos a J.T. Baker (Ecatepec, México) y CH2Cl2, grado HPLC, a Macron (Philipsburg, EE. UU.). El agua tipo I, se obtuvo en un sistema de purificación Synergy ® UV Purification System (Millipore, Molshein, Francia), disponible en el laboratorio.
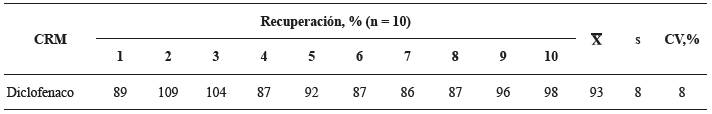
La exactitud del método analítico se midió calculando el porcentaje de recuperación (%) de DCF a partir de una matriz fisicoquímicamente similar a la de la tableta del PFC analizado en este estudio. Para una muestra del blanco (control) negativo se usó un producto comercial, acetaminofén (500 mg, Industria Colombiana de Medicamentos, ICOM®, registro sanitario de Invima 2012M-03437-R3), adquirido en el mercado local. El blanco (control) negativo se enriqueció con 10 µL de una solución de diclofenaco (CRM) (5000 µg mL-1) en MeOH; la extracción se llevó a cabo una hora después de la adición del estándar. Se realizaron diez mediciones y el porcentaje de recuperación fue 93 ± 8%, con CV igual al 8%, así:
Para las calibraciones por el método cromatográfico con estándar externo, se llevó a cabo el siguiente procedimiento: una solución stock del CRM de DCF (5000 µg mL-1) se preparó por su adición (5,06 mg) a MeOH grado HPLC (1 mL). Para el análisis y la cuantificación por HPLC-DAD, se prepararon soluciones de calibración en el rango de 10 - 400 µg mL-1 (10, 25, 50, 75, 100, 150, 200, 300 y 400 µg mL-1). Para el análisis por LC/MS (UHPLC-ESI+-HRMS-Orbitrap), una solución de trabajo de 5 µg mL-1 se diluyó así: 5 µL de la solución stock aforada a 5 mL con una mezcla metanol:agua tipo I (1:1 v/v). Para la cuantificación de DCF por UHPLC-ESI+-HRMS-Orbitrap, se prepararon las soluciones de trabajo en el rango de 20 - 250 µg mL-1 (20, 40, 80, 100, 120, 160, 200 y 250 µg mL-1). Para el blanco (control) positivo se usó DCF sódico (75 mg/ 3 mL, MK®, presentación - ampolla, lote - T19143, fabricado por Tecnofar TQ S.A.S. y comercializado por Tecnoquímicas S.A. con el registro sanitario de Invima 2010 M-003535-R3), adquirido en el mercado local de Bucaramanga (Colombia).
Para la calibración por el método de adición de estándar, el CRM (DCF) en una concentración conocida se adicionó a los extractos metanólicos de las tabletas del PFC. Una solución de CRM de DCF (3,77 µL, 5000 µg mL-1) fue aforada a 1 mL con el extracto de cada una de las muestras analizadas previamente. Las mezclas se analizaron luego por HPLC-DAD bajo las mismas condiciones operacionales descritas arriba.
El análisis estadístico se realizó usando el software R (Versión 3.6.1, R Foundation for Statistical Computing, Viena, Austria, www.R-project.org). El establecimiento de diferencias honestamente significativas utilizó la comparación de corredores de error del 95% y la prueba de Tukey.
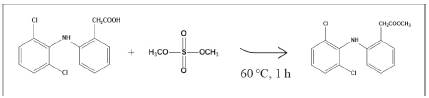
Obtención del éster metílico de diclofenaco.Una alícuota (15 µL) de solución stock de CRM de DCF (5000 µg mL-1) se colocó en un vial ámbar (2 mL) e inmediatamente, se adicionó sulfato de dimetilo (200 µL), se introdujo un agitador magnético a la mezcla de reacción y el vial se cerró. La reacción se llevó a cabo a 60 ± 2 °C, durante 1 h, a 500 rpm. Posteriormente, el sistema se dejó enfriar a temperatura ambiente; la solución obtenida se diluyó a 1 mL. Seguidamente, la mezcla se diluyó 75 veces con MeOH:H2O (1:1 v/v) y se filtró (0,22 µm) para su análisis por LC/MS.
Obtención de la γ-lactama de diclofenaco (derivado de indolinona). Diclofenaco (5,62 mg, CRM, Dr. Ehrenstorfer), se mezcló con una solución acuosa (5 mL) a pH < 2, ajustado con ácido clorhídrico diluido. Posteriormente, se llevó a cabo la extracción líquidolíquido por lotes, con acetato de etilo (5 mL), que se repitió dos veces más. Las fases orgánicas se combinaron, la mezcla se concentró en un rotoevaporador (T = 45 °C, 260 mbar). Del sólido obtenido, se pesaron 1,38 mg en un vial ámbar, que se calentaron en un baño de arena a diferentes temperaturas: 120 ± 5 °C (durante 15, 30 o 60 min) y 250 ± 2 °C (durante un minuto). El sólido obtenido se disolvió en acetato de etilo (1 mL) y se analizó por GC/MS; la misma solución se diluyó a 1 µg mL-1 para su análisis por UHPLC-ESI+-HRMSOrbitrap.
Resultados
Análisis de fracciones volátiles
Durante la primera etapa del trabajo (Figura 1), se realizó el análisis de la fase gaseosa (HS, headspace) de las tabletas del PFC para identificar por GC/MS las sustancias volátiles y volatilizables presentes. Se usó la técnica de microextracción en fase sólida en fase gaseosa (HS-SPME) 21), (22 y los resultados de análisis (Figura 2) de la fracción volátil de las tabletas permitieron diferenciar dos grupos de sustancias presentes, a saber: (1) terpenoides y otros metabolitos secundarios volátiles de plantas y (2) compuestos exógenos del material vegetal. El primer grupo lo constituyeron 6-metil-5-hepten-2-ona, anetol, metilchavicol y monoterpenoides (C10), e.g., limoneno, p-cimeno, mentol, carvona, así como hidrocarburos sesquiterpénicos, C15H24, α- y γ-cadinenos, α- y β-cubebenos, muurolenos, calacorenos, viridifloreno, calameno, calacoreno; sesquiterpenoles, C15H24O, α- y γ-cadinoles, carotol, α- y γ-muurololes y eudesmol, entre otros; también, se encontraron algunos ésteres metílicos de ácidos grasos, fitol y parafinas lineales. El segundo grupo de sustancias estaba conformado por compuestos, que no se hallan naturalmente en plantas, entre éstos, se detectaron 2-cloroetanol, etano-1,2diol (etilenglicol), 2,6-dicloroanilina y 2,6-dicloroN-fenil-bencenamina y trazas de plastificantes (e.g., ftalato de dietilo).
Etano-1,2-diol (etilenglicol) (tR = 26,9 min) y 2-cloroetanol (tR = 23,1 min) son sustancias volátiles, polares, posibles solventes residuales, fácilmente detectables en matrices sólidas por técnicas HS 23), (24. En el espectro MS de etilenglicol aparecen el ion molecular M+. en m/z 62 (3%) y el ion-producto (pico de base) CH2=OH+ en m/z 31 (100%), típico para alcoholes primarios25,26. En el espectro MS del 2-cloroetanol (tR = 23,1 min), el ion M+. en m/z 80 (4%, 35Cl) se detectó con la relación isotópica típica 35Cl:37Cl de ≈ 3:1. El ion molecular M+. del 2-cloroetanol -bajo el impacto de electrones (EI, 70 eV, 35 µA)-, se disocia en dos ionesproducto complementarios, i.e., [CH2=OH]+ en m/z 31 (100%) y [CH2Cl]+ en m/z 49 (6%, 35Cl).
El compuesto aromático clorado, registrado en el cromatograma GC con el tR = 31,2 min (Figura 2B), según su espectro MS, corresponde a la 2,6-diclorobencenamina (2,6-dicloroanilina). La presencia de dos átomos de cloro en esta molécula se confirma con la distribución típica de intensidades de señales isotópicas en su ion M+., m/z 161 (100%, dos átomos de 35Cl) : m/z 163 (35Cl y 37Cl) : m/z 165 (dos átomos de 37Cl) ≈ 9:6:1. La presencia de cloro en esta molécula se corrobora también por la aparición en su espectro MS de ionesproducto en m/z 126 [(M - Cl)+, 10%] y m/z 125 [(M - HCl)+., 11%,]. La masa molecular impar (M+., m/z 161, 35Cl) y los iones [(M - Cl) - HCN)]+ en m/z 99 (10%) y [(M - 2Cl) - HCN)]+. en m/z 63 (13%), indican la presencia en la molécula de un átomo de nitrógeno y dos de cloro.
El pico cromatográfico con tR = 47,8 min (Figura 2C) corresponde a la 2,6-dicloro-N-fenil-bencenamina; la masa impar de su ion molecular M+. en m/z 237 (35%, 35Cl) indica que hay un átomo de nitrógeno, mientras que la presencia de dos átomos de cloro se corrobora tanto por la distribución de señales isotópicas del ion M+., como por la formación de iones en m/z 202 [(M - Cl)+, 12%] y en m/z 167 [(M - 2Cl)+., 100%,]; el fragmento en m/z 140 (7%) [(M - 2Cl) - HCN]+. confirma la presencia en la molécula tanto de un átomo de nitrógeno, como de dos átomos de cloro. En los espectros MS de ambas aminas cloradas (Figuras 2B y 2C), los iones moleculares M+. son de intensidades alta y media, debido a la presencia de un anillo aromático en sus estructuras. Ambas sustancias son productos intermedios en la síntesis de diclofenaco 27. Un pico cromatográfico con tR = 36,1 min corresponde a ftalato de dietilo (plastificante), su espectro MS contiene iones típicos en m/z 222 (M+., 1%), m/z 177 [34%, (M - OC2H5)+] y en m/z 149 (100%, C8H5O3 +); este último es un ion “diagnóstico”, pico de base en los espectros MS de ftalatos (ésteres del ácido tereftálico) 15), (25, que se pueden encontrar en muchos productos (tapas, recipientes, envolturas, productos químicos, solventes industriales, polímeros, perfumes, productos agroquímicos, etc.) 28.
Los cromatogramas (GC/MS) de las fracciones volátiles aisladas por HS-SPME de las tabletas del PFC de cuatro lotes diferentes (Figura 2D) fueron similares cualitativamente, salvo el de la muestra 1-01-F33317 (Figura 2D, a), que tuvo la cantidad más alta de 2,6-dicloro-N-fenil-bencenamina (tR = 47,8 min) en comparación con las demás muestras. Este compuesto, intermediario en la síntesis (Esquema 1)27, pudo provenir de DCF no purificado.
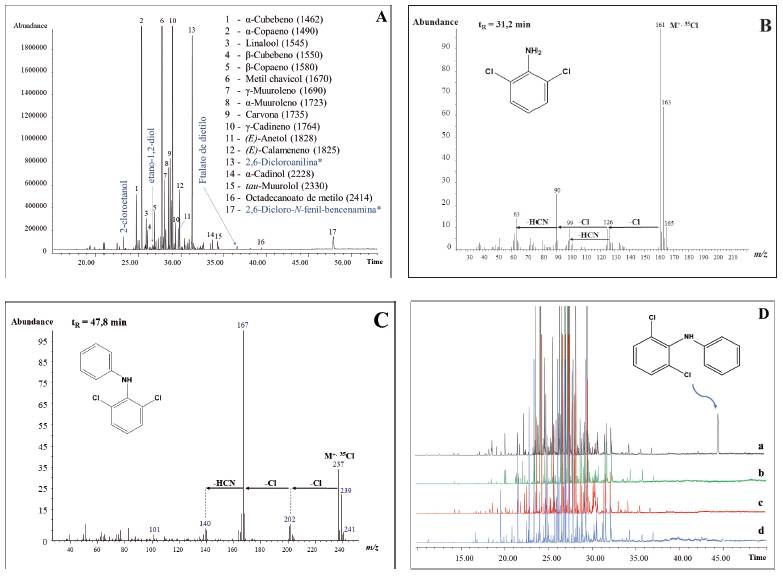
Figura 2 A. Perfil cromatográfico (TIC, GC/MS) de la fracción volátil obtenida por HS-SPME (PDMS/DVB, 65 µm, 30 min, 50 °C) de una tableta pulverizada del PFC (Muestra 1-01-F333-17). Columna DB-WAX (60 m), split 1:30. Compuestos mayoritarios se identificaron con base en sus espectros MS (EI, 70 eV), patrones de fragmentación e índices de retención lineales (LRI)12,1720, que aparecen entre paréntesis. B. Espectro de masas (EI, 70 eV) de la 2,6-dicloroanilina (tR = 31,2 min) (*) y formación de iones-producto característicos en m/z 126 (M - Cl)+, m/z 125 (M - HCl)+., m/z 99 [(M - Cl) - HCN)]+, m/z 90 [(M - Cl) - HCl)]+. y en m/z 63 [(M - Cl - HCl) - HCN)]+.. C. Espectro de masas de 2,6-dicloro-N-fenil-bencenamina (tR = 47,8 min) (EI, 70 eV) (*) y los iones característicos (pérdida sucesiva de dos Cl. y de una molécula HCN), que se generan durante su EI (70 eV) y confirman la presencia en la molécula de un átomo de nitrógeno y dos de cloro. D. Comparación de perfiles cromatográficos (TIC, GC/MS) de las fracciones volátiles obtenidas por HS-SPME de las tabletas del PFC de cuatro lotes diferentes: a - Muestra 1-01-F333-17; b - Muestra 2-01-F460-17; c - Muestra 3-01-F463-17; d - Muestra 5-01-F500-18.
Análisis por GC/MS de los extractos de tabletas obtenidos con CH2Cl2
La siguiente etapa (Figura 1) de análisis de tabletas del PFC, fue la obtención de extractos con solventes orgánicos (CH2Cl2 y MeOH:H2O), seguida de sus análisis por GC/MS, LC/MS y HPLC-DAD, para identificar y cuantificar DCF. La extracción con estos solventes permitió aislar sustancias más polares, poco o no volátiles, algunas, con los pesos moleculares más altos que de los compuestos volátiles aislados por HSSPME.
En la Figura 3A aparece el cromatograma (GC/MS) del extracto en CH2Cl2 del PFC (Muestra 1-01-F333- 17). Los cromatogramas (TIC, GC/MS) (Figura 3B ) de los extractos obtenidos de tabletas de cuatro lotes diferentes son cualitativamente similares (Figura 3B), ca. 20 sustancias se detectaron en ellos. El compuesto mayoritario (pico N° 8) fue la 1-(2,6-diclorofenil)- 1,3-dihidro-2H-indol-2-ona (γ-lactama de DCF o derivado de indolinona), conocida también como impureza A, según la Farmacopea Europea29. La impureza A puede provenir tanto de los productos de síntesis de DCF (intermediario) (Esquema 1), como -lo más frecuentemente- de su degradación térmica, acompañada de ciclización intramolecular y pérdida de agua30. La termo-degradación de DCF puede generar varios compuestos (impurezas B y C, otros)29.
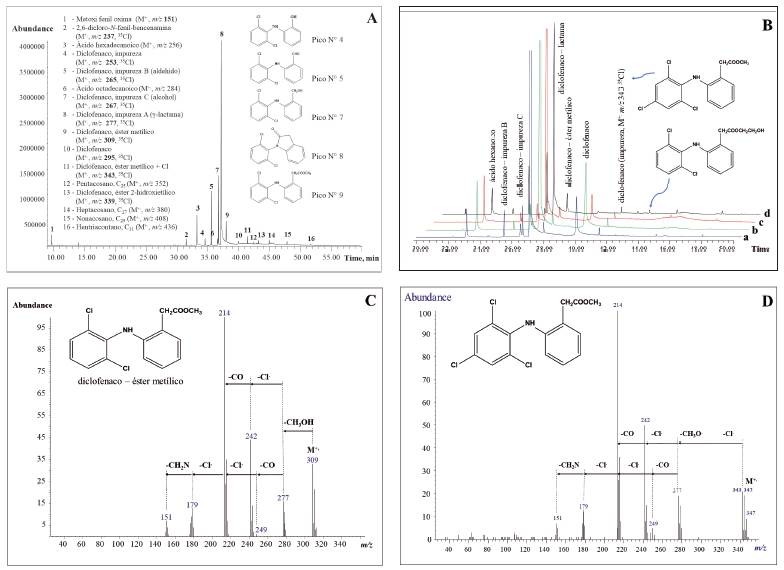
Figura 3 A. Perfil cromatográfico (TIC, GC/MS) del extracto (CH2Cl2) de tabletas pulverizadas del PFC. Muestra 1-01-F33317. Columna DB-5MS (60 m). Inyección en modo splitless (250 °C, Viny = 2 mL). Compuestos mayoritarios se identificaron con base en sus espectros MS (EI, 70 eV), los iones moleculares M+. aparecen entre paréntesis. B. Comparación de cromatogramas de los extractos (CH2Cl2) de tabletas del PFC de cuatro lotes diferentes: a. Muestra 5-01-F500-18; b. Muestra 4-02-F463-17; c. Muestra 3-01-F463-17; d. Muestra 1-01-F333-17. C. Espectro MS (EI, 70 eV) del éster metílico de DCF. D. Espectro MS (M+., m/z 343, 25%, 35Cl) de una impureza, que corresponde al éster metílico de diclofenaco (+ Cl).
En los cromatogramas GC/MS de los extractos de CH2Cl2 de tabletas del PFC se encontraron se encontraron sustancias denominadas impureza B (pico N° 5) e impureza C (pico N° 7), que son, respectivamente, 2-[(2,6-diclorofenil) amino] benzaldehído y [2-[(2,6-diclorofenil) amino]fenil] metanol 29), (30), (31. Estas sustancias, que se generan por degradación térmica de DCF, se encontraron en todos los cromatogramas obtenidos por GC/MS de las muestras analizadas, junto con algunos ésteres de DCF (picos N° 9, 11 y 13, Figura 3A).
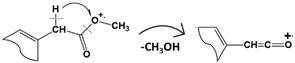
En el espectro MS del éster metílico del ácido 2-[2-[(2,6-diclorofenil) amino]fenil]acético (pico N° 9, Figura 3C ), aparece el ion en m/z 277 (22%), producto de una reacción de migración-1,4 del hidrógeno en el grupo -CH2COOCH3, acompañada de una pérdida de la molécula de metanol [M - MeOH]+ como sigue:
La aparición del ion ceteno [M - CH3OH]+ en m/z 277 (22%) confirma que el ácido es metilado: en su espectro MS se detectan también iones-producto en m/z 242, m/z 214 y m/z 179, típicos para DCF y sustancias relacionadas. El ion [M - CH3OH]+., posiblemente, se reagrupa a una estructura cíclica de indolinona (ɸ 3) que, por la eliminación de CO, decae luego con formación del ion ɸ 4 (Esquema 2).
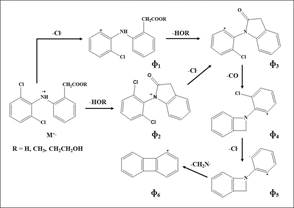
Esquema 2 Patrón de fragmentación de diclofenaco y sus ésteres y la formación de iones característicos ɸ 1 - ɸ 6 en sus espectros MS (EI, 70 eV). Las masas exactas de iones típicos, medidos por HRTOF-MS, aparecen en la Tabla 2. Las masas nominales de iones y sus intensidades (%) en los espectros MS de DCF y sus derivados (impurezas A, B y C) detectados en los cromatogramas obtenidos por GC/MS de los extractos (CH2Cl2) de tabletas del PFC se reportan en la Tabla 3.
El pico N° 11 (Figura 3D) corresponde a otro compuesto relacionado con DCF, que, en vez de dos átomos de cloro, contiene tres. Esto se confirma por la presencia en su espectro MS de iones correspondientes a las pérdidas sucesivas de tres átomos de cloro, así: [(M - OCH3) - Cl)]+., [(M - OCH3) - 2Cl]+, [(M - OCH3) - 3Cl]+., que aparecen, respectivamente, en m/z 277, m/z 242 y m/z 179. La distribución isotópica de señales en su ion molecular M+. (m/z 343, 25%,35Cl) confirma la relación isotópica típica para la presencia de tres átomos de Cl en la molécula, a saber: [3 35Cl] : [2 35Cl y 37Cl] : [35Cl y 2 37Cl] : [3 37Cl] ≈ 30 : 28 : 10 :1 (Figura 3D).
Estudio de espectros de masas de diclofenaco y sus derivados, obtenidos por ionización con electrones (EI, 70 eV)
En el Esquema 2 se presenta el patrón de fragmentación de iones M+. (EI, 70 eV) de DCF, sus ésteres y otros compuestos relacionados, detectados en los cromatogramas GC/MS de los extractos obtenidos con CH2Cl2 de tabletas del PFC (Figuras 3). Los iones ɸ 2 - ɸ 6, comunes en los espectros MS de DCF y sus derivados, las fórmulas elementales y masas exactas aparecen en la Tabla 2, mientras los nombres IUPAC de las sustancias, las masas nominales de los iones M+., iones-producto típicos y sus intensidades (%), se registran en la Tabla 3. La presencia de DCF en los extractos se confirmó también por GC/MS, operado en modo SIM, que detectó selectivamente los iones característicos (“diagnósticos”) de DCF en m/z 295 (M +.), m/z 242 (ɸ 3) y m/z 214 (ɸ 4) (los datos no se muestran).
La medición de masas exactas de iones característicos ɸ 1 - ɸ 6 (Tabla 2) se realizó en el equipo GC-HRMS, equipado con un analizador de masas de tiempo de vuelo de alta resolución HRTOF-MS (Rs = 40000), en el cual, gracias a varios reflectrones ubicados en el camino del haz de iones, se logra medir sus masas con un error cercano a 1 ppm o menor32; esto permitió inequívocamente obtener las fórmulas elementales de iones-producto y moléculas ionizadas.
Es interesante observar, que la formación del ion ɸ 6 a partir del fragmento ɸ 5 (Esquema 2) sucede por la eliminación de una partícula neutra con la masa nominal 28 (m/z 179 - m/z 151 = 28), que puede corresponder a una de las siguientes especies moleculares: CO, N2, C2H4 o CH2N. En este caso, solo las dos últimas especies, C2H4 o CH2N, son posibles. La medición de las masas exactas -sin dar lugar a duda- confirmó la pérdida del ion ɸ 5 de CH2N. -y no de C2H4-; si lo último fuese cierto, el error en la medición de la masa exacta del fragmento permite obtener una prueba experimental contundente hipotético [ɸ 5 - C2H4]+ hubiera sido inaceptablemente para hallar sus composiciones elementales, importantes grande (Δ ppm > 80) (Tabla 2). La medición de masas exactas de moléculas ionizadas o de sus iones-producto permite obtener una prueba experimental contundente para hallar sus composiciones elementales, importantes para dilucidar las estructuras químicas (32.
Tabla 2 Determinación de masas exactas medidas por HRTOF-MS y fórmulas elementales de iones característicos en los espectros de masas de diclofenaco y sus derivados.
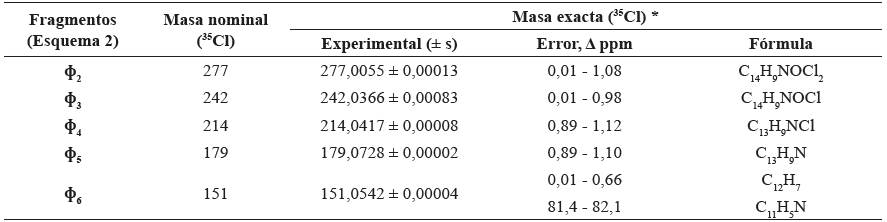
* Se midieron las masas exactas de cada ion, por lo menos, en cinco experimentos independientes (n = 5).
Tabla 3 Iones característicos (m/z, I, %) en los espectros de masas, obtenidos por EI (70 eV), de diclofenaco y de compuestos relacionados en los cromatogramas de los extractos (CH2Cl2) de las tabletas del producto fitoterapéutico a base de caléndula, analizadas en este estudio.
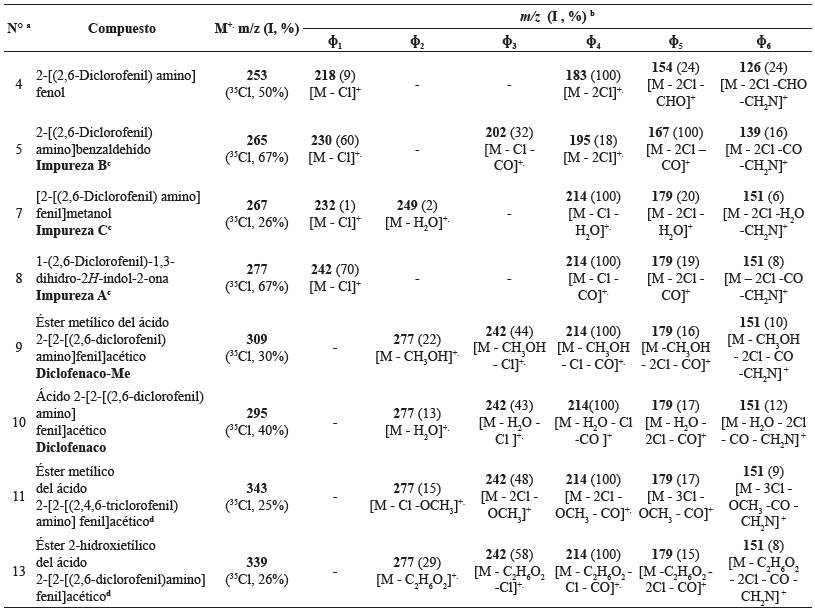
a - Número de pico cromatográfico en la Figura 3A.
b - Relación m/z e intensidad relativa (%) de los iones característicos cuyo origen se explica en el Esquema 2.
c - Impurezas A, B, C, según la nomenclatura empleada por la Farmacopea Europea29.
d - Detectados en los cromatogramas e identificados con base en sus espectros de masas (EI, 70 eV) y patrones de fragmentación.
El estudio detallado de patrones de fragmentación de DCF y compuestos relacionados (Esquema 2, Tablas 2 y 3), permitió identificar la sustancia que corresponde al pico N° 13 en el cromatograma de la Figura 3A, i.e., éster 2-hidroxietílico del ácido 2-[2-[(2,6-diclorofenil) amino]fenil]acético (Pico N° 13). Es interesante observar, que en la fracción volátil de las tabletas del PFC, analizadas por HS-SPME-GC/MS, se encontraron dos alcoholes, etilenglicol y 2-cloroetanol (Figura 2A), que -eventualmente- hubieran podido reaccionar con el ácido (DCF) para formar su éster 2-hidroxietílico, en cuyo espectro MS (EI, 70 eV) justamente aparecen los iones característicos ɸ 2 - ɸ 6, mientras que la masa molecular [M+., m/z 339 (16%), 35Cl] concuerda con la del éster 2-hidroxietílico (Esquema 3):
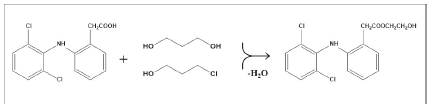
Esquema 3 Obtención del éster 2-hidroxietílico del ácido 2-[2-[(2,6-dicloro-fenil) amino]fenil]acético (diclofenaco), detectado en los cromatogramas GC de los extractos obtenidos con CH2Cl2, de tabletas del PFC (Figura 3A, pico N° 13). En la fracción volátil de las tabletas analizadas por HS-SPMEGC/MS están presentes los dos alcoholes, etilenglicol y 2-cloroetanol (Figura 2A).
En los extractos de las tabletas del PFC, obtenidos con CH2Cl2 y analizados por GC/MS, se encontraron también ácidos grasos, palmítico (C16) y esteárico (C18), mientras que, en la fracción volátil de las mismas tabletas (HS-SPME), se hallaron sus ésteres metílicos. Entre otras sustancias, en los extractos (CH2Cl2) se hallaron hidrocarburos lineales (parafinas) de alto peso molecular, con número impar de átomos de carbono, C25, C27, C27, C29 y C31, cuyo origen en las tabletas no es claro.
Estudio de espectros de masas de diclofenaco y sus derivados, obtenidos por UHPLC-ESI+HRMS-Orbitrap
La última parte del estudio (Figura 1) se enfocó en el análisis de extractos metanólicos de tabletas del PFC, por cromatografía líquida con diferentes sistemas de detección. El método HPLC-DAD 29), (33), (34 se empleó para la cuantificación de DCF en tabletas por los métodos de estandarización externa y adición de patrón, mientras que el método LC/MS 35 (UHPLC-ESI+-HRMS- Orbitrap), se usó tanto para la cuantificación como para la identificación de DCF y compuestos relacionados. La cromatografía líquida, en comparación con la de gases tiene una evidente ventaja en cuanto a las temperaturas que usa: son mucho más bajas tanto en el sistema de inyección como en la columna (30 °C), lo que permite evitar la degradación térmica del DCF (sustancia termolábil) y sus transformaciones, descritas en la literatura 36, por ejemplo, al éster metílico (cuando se usa MeOH como solvente), la descarboxilación (- CO2), la deshidratación (- H2O), o la ruptura de enlaces C-O o C-N, etc.; algunas de estas, pueden suceder en un inyector GC caliente (≥ 250°C).
Para confirmar completamente la identidad del éster metílico de DCF encontrado en los extractos, se hizo el siguiente experimento: el CRM de diclofenaco se sometió a la reacción con sulfato de dimetilo a 60 °C (1 h), con agitación magnética (Esquema 4).
Luego, se obtuvieron el tR y el espectro MS del producto de metilación de DCF (Figura 4). En el espectro full scan MS, obtenido por LC/MS, se detectaron ionesaducto [M + Na]+, moléculas protonadas [M + H]+ e iones-producto [(M + H) - OCH3]+ (Figura 4B), mientras que en el espectro MS de iones [M + H]+, energizados y fragmentados en la cámara de colisiones activadas (HCD, N2, 10 V), se encontraron los iones característicos [(M + H) - CH3OH]+, [(M + H) - CH3OH - CO]+ y [(M + H) - CH3OH - CO - Cl]+ (Figura 4C); se determinaron sus masas exactas con errores muy bajos (Δ ppm < 1,7), que permitieron hallar la composición elemental de la molécula y confirmar positivamente la identidad química del éster metílico de DCF. La fragmentación de las moléculas protonadas [M + H]+ del éster metílico de DCF en la HCD del LC/MS guarda mucha similitud con la obtenida por ionización con electrones (GC/MS, EI, 70 eV) (Figura 3C).
La identificación de DCF encontrado en los extractos del PFC (Figura 5) fue completa, confirmatoria e inequívoca y se basó tanto en sus parámetros cromatográficos (tR, LRI), como en los espectros MS obtenidos por técnicas GC/MS, GC/HRMS y LC/ HRMS (patrón de fragmentación, masas exactas de iones, composición elemental y relación isotópica), que fueron idénticos a los del material de referencia certificado de DCF (CRM, Dr. Ehrenstorfer).
El valor LRI = 2484 de DCF, medido en la columna apolar (DB-5MS) (Figura 3), fue cercano al de la base de datos de NIST 13) ; la fórmula condensada y la relación isotópica, obtenidas de los espectros HRMS de DCF presente en los extractos (Figura 5A), fueron idénticas a las del CRM de diclofenaco.
Se llevaron a cabo los experimentos importantes con los blancos positivo (diclofenaco comercial) y negativo (acetaminofén) (Figura 5), que confirmaron la validez de la estrategia analítica instrumental empleada en este estudio para detectar e identificar confirmatoriamente diclofenaco en el PFC comercializado en Bucaramanga (Colombia) (Figura 5).
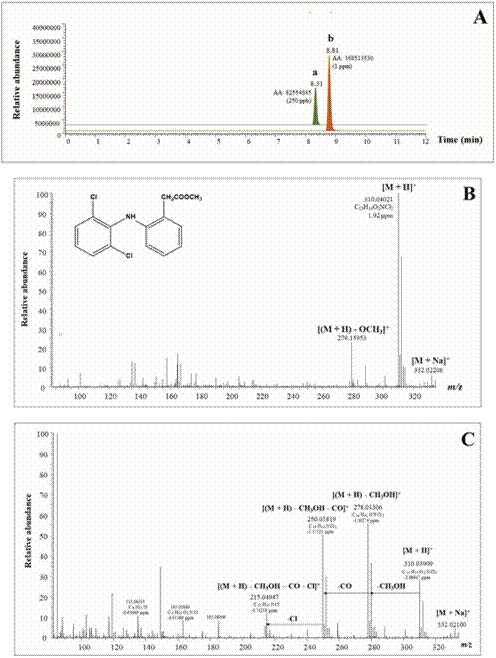
Figura 4 A. Corrientes iónicas extraídas (EIC, UHPLC-ESI+-HRMS-Orbitrap) de: a - diclofenaco y b - éster obtenido por metilación de DCF con sulfato de dimetilo. B. Espectro full MS del éster metílico de DCF; C. Espectro MS del ion [M + H]+ del éster metílico de DCF, energizado y fragmentado en la HCD (N2, 10 eV) y los iones-producto característicos, que confirman su estructura.
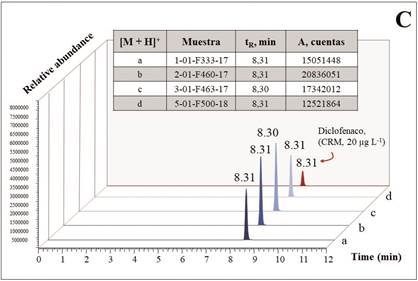


Figura 5 A. Espectro full MS de diclofenaco, obtenido por UHPLC-ESI+-HRMS-Orbitrap: región de masas (m/z) en donde se detecta la molécula protonada [M + H]+ de DCF y la relación isotópica de iones (35Cl, 35Cl; 100%) : (35Cl, 37Cl; 59.5%) : (37Cl, 37Cl; 10.6%) ≈ 9:6:1. Muestra 5-01-F500-18 del PFC. B. Comparación de las corrientes iónicas extraídas (EIC, UHPLCESI+-HRMS-Orbitrap), de las moléculas protonadas [M+H]+ de DCF (m/z 296.02396): a. El PFC, muestra 5-01-F500-18. b. Blanco (control) negativo - producto comercial de acetaminofén (Acetaminofén, ICOM®); c. Blanco (control) positivo - producto comercial de DCF (Diclofenaco sódico, MK®); d. CRM de DCF (Dr. Ehrenstorfer, Augsburgo, Alemania) y C. Comparación de las EIC de moléculas protonadas [M + H]+ de DCF de las muestras de cuatro lotes diferentes del PFC (véanse en la tabla) y del CRM de DCF (20 µg L-1).
En los extractos de las tabletas del PFC se detectaron e protonadas [M + H]+, a saber: la impureza C (ca. 0,1 identificaron por LC/MS sustancias relacionadas con el mg/tableta) y el éster metílico de DCF (ca. 0,2 mg/ DCF; en la Figura 6 aparecen las EIC de sus moléculas tableta) (Muestra 1-01-F333-17).
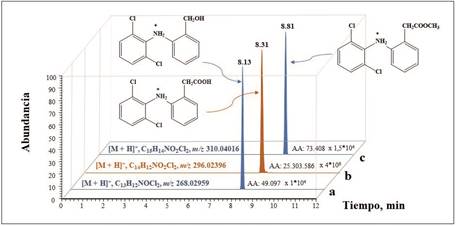
Figura 6 Corrientes iónicas extraídas (EIC) de la TIC, obtenida por UHPLC-ESI+-HRMS-Orbitrap, del extracto aislado por MeOH:H2O (1:1 v/v) de tabletas del PFC (Muestra 1-01-F333-17), de: a - impureza C; b - DCF; c - éster metílico de DCF. Se reportan tR (min) y áreas de picos cromatográficos (cuentas) reconstruidos (con factor de amplificación) con base en las EIC de moléculas protonadas [M + H]+.
Cuantificación de diclofenaco en tabletas del PFC
En la Tabla 4 se reportan los datos de la reproducibilidad de medición de los tR y de las áreas cromatográficas, obtenidos por HPLC-DAD y LC/MS. Se observa una reproducibilidad alta de estos parámetros acorde con las GLP.
Tabla 4 Reproducibilidad de los tiempos de retención, tR, y de las áreas cromatográficas de diclofenaco (100 μg mL-1), analizado por HPLC-DAD (λ = 274 nm) y LC-MS [UHPLCESI+- HRMS-Orbitrap (Vcap = +3,5 kV)].
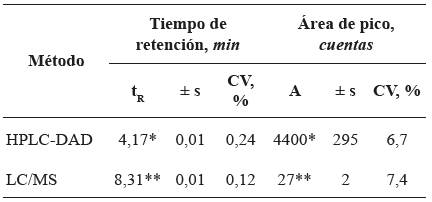
* Promedio de once mediciones (n = 11).
** Promedio de siete mediciones (n = 7); área x 106 (cuentas).
Para cuantificar el DCF se usaron dos técnicas, HPLCDAD y LC/MS (UHPLC-ESI+-HRMS-Orbitrap), siendo la primera recomendada por varias Farmacopeas29,33,34. En la Tabla 5 aparecen los principales parámetros de las curvas de calibración, así como los niveles mínimos de detección (LOD) y cuantificación (LOQ) de DCF. Para su cuantificación por HPLC-DAD, se usó también el método de adición de estándar; el DCF se cuantificó tanto en las tabletas del PFC inmediatamente pulverizadas, como en las almacenadas en forma de polvo por cuatro meses, ello, para observar los posibles cambios con el tiempo. La técnica LC/MS tiene una ventaja sobre HPLC-DAD, porque permite no solamente identificar35 los componentes de la mezcla, sino cuantificarlos, con una buena reproducibilidad (CV < 10%); la cuantificación por UHPLC-ESI+-HRMSOrbitrap se basó en la medición de la corriente iónica extraída (EIC) de moléculas protonadas de DCF [M + H]+. Los resultados de cuantificación de DCF por HPLC-DAD y por LC/MS, presentaron una buena concordancia, así como los obtenidos por dos diferentes métodos de calibración, i.e., estandarización externa y adición de estándar (Tabla 6).
Tabla 5 Parámetros de las curvas de calibración de diclofenaco, obtenidos por HPLC-DAD (λ = 274 nm) y LC/MS [UHPLCESI+-HRMS-Orbitrap (V cap = +3,5 kV)].

* Nivel mínimo de detección, LOD = 3S/m.
** Nivel mínimo de cuantificación, LOQ = 10S/m.
Tabla 6 Cantidad de diclofenaco (mg/tableta) determinada por HPLC-DAD (λ = 274 nm) y por LC/MS (UHPLC-ESI+-HRMSOrbitrap) en tabletas del PFC, adquirido en 2018 en el mercado local de Bucaramanga (Colombia).
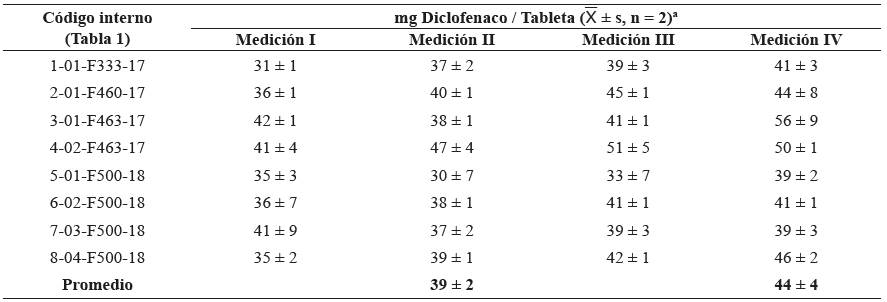
a Error estándar de la media, calculado según t*s / raíz (n) para (n - 1) grados de libertad y un 95% de confianza. Medición I: muestra obtenida a partir de cinco tabletas escogidas al azar de cada caja del PFC, homogeneizada por pulverización y almacenada por cuatro meses en una bolsa sellada. Calibración por HPLC-DAD, usando el método de estándar externo. Medición II: muestra obtenida a partir de dos tabletas escogidas al azar de cada caja del PFC, homogeneizada por pulverización y procesada inmediatamente. Calibración por HPLC-DAD, usando el método de estándar externo. Medición III: muestra homogeneizada, obtenida a partir de dos tabletas escogidas al azar de cada caja del PFC, homogeneizada por pulverización y procesada inmediatamente. Calibración por HPLC-DAD, usando el método de adición de estándar. Medición IV: muestra obtenida a partir de cinco tabletas escogidas al azar de cada caja del PFC, homogeneizada por pulverización y almacenada por cuatro meses en una bolsa sellada. Calibración por UHPLC-ESI+-HRMS-Orbitrap, usando el método de estándar externo.
Adicionalmente, se realizó un experimento con el calentamiento de diclofenaco (CRM) a 120 ± 5 °C (durante 15, 30 o 60 min) y a 250 ± 2 °C durante un minuto; con esta última temperatura se reproducían las condiciones térmicas del puerto de inyección de un cromatógrafo de gases. Posteriormente, se llevó a cabo el análisis por GC/MS y LC/MS de los productos de termodegradación (Figura 7). La identidad de las sustancias obtenidas se estableció con base en sus espectros MS (patrones de fragmentación, medición de masas exactas, relaciones isotópicas). Durante el calentamiento de DCF (CRM) se generaron varios compuestos. Algunos de ellos, también, se pueden encontrar entre los productos intermediarios y colaterales de síntesis de DCF. Sin embargo, es importante diferenciar la procedencia de cada una de estas sustancias, es decir: ¿provinieron de la reacción de síntesis27 de DCF (i.e., sus impurezas e intermediarios)? o ¿se formaron como artefactos en el puerto de inyección GC caliente (≥ 250 °C)?
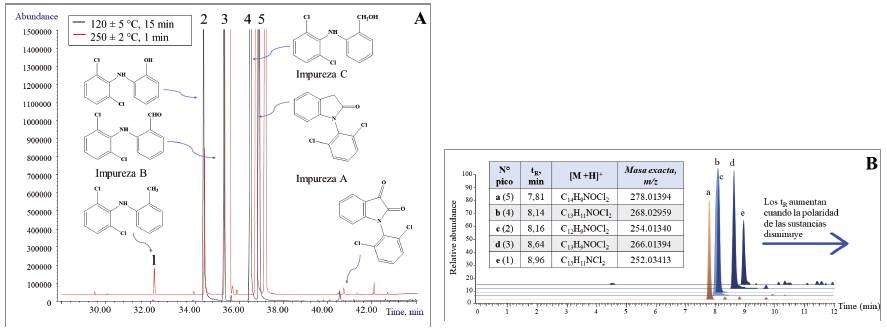
Figura 7 A. Perfiles cromatográficos obtenidos por GC/MS (EI, 70 eV) de DCF, calentado a 120 ± 5 °C, durante 15 min, y a 250 ± 2 °C, durante un minuto. B. Cromatogramas de masas basadas en los EIC (UHPLC-ESI+-HRMS-Orbitrap) de moléculas protonadas [M + H]+ de los productos de calentamiento de diclofenaco a 120 ± 5°C, durante 15 min; los números entre paréntesis(1 - 5) en la tabla corresponden a los de los picos de estas sustancias en el cromatograma obtenido por GC/MS (Figura 7A).
En promedio, en tabletas analizadas (> 70 tabletas), escogidas al azar de ocho cajas del PFC, adquirido en el mercado local (Bucaramanga, Colombia), se hallaron alrededor de 40 - 42 mg de diclofenaco (7 - 8%); con base en este hallazgo, se deduce que la toma de tres tabletas de este producto puede ascender a ca. 120 mg de diclofenaco, una cantidad que se acerca a la dosis máxima diaria para este medicamento 37 cuando está presente como sal sódica, lo que se determinó por difracción de rayos X 38. Prescribers’ Digital Reference no recomienda dosis mayores de 150 mg/día para productos administrados oralmente que contienen diclofenaco sódico tales como Cataflam, Voltaren y Zorvolex 39. En las tabletas, usando LC/HRMS, se confirmaron la presencia y la identidad de los siguientes compuestos relacionados con DCF en cantidades totales no mayores de ca. 0,1 - 0,5 mg (≤ 0,08%), a saber: la impureza A (lactama) [tR = 7,81min; C14H9NOCl2, (M + H)+ en m/z 278,01394, Δ ppm = 0,92]; la impureza B (aldehído) [tR = 8,64 min; C13H9NOCl2, (M + H)+ en m/z 266,01394, Δ ppm = 1,01]; la impureza C (alcohol) [tR = 8,14 min; C13H11NOCl2, (M + H)+ en m/z 268,02959, Δ ppm = 0,87]; la impureza D (fenol) [tR = 8,16 min; C12H9NOCl2, (M + H)+ en m/z 254,01340, Δ ppm = 1,02] y los ésteres de DCF metílico [tR = 8,81 min; C15H14NO2Cl2, (M + H)+ en m/z 310,04016, Δ ppm = 0,95] (Figuras 6y7B), así como 2-hidroxietílico [tR = 8,19 min; C16H16NO3Cl2, (M + H)+ en m/z 340,05072, Δ ppm = 1,05] y una impureza del éster metílico de DCF con tres átomos de cloro [tR = 5,57 min; C15H13NO2Cl3, (M + H)+ en m/z 344,00119, Δ ppm = 1,05].
Discusión
Comparación de métodos de análisis instrumental (GC/MS y LC/MS) de diclofenaco
Los métodos de análisis instrumental se dividen en dos grupos: (I) preliminares o presuntivos que permiten obtener la identificación tentativa de una sustancia y (2) confirmatorios, conducentes a su identificación inequívoca. Entre los primeros figuran IR, UV-Vis, TLC, GC con sistemas de detección convencionales o HPLC con detectores no espectroscópicos. La identificación confirmatoria de una sustancia requiere obtener su “huella digital” a través de un conjunto de métodos espectroscópicos. Sin embargo, la situación se dificulta, cuando esta sustancia (llamada analitotarget) se encuentra en una mezcla muy compleja o en presencia de muchas otras sustancias de diversa naturaleza química y en cantidades disímiles. El método de extracción y la técnica de análisis se escogen según la naturaleza química del analito-target (peso molecular, polaridad, volatilidad y estabilidad térmica). La espectrometría de masas (MS, HRMS) juega un rol fundamental en el análisis, sobre todo, cuando se combina con la cromatografía (GC o LC) 22), (35, ya que permite obtener los espectros MS únicos de cada sustancia en una mezcla compleja, partiendo de la cantidad muy pequeña de la muestra (mg y hasta µg podrían ser suficientes). En este estudio se usaron los métodos modernos de GC y LC combinados con espectrometría de masas de alta resolución.
La técnica de HS-SPME-GC/MS, que, no solamente extrae las sustancias volatilizables de matrices complejas, sino las concentra sobre una fibra adsorbente, permitió detectar -en las tabletas analizadas- terpenos presentes en el PFC en bajas concentraciones, residuos de solventes e intermediarios de síntesis de diclofenaco; mientras en los respectivos extractos obtenidos con solventes (CH2Cl2 o MeOH) se detectaron los compuestos en concentraciones más altas, e.g., diclofenaco, sus impurezas y algunas otras sustancias (ácidos grasos, parafinas).
Hay un asunto muy interesante para discutir. Al ver los cromatogramas obtenidos por GC/MS de los extractos de tabletas en CH2Cl2, una primera y desprevenida impresión que puede surgir es que el diclofenaco se encontraba en las tabletas “en rastros” (Figura 3A, pico N° 10), pero desde lejos no es cierto, ya que el DCF no solamente no se hallaba en trazas (< 1 ppm), sino estaba presente en cantidad apreciable, 7 - 8% en cada tableta (Tabla 6), cuyo peso principal lo conformaba la Iβcelulosa 38. En un estudio previo 30 sobre la esterilización de un producto inyectable de diclofenaco sódico, en un autoclave a 123 ± 2 °C, se observó la formación de lactama (derivado de indolinona, denominada la impureza A29). En otro estudio 31, los productos de degradación de DCF, mantenido en medio acuoso a 60 °C durante nueve semanas, fueron las tres impurezas A, B y C.
El análisis de muestras por GC/MS se realiza usando un sistema de inyección split/splitless mantenido a 250 °C. En el modo splitless la transferencia de vapores de la muestra a la columna cromatográfica es bastante lenta (ca. 1,0 min)40, pero es un tiempo suficiente para que ocurran las transformaciones térmicas del DCF (Figura 7A). Por ende, existe un notorio inconveniente para analizar el DCF por GC/MS, que radica en su alta labilidad térmica, conducente a la formación de productos de ciclación intramolecular (impureza A) y de la reducción del grupo CH2COOH a los de alcohol (-CH2OH, impureza C) y aldehído (-CHO, impureza B) y otros derivados, en el puerto de inyección split/splitless caliente 40), (41. El uso de un sistema de inyección cool on-column (inyección de la muestra en frío directamente a la columna) podría evitar la degradación térmica de DCF, pero esto implicaría un cambio del hardware del equipo e instalación de un nuevo puerto de inyección (on-column) También, se puede -antes del análisis del DCF por GC- acudir a su derivación, e.g., convertirlo a su éster trimetilsilílico (TSM), pero es un paso adicional en la cadena analítica, que puede aumentar el error y la contaminación cruzada 42), (43. Por eso, la cromatografía líquida es una opción, aunque es más difícil alcanzar la misma resolución en la columna HPLC, similar a la que se obtiene en una columna capilar GC o usando GCxGC 44), (45. Aunque en las columnas HPLC la co-elución de sustancias es más frecuente y los espectros UV pueden resultar muy parecidos (e.g., DCF y su lactama), usando la técnica de acoplamiento LC/MS -una herramienta de separación mucho más fina, sobre todo, si se emplea la espectrometría de masas de alta resolución-, se puede “separar” los picos cromatográficos extrayendo las corrientes iónicas (EIC) -características para cada sustancia-, para que, de esta manera, los compuestos puedan ser identificados aunque coeluyen o tienen bien cercanos sus tR (Figura 7B, picos b y c).
Sobre caléndula (Calendula officinalis)
El nombre genérico de Calendula officinalis (familia Asterácea) deriva del latín calendae, primer día del mes, aludiendo a que la planta florece casi todo el año. El nombre específico (officinalis) expresa su carácter medicinal. Originaria de Egipto y cultivada en Europa, desde el siglo XII, existe como subespontánea en la región mediterránea, fue introducida a Sur América en los tiempos de la Conquista. Contiene de un 0,2% a un 0,3% de aceite esencial, un 10% de materia mineral, carotenoides en abundancia, flavonoides, taninos, saponinas triterpénicas, entre otros grupos de componentes 46. La planta de caléndula está incluida en el “Vademécum colombiano de plantas medicinales”, que contiene las 119 plantas aprobadas por el Invima 47. Según el Vademécum, las indicaciones para el uso interno son antiinflamatorias, en tratamientos de alteraciones bucofaríngeas; para uso externo se recomienda como antiinflamatorio, cicatrizante, como tratamiento tópico de inflamaciones de piel y mucosas 47. Sin embargo, ni en una revisión publicada en 2013 ni en su actualización hasta agosto de 2020 hecha en esta investigación, se encontró algún artículo científico que comprobara algún efecto anti-inflamatorio de C. officinalis por uso oral en humanos 48. Tampoco se encontró algún estudio clínico que demuestre el efecto analgésico de C. officinalis por usos externo u oral.
Las flores y hojas de la c. Officinalis se han empleado por muchos siglos tanto en la culinaria como en la medicina popular. Su uso como condimento aparece en la lista de sustancias reconocidas generalmente como seguras (gras) de la administración de alimentos y drogas (fda) de los ee. Uu. 49. En la medicina tradicional de muchos países la caléndula se ha utilizado para varios propósitos, en los que se le atribuyen efectos estimulante, antiespasmódico, emenagogo, o diaforético, o usos como ayudante en el tratamiento de la ictericia o el estreñimiento 50. Revisiones sobre la bioactividad de los extractos de calendula officinalis contienen una lista amplia de resultados positivos de ensayos in vitro, que incluyen actividades antinflamatoria, antibacteriana, anticancerígena, antifúngica, antigenotóxica, antioxidante, antiviral, cicatrizante, inmunoestimulante e insecticida 51), (52. Sin embargo, no hay resultados de estudios clínicos que permitan comprobar la eficacia de los extractos de caléndula al aprovechar alguna de estas actividades biológicas para el tratamiento de alguna enfermedad. Por esto, una revisión hecha para Natural Standard Research Collaboration estableció que no hay suficiente evidencia científica para una lista de 90 aplicaciones farmacéuticas de C. officinalis, dentro de las que se incluyó la analgesia 53. La Agencia Europea de Medicamentos publicó en 2007 los resultados de un estudio en el que se examinó la eficacia comprobada de productos cuyo ingrediente fuese C. officinalis y hubiesen completado por lo menos 30 años de uso en medicina 54. La ayuda en la curación de heridas leves, o de inflamaciones de la mucosa oral o faríngea, o de úlceras de las piernas, fueron los usos como agente externo con eficacia verificada. Las aplicaciones de uso interno comprobadas fueron solamente aquellas dirigidas al tratamiento de la gastritis y de otros malestares del sistema digestivo relacionados con inflamaciones 54.
En el aceite esencial (0,3%), obtenido por arrastre con vapor, de flores de caléndula, cultivada en Massif Central, Francia, los compuestos mayoritarios eran sesquiterpenos, C15H24, y sesquiterpenoles, C15H26O, principalmente, δ-cadineno (12,1%), α-cadinol (25,5%) y α-muurolol (7,1%) 55. Las flores secas de plantas de caléndula, cultivada en Brasil, fueron destiladas con vapor y su fragancia se obtuvo por métodos HS-SPME y HS estático56. En el aceite esencial prevalecieron γ-cadineno (8,9%), epi-α-muurolol (12,9%), α-cadinol (20,4%) y δ-cadineno (22,5%), mientras que, en la fracción volátil aislada por HS-SPME, α-copaeno (15, 1%), δ-cadineno (22,1%) y γ-cadineno (25,5%). En el extracto alcohólico de flores secas de caléndula cultivada en Colombia 38, se encontraron α- y γ-muurolenos, α- y γ-cadinenos, α-cadinol, β-eudesmol, oplopanona (C15H26O2), viridiflorol, fitol, oleamida (C18H35NO) y otros sesquiterpenoles, en menor proporción. Algunos de estos compuestos se encontraron en fase vapor de las tabletas del PFC, analizado en este estudio por HSSPME-GC/MS, sin embargo, la presencia de linalool, anetol, carvona y metilchavicol, que son metabolitos secundarios de plantas de otras familias botánicas, indica la contaminación o mezcla con material vegetal distinto al de la caléndula.
Los fitofármacos se preparan a partir plantas medicinales, que se deben cultivar bajo condiciones controladas de suelo, riego, presencia de malezas, evitando las afectaciones por enfermedades y pestes; en el cultivo no deben usarse pesticidas y el suelo debe ser libre de metales pesados, que las plantas -con facilidad- absorben 57. Las GMP requieren un análisis obligatorio de la materia prima para fabricar los fitofármacos, de sus principios activos, residuos de pesticidas, metales pesados, entre otras pruebas importantes. En las tabletas del PFC analizadas en este estudio, se encontraron cantidades pequeñas de algunos flavonoides, tifaneósido (40 - 60 µg/g), calendoflavósido (30 - 50 µg/g), isoquercetina (300 - 450 µg/g) y narcisina (150 -300 µg/g), presentes en cantidades variables y no en todos los lotes 38.
Sobre diclofenaco
En 1988 se aprobó en los EE. UU. el uso de diclofenaco para el tratamiento de artritis reumatoidea, osteoartritis y espondilitis anquilosante 58. Una vez se inició su consumo regular, se notó la afectación de hígado 59, sistema cardiovascular 60, sistema gastrointestinal 61), (62) y riñones 63. Entre noviembre de 1988 y junio de 1991 se reportaron a la FDA 434 casos de daño hepático por consumo de DCF. Una revisión de estos casos permitió seleccionar 180 en los que era clara la conexión entre consumo de diclofenaco y el daño hepático. En el 85% de los casos aparecieron síntomas de afectación del hígado, luego de seis meses de iniciar un tratamiento basado en el consumo de DCF. Solo en 5 (3%) de los 180 casos, los síntomas de daño hepático aparecieron un año después 64. En un estudio en el que se suministraron 25 mg de DCF tres veces al día durante siete días a un grupo de 20 voluntarios, se tomaron fotografías de la mucosa gástrica para evaluar su erosión 65. Estas imágenes mostraron que el consumo de DCF causó un aumento de erosiones gástricas en un factor de ocho (de 0,5 ± 0,2 hasta 3,9 ± 1,1). Tal como sucede con otros AINES, el consumo de DCF tiene un riesgo alto de afectación severa del riñón. Una revisión de 2201 registros médicos seleccionó estudios que tuviesen los detalles sobre el tipo de AINES consumido y los daños renales acaecidos. La agrupación de los resultados de estos estudios sobre los riesgos relativos de generar daño renal agudo para los siete AINES registrados, entre los que estuvo el diclofenaco, fueron altos (1,58 - 2,11) y no hubo diferencias significativas entre cualquier pareja de AINES 66. Ciertas personas son hipersensibles a algunos medicamentos y casi inmediatamente desarrollan reacciones fuertes y variadas que pueden incluso llevar a la muerte. En un estudio de 806 casos de hipersensibilidad a drogas, se distinguieron 117 casos que correspondieron a reacción alérgica aguda y, entre estos, el mayor causante (48,7% de los casos) fue algún AINE. Entre estos, aspirina, dipirona y DCF, fueron los más frecuentes 67.
Como se puede apreciar, quien consuma un analgésico de origen natural, sin conocer que su componente activo es en realidad el DCF, no será consciente de los riesgos a que está exponiendo a su sistema cardiovascular, su hígado, riñones o tracto digestivo. Aunque hay efectos que aparecen prontamente, la afectación se agrava si el consumo es regular, continuo, como tendería a hacer -sin mucha preocupación- alguien que piense que está ingiriendo extracto de caléndula, 100%-natural e inocuo, tal como normalmente cree la gente sobre la medicina a base de plantas medicinales, que no hacen daño como los “químicos”. Además, si la persona consume otros medicamentos, puede haber una interacción farmacológica negativa. No se encontraron triterpenoides (faradiol, oleanano, maniladiol) o sus ésteres, en niveles por encima de los LOD de los equipos utilizados en esta investigación.
Sobre los medicamentos falsificados
La Asamblea de la Organización Mundial de la Salud (OMS) realizada en 1998 trató por primera vez el tema de los medicamentos falsificados. Este problema, que tiene impactos socioeconómicos y sobre la salud, ha crecido tanto, que varias publicaciones científicas lo denominan una pandemia 68. Por varias décadas se usaron varias denominaciones sobre las diferentes modalidades de este comercio ilegal, hasta que en la Asamblea de la OMS en 2017 se unificaron todas estas variantes en solo tres tipos de productos: (1)subestándar, (2) no-registrado/no-licenciado y (3) falsificado 69. Estos últimos son productos que deliberadamente/fraudulentamente falsifican su identidad, composición, o fuente. Según estimación de la Organización para la Cooperación Económica y el Desarrollo, OECD64, el mercado creciente de bienes falsificados o piratas ya representó en 2016 (509 mil millones de dólares), 3,3% del comercio global. Dentro de estos bienes, 4,4 millardos de dólares que cruzaron las fronteras de los países correspondieron a productos farmacéuticos subestándar o falsificados. El 84% de la población mundial vive en los países que el Banco Mundial clasifica como de ingresos medio y bajo 71. Un estudio de la OMS halló que en estos países el gasto anual en medicamentos falsificados fue de 30,5 millardos de dólares en 2016 72. Este estudio revisó publicaciones científicas sobre productos farmacéuticos falsificados y encontró que el 10,5% de los productos obtenidos en el comercio en estos países fallaron las pruebas de composición química. El presente estudio es un ejemplo de análisis de un producto comercial de origen natural, cuyo principio activo -en realidad- fue un antiinflamatorio analgésico de origen sintético, diclofenaco. En lugar de los 150 mg de extracto seco de caléndula que declara la etiqueta del PFC, se hallaron 40 mg de un compuesto sintético. El contenido de sustancias naturales (terpenos, flavonoides) no superó 1 mg/tableta. En la clasificación de la OMS correspondería tanto a productos “subestándar” (por no cumplir sus normas de calidad o sus especificaciones), como a productos “falsificados” (aquellos en los que la identidad, la composición o la fuente no corresponden a la realidad). La resolución de la Asamblea de la OMS de 2017 agrega que cuando un producto está en dos categorías, pero es el fabricante quien deliberadamente causa el incumplimiento de las especificaciones, el caso corresponde a un producto falsificado 69.
Conclusión
Usando la combinación de técnicas modernas de análisis instrumental, se determinó la composición química de sustancias orgánicas en tabletas del producto fitoterapéutico a base de caléndula (Calendula officinalis), adquirido en establecimientos legalmente constituidos, en Bucaramanga (Colombia). En la fracción volátil de las tabletas, obtenida por HSSPME, se detectaron varios mono- y sesquiterpenoides, residuos de solventes y compuestos intermedios de la síntesis de diclofenaco. En los cromatogramas de los extractos, aislados con diclorometano y analizados por GC/MS y GC/HRMS, se detectaron tanto el diclofenaco como los compuestos relacionados, principalmente, γ-lactama (impureza A), que se forma por la reacción intramolecular de ciclación y pérdida de agua, en el inyector caliente (250°C) del GC. La identificación confirmatoria del diclofenaco se realizó con base en los criterios cromatográficos (tR, LRI) y espectroscópicos,
i.e., los espectros de masas de alta resolución (HRTOFMS, MS-Orbitrap) y usando el material de referencia certificado (CRM). Los compuestos relacionados del diclofenaco (impurezas A, B, C y algunos ésteres) se identificaron con base en sus espectros de masas, medición de masas exactas de iones-producto y moleculares, estudio de relaciones isotópicas y patrones de fragmentación. La cuantificación del diclofenaco se llevó a cabo por métodos de estandarización externa y adición de estándar (CRM), usando las técnicas HPLC-DAD y UHPLC-ESI+-HRMS-Orbitrap. El contenido promedio de diclofenaco en tabletas del producto fitoterapéutico a base de caléndula (Calendula officinalis) fue de ca. 40 - 42 mg/tableta (7 - 8%). El diclofenaco, un compuesto sintético de la familia de medicamentos llamados AINES, encontrado en el PFC analizado, no fue declarado en su etiqueta, que, según el Invima(1),(73 un producto fitoterapéutico “no podrá contener en su formulación principios activos aislados y químicamente definidos”, tal como es el caso del ácido 2-[2-[(2,6-diclorofenil)amino]fenil]acético (diclofenaco).
En esta investigación, que continúa, se detectó una cantidad muy baja (<1 mg) de flavonoides y no se hallaron (a niveles por encima del LOD de los equipos utilizados en la investigación) triterpenoides (e.g., faradiol, oleanano, maniladiol, etc.) o sus ésteres, que son las sustancias presumiblemente responsables por la actividad antinflamatoria de la caléndula. Para lograr un mayor control de calidad de los productos fitofarmacéuticos, se recomienda que la declaración de contenido de su etiqueta incluyese explícitamente componentes mayoritarios o característicos del ingrediente natural, independientemente de si se ha alcanzado el conocimiento de cuáles son las sustancias responsables por su actividad biológica. Las instituciones de control podrían involucrar las capacidades analíticas de los laboratorios universitarios y sus investigadores en las tareas de verificación de la composición de los productos fitoterapéuticos.