Introducción
Las infecciones por Staphylococcus aureus resistente a Meticilina (SARM) estuvieron relacionadas con individuos hospitalizados. Sin embargo, desde la década de los 90, se iniciaron reportes de infecciones por SARM adquiridas en la comunidad (SARM-AC), en algunos grupos con factores de riesgo como hacinamiento; asimismo, se presentaron informes desde entonces de casos en niños previamente sanos. A la fecha, se evidencia un claro incremento de los casos en regiones como Estados Unidos y América Latina1. Informes recientes de paises como Argentina reportan una prevalencia de casi 80 % de infecciones por SARM-AC en la población pediátrica, donde las infecciones de piel y tejidos blandos son las formas de presentación más frecuentes, hasta infecciones sistémicas como neumonia necrotizante, bacteremia, sepsis, entre otras2. Lo anterior plantea retos en el abordaje antimicrobiano inicial en los casos ambulatorios, donde clásicamente las cefalosporinas de primera generación son drogas de elección en cuadros iniciales de infecciones locales de tejidos blandos, hasta casos sistémicos como neumonias complicadas, donde en algunos grupos etarios no se tiene cubrimiento para SARM de forma convencional, por ejemplo, periodo neonatal o menores de tres meses. La mayoria de los protocolos de sepsis en esta edad están basados en ampicilina, asociados a un aminoglucósido o cefalosporina de tercera generación, y dejan por fuera el cubrimiento para SARM, conducta que debe tenerse en cuenta en la actualidad.
Se reportan dos casos: uno de neumonía complicada en un neonato y un segundo caso de infección de piel y tejidos blandos en un lactante menor. El manejo antibiótico inicial no contempló el cubrimiento para infección SARM, lo cual puede generar complicaciones, principalmente en caso de infecciones graves como neumonías; entre estas se destaca la prolongación de estancia hospitalaria, tratamientos más invasivos e impacto grave en gastos de salud, situación que puede ser más relevante en países subdesarrollados.
Caso 1
Recién nacido masculino, producto de primer embarazo, controlado y sin complicaciones. Parto vaginal a las 39 semanas sin complicaciones. A los 14 días de vida, presenta síntomas respiratorios como tos seca, rinorrea hialina y fiebre no cuantificada, por lo que acude a consulta; es manejado como rinofaringitis viral. Presenta deterioro en las siguientes 48 horas, dado por aumento de los episodios de tos y signos de dificultad respiratoria por taquipnea, retracciones intercostales y respiración ruda, por lo cual consulta nuevamente. A su ingreso presenta evidencia de dificultad respiratoria y SPO2 de 80 %, por lo cual se decide tomar hemograma que muestra leucocitos de 14 3 50 x 103 cel/μL y PCR de 197 mg/dl. La radiografía de tórax muestra opacidad en lóbulo superior derecho, por lo que se inicia esquema antibiótico con Ampicilina-Amikacina. Se decide remitir a la unidad de recién nacidos para continuar manejo. No hay antecedentes familiares ni perinatales de importancia.
A su ingreso requiere oxígeno por cánula nasal (1lt/min- SPO2 98 %). Se encuentra en aceptable estado general, alerta, hidratado y con frecuencia respiratoria 55 por minuto, frecuencia cardiaca 140 latidos por minuto, presión arterial 92/50/65 mm/hg. Al examen clínico presenta polipnea, leves tirajes bajos, sibilancias y crépitos difusos, de predominio en hemitórax derecho.
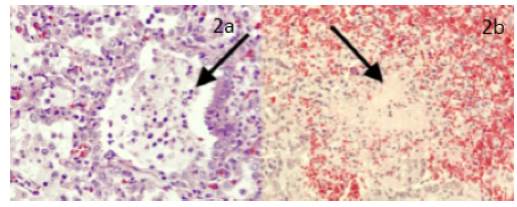
Laboratorios iniciales, con hemograma que reporta leucocitos de 19 3 50 x 103 cel/μL, N: 60 %, L 23 %, M 15 %, Eos 0,3 %, Baso 1,7 % y plaquetas 687 000 x 103/ μL, Hb 11,2 gr/dl, Hto 32,9 % y PCR de 259 mg/dl. Además, se toma panel viral que reporta positivo para virus sincitial respiratorio (VSR). Hemocultivos iniciales negativos. La radiografía de tórax a su ingreso muestra consolidación parenquimatosa del lóbulo superior e inferior del hemitórax derecho. Adicionalmente, hay presencia de cámaras aéreas del vértice pulmonar derecho y neumomediastino anterior (otros hallazgos asociados en Figura 1a). Se continúa con antibióticos de primera línea, pero por gran compromiso radiológico, se cambia a las 12 horas a Cefepime-Clindamicina;y esta se cambia a vancomicina (72 horas postingreso) por deterioro clínico, dado por fiebre, taquicardia y falla ventilatoria. Rx de tórax de control evidencia velamiento del hemitórax derecho (Figura 1b). Eco pleural reporta derrame pleural del hemitórax derecho. Presenta falla respiratoria, y es valorado por cirugía pediátrica, quien realiza toracostomía cerrada con salida de material purulento que se envía a estudio. Hay compromiso hemodinámico, por lo que requiere soporte inotrópico y altos parámetros ventilatorios por acidemia respiratoria e hipoxemia. Es llevado a tomografía contrastada, donde se evidencia empiema tabicado en el hemitórax derecho, por lo que es llevado a cirugía; se realiza decorticación pulmonar hasta lograr expansión pulmonar. Resultado de Gram de líquido pleural cocos Gram positivos escasos, reacción leucocitaria abundante, con reporte final de cultivo de líquido pleural de SARM, resistente a Clindamicina (ver Tabla 1). Dado el reporte, se suspende Cefepime. La muestra de patología reportó material fibrinopurulento, con focos de necrosis de licuefacción, colonias de bacterias cocoides en racimos, organizados en abscesos y dispersos en el parénquima adyacente; los septos presentan infiltrado inflamatorio; algunos vasos muestran trombosis; la superficie pleural presenta hemorragia (Figura 2a,2b). La evolución clínica muestra mejoría; completa catorce días de vancomicina y egresa para seguimiento ambulatorio.

Figura 1 a. Ensanchamiento del cardiomediastino (flecha doble) con leve desviación del mismo a la izquierda, asociado a opacidad parenquimatosa compleja del hemitorax derecho (flecha larga) sin mayor broncograma aéreo, con velamiento de ángulos costo y cardiofrénicos e imágenes de niveles hidroaéreos y/o cavidades aéreas (pseudoquísticas) de esta base pulmonar y al parecer extendida o comunicada al cardiomediastino (flecha corta); también hay desviación de columna aérea a la izquierda (*) y probable derrame subpulmonar derecho asociado. b. Opacidad hemitórax derecho por derrame pleural masivo (flecha corta), y atelectasia adyacente, desplazamiento del cardiomediastino a la izquierda (lecha larga).
Caso 2
Lactante menor de diez meses, sin antecedentes personales de importancia. Consulta por cuadro de un día de eritema y edema en dedo pulgar, tercio medio de la mano izquierda y sin limitación funcional. No hay síntomas constitucionales; adecuada tolerancia de la vía oral, por lo cual se decide iniciar manejo con Cefalexina a dosis de 50 mg/k/día. A las 48 horas presenta fiebre y persistencia de edema, mayor eritema y coloración verdosa a nivel central. Reconsulta por lo anotado, por lo cual se decide hospitalizar. El hemograma muestra leucocitos 16 4 50 x 103 cel/μL N: 75 %, linf 20 % M: 2 % Eos 3 %, plaquetas 465 000 x 103 /μL Hb 11,2 gr/ dl Hto 33,5 % y PCR 25 mg/dl. Se inicia manejo con Clindamicina a dosis de 30 mg/k/día. Presenta mejoría clínica progresiva, con drenaje espontáneo del absceso; se toma muestra para tinción Gram y cultivo de secreción. Resolución paulatina de signos inflamatorios (Figura 3a,b,c). No hay dolor a la palpación en dedo comprometido y resolución de signos de respuesta inflamatoria. Descenso de leucocitos y PCR. Cultivo de secreción positivo para SARM, sensible a Clindamicina (Ver Tabla 1). Egresa a las 72 horas y completa manejo antibiótico ambulatorio.

Figura 3 a. Día 2, compromiso del tercio medio del pulgar, mano izquierda. Edema, eritema y punto central indurado (Inicio de Cefalexina). b. Día 4, con persistencia de gran edema, mayor eritema, dolor a la palpación y centro verdoso. Limitación a la movilización y rubor (suspensión de Cefalexina e inicio de Clindamicina). c. Día 7, postdrenaje espontáneo de colección, aparición de costras y descamación peri-lesional.
Discusión
El Staphylococcus aureus es una bacteria considerada como comensal que puede encontrarse en fosas nasales, orofaringe, intestino y piel. Por disrupción de barreras de piel y mucosas, puede comportarte como patógeno, lo que origina infecciones de piel y tejidos blandos, que son principal causa de presentación clinica. Además, puede ser el punto inicial de infecciones sistémicas como sepsis, endocarditis, neumonia y osteomielitis, lo que está relacionado con mayor estancia hospitalaria y algunas veces con mortalidad3. Las infecciones por Staphylococcus aureus se han hecho cada vez más prevalentes, incluyendo las meticilino resistentes. Estas no se limitan al ámbito hospitalario, sino que cada vez son más frecuentes en pacientes ambulatorios, sin factores de riesgo predisponentes. Los casos de estudio son claramente ejemplo del espectro clinico de estas infecciones (SARM-AC), consideradas un germen emergente en la actualidad.
Estudios recientes demuestran que las infecciones de piel y tejidos blandos son las de mayor frecuencia (75 %), y se manifiestan como celulitis abscedadas, celulitis, abscesos y miositis, muchas veces relacionadas con antecedentes de trauma local3,4.
Sin embargo, puede existir compromiso sistémico e invasivo, con características clínicas de mayor virulencia, lo que las puede convertir en infecciones rápidamente invasivas, que derivan en condiciones amenazantes para la vida. Este comportamiento clínico ha estado relacionado con Panto-Valentine leucocidina (PVL), lo cual puede promover reclutamiento de leucocitos polimorfonucleares y mayor injuria tisular. Su producción está relacionada con un islote genómico (SCCmec) que codifica ocho serotipos. Los adquiridos en la comunidad son el IV-V, con menor resistencia a antibiótico no betalactámicos, pero con capacidad de producir PVL, la cual además está involucrada con el compromiso necrótico de estas infecciones, principalmente de piel y pulmón5.
Algunos factores de riesgo relacionados con estas infecciones son pobres condiciones de higiene, uso previo de antibióticos, colonización nasal por SARM-AC, infecciones cutáneas previas por SARM, previo contacto con trabajadores de la salud, entre otros. Además, la edad es un factor adicional, donde en los niños, debido a un sistema inmune menos efectivo y altas tasas de colonización nasal, se favorece la infección y diseminación del microorganismo5. Si bien el grupo de mayor riesgo son los niños entre 2 y 5 años, por debajo de este grupo etario también hay compromiso importante, como lo muestran los casos presentados4,6. Esta situación ya ha sido reportada en el país, con una incidencia del 41,2 % de infecciones por SARM-AC en niños menores de un año5. A esta edad, incluyendo el periodo neonatal, las infecciones de piel continúan siendo las de mayor prevalencia, pero el compromiso invasivo adquirido en la comunidad, como neumonía grave en neonatos previamente sanos, ha sido reportado. La presentación clínica es similar a niños mayores: falla respiratoria, fiebre e imágenes radiológicas compatibles con empiema y neumonía necrotizante7. Las infecciones virales, principalmente por influenza, están relacionadas como el factor que desencadena el desarrollo de neumonía grave. Esto provoca una disrupción del epitelio respiratorio, permitiendo una mejor unión de la PVL. Se cree que otros virus como el virus sincitial respiratorio pueden ser un factor de riesgo de severidad, similar a lo descrito con la influenza. Por lo cual, la evaluación etiológica debe incluir el estudio viral en todos estos pacientes con cuadro respiratorios bajos3,7.
Los diferentes clones varían en las regiones a nivel mundial. USA300 prevalece en EE. UU., Canadá y algunos pacientes de Europa; ST30 es más común en Australia, Japón y Grecia; ST80 es más común en Europa. Sin embargo, en algunos países como España la incidencia parece ser menor y los casos reportados no son autóctonos; situación que debe ser vigilada por el aumento del número de casos a nivel mundial8.
El manejo de estos cuadros debe ser establecido de acuerdo con el sitio y la severidad de la infección, así como con la epidemiología local, que incluye patrones de susceptibilidad antimicrobiana. Clásicamente, el manejo de infecciones de piel se realiza con antibióticos betalactámicos como cefalosporina de primera generación o Flucloxacilina9,10. Sin embargo, se observan fracasos terapéuticos como en el caso de estudio número 2. En caso de alta tasas de SARM-AC, una opción es el uso de Clindamicina o Trimetoprim Sulfametozaxol. El manejo con antibióticos tópicos como mupirocina o ácido fusídico podría ser alternativa, dependiendo del tamaño de la lesión10. Sin embargo, es importante conocer el porcentaje de resistencia a Clindamicina, de ahí la importancia de los reportes locales; esto determinará el inicio empírico en algunas situaciones clínicas.
En relación con el manejo de las neumonías complicadas, este se orienta a la esterilización de la cavidad pleural y al drenaje del líquido pleural, de forma precoz y con el menor trauma posible. La selección del antibiótico estará determinada por el grupo etario y la epidemiología local. Existen múltiples esquemas en menores de tres meses; este se determina por la presencia de derrame y por el estado de vacunación. Una primera opción sería ampicilina asociada a Cefotaxime, lo cual cubre gérmenes frecuentes a esta edad como Streptococcus pneumoniae9. Sin embargo, en casos graves otros gérmenes deben ser evaluados, como Staphylococcus aureus, lo que lleva a plantear otras opciones terapéuticas como Oxacilina o Clindamicina11, no obstante, el aumento de resistencia del Staphylococcus aureus a la Clindamicina y a otros antibióticos en los últimos años12 obliga a conocer el perfil de resistencia local a Clindamicina. Sin embargo, en el 2014 la sociedad de enfermedades infecciosas de USA recomendó el uso de vancomicina o Linezolid ante casos de infecciones pulmonares complicadas por SARM-AC asociado a un rápido drenaje del sitio comprometido, lo que optimiza la recuperación; además, busca la recuperación bacteriológica que permite optimizar la terapia antimicrobiana13. El uso irracional de antibióticos y la prescripción médica sin una investigación bacteriológica contribuyen al desarrollo de clones SARM-AC.
Es de anotar que comienzan a plantearse manejos menos agresivos en algunas situaciones clínicas como neumonía, con resultados clínicos favorables14. Esto debe estar asociado a la adecuada selección antibiótica de forma precoz.
Las infecciones por SAMR han emergido como un germen adquirido en la comunidad; la infección cutánea es la más prevalente, pero también se presenta con compromiso sistémico como neumonía, fascitis necrotizante, piomiositis, osteomielitis y sepsis15.
Hoy es posible plantear el cubrimiento del SARM-AC, sobre todo en regiones con reportes de alta prevalencia de infecciones por este germen, hasta resultados finales de cultivos que permitan ajustar la terapia. El estudio de los SARM debe ser completo, lo que permitirá determinar el genotipo circulante y posiblemente ajustar las terapias en cada situación clínica.
Desafortunadamente, en los casos anotados no se evaluó el genotipo del germen aislado, lo que habría permitido determinar la presencia de LPV; sin embargo, se ha documentado la circulación local de especies productoras de LVP en la población pediátrica16.
Es posible que deba existir una modificación de los esquemas antibióticos convencionales, en relación con el manejo de infecciones de piel y algunas infecciones sistémicas, según datos regionales de infecciones por SARM-AC, asociación con PLV, resistencia a Clindamicina, entre otros.