Introducción
El 31 de diciembre de 2019 se reportaron en Wuhan, China los primeros casos de una nueva forma de neumonía atípica grave en humanos, de etiología desconocida, se identificó como agente causal a un nuevo tipo de coronavirus, llamado SARS-CoV-2 (coronavirus tipo 2 del síndrome respiratorio agudo severo) y se denominó coronavirus disease 2019) COVID-19. Esta nueva enfermedad se encuentra actualmente en fase de pandemia con un alto índice de morbilidad y mortalidad en todo el mundo, genera cifras de enfermos y muertes que se incrementan día tras día, hasta el punto de colapsar los sistemas de salud de todas las naciones, por lo que este es un reto histórico para la salud pública de México y del mundo.
Los coronavirus son virus de ARN envueltos que se distribuyen ampliamente entre los humanos, otros mamíferos y aves; causan enfermedades respiratorias, entéricas, hepáticas y neurológicas1-6. La nueva enfermedad se propagó rápidamente a nivel nacional y mundial7,8.
A pesar de la propagación mundial, los patrones epidemiológicos y clínicos de COVID-19 siguen siendo poco claros, especialmente entre los niños, aunque los datos de varios países, incluido China, sugieren que los casos pediátricos de esta enfermedad podrían ser menos graves y presentar síntomas diferentes a los adultos3,9.
Estudios epidemiológicos informan que los niños han representado aproximadamente 2% de los casos diagnosticados en China, 1,2% de los casos en Italia y 5% en los Estados Unidos. En Canadá, hasta el 25 de abril, los niños ≤19 años representaron 4,7% de los casos confirmados10-12. En México, según la Dirección General de Epidemiología, hasta el 21 de septiembre de 2020, se habían reportado 13 607 casos en menores de 19 años (1,95% del total de casos)13, de los cuales la mayoría experimentó una enfermedad mínima o leve que no requirió hospitalización.
Hay una serie de hipótesis postuladas que explican el menor riesgo de que los niños se infecten y/o se vean afectados por SARS-CoV-2. Estas incluyen diferencias en la cinética viral, una carga de patógenos competidores en la mucosa y alteraciones en la respuesta inmune, incluida la susceptibilidad vascular a la infección por SARS-CoV-2. La enzima convertidora de angiotensina 2 es un mediador clave de la entrada del SARS-CoV-2 a la célula huésped en diferentes tipos de tejidos, y podría jugar un papel diferencial en la respuesta inflamatoria endotelial.
Otra hipótesis plantea que la posible asociación con otros virus respiratorios puede conferir inmunidad al SARS-CoV-2. Asimismo, se postula que los menores generan inmunidad natural con anticuerpos IgM, producida por las células B, que responden a antígenos nuevos, los cuales no se encuentran en los adultos. También se ha visto que los niños presentan menor producción de citocinas inflamatorias que los adultos. Adicionalmente, los niños, al no presentar comorbilidades como los adultos, tienen menos severidad de la enfermedad por SARS-CoV-214-20.
Esta enfermedad puede tener una amplia variedad de manifestaciones clínicas, que abarcan casos asintomáticos, cuadros de resfriado común, manifestaciones semejantes a las de la gripe, neumonía severa, síndrome de dificultad respiratoria agudo, sepsis, abdomen agudo, lesiones cutáneas, crisis convulsivas, choque séptico e incluso la muerte21-23.
El síntoma más común reportado en niños es fiebre, seguido de rinorrea, tos, síntomas gastrointestinales, cefalea y mialgia; también se han descrito astenia, odinofagia, vómito, hiporexia y estornudos9,10,20,24,25. Sin embargo, una proporción de niños con SARS-CoV-2 detectado por RT-PCR no tienen características clínicas o radiológicas de la enfermedad20,26,27. Si bien se ha propuesto que ocurre transmisión vertical, existe evidencia que sugiere que la adquisición perinatal es poco probable en el contexto de las medidas de higiene adecuadas en el momento del parto (higiene de manos y uso de mascarilla quirúrgica en madres positivas al SARS-CoV-2)20,26.
El estado proinflamatorio en niños puede estar asociado a COVID-19 severo similar al adulto9,20,28. En algunas regiones se ha reportado un síndrome inflamatorio multisistémico (MIS-C) varias semanas después de una posible infección por SARS-CoV-2, detectado por inmunoglobulina G (IgG) positiva al virus, con complicaciones cardíacas graves que incluyen hipotensión, choque e insuficiencia cardíaca aguda, que se acompañan de marcadores inflamatorios elevados29,30,31,32. Además, se han observado trombosis y embolia pulmonar con niveles elevados de dímero-D y fibrinógeno en pacientes graves33.
El estándar de oro para el diagnóstico de SARS-CoV-2, al igual que con otros coronavirus humanos, es la RT-PCR, que utiliza comúnmente genes que codifican la polimerasa interna dependiente de ARN y la glicoproteína de pico de superficie. La infección por SARS-CoV-2 también se puede determinar mediante la detección de anticuerpos contra el virus, que pueden ser útiles para ayudar en el diagnóstico de síndromes inflamatorios postinfecciosos en niños. El primer marcador serológico detectable son los anticuerpos totales, aunque el ensayo inmunoabsorbente ligado a enzimas (ELISA) de IgM e IgG se ha documentado como positivo a los cuatro días de aparición de los síntomas20.
Las alteraciones más frecuentes en los estudios de laboratorio en pacientes pediátricos son linfopenia, incremento de procalcitonina, dímero-D, creatincinasa fracción MB y PCR34. El engrasamiento bronquial leve y las opacidades en vidrio deslustrado son los principales hallazgos radiológicos en la radiografía de tórax o en la tomografía computarizada, y pueden ser evidentes en niños asintomáticos20.
Debido a la situación actual de esta enfermedad, a la variabilidad de la presentación clínica reportada alrededor del mundo en pacientes pediátricos y al incremento constante de casos y muertes, la presente investigación plantea describir y analizar las características clínicas y epidemiológicas de población pediátrica con sospecha de COVID-19 del HGR C/MF N.o 1 en el IMSS de Cuernavaca, Morelos.
Métodos
Diseño de estudio
El presente es un estudio observacional, con una caracterización inicial de orden transversal analítico, y con un componente longitudinal o de seguimiento de un grupo de menores que presentaron desenlaces como mejoría, traslado o defunción por sintomatología respiratoria. El estudio se llevó a cabo en el Hospital General Regional con Medicina Familiar N.° 1, con información de niños atendidos de forma ambulatoria y hospitalizados en el IMSS de Cuernavaca, Morelos, Lic. Ignacio García Téllez (HGR C/MF N.° 1)
Población de estudio y fuentes
Correspondió a un grupo de niños y adolescentes, de ambos sexos, con sintomatología respiratoria como caso sospechoso o probable de COVID-19, que fueron atendidos de forma ambulatoria en medicina familiar, y otros que, por la sintomatología que presentaban, fueron llevados al servicio de urgencias pediátricas del hospital.
Esta información se registró y se sistematizó en expedientes clínicos, los cuales fueron la fuente principal, y se complementaron con los datos provenientes del Sistema Único de Información de Vigilancia Epidemiológica (SINOLAVE) y del Sistema Institucional de Optimización de Camas (SIOC).
Fueron incluidos para el análisis hombres y mujeres, recién nacidos hasta 15 años y 11 meses, derechohabientes del HGR C/MF N.° 1, Cuernavaca, Morelos, que fueron llevados a revisión con sintomatología respiratoria como caso sospechoso y/o probable de COVID-19; asimismo, se incluyeron hijos de madres con sospecha de la enfermedad, a quienes se les realizó prueba de RT-PCR. Se tuvo en cuenta a quienes recibieron tratamiento ambulatorio y a quienes por la sintomatología ameritaron hospitalización.
No se realizó estimación del tamaño de muestra, debido a que fueron incluidos todos los participantes que recibieron atención médica en medicina familiar o en el servicio de urgencias, desde el mes de abril hasta el 14 de septiembre de 2020.
En el componente transversal analítico, la variable dependiente correspondió al resultado del laboratorio clínico positivo (SARS-CoV-2) o negativo (agente infeccioso diferente a SARS-CoV-2). Para la presente investigación, se realizó una caracterización de variables sociodemográficas (sexo y edad), antecedentes clínicos (enfermedad crónica, obesidad, enfermedad neurológica, cardiopatía, alteraciones cromosómicas) y síntomas clínicos (crisis convulsivas, fiebre, tos, cefalea, odinofagia, malestar general, artralgias, mialgias, rinorrea, escalofrío, dolor abdominal, conjuntivitis, disnea, cianosis, dolor torácico, polipnea, irritabilidad y diarrea), así como diagnóstico de neumonía.
En el componente longitudinal, la variable dependiente correspondió al tiempo de estancia hospitalaria (fecha de egreso menos fecha de ingreso), sumado al resultado que tuvieron los pacientes al egreso (fallecido o no fallecido). Las variables independientes fueron las mismas respecto al componente transversal.
Procesamiento y análisis de información
Se realizó análisis transversal, con enfoque analítico, donde los casos correspondieron a los pacientes que fueron positivos para SARS-CoV-2; los controles fueron los pacientes negativos para este agente infeccioso. Se generó un análisis bivariado, con las variables independientes sociodemográficas, antecedentes clínicos y sintomatología clínica (incluidos los que requirieron o no hospitalización). Para realizar análisis bivariado se usó la prueba de chi-cuadrado y exacta de Fisher. Se empleó un valor p < 0,05 para identificar diferencias estadísticamente significativas entre los dos grupos.
En el análisis longitudinal, se realizó un análisis bivariado y análisis múltiple. Para el análisis bivariado se realizaron gráficos de Kaplan Meier con la prueba de log rank. El análisis múltiple se empleó para evaluar el resultado del egreso hospitalario, empleando un análisis de regresión logística, en el cual la variable dependiente fue el resultado al final del egreso: 0 (mejoría), 1 (defunción). Las independientes fueron sexo, 0 (mujeres), 1 (hombres); diarrea 0 (no) 1 (sí); hospitalización 0 (ambulatorio) 1 (hospitalizado); y edad, la cual, solo con fines de análisis, se categorizó de la siguiente manera: 0 (recién nacido a 5 años), 1 (5 a 10 años), 2 (mayores de 10 años). Los datos obtenidos fueron registrados inicialmente en una base de datos de Excel, y el análisis estadístico se realizó con el paquete estadístico STATA, versión 13.
Resultados
La muestra estuvo conformada por 98 niños clasificados como caso probable para COVID-19 (59 ambulatorios y 39 hospitalizados); a todos se le realizó prueba de RT-PCR. Del total de niños, 24 presentaron resultado positivo (24,5 %), mediana de edad de 64,4 meses (rango entre 0 a 202,9 meses), 43 eran de sexo femenino y 55, de sexo masculino. De los niños que tuvieron manejo ambulatorio, 14 presentaron resultado positivo. De los que requirieron manejo hospitalario, 10 fueron positivos.
Del total de niños, 84,7 % alcanzaron la mejoría y fueron enviados a casa, mientras que 4 niños fueron trasladados a nivel superior de atención. De los 98 niños, 11 fallecieron, 7 con resultado negativo y por otras patologías no asociadas a infección por SARS-CoV-2. Los 4 restantes presentaron prueba positiva para SARS-CoV-2, y, además, tenían comorbilidades como desnutrición, hipotiroidismo congénito, retraso del desarrollo psicomotor, síndrome de Down y malformaciones congénitas.
La mayoría de los menores no presentaba una enfermedad preexistente (82,7 %), sin embargo, 4 niños tenían obesidad, 4 presentaban antecedente de alguna enfermedad neurológica y 8 niños tuvieron diagnóstico de neumonía. Entre los síntomas reportados más frecuentes estuvieron: fiebre (87,8 %), tos (76,5 %), cefalea (55,1 %), irritabilidad (44,9 %), odinofagia (43,9 %), malestar general (40,8 %), mialgias (41,8 %), escalofrío (41,8 %), inicio súbito (39,8 %), artralgias (37,8 %), rinorrea (32,6 %), disnea (28,6 %), diarrea (27,6 %), y crisis convulsivas (3 %).
Se realizó análisis bivariado, en donde la variable dependiente fue el resultado de la RT-PCR (positivo o negativo). Como se reportó previamente, para este análisis se empleó la prueba de chi-cuadrado o la prueba exacta de Fisher, según las características de la variable. No se encontró asociación entre el sexo, la condición de ambulatorio u hospitalizado o el desenlace (mejoría/ defunción) con el resultado de la prueba (p > 0,05) (ver Tabla 1).
Tabla 1 Características sociodemográficas y clínicas de población pediátrica con sospecha de COVID-19 en el IMSS, Cuernavaca, Morelos.
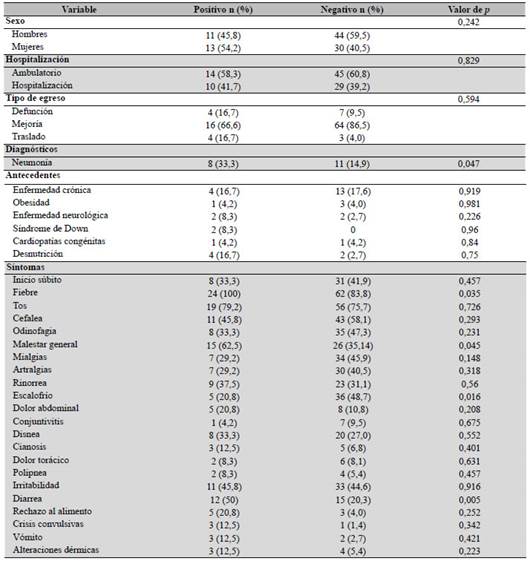
Al analizar las comorbilidades de los niños, se encontró una diferencia estadísticamente significativa marginal entre quienes tuvieron diagnóstico de neumonía, según el resultado de la prueba (p = 0,047). Para otras patologías crónicas y para la obesidad, se identificaron diferencias más frecuentes en aquellos niños con resultado negativo. Por el contrario, en niños con enfermedades neurológicas, el resultado positivo fue más prevalente, sin embargo, ninguna de estas diferencias fue significativa (p > 0,05) (ver Tabla 2).
Tabla 2 Probabilidad de muerte en pacientes pediátricos en el Hospital General Regional con Medicina Familiar N.° 1 IMSS, Cuernavaca, Morelos
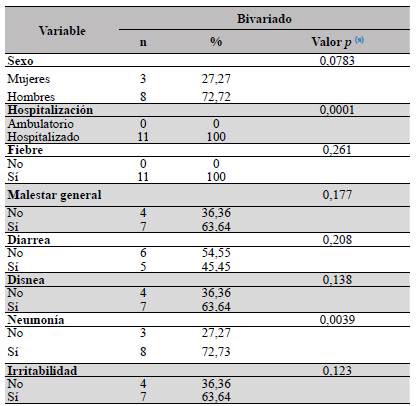
a) Prueba exacta de Fisher
Cuando se evaluó la sintomatología de los niños, se identificaron resultados estadísticamente significativos entre aquellos que presentaron fiebre (p = 0,035), escalofrío (p = 0,016) y diarrea (p = 0,005). Para los demás pacientes, con otros síntomas y signos, no hubo diferencias estadísticamente significativas.
Discusión
Hasta finales de 2020, no se encontraba evidencia clara y precisa sobre COVID-19 en niños. Los reportes a nivel mundial mencionan menor severidad en comparación con los adultos, debido a las diferencias en las manifestaciones clínicas y en la respuesta fisiopatológica, soportada en las hipótesis inicialmente planteadas entre estos dos grupos poblacionales9,14-20,33. En el presente estudio se describen las principales características clínicas y epidemiológicas de la población pediátrica con sospecha de COVID-19 del HGR C/MF N.° 1 en el IMSS de Cuernavaca, Morelos, se contó con una muestra de 98 niños, de los cuales 24 presentaron resultado positivo para SARS-CoV-2, detectado mediante RT-PCR. Entre los niños positivos, 14 (58,3 %) tuvieron manejo ambulatorio y 10 (41,6 %) fueron hospitalizados debido a sus condiciones clínicas. Del total de niños con resultado positivo, 4 fallecieron (16,6 %), los niños hospitalizados presentaron mayor riesgo de mortalidad.
La proporción de casos confirmados por RT-PCR en este estudio fue de 24,4 %, en comparación con lo reportado por Dong et al., en cuyo estudio la proporción de casos confirmados fue de 34,1 %35. Al comparar ambos estudios, es importante recordar que el número de casos positivos reales hasta la fecha es incierto debido a que, aunque la especificidad de la prueba es hasta de un 95 %, la sensibilidad de la prueba es del 70 %35, además, el número de pruebas realizadas en cada país varía de acuerdo a sus políticas internas, lo cual afecta la estimación de la incidencia real de la enfermedad36.
Del total de pacientes sospechosos, se encontró una proporción de niños del 56,1 %, cifra similar a la reportada en el estudio de Dong et al., en donde la proporción de niños fue del 56,6 %; no se encontraron diferencias significativas entre niños y niñas37. La mediana de edad en el presente estudio es de 5,4 años, igual a la reportada en Europa38.
En cuanto a las características clínicas, entre los casos confirmados, se encontraron como síntomas principales fiebre (100 %), tos (79,2 %), malestar general (62,5 %), diarrea (50 %) cefalea (45,8 %) e irritabilidad (45,8 %); de estos, el 33,3 % tuvo diagnóstico de neumonía. En contraste, estudios realizados en Italia por Parri et al.39 reportan como síntoma principal fiebre (48 %), tos (43 %), rechazo a la alimentación (35 %) y rinorrea (20 %), y el estudio realizado en Zhejiang por Qiu et al.34 reporta 53 % de casos con diagnóstico de neumonía y como síntomas principales fiebre (36 %), tos (19 %) y cefalea (8 %) (ver Tabla 4).
Tabla 4 Características clínicas y epidemiológicas en niños con prueba de RT-PCR positiva para SARS-CoV-2 del HGR C/MF No 1 Cuernavaca y otros reportes internacionales.
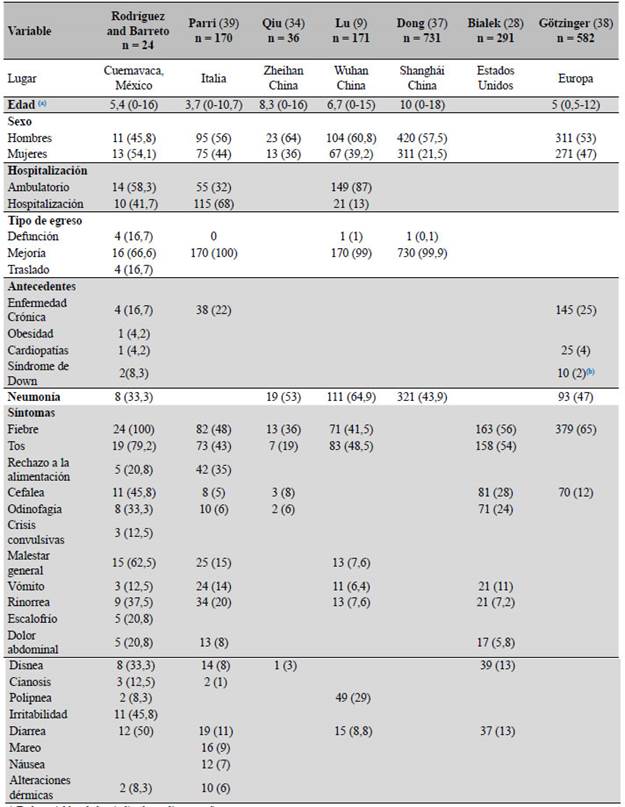
a) En la variable edad se indica la mediana en años.
b) En el estudio realizado en Europa por Gótzinger et al. se reportan únicamente alteraciones cromosómicas no especificadas.
En el presente estudio, los niños hospitalizados presentaron menor supervivencia, de los casos positivos se encontró una tasa de letalidad del 16,6 %, que contrasta con los reportes de China, donde la tasa de letalidad es menor al 1 %9,37, y los de Italia, donde no se reportan defunciones39, esto hace referencia a la gravedad de la enfermedad de los pacientes de este estudio. De los cuatro niños con desenlace fatal, el primero ingresó referido de otro hospital con antecedente de probable broncoaspiración y retraso en el desarrollo; el segundo, con antecedente de desnutrición, retraso del desarrollo, y presentó a su ingreso datos de insuficiencia respiratoria severa y choque séptico; el tercero, con antecedente de síndrome de Down, desnutrición severa y atresia tricuspídea, ingresó por crisis de hipoxia; y el cuarto, sin comorbilidades, ingresó por estado epiléptico.
En la población de niños estudiados, no se documentó ningún caso con datos clínicos de síndrome inflamatorio multisistémico, en contraste con reportes como el de Chiotos et al.40,donde se describen estos síntomas en niños estadounidenses asociados a infección por SARS-CoV-2.
Respecto a las comorbilidades en los niños, 4 (16,7 %) tenían antecedente de enfermedad crónica; 2 (8,3 %), síndrome de Down; 1 (4,2 %), obesidad, y un 1 niño (4,2 %), cardiopatía. La proporción de enfermedades crónicas y obesidad fue casi igual entre aquellos en los que se les confirmó la enfermedad por RT-PCR (4,2 %) y en los que no (4 %), sin embargo, sí fue mayor, en los casos positivos, la presencia de diagnóstico de neumonía (33,3 %).
Es importante mencionar que el presente estudio tiene una serie de limitantes y fortalezas. Una de las limitantes es la obtención de los datos de fuentes secundarias, es decir, los registros orientados al manejo clínico y epidemiológico que ha dispuesto el IMSS para pacientes con sintomatología respiratoria no son obtenidos con fines de investigación, por tanto, en el componente transversal, en el seguimiento y registro posterior, se encontraron problemas de registro de algunos de estos. Otra limitante correspondió a la muestra estudiada, fueron menos de 100 pacientes, y en especial menos de 30 que dieron positivo para SARS-CoV-2, lo cual imposibilitó realizar un análisis de supervivencia múltiple por el bajo número de "fallas" en la población estudiada. De igual forma, los "factores pronósticos" identificados con el análisis de regresión logística evidencian el problema del tamaño de muestra, por los intervalos de confianza muy amplios y la ausencia de significancia estadística para el antecedente de diarrea.
No obstante, las potenciales limitantes, esta es una investigación que presenta resultados de pacientes con sintomatología de COVID-19 (cerca de una cuarta parte de ellos confirmados), lo cual está dentro de las primeras evidencias de esta patología en niños de México y de América Latina. El estudio fue realizado en un hospital público de segundo nivel de atención, que concentra a la mayoría de los pacientes pediátricos con sospecha de COVID-19 del estado de Morelos, esto abre la oportunidad para realizar futuras investigaciones con diseños epidemiológicos con mayor fortaleza metodológica que permitan evaluar causalidad entre los factores de riesgo y la infección por SARS-CoV-2 en niños mexicanos.
















