Introducción
La hipertensión arterial sistémica (HTA) se caracteriza por una presión arterial (PA) persistentemente alta en las arterias sistémicas1. Constituye el principal factor de riesgo para morbilidad y mortalidad cardiovascular a nivel global; afecta a todas las edades, sin distinción entre género y etnicidad2. Su prevalencia está aumentando globalmente debido al envejecimiento de la población, especialmente en países de ingresos bajos y moderados. Algunos estimados sugieren que el 31,1 % de los adultos a nivel mundial (1,39 billones de personas) tenía cifras tensionales ≥140 mmHg y/o diastólica ≥90 mmHg en el 20 1 03. A nivel Latinoamericano, afecta entre el 20 y 40 % de adultos, y la mortalidad cardiovascular en la mayoría de estas regiones se facilita por el incremento en la frecuencia de HTA4. En Colombia, Zurique et al.5 realizaron una revisión sistemática para determinar la prevalencia de la HTA, y encontraron que es de 24 %, con mayor preponderancia a mayor edad, y menos prevalente en el área urbana en un 21 %5.
La HTA se cataloga como la principal causa de discapacidad ajustada por años en el mundo; su control subóptimo es el factor de riesgo atribuible más común para enfermedad cardiovascular (ECV) y cerebrovascular, enfermedad arterial coronaria (EAC) y otras formas de ECV, incluida la insuficiencia cardíaca y la enfermedad arterial periférica (EAP)6.
La U. S. Preventive Services Task Force (USPSTF) recomienda un tamizaje anual de HTA en los adultos mayores de 40 años y en quienes tienen alto riesgo de HTA, lo cual incluye personas con cifras tensionales entre 130-139/85-89 mmHg, con sobrepeso u obesidad y afrodescendientes. En contraste, para quienes tienen entre 18 a 39 años, se recomienda tamizaje cada 3 a 5 años con cifras tensionales menores de 130/85, cuando no hay otros factores de riesgo7.
El control de la HTA es, por tanto, un objetivo mayor para cada servicio de salud. En Estados Unidos se ha observado una mejor detección y control de la misma en los últimos 30 años, pues se pasó de 27,3 % entre 1988-1994 a 50,1 % en 2007-2008; las tasas de control en países europeos son similares. No obstante, en los países sudamericanos incluidos en el estudio PURE (Argentina, Brasil, Chile y Colombia), solo el 35,5 % de los pacientes con diagnóstico de HTA que recibían medicamentos tenían controlada su presión arterial8. Entre los factores que coadyuvan con el mal control se encuentran la baja adherencia a la medicación, que es común, y la inercia terapéutica por parte del médico6. El manejo acertado de la HTA y el uso adecuado de los medicamentos es un punto crítico para prevenir complicaciones derivadas del pobre control y lograr así una optimización del tratamiento para alcanzar la meta individualizada. El objetivo de este artículo es dar a conocer el manejo actualizado de la HTA, con el conocimiento de los fenotipos y los puntos clave para la elección de la terapia antihipertensiva más adecuada.
Fenotipos intermedios de HTA
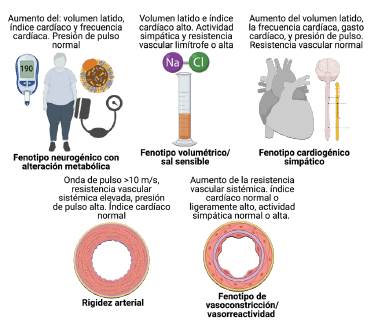
El equipo Sicor9 propone dividir la hipertensión esencial en cinco fenotipos intermedios, entre los que se destacan:
Respuesta cardiogénica simpática, que indica una variante genética del receptor beta-2 adrenérgico que lleva a un patrón hiperdinámico circulatorio. Entre algunas formas clínicas compatibles con hipertensión cardiogénica se encuentra la HTA paroxística, lábil, resistencia a la combinación IECA o ARAII + diurético, HTAa edad temprana (<20 años), abuso de alcohol, apnea del sueño. En este grupo de pacientes se recomienda el uso de betabloqueadores o calcioantagonista no dihidropiridínicos.
Fenotipo neurogénico con alteración metabólica, en donde la obesidad aumenta las cifras tensionales en relación con un incremento de la actividad del sistema nervioso simpático, por estimulación de los receptores periféricos alfa 1.
Fenotipo volumétrico y de alteración en la excreción renal del sodio y agua, que se caracteriza como renina alta, normal o baja. En la HTA sensible a la sal se evidencia la pérdida del descenso nocturno o patrón invertido en el monitoreo ambulatorio de la presión arterial (MAPA). En este grupo de pacientes es recomendable iniciar o aumentar los diuréticos.
El fenotipo de vasoconstricción y aumento primario de la resistencia vascular sistémica es el más difícil de evaluar. En este se recomienda iniciar o aumentar ARA II, calcioantagonista dihidropiridínicos o vasodilatadores.
Aquellos pacientes con aumento de la rigidez de grandes vasos muestran aumento en la presión de pulso. Se prefieren los fármacos vasodilatadores del grupo de ARA-II, diuréticos tipo espironolactona y los nitratos de larga acción. La Figura 1 ilustra los fenotipos intermedios de la HTA.
Metodología
Se realizó una búsqueda avanzada con los términos Descriptores en Ciencias de la Salud (DeCS) y Medical Subject Headings (MeSH): hipertensión, agentes antihipertensivos, hipertensión esencial, terapia combinada. Se usaron los motores de búsqueda PubMed, Clinical Key, Lilacs, Scielo. Se obtuvo un total de resultados entre artículos originales, revisión de literatura, guías de manejo de 3639 artículos. Se seleccionó un total de 109 artículos que fueron utilizados para la realización de la presente revisión de la literatura.
¿Qué papel tiene la frecuencia cardíaca (FC) elevada en el manejo de la HTA?
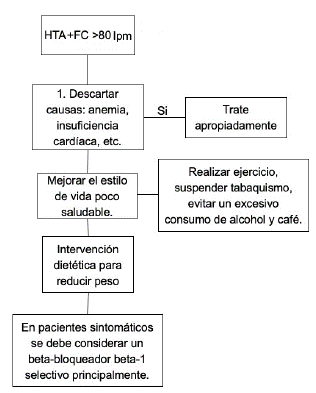
La medición de la FC en reposo es uno de los elementos más importantes del examen físico, pues provee algunos datos clave de la condición del paciente, incluidos el estado general de salud, la condición del sistema cardiovascular y su regulación autonómica10. La evidencia indica que la FC elevada en reposo puede ser considerada como un determinante de aterosclerosis11 y un predictor independiente de morbilidad y mortalidad cardiovascular, incluyendo muerte cardíaca súbita, incluso después de ajustes con modelo multivariado para otros factores de riesgo convencionales10. Los pacientes hipertensos con una FC >80 latidos por minuto (lpm) tienen un incremento de muerte por estas causas y a nivel cardiovascular, con el mayor riesgo entre 81-90 lpm11.
En este contexto, se ha intentado dilucidar el uso de medicamentos como la ivabradina, que inhibe selectivamente la corriente If (Funny) y disminuye el consumo miocárdico de oxígeno y la FC, motivo por el que muchos de sus estudios se centran en enfermedad coronaria estable12,13. En materia de HTA, se ha descrito que por acciones pleiotrópicas impacta sobre la inflamación, oxidación y aterosclerosis, con efectos incluso en la inhibición del SRAA, lo que lleva a la reducción del remodelado vascular14, reducción de la rigidez arterial y vasodilatación dependiente e independiente de endotelio, con la disminución subsecuente de la PA14,15.
En los pacientes hipertensos, la meta de FC permanece poco clara, pero la reducción de al menos 10 lpm de la basal puede proveer beneficios que necesitan ser confirmados en los estudios prospectivos16. Un algoritmo resume el enfoque del paciente hipertenso con taquicardia en la Figura 2.
Beta-bloqueadores (BB): las guías de manejo actual no consideran la edad como un factor fundamental para la elección de los medicamentos antihipertensivos de primera línea. De hecho, las guías de la sociedad internacional de HTA (ISH) más recientes recomiendan que los BB deben ser considerados en cualquier momento del tratamiento, cuando exista alguna indicación para su uso como insuficiencia cardíaca, angina, posterior a infarto agudo de miocardio (IAM), fibrilación auricular o mujeres jóvenes con o en plan de embarazo17. Por su parte, las guías europeas describen que los BB son menos efectivos que los bloqueadores del SRAA y los calcioantagonistas (CA) al momento de prevenir o generar disminución de la hipertrofia ventricular izquierda(HVI), engrosamiento de la íntima media arterial carotídea (CIMT), rigidez arterial y del remodelado de las pequeñas arterias18.
No obstante, tal como se mencionó previamente en los fenotipos intermedios, la HTA en los pacientes jóvenes o de edad media está frecuentemente relacionada con obesidad, y su base se sustenta en una alta actividad simpática, lo que constituye una situación favorable para el uso de BB o IECA que reducen la actividad nerviosa simpática19.
Inclusive, las guías canadienses consideran la monoterapia de BB en pacientes menores de 60 años, y como primera línea en pacientes con hipertensión diastólica con o sin hipertensión sistólica20. Por este motivo, los estudios han demostrado una reducción más significativa de la PA sistólica en obesos, comparado con los pacientes hipertensos delgados, sin embargo, por su asociación con cambios metabólicos, especialmente ganancia de peso y alteración glicémica o lipídica, no son recomendados como primera línea en este grupo de pacientes21-23. No obstante, los BB de tercera generación como nebivolol y carvedilol21 no solo han demostrado ser mejor tolerados que los BB no vasodilatadores, sino que no aumentan el riesgo de DM, dislipidemia aterogénica o ganancia de peso24, e incluso se ha documentado que tienen un efecto similar sobre la reducción de las cifras tensionales así como sobre los niveles de glicemia, insulina, LDL y apolipoproteína B25. Cabe destacar que recientemente Nazarzadeh et al.16 realizaron un metanálisis en el cual encontraron que el uso de BB aumenta el riesgo de nuevo inicio de DM (RR 1,48), aunque no mencionaron los nombres de los BB estudiados.
Otro punto por considerar es que los BB son capaces de reversar el proceso de aterosclerosis, así como disminuir el riesgo de ruptura de placa; por este motivo, la evidencia concluye un efecto favorecedor para su uso en <60 años por su impacto en la reducción de mortalidad, accidente cerebrovascular (ACV) e IAM en este grupo de pacientes; aunque cabe anotar que es un beneficio no evidenciado en fumadores ni mujeres19.
Thomopoulos et al.11 realizaron un metaanálisis en el que encontraron que comparados con otros agentes antihipertensivos, los BB parecen ser menos protectores frente al ACV y ante todas las causas de muerte, pero cuando se usan como agente adicional antihipertensivo ante PA con modesta elevación, exhiben un efecto reductor de todos los eventos.
Inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas de los receptores de angiotensina II (ARA-II): constituyen la clase de medicamentos antihipertensivos más ampliamente usados18. Cuando se comparan los IECA con ARA-II en pacientes con HTA, se ha documentado que no existen diferencias en términos de eficacia ni de resultados evaluados de mortalidad por causas cardiovasculares, IAM, insuficiencia cardíaca, ACV y enfermedad renal en estadio final, pero se atribuye a los ARA-II un mejor perfil de seguridad con menos efectos adversos (22 % menor), por lo que el análisis riesgo-beneficio indica que actualmente, dependiendo de la disponibilidad o accesibilidad, se debe preferir el uso de ARA-II sobre IECA en el tratamiento de la HTA28. Cabe resaltar que la combinación de estos dos grupos de medicamentos no se recomienda, pues no existe un beneficio añadido en los resultados y, por el contrario, se ha descrito un exceso de eventos adversos renales18. Cuando se comparan los diferentes tipos de IECA, se ha encontrado que el captopril posee la tasa de mortalidad más alta comparada con otros IECA, sin diferencias de mortalidad con el uso de lisinopril, perindopril e imidapril comparado con ramipril29.
Aunque al comparar los IECA con ARA-II, como se mencionó previamente, existe una eficacia similar, incluso en revisiones sistemáticas y metaanálisis30, estudios cabeza a cabeza han encontrado una tendencia a mayor eficacia hipotensora entre los ARA-II. Zou et al.31 realizaron un metaanálisis en donde documentaron que el telmisartán provee un control de PA superior, menor número de eventos adversos y mejor tolerabilidad cuando se compara con enalapril, ramipril y perindopril. En comparación con otros ARA-II, el olmesartán demostró una reducción significativamente mayor comparado con losartán, valsartán, irbesartán, e incluso fue superior al olmesartán/amlodipino respecto al perindopril/amlodipino32. Un estudio cabeza a cabeza en donde se comparó el candesartán con losartán encontró una reducción significativamente mayor con 8 mg de candesartán comparado con 50 mg de losarán33.
Por su parte, el azilsartán exhibe la acción antihipertensiva más potente cuando se compara con otros de su clase en ensayos clínicos aleatorizados; se encontró que tenía mayor efecto hipotensor con diferencias estadísticamente significativas comparado con valsartán, olmesartán, candesartán e incluso ramipril34. Aunque no hay un estudio que compare directamente eprosartán con azilsartán, este medicamento es el que alcanzó mayores reducciones en la PA en el estudio POWER35. El azilsartán ha demostrado que mejora la función diastólica en pacientes con HTA y puede ser una opción en pacientes con insuficiencia cardíaca con FEVI preservada36.
Los IECA o ARA-II deben ser evitados durante el embarazo o en mujeres con potencial de embarazarse, hipercaliemia >5,5 mmol/L, estenosis renal bilateral y, en el caso de IECA, en el antecedente de edema angioneurótico previo18. En la Tabla 1 se comparan los distintos grupos de medicamentos y se indica el contexto en el que se debe elegir un ARA-II sobre el otro.
Tabla 1 Manejo individualizado basado en el perfil de renina/aldosterona. Adaptado de 40,57. Convenciones: IECA, inhibidor de enzima convertidora de angiotensina. ARA-II, antagonista de los receptores de angiotensina II. CA: Calcioantagonista
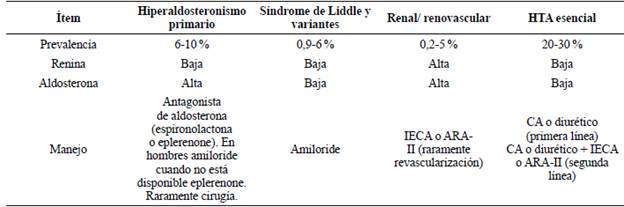
Medición de los niveles de renina: forma parte del algoritmo de estudio de HTA resistente, e incluso se ha demostrado su beneficio en personas con HTA mal controlada en tratamiento31. Sin embargo, en el manejo de la HTA esencial continúa siendo controversial, pues no se ha evaluado su costo-efectividad en ensayos clínicos grandes que estimulen su uso generalizado38,39.
Recientemente, se ha descrito que la HTA esencial con renina baja afecta al 30 % de pacientes, presenta también niveles disminuidos de aldosterona, es más común en adultos mayores y de raza negra, con causas multifactoriales, entre las que destaca un consumo excesivo de sodio, reducción en las nefronas (nefropatía diabética), glomerulonefritis crónica, estrés, uso de antinflamatorios no esteroides (AINES); se presenta clínicamente como apnea obstructiva del sueño, obesidad, síndrome metabólico, síntomas cardíacos y neuromusculares40. En el caso de HTA esencial con renina baja, se evidencia una mayor tasa de éxito con el uso de diuréticos y vasodilatadores41. Muchos medicamentos antihipertensivos son efectivos, sin embargo, por la sensibilidad volumétrica y al sodio, se ha determinado que los diuréticos son los medicamentos de elección y que el uso de IECA o ARA-II también es efectivo, pues los niveles tisulares de renina se elevan42. La Tabla 2 compara el manejo de los diferentes tipos de HTA con renina baja.
Tabla 2 Comparación de efecto hipotensor de medicamentos comparado con placebo. Convenciones: IECA: inhibidor de enzima convertidora de angiotensina. ARA-II: antagonista de los receptores de angiotensina II. CA: calcioantagonista. HTSa: hipertensión sistólica aislada.
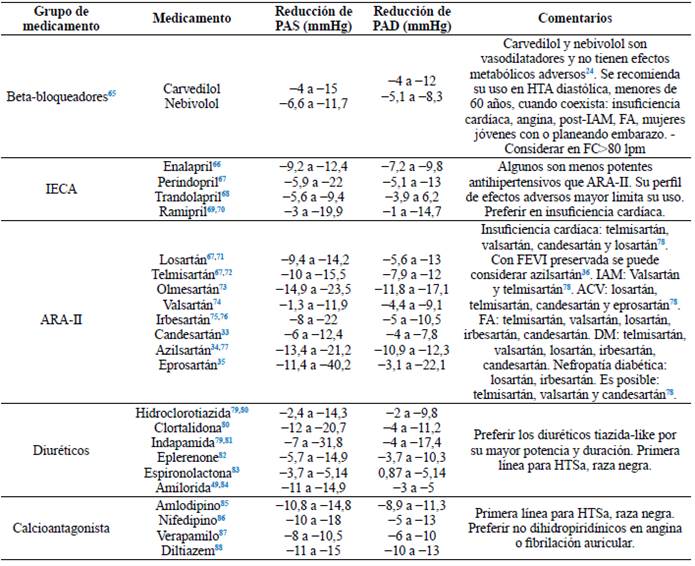
Diuréticos: los diuréticos tiazídicos (DT) o tiazida like han permanecido como la piedra angular en el tratamiento antihipertensivo desde su introducción en 196018. Diferentes ensayos clínicos, entre los que se incluyen metaanálisis, han demostrado su efecto protector sobre la reducción del riesgo de eventos cardiovasculares, con un efecto mayor entre los tiazida-like, especialmente en insuficiencia cardíaca43, con un 12 % de reducción de riesgo adicional para eventos cardiovascular y 21 % para insuficiencia cardíaca comparado con DT44. Por este motivo, la guía ISH indica que al optimizar el manejo, se debe realizar una elección adecuada de diuréticos en donde se prefiera el uso de tiazida-like en lugar de DT11, pues, además, la duración es mayor (hidroclorotiazida de 16-24 horas, clortalidona de 48-72 horas e indapamida >24 horas)45. No obstante, el uso de hidroclorotiazida sigue mostrando efectos protectores y eficacia similar, comparado con otra clase de medicamentos antihipertensivos46.
La guía europea, por su parte, indica que tanto los tiazídicos como tiazida-like pueden ser aptos para el manejo de la HTA, y sus efectos adversos metabólicos y de reducción del potasio pueden ser atenuados con el uso de un diurético ahorrador de potasio. Se deben usar únicamente ante tasa de filtración glomerular (TFG) mayor a 30 mL/min, pues los diuréticos de asa serían los de elección con una TFG menor18.
Debido a que todas las formas de HTA tienen retención de sodio como el principal mecanismo para el incremento de la PA, los DT se consideran en las guías como primera línea de manejo junto con los IECA, ARA-II y calcioantagonistas (CA), y deberían ser usados especialmente en pacientes diabéticos, adultos mayores, afrodescendientes, con historia de ACV, con niveles bajos de renina, así como en pacientes con insuficiencia cardíaca, HTSa45.
Roush y cols.41 encontraron que los diuréticos tiazida-like y los ahorradores de potasio reducen la hipertrofia ventricular izquierda (HVI) dos veces más que los DT entre pacientes con HTA, sin que estén relacionados con la reducción de la PA, pues fue similar entre ambos grupos. En contraste, un metaanálisis realizado por Liang et al.48 mostró que los tiazida-like son superiores a los DT en la reducción de la PA, sin aumentar la incidencia de hipocaliemia o generar algún cambio en glicemia o colesterol total. Cabe resaltar que todos tienen efectos como el descenso de potasio; la indapamida es neutra sobre el aumento de glicemia y lípidos, pero sí se ha documentado que todos tienen efecto aumentando niveles de ácido úrico45. Por su parte, no hay estudios cabeza a cabeza que comparen indapamida con clortalidona, pero ambas muestran beneficios e impacto sobre todas las causas de mortalidad, ACV y enfermedad coronaria45.
Los diuréticos ahorradores de potasio como la espironolactona se recomiendan como agentes de cuarta línea en personas con niveles de potasio <4,5 mmol/L y TFG >45 mL/min/1,73 m2; en caso de que esta esté contraindicada o no sea tolerada, se puede utilizar amilorida o eplerenone11. Brown et al. realizaron un ensayo clínico doble ciego, aleatorizado (PATHWAY-3), y encontraron que la combinación de amilorida con hidroclorotiazida previene la intolerancia a la glucosa y mejora el control de la PA, comparado con cualquiera de los dos medicamentos en monoterapia49. Cabe destacar que ante HTA no controlada resistente, el uso de espironolactona como cuarta línea de manejo generó una reducción de PA de 21,9/9,5, lo que demostró su efecto benéfico en HTA no controlada50; estos datos se confirmaron en el estudio PATHWAY-2, en el que se demostró que la espironolactona fue la estrategia más efectiva para el tratamiento de HTA resistente, comparada con bisoprolol y doxazosina51.
Calcioantagonistas (CA): son ampliamente usados para el tratamiento de la HTAy tienen una eficacia similar a otros grupos de medicamentos sobre la PA, eventos cardiovasculares mayores y mortalidad18. Existen dos grupos de medicamentos de distintas generaciones como dihidropiridínicos (nifedipino, amlodipino), no dihidropiridínico (diltiazem, verapamilo), con recomendaciones especialmente en raza negra, adultos mayores con HTSa, síndrome metabólico, HVI, aterosclerosis, ACV previo o enfermedad arterial periférica. Se considera a los no dihidropiridínicos en HTA con angina de pecho y fibrilación auricular con el objetivo de lograr control de la FC52.
Los CA no dihidropiridínicos como el diltiazem han demostrado su efecto benéfico sobre pacientes con diabetes mellitus tipo 2 (DM2) y microalbuminuria; han demostrado la reducción de la progresión independiente del efecto hipotensor o control metabólico y han mostrado que este grupo de medicamentos pueden ser considerado junto con los IECA o ARA-II en estos pacientes53. Cativo et al.54. compararon los efectos de los CA con los ARA-II sobre la progresión de albuminuria debido a HTA o DM2; se encontró que los ARA-II fueron superiores.
Otros medicamentos: los de acción central son ampliamente utilizados cuando no hay disponibilidad de otro tipo de medicamentos, pero actualmente son menos usados, especialmente, por su pobre tolerabilidad18. En las guías de la IST, la doxazosina y clonidina se recomiendan en HTA resistente17.
La Tabla 1 recopila la potencia de cada grupo y agente antihipertensivo.
Otras consideraciones:
Raza negra: es fundamental considerar la respuesta que existe de acuerdo con la raza. Los IECA o ARA-II no deberían ser iniciados como monoterapia en pacientes afrodescendientes, pero el uso en combinación con CA o DT es eficaz en esta raza55. Clemmer et al.56 analizaron retrospectivamente las diferencias de respuesta en los antihipertensivos de primera línea entre pacientes de raza negra y blanca y entre género, documentaron que los pacientes con IECA + DT tuvieron mejor control de la PA vs. DT solo, independiente de la raza. Comparando entre raza negra, las mujeres respondieron más a los CA y DT, mientras que los hombres lo hicieron más a los DT. Los pacientes de raza negra suelen tener un fenotipo Liddle con hiperactividad de los canales de sodio epitelial, supresión tanto de renina como aldosterona, así como más aldosteronismo primario por hiperplasia adrenocortical bilateral57.
La guía de la ISH17 recomienda un tamizaje anual para HTA en adultos >18 años, donde el manejo de primera línea para quienes no cumplen criterios para terapia dual debe ser un DT o CA, y únicamente se debe indicar un IECA o ARA-II en aquellos con comorbilidades como enfermedad renal crónica (ERC) e insuficiencia cardíaca58.
Aumento de la rigidez arterial: se evidencia por un aumento de la PA sistólica, aumento de la presión de pulso por encima de 50 mmHg, con una PA diastólica neutra o disminuida. Cabe destacar que los agentes antihipertensivos que actúan sobre la rigidez por su impacto en la velocidad de onda de pulso son los IECA como el ramipril, enalapril, perindopril; BB como el nebivolol (bisoprolol la aumenta); CA como el amlodipino, nifedipino, y los antagonistas de receptor mineralocorticoide como espironolactona y eplerenone59.
Cronoterapia: es un término emergente en cuanto a la existencia del ritmo circadiano en cada célula y sistema del cuerpo, y al considerar que el patrón de 24 horas de PA con un aumento matutino puede explicar el incremento de los eventos adversos cardiovasculares en este horario, cada vez ha venido tomando más fuerza en este aspecto60. 0este motivo, parece que administrar los agentes antihipertensivos al momento de acostarse es superior en términos de mejorar los resultados cardiovasculares y la función renal en comparación con la administración en la mañana61.
Monoterapia vs. terapia combinada: las guías de la ESC/ESH y ACC/AHA recomiendan monoterapia en población seleccionada de pacientes con HTA grado 1 y con riesgo cardiovascular (RCV) global bajo, o en aquellos pacientes en alto riesgo de efectos adversos deletéreos, tales como adultos muy mayores (>80 años) o pacientes frágiles, así como mujeres embarazadas62. Actualmente, las guías de HTA aconsejan el inicio de terapia combinada en la mayoría de los pacientes, pues no solo logra una reducción más rápida de la presión, sino que también disminuye la heterogeneidad de la respuesta entre los pacientes, y hace que la titulación sea más fácil, rápida y frecuentemente exitosa; adicionalmente, reduce las dos principales barreras en el control a largo plazo de la presión arterial: la baja adherencia al tratamiento y la inercia terapéutica63. Recientemente, Chow et al.64 publicaron el estudio QUARTET donde realizaron un estudio aleatorizado, doble ciego, fase 3, en el que iniciaron en una sola tableta cuatro grupos de medicamentos antihipertensivos distintos comparado con monoterapia; encontraron que esta estrategia logró y mantuvo mayor control de las cifras tensionales comparada con monoterapia, pues demostró eficacia, tolerabilidad y simplicidad de la estrategia de una píldora con cuatro medicamentos, comparado con monoterapia.
Conclusiones
Actualmente, las prácticas de manejo en la medicina buscan la individualización del paciente, para reconocer los diferentes fenotipos hemodinámicos, la presencia de complicaciones, variables como la frecuencia cardíaca, edad, raza, comorbilidades acompañantes y la predominancia de elevación entre presión arterial sistólica o diastólica que facilite una decisión costo-efectiva en un sistema de salud como el colombiano, con metas individualizadas para el perfil del paciente que favorezca un adecuado control. Así, en ausencia de una comorbilidad indicativa de uso de betabloqueador, estos podrían ser considerados para el manejo de pacientes menores de 60 años, con HTA diastólica eligiendo especialmente los de tercera generación. La elección entre IECA o ARA-II favorece, por su menor perfil de eventos adversos, el uso de ARA-II, que también han demostrado tener mayor eficacia hipotensora. Los diuréticos de elección actualmente son los tiazida-like, por su mayor duración y menores efectos metabólicos, con los ahorradores de potasio como cuarta línea ante HTA refractaria. Los calcioantagonistas son primera línea en raza negra o HTA sistólica aislada. Estos aspectos permiten definir cuál agente antihipertensivo elegir acorde a su potencia, seguridad y al perfil único que posee cada paciente.