Introducción
A pesar de las extensas investigaciones, la tasa de sobrevivencia en pacientes con cáncer escamocelular de cavidad oral (CECO) no se ha modificado en los últimos 40 años1. Es así como, en un periodo calculado de 5 años, la tasa de sobrevivencia alcanza apenas un 40 % en pacientes con cáncer escamocelular en estadio avanzado y con recurrencia local2. Varios factores han sido relacionados con la recurrencia y con el peor pronóstico de este cáncer, a nivel histopatológico los tumores pobremente diferenciados presentan mayor tendencia a resurgir3 y a nivel molecular se ha encontrado la sobreexpresión del Receptor del Factor de Crecimiento Epidérmico (EGFR) en tumores avanzados y pobremente diferenciados4. Del mismo modo, las oncoproteínas E6 y E7 del Virus del Papiloma Humano han sido reconocidas como promotoras de este tumor5-7. Algunos datos señalan a las células tumorales progenitoras (del inglés: Cancer Stem Cells), una subpoblación de células pluripotentes, como responsables de la auto renovación, iniciación tumoral, migración y metástasis8, e inclusive se les da un papel activo en la recurrencia del tumor posterior al tratamiento9-11.
Sin embargo, todavía no existe un consenso sobre la verdadera participación de estas células, y su identificación y caracterización es aún un reto experimental en el que no se ha podido establecer un protocolo estandarizado que permita confirmar su identidad12,13. En este estudio se logró identificar en muestras de cáncer de cavidad oral, con la técnica de inmunofluorescencia, diferentes marcadores de células tumorales progenitoras: OCT4 (del inglés: Octamer-binding transcription factor 4), SSEA-4 (del inglés: Stage specific embryonic antigen-4), NANOG, derivado del vocablo mitológico Celta Tir nan Óg, que significa tierra de la juventud y TRA-1-60 (del inglés: Tumour related antigen).
La presencia de estos marcadores sugiere la participación de las células progenitoras tumorales en la evolución de este tipo de cáncer y brinda nuevas posibilidades sobre opciones terapéuticas para el tratamiento de esta patología.
Materiales y métodos
En este estudio se incluyeron 32 muestras de tejido de pacientes diagnosticados con cáncer escamocelular de cavidad oral y regiones adyacentes, provenientes del Departamento de Patología del Hospital Universitario Hernando Moncaleano Perdomo de la ciudad de Neiva, Colombia. La muestra fue no aleatoria, fue seleccionada por conveniencia, como criterios de inclusión se tuvieron aquellos pacientes diagnosticados con cáncer escamoso de cavidad oral, en el periodo de tiempo determinado (Tabla 1). La clasificación tumoral se realizó de acuerdo con las características histopatológicas del tejido en carcinoma escamocelular bien diferenciado, moderadamente diferenciado y pobremente diferenciado.
Tabla 1 Resumen de las principales características encontradas en la muestra seleccionada por conveniencia de pacientes con Carcinoma Escamocelular de Cavidad Oral. Se muestra el grado de diferenciación del tumor, rango y promedio de edad, género y localización de la lesión.
| Grado de diferenciación del carcinoma escamo celular | Rango de edad (años) | Casos | Género | Localización anatómica |
|---|---|---|---|---|
| Bien diferenciado | (38-92) x = 61,93 | 16 | 5 ♀ 11 ♂ | Lengua (12), Amígdala (1), Laringe (3) |
| Moderadamente diferenciado | (41-93) x = 65,23 | 13 | 4 ♀ 9 ♂ | Lengua (7), Amígdala (1), Laringe (3), Labio (2) |
| Pobremente diferenciado | (60-76) x = 66,6 | 3 | 3 ♂ | Lengua (1), Amígdala (1), Labio (1) |
Reacción de inmunofluorescencia
Para la identificación de los marcadores específicos se usó la técnica de fluorescencia. Esta metodología fue aplicada a cortes histológicos representativos de las lesiones de 5 µm de espesor, los cuales fueron desparafinizados y posteriormente rehidratados de forma rutinaria. La recuperación de los epítopes se llevó a cabo en Tampón Citrato 10 Mm, a un ph 6,0 por 15 min, mientras que el bloqueo de uniones inespecíficas se logró incubando las láminas en BSA 3 % por 1 h a temperatura ambiente. Se usó cloruro de amonio 50 mM en PBS 1 % durante 1 h, para disminuir la fluorescencia endógena de las muestras.
Se emplearon los siguientes anticuerpos, que son marcadores específicos de células progenitoras: anti-OCT-4, anti-SSEA4, anti-NANOG y anti-TRA-1-60, todos provenientes de Abcam Inc. (Cambridge, MA, USA). En los controles negativos de las reacciones se omitió la adición del anticuerpo primario.
Como anticuerpo secundario se usó un anti-IgG de conejo desarrollado en cabras, acoplado a Alexa Flúor 488, de Abcam Inc. (Cambridge, MA, USA). Finalmente se usó el medio de montaje acuoso con DAPI (ab 104139, Abcam, Cambridge, MA, USA) por 5 min y enseguida se realizó la observación en el microscopio acoplado a lámpara de fluorescencia.
Captura y análisis de imagen
Una vez detectadas las regiones de interés, fueron analizadas en el microscopio Axio Imager Z2, y con los filtros correspondientes para DAPI y FITC, las imágenes fueron capturadas con la cámara AxioCam ICm 1 con el objetivo 40x (Carl Zeiss, Jena, Germany). El analisis inicial se realizó en el Software ZEN (blue edition) (Carl Zeiss, Jena, Germany), y la combinacion con ayuda del programa FIJI (Wayne Rasband, National Institutes of Health, Bethesda).
Medición de la intensidad de la fluorescencia
Para buscar diferencias de intensidades de las marcaciones se capturaron imágenes en 10X y posteriormente fueron analizadas en el programa FIJI (https://imagej.net/software/fiji/). Se resaltó el brillo y contraste para eliminar el fondo (background), con fluorescencia inespecífica. Se seleccionaron aleatoriamente cuatro regiones de tres láminas diferentes por muestra, para un total de 12 mediciones de los diferentes grupos estudiados, carcinoma escamocelular bien diferenciado, moderadamente diferenciado y pobremente diferenciado.
Enseguida, en la opción análisis del programa se usó el aplicativo ROI (región de interés) para seleccionar un área de 2 pulgadas cuadradas representativas del tejido en cada lámina, posteriormente se usó el aplicativo Plot Profile, que muestra la intensidad de la Fluorescencia en el área seleccionada. Las figuras de los diferentes estadios tuvieron la misma área de selección de una región representativa del tejido y fueron sometidas al mismo análisis. Los gráficos de caja y las imágenes seleccionadas fueron agrupadas y organizadas en el programa Photoshop para su presentación final.
Análisis Estadístico
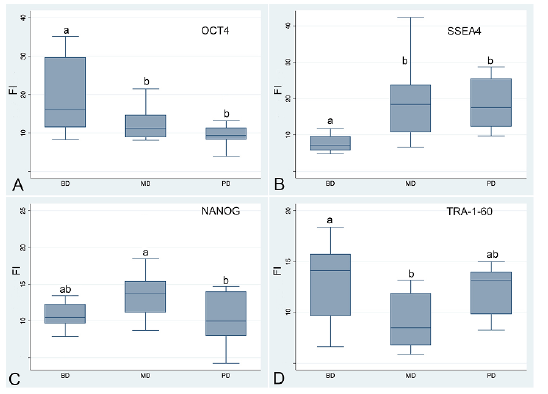
Para ver si existían diferencias estadísticas entre la intensidad de la fluorescencia de los diferentes grados del carcinoma de cavidad oral bien diferenciado (BD), Moderadamente diferenciado (MD) y Pobremente diferenciado (PD), se usó la prueba de ANOVA. Como variable cuantitativa se tomó intensidad de la fluorescencia.
Al realizar la prueba de Bartlett para analizar si la muestra cumplía con los supuestos para realizar la prueba de ANOVA, encontramos un valor de (0,028), lo cual indica que las varianzas no cumplen esos supuestos de homogeneidad. Por tal razón, se realizó la prueba no paramétrica de Kruskal-Wallis, donde se comparó la suma de los rangos y las diferencias específicas entre los grupos, en este caso, el nivel de confianza que se usó fue de 95 %.
Resultados
En el análisis histológico comparativo fue posible apreciar las alteraciones del tejido, acorde con los diferentes grados de diferenciación del tumor (Figura 1). En el tejido normal se aprecia la estratificación del epitelio, con sus diferentes tipos celulares debidamente organizados sin presentar alteraciones morfológicas a nivel nuclear o citoplasmático. Posteriormente, en las muestras de cáncer fue posible identificar las alteraciones celulares y pérdida de organización del tejido a medida que el tejido pierde su grado de diferenciación.
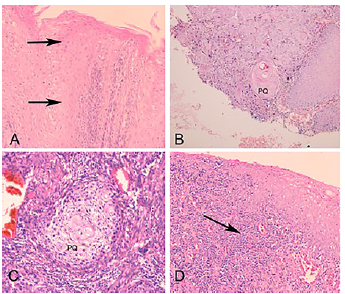
Figura 1 Imágenes en menor aumento de tejido normal (A), y Carcinoma Escamocelular de Cavidad Oral, bien diferenciado (B) moderadamente diferenciado (C) y pobremente diferenciado (D).
En el estadio bien diferenciado (Figura 1B) fue posible identificar algunas perlas de queratina (PQ) totalmente desarrolladas, densas y eosinofílicas, rodeadas por células en la región externa. En el estadio moderadamente diferenciado (Figura 1C) se destaca la infiltración de células, probablemente neutrófilos, hacia la parte central, los cuales comienzan a formar espacios en esta region. La región periférica de la perla comienza a presentar infiltración celular.
En el estadio pobremente diferenciado (Figura 1D) se destacan neutrófilos, células inflamatorias, linfocitos entre otros y el tejido se torna más basófilo (flecha), y su arquitectura se ha perdido totalmente.
El marcador SSEA4 presentó marcación en todos los estadios de diferenciación, sin embargo, en algunas regiones del epitelio de las muestras de CECO pobremente diferenciado, fue más intensa (Figuras 3A y 3B).
Las reacciones de inmunofluorescencia fueron positivas en los tejidos para los diferentes marcadores. Se consiguió la detección del marcador OCT4 en el epitelio de las muestras de CECO y se notó una variación en la intensidad entre bien diferenciado, moderadamente diferenciado y pobremente diferenciado. Esto se hace evidente en el citoplasma de algunas células epiteliales (Figura 2A y 2B).
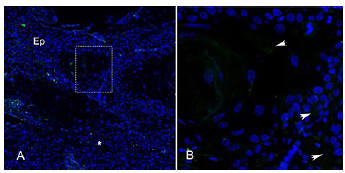
Figura 2 Identificación por inmunofluorescencia de la proteína OCT4, en muestras de carcinoma escamocelular de cavidad oral moderadamente diferenciado. Se observa en detalle general 10x (Fig. A); y, en magnificación de 40x recuadro punteado en A (Fig. B).
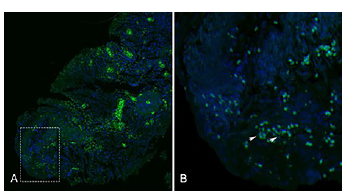
Figura 3 Identificación por inmunofluorescencia de la proteína SSEA4 en muestras de carcinoma escamocelular de cavidad oral pobremente diferenciado. Se observan en pequeño aumento 10x (Fig. A) y mayor aumento 40x (Fig. B) las diferentes características del tejido. Donde se observa una marcacion (flechas blancas).
Así mismo, la expresión de la proteína NANOG fue evidente, se encontró distribuida a lo largo del tejido y también se pudo detectar alrededor de algunos vasos (Figura 4A), su localización celular es citoplasmática de algunas células (flechas, Figura 4B).
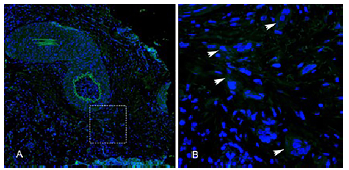
Figura 4 Marcación positiva para la proteína NANOG en muestras carcinoma escamocelular de cavidad oral bien diferenciado. Microfotografía en aumento de 10X (A) donde se destacan marcaciones positivas en verde indicando la presencia de celulas que expresan Nanog. La figura B es el aumento en 40X de la selección puenteada en A, donde se muestran las celulas en detalle con la marcación citoplasmática.
Por otro lado, el marcador TRA-1-60 fue detectado en las muestras de carcinoma moderadamente diferenciado, donde fue posible apreciar su localización citoplasmática (Figuras 5A y 5B).
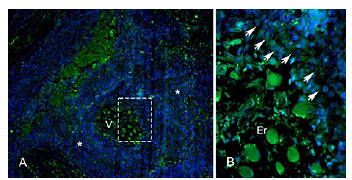
Figura 5 Identificación por inmunofluorescencia de la proteína TRA-1-60 en muestras de carcinoma escamocelular de cavidad oral moderadamente diferenciado. micrografia en menor aumento 10X (Fig.A) y detalles del recuadro punteado en mayor aumento (Fig B).
La intensidad de la fluorescencia (Figura 6) permitió corroborar las variaciones de marcaciones inicialmente observada entre los diferentes grupos: la proteína OCT 4 fue más intensa en el estadio bien diferenciado y su marcación disminuye en los estadios moderamente y pobremente diferenciado, la proteína SSEA4 tiene una marcacion baja en el estadio bien diferenciado que se incrementa en los estadios moderadamente y pobremente diferenciado. Las proteínas NANOG y TRA-1-60 estan presentes en los tres estadios de diferenciación del tejido, sin presentar variaciones significativas (Figura 7).
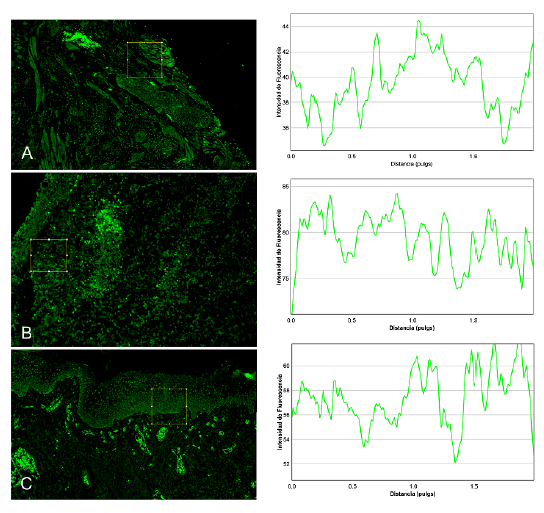
Figura 6 Cuantificación de la fluorescencia de los diferentes tratamientos, muestra aleatoria de cancer de cavidad oral. Figura A, muestra de carcinoma escamocelular de cavidad oral bien diferenciado, Figura B, muestra de carcinoma escamocelular de cavidad oral moderadamente diferenciado, Figura C, muestra de carcinoma escamocelular de cavidad oral pobremente diferenciado. Paneles laterales respectivas mediciones de la intensidad de la fluorescencia, a través del aplicativo Plot Profile del Programa FIJI.
Discusión
Estudios previos han validado el papel patofisiológico de las células tumorales progenitoras en el mantenimiento a largo plazo de algunos tipos de cáncer14.
Las células tumorales progenitoras son pequeñas poblaciones de células que comparten algunas características moleculares con las células normales progenitoras, inclusive se han aislado de diferentes tipos de cáncer, incluido el CECO8. Se cree que coordinan procesos relacionados con la recidiva local y diseminación regional del tumor, debido a su habilidad de dividirse de forma asimétrica y repoblar células tumorales15.
Experimentalmente se ha identificado la presencia de diferentes marcadores de células tumorales. La proteína OCT4, cuya expresión en tejido tumoral ha sido relacionada con el potencial tumorigénico y con características clínicas de agresividad como metástasis y progresión tumoral, actúa además en la renovación de las células madre embriológicas y mantiene la pluripotencia de estas a través de la interacción con factores de transcripción como Stat3, Zic3 y HeX116.
Siu et al. encontraron que la expresión de OCT4 en combinación con NANOG y CD133 muestran un peor pronóstico y tasa de sobrevida en cáncer escamocelular, lo cual indica su utilidad como marcador pronóstico y de invasión17,18.
En cáncer de cavidad oral (específicamente en labio) se ha identificado la presencia de NANOG en subpoblaciones celulares dentro de nichos tumorales, incluso se cree que pueden estar en las regiones estromales adyacentes19, ya su utilidad clínica queda en evidencia al correlacionar su expresión en CECO con bajas tasas de sobrevivencia de los pacientes20.
La literatura reporta un comportamiento agresivo de las células de CECO que expresan en conjunto la proteína SSEA-4 (Stage-specific embryonic antigen-4) y el marcador CD44+, las cuales tienen capacidad de formación de esferas in vitro, resistencia a medicamentos y habilidad para formar tumores en murinos atímicos21. Por otro lado, el papel de TRA-1-60 Tumour-related antigen, en cáncer escamocelular de cavidad oral, es aún indeterminado. En el experimento encontramos su presencia en el tejido, pero no mostró variación durante el proceso de desdiferenciación del tumor, lo que indica una expresión generalizada de esta proteína.
Es bastante atrayente la exploración del papel de las células tumorales progenitoras en el CECO y aquí se plantea la presencia de ellas en diferentes estadios del tumor, nuestro modelo muestra la presencia de los marcadores en todo el proceso de perdida de diferenciación celular, pero con intensidades variables de algunos marcadores. Al parecer las células que expresan OCT4 están más presentes al inicio del proceso y posteriormente su expresión disminuye, mientras que SSEA4 seria prevalente en estados de carcinoma escamocelular moderada y pobremente diferenciado. Ya NANOG y TRA-1-60 estarían presentes durante toda la perdida de diferenciacion del tumor (Figura 8). Los anteriores hallazgos desde el punto de vista clínico son interesantes, ya que, al hacer un paralelo con los tratamientos de quimioterapia actuales, nos permite recordar que estos no discriminan entre la heterogeneidad celular del tumor.
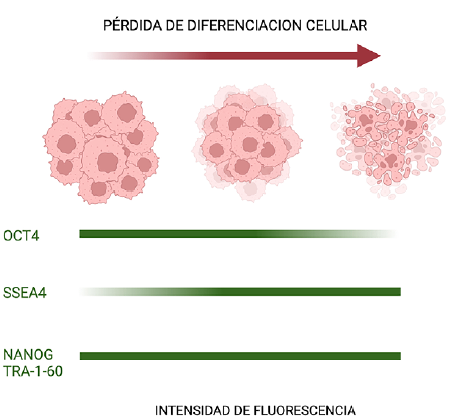
Figura 8 Modelo hipotético de la participación de células progenitoras en el cancer escamocelular de cavidad oral. A medida que ocurre la perdida de diferenciación celular, disminuye la expresión del marcador OCT4 y aumenta la expresión del marcador SSEA4. Los marcadores NANOG y TRA-1-60 permanecen constantes durante el proceso. Figura elaborada por los autores en https://biorender.com/
Las células con características tumorales, de lento crecimiento, pueden no ser afectadas por tratamientos convencionales, logran mantener el crecimiento del tumor y ser responsables por la resistencia a las terapias22 y ocasionar la recurrencia tumoral. Por tal razón, es recomendable direccionar nuevas terapias hacia blancos más específicos y teniendo en cuenta la variabilidad celular tumoral.
Además de esto, es recomendable incorporar nuevas tecnologías en histopatología, se ha notado un crecimiento de la literatura que resalta el uso de inteligencia artificial y diferentes softwares como herramienta de diagnóstico y pronóstico de algunas patologías. Si bien el trabajo del especialista es insustituible, sí existen ciertos procesos que pueden ser agilizados y estandarizados de una forma más objetiva.