Introducción
La disfagia es la alteración de la deglución, donde hay problemas para mover el bolo alimenticio de manera segura desde la cavidad oral al estómago sin la entrada de alimentos, líquidos, saliva o secreciones al sistema respiratorio1. A su vez, la deglución es un evento neuromuscular complejo2 que requiere una coordinación precisa de al menos 25 pares de músculos, sensación faríngea intacta, interconexiones entre tronco encefálico y corteza cerebral3,4y una respuesta modelada en varios niveles del sistema nervioso, tanto corticales como subcorticales5. La gran variedad de estructuras involucradas en el proceso de tragar sugiere que diferentes mecanismos fisiopatológicos pueden resultar en disfagia dependiendo de la enfermedad subyacente y el deterioro estructural y funcional asociado4, apoyando que la disfagia en sí y los síntomas de esta no sean aspectos estáticos y homogéneos en los pacientes.
Por localización y sintomatología, la disfagia se clasifica en orofaríngea y esofágica. Si la dificultad para mover el bolo alimenticio es por compromiso de la fase oral, preparatoria oral o faríngea de la deglución, por mala función oral, faríngea o del esfínter esofágico superior, se clasifica como orofaríngea, y si la dificultad es debida a una mala función del esófago se clasifica como esofágica6,7.
La disfagia orofaríngea suele ser producida por causas estructurales que mantengan una luz estrecha en cavidad oral, faríngea o esofágica, y por causas funcionales, donde hay deterioro en la fisiología deglutoria por entidades que alteran el control neurológico central orofaríngeo, modulación del peristaltismo, coordinación neuromuscular de los esfínteres o la acción de los efectores musculares6,7. Es así que existe la categoría de disfagia orofaríngea funcional, en la cual se encuentran los términos de disfagia neurogénica y disfagia orofaríngea neurogénica (en inglés neurogenic oropharyngeal dysphagia o NOD) para poder abarcar de manera clínica el gran espectro de causas neurológicas y neuromusculares8 que producen esta categoría en particular.
Mundialmente se reporta entre 400 000 a 800 000 casos de disfagia neurogénica al año9, donde las etiologías neurológicas y neuromusculares son frecuentes e importantes por las complicaciones asociadas que producen10-12. La NOD en adultos se genera principalmente por el accidente cerebrovascular (ACV), enfermedad de Parkinson (EP), esclerosis múltiple (EM) y esclerosis lateral amiotrófica (ELA), como consecuencia de traumatismo encéfalo craneano (TEC) y por enfermedades neuromusculares como la miastenia grave (MG), miopatías y miositis6.
La disfagia produce una diversidad de síntomas y signos que se usan en los métodos de tamizaje, en las evaluaciones formales clínicas de la deglución y en los métodos instrumentales para detectar su presencia, identificar déficits fisiológicos y gravedad de esta. Pero son escasos los trabajos que muestren el comportamiento en el tiempo o por evolución de la enfermedad de los síntomas de disfagia en pacientes con NOD por causas neurológicas y neuromusculares.
Una revisión sistemática de 2017 reportó 34 medidas de resultados informados por el paciente (patient-reported outcome -PRO)13. Dentro de las herramientas disponibles para tamizaje sobresale el Eating Assessment Tool-10 (EAT-10)14, que es un instrumento analógico verbal autoadministrado de puntuación directa, caracterizado por una aplicación breve, simple y unidimensional, que permite la evaluación de síntomas específicos de disfagia, el establecimiento inicial de la gravedad del síntoma, valoración del tratamiento y cribado de disfagia orofaríngea15. Ha sido validada en varios idiomas y se reporta como una herramienta sintomática válida, fiable y específica para la evaluación de la disfagia y de uso clínico16. Consiste en diez preguntas que se califican de forma subjetiva en una escala de cero a cuatro puntos, donde cero indica la ausencia del problema y cuatro indica un problema serio. El puntaje final se obtiene de sumar las puntuaciones obtenidas en cada uno de los diez ítems, donde las puntuaciones más altas indican mayor percepción de disfagia15. Este cuestionario se puede utilizar con éxito en condiciones clínicas para evaluar pacientes con disfagia neurogénica17.
El objetivo de este estudio fue conocer la percepción y comportamiento en el tiempo de síntomas de disfagia mediante el instrumento EAT-10 en pacientes con NOD por enfermedades neurológicas y neuromusculares, para comprender mejor la dinámica sintomática y características clínicas de esta forma de disfagia, y sensibilizar a los profesionales de la salud en el reconocimiento activo de síntomas de disfagia en pacientes con estas etiologías. La hipótesis de este trabajo es que la etiología neurológica y neuromuscular, que abarca un gran espectro de condiciones tanto progresivas como no progresivas, modifica la autopercepción de síntomas de disfagia en pacientes con disfagia orofaríngea en el tiempo.
Metodología
Estudio observacional tipo cohorte en pacientes con NOD de causas neurológicas y neuromusculares con seguimiento a tres y seis meses.
Criterios de elegibilidad: mayores de edad con disfagia orofaríngea funcional tipo NOD por enfermedades neurológicas (aquellas donde hay disrupción en los mecanismos neurológicos de la deglución por compromiso del sistema nervioso central) o enfermedades neuromusculares (aquellas que comprometen los mecanismos efectores del acto deglutorio por alteraciones en los nervios, placa motora o en los músculos de la faringe y del esófago), con evaluación clínica de la deglución realizada por neurología clínica y fonoaudiología con entrenamiento en disfagia, y diligenciamiento del instrumento EAT-10 en cada uno de tres momentos: evaluación basal, tercer y sexto mes de seguimiento.
Se excluyeron pacientes sin diagnóstico confirmado de enfermedad neurológica o neuromuscular, sin disfagia orofaríngea por anamnesis y examen físico, pacientes con disfagia esofágica y aquellos con disfagia orofaríngea de causas iatrogénicas, estructurales o de propulsión; en el caso de pacientes con demencia se excluyeron aquellos en fase avanzada que impidiera la comprensión de órdenes sencillas y expresión de síntomas de disfagia.
Muestra y muestreo: este estudio deriva de una investigación que pretende desarrollar un algoritmo diagnóstico mediante la integración de datos clínicos y señales no invasivas del proceso deglutorio. Para ello se determinó una muestra de 76 pacientes con NOD de causas neurológicas y neuromusculares y 76 personas sanas, con una sensibilidad del 80 % según literatura de la evaluación clínica de la deglución a la cabecera del paciente18, confianza del 95 % y potencia del 80 %. En este artículo solo se tomaron las personas con NOD y diligenciamiento del EAT-10.
El personal médico y de fonoaudiología de varias instituciones de salud de diferentes niveles de complejidad, ubicadas en el Área Metropolitana del Valle de Aburrá y Valle de San Nicolás (Antioquia, Colombia), identificaron pacientes con disfagia orofaríngea de etiología funcional, que luego fueron contactados telefónicamente por una fonoaudióloga con entrenamiento en disfagia para invitarlos a participar del estudio. Aquellos que aceptaron participar se les agendó una consulta basal de revisión gratuita con neurología clínica, donde se confirmaron criterios de elegibilidad. Desde la evaluación basal se realizó una cita de revisión al tercer mes ejecutada por una fonoaudióloga entrenada en deglución, y al sexto mes una cita de evaluación final nuevamente por neurología clínica.
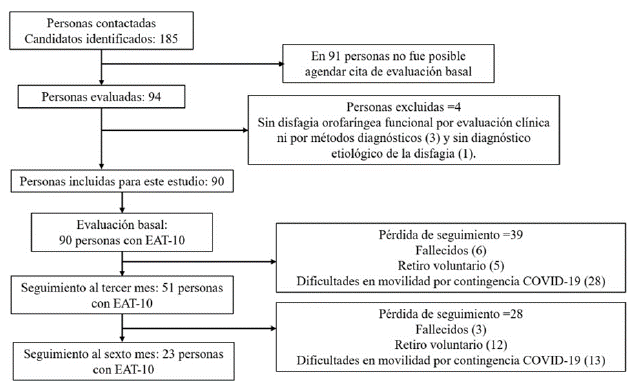
La recolección de la información se realizó entre marzo de 2019 hasta marzo de 2021, donde la contingencia en salud y social generada por el SARS-CoV-2 y su enfermedad COVID-19 comprometió la realización del seguimiento y finalización del estudio en varios pacientes. Es por ello que el número de la muestra al tercer y sexto mes de seguimiento es menor que el basal, además de otras razones como fallecimientos y retiros voluntarios de pacientes.
La información se recolectó directamente de los pacientes mediante la aplicación del instrumento EAT-10 validado para Colombia19, al ingresar a la cohorte (evaluación basal), tercer y sexto mes de seguimiento. Las variables sexo, edad y presencia de terapias fueron extraídas de los formatos de investigación del examen físico realizado por neurología.
El EAT-10 fue diligenciado por cada paciente de forma autónoma con acompañamiento de una fonoaudióloga con entrenamiento en disfagia del equipo de investigación. Aquellos pacientes con dificultades en independencia o problemas para diligenciar el EAT-10 contaron con ayuda de sus familiares y/o cuidadores.
El resultado principal (efecto) del estudio consistió en la puntuación total del EAT-10 obtenida en cada momento del seguimiento por paciente, más el detalle de cualificación realizada en cada una de las 10 preguntas del instrumento. La exposición fue la presencia de disfagia orofaríngea neurogénica por causas neurológicas y neuromusculares. El sexo se consideró como un factor de confusión, y la recepción o no de terapias durante el seguimiento se asumió como posible factor modificador del efecto.
Plan de análisis: descripción de los resultados mediante frecuencias absolutas y relativas de las respuestas de cada pregunta del EAT-10. Se aplicaron pruebas de normalidad en las variables obtenidas para ver su distribución en cada momento del seguimiento. Se mostró el puntaje del EAT-10 según mediana y rango intercuartil (RIC): percentil 25 y 75 o promedio con desviación estándar (DE), e intervalo de confianza del 95 %. Se realizó análisis bivariado para comparar la mediana de puntaje del EAT-10 por sexo y entre pacientes que en medio del estudio recibieron terapia física, deglutoria o respiratoria. Se comparó mediante una T de Student si existen diferencias en el puntaje promedio del EAT-10 entre mujeres y hombres, y diferencias en la variación promedio del puntaje del EAT-10 basal versus tercer mes entre quienes recibieron terapias. Los puntajes del EAT-10 de los pacientes ausentes en el tercer y sexto mes de seguimiento (independiente del motivo: fallecimiento, retiro voluntario o dificultad derivada de la pandemia COVID-19) se tomaron solo en el análisis del momento basal, y no fueron tenidos en cuenta en los otros dos momentos de análisis (tercer y sexto mes). Se identificaron los pacientes que completaron el seguimiento a seis meses, con tres mediciones continuas del EAT-10, como subgrupo de análisis. Las respuestas de cada pregunta del EAT-10 se agruparon en rango problema cuando fueron calificadas con un 1, 2, 3 o problema serio, de manera que representan un síntoma de disfagia.
Resultados
Del estudio referencia se contactaron 185 personas, de las cuales 94 fueron evaluadas clínicamente por neurología clínica en la sesión basal para ingresar al estudio. Tras aplicación de criterios de elegibilidad se tomó una muestra de 90 personas en la evaluación basal, de las cuales 51 personas (56,7 %) tienen seguimiento al tercer mes y 23 personas (25,6 %) con seguimiento al sexto mes desde el momento de ingreso al estudio, Figura 1.
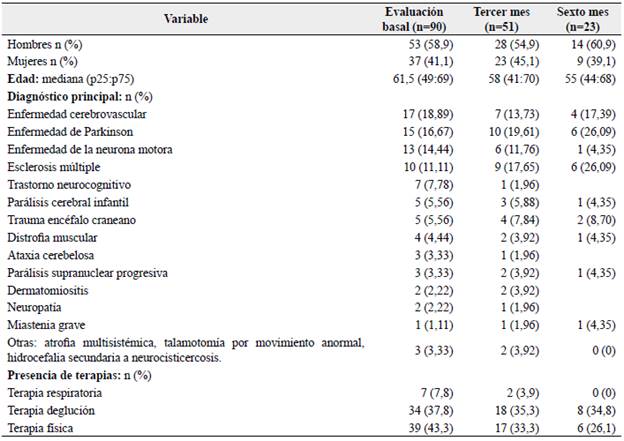
El 58,9 % (53/90) de la muestra en la evaluación basal son hombres, donde el sexo masculino fue el más frecuente en los tres momentos del estudio, con una mediana de edad basal de 61,5 años. El diagnóstico neurológico principal más frecuente en el momento basal fue la enfermedad cerebrovascular (ECV) seguida de enfermedad de Parkinson (EP), y en el tercer y sexto mes de seguimiento fueron la EP seguida de esclerosis múltiple (EM). El tipo de terapia más frecuente en el momento basal fue la terapia física, mientras que en el tercer y sexto mes fue la terapia de deglución. En la Tabla 1 se detallan las características de las personas del estudio.
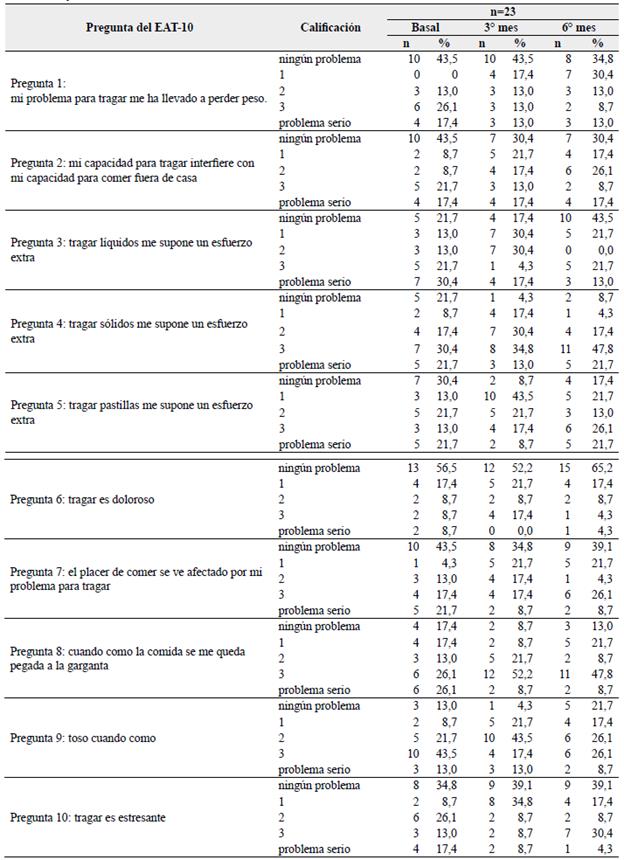
Se obtuvo un total de 164 EAT-10 diligenciados, distribuidos en 55 % (90/164) en el momento basal, 31 % (51/164) al tercer mes y 14 % (23/164) al sexto mes. En toda la muestra, al momento basal, las preguntas con mayor frecuencia de respuestas en el rango problema para los pacientes fueron la pregunta 4, referente al esfuerzo extra al tragar sólidos, con un 86,6 %, pregunta 9, referente a toser cuando se come, con un 85,6 %, y pregunta 8, referente a comida pegada en la garganta al comer, con un 75,6 %.
En el tercer mes de seguimiento, las preguntas con mayor frecuencia de respuestas en rango problema fueron la 4 con un 98 %, la 9 con un 94 %, la 5, referente a dificultad para tragar pastillas, con un 92 %, la 8 con un 90,2 % y la pregunta 3 sobre dificultad para tragar líquidos, con una frecuencia del 86,2 %. Al sexto mes de seguimiento las preguntas con mayor frecuencia de respuestas en rango problema fueron nuevamente la 4 con un 91,2 %, la 8 con un 87 % y la 5 con un 82,5 %. La pregunta 4 (dificultad para tragar sólidos), 8 (sensación de comida pegada en garganta) y 9 (tos al comer) fueron las que en los tres momentos presentaron una frecuencia mayor al 75 % con respuestas en rango problema.
La pregunta con mayor frecuencia en cuanto a no ser calificada como problema (síntoma) en los pacientes en los tres momentos del estudio fue la 6 (dolor al tragar), con frecuencias de calificación en el rango problema de 32,2 % en el momento basal, 49 % al tercer mes y 34,7 % al sexto mes. La Tabla 2 muestra en detalle las frecuencias de las calificaciones en cada pregunta del EAT-10.
Tabla 2 Descriptivo general de las frecuencias en las calificaciones de cada pregunta del EAT-10 en todos los pacientes y en los tres momentos del estudio.
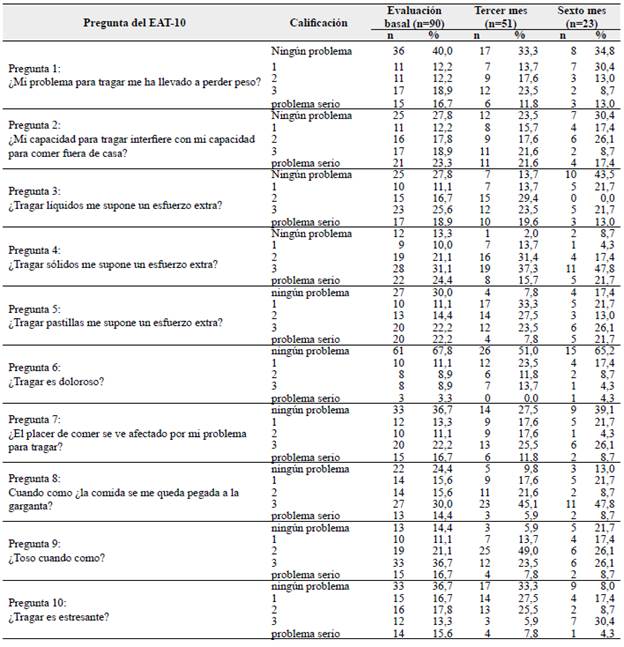
En el momento basal la pregunta 2 (interferencia con comer fuera de casa), pregunta 4 (tragar sólidos) y pregunta 5 (tragar pastillas) fueron las que obtuvieron una mayor frecuencia en la respuesta problema serio con un 23,3 % (21/90), 24,4 % (22/90) y 22,2 % (20/90) respectivamente.
El promedio del puntaje total del EAT-10 en el momento basal fue de 18,1 ± 9,5 puntos (IC 95 %: 16,10 - 20,10), en el tercer mes 18,57 ± 7,9 puntos (IC 95 %: 16,35 -20,79) y en el sexto mes 16,61 ± 9 puntos (IC 95 %: 12,72 - 20,49). Se obtuvieron puntajes mínimos de 1, 5 y 4 en el momento basal, tercer y sexto mes respectivamente, y puntajes máximos de 40 en el momento basal y de 36 en el tercer y sexto mes.
En los 23 pacientes con diligenciamiento de tres EAT-10 en seis meses, las preguntas que obtuvieron de manera sostenida altas frecuencias de respuestas en calificación problema fueron la 4 (tragar sólidos), con frecuencias del 78,2 %, 95,6 % y 91,2 %; la pregunta 8 (comida pegada en garganta), con frecuencias del 82,6 %, 91,3 % y 86,9 %; y la pregunta 9 (tos al comer), con frecuencias 86,9 %, 95,6 % y 78,3 % en el momento basal, tercer y sexto mes respectivamente. La pregunta 3 (tragar líquidos) en el momento basal y tercer mes obtuvo altas frecuencias de respuestas en rango problema (78,1 % y 82,5 % respectivamente), pero disminuyó al sexto mes a una frecuencia del 56,4 %. La pregunta 5 (tragar pastillas) al momento basal obtuvo una frecuencia del 69,4 % de respuestas en rango problema, la cual aumentó al tercer y sexto mes con frecuencias del 91,3 % y 82,5 % respectivamente. Las preguntas 1 (perder peso), 2 (comer fuera de casa), 7 (placer de comer) y 10 (tragar es estresante) a lo largo de los tres momentos de medición obtuvieron frecuencias estables de respuesta, calificadas como problema entre un 56,5 % a 69,5 % en general. Nuevamente la pregunta 6 (dolor al tragar) fue la que obtuvo en los tres momentos del estudio la menor frecuencia de respuestas en rango problema (basal 43,5 %, tercer mes 47,8 % y sexto mes 34,7 %). La Tabla 3 muestra en detalle las frecuencias de las calificaciones en de cada pregunta del EAT-10 en los 23 pacientes.
Tabla 3 Descriptivo de las frecuencias en las calificaciones de cada pregunta del EAT-10 en los 23 pacientes con evaluación basal, tercer y sexto mes.
El promedio del puntaje total del EAT-10 en los 23 pacientes con seguimiento completo en el momento basal fue de 18,61 ± 11 puntos (IC 95 %: 13,91 - 23,31), tercer mes 16,87 ± 8,8 puntos (IC 95 %: 13,05 - 20,69) y sexto mes 16,61 ± 9 puntos (IC 95 %: 12,72 - 20,49).
No se encontraron diferencias estadísticamente significativas en los puntajes totales del EAT-10 entre mujeres y hombres en ninguno de los tres momentos del estudio (ver Tabla 4).
Tabla 4 Comportamiento del puntaje EAT-10 por sexo y momento del estudio
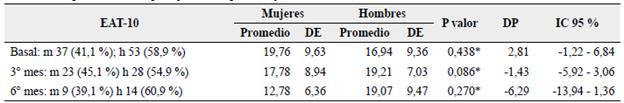
m: mujeres; h: hombres. DE: desviación estándar. * t de Student. DP: diferencia de promedios. IC: intervalo de confianza.
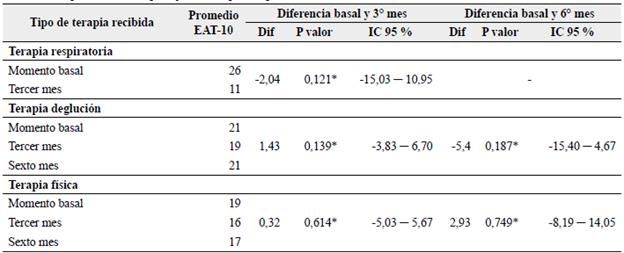
Se observó cómo en los pacientes que al momento basal estaban recibiendo terapia respiratoria, de la deglución o física el promedio del puntaje EAT-10 total fue más alto, y cómo en el tercer mes de seguimiento fue comparativamente menor. Sin embargo, no se encontraron diferencias estadísticamente significativas entre los puntajes promedio del EAT-10 por alguna de las tres terapias al compararlas entre el momento basal y tercer mes, y basal con sexto mes (ver Tabla 5).
Discusión
Este estudio muestra la percepción y comportamiento a tres y seis meses de seguimiento, desde una evaluación basal, de síntomas de disfagia en una muestra representativa de pacientes con NOD por enfermedades neurológicas y neuromusculares mediante el instrumento EAT-10. Los principales resultados fueron: 1) muestra donde el 50 % poseen una edad de 61,5 o más años; 2) varias categorías de diagnósticos, donde las más frecuentes fueron el ACV, EP, enfermedad de la neurona motora y esclerosis múltiple; 3) la presencia de terapia de la deglución o terapia física en los tres momentos; 4) la mediana de puntaje total del EAT-10 en toda la muestra y en los pacientes con seguimiento completo fue cercano a 17 puntos; 5) al momento basal, los síntomas evaluados por el EAT-10 con mayor percepción fueron dificultad para tragar sólidos, tos al comer y sensación de comida pegada en la garganta; al tercer mes se adicionaron a los anteriores dificultad para tragar pastillas y para tragar líquidos; y al sexto mes nuevamente dificultad para tragar sólidos y sensación de comida pegada en la garganta, más dificultad para tragar pastillas; 6) la odinofagia no fue un síntoma frecuentemente percibido; 7) se observó como las terapias pueden disminuir la percepción de síntomas de disfagia en el tiempo; y 8) el sexo no parece influir sobre la percepción de síntomas de disfagia.
ElACV, los procesos neurodegenerativos y las demencias conllevan una alta incidencia de disfagia10, de manera que la NOD en adultos se produce principalmente por el ACV, EP, EM y ELA, habitualmente en población que envejece10. Estos dos aspectos (causas y edad avanzada) fueron observados en los pacientes del estudio.
Las enfermedades neurológicas, independiente de sus particularidades fisiopatológicas, poseen un profundo impacto sobre la deglución10, pudiendo afectar con una gravedad entre leve a profunda a esta20, aspecto que puede explicar la variación de puntajes del EAT-10 observados con puntajes mínimos de 1, 5 y 4 en el momento basal, tercer y sexto mes respectivamente hasta puntajes máximos de 40 puntos en el momento basal y de 36 al tercer y sexto mes. Según la literatura, los pacientes con disfagia orofaríngea suelen obtener puntajes totales del EAT-10 de 2314,21. En este estudio el promedio ponderado del puntaje total EAT-10 en toda la muestra fue de 17,8 puntos y en los 23 pacientes con seguimiento completo fue de 17,4 puntos. Las puntuaciones más altas indican mayor percepción de disfagia15, de manera que en los pacientes con NOD aquí evaluados, especialmente en los pacientes con seguimiento completo, se encontraron desde mínimas a mayores percepciones, mostrando que el grado de percepción de disfagia y gravedad de los síntomas de manera individual puede cambiar en el tiempo y no es constante. La NOD es una condición dinámica e influida por diferentes variables.
Si bien los pacientes del presente estudio hacen parte de una única categoría clínica y etiogénica denominada NOD, se observó varias etiologías individuales que fisiopatológicamente pueden diferir (p. ej. ECV como entidad vascular versus TEC como entidad traumática versus parálisis supranuclear progresiva como entidad neuro neurodegenerativa), y por lo tanto influir e impactar directa o indirectamente en la percepción de síntomas de disfagia visualizados. Sin embargo, en entidades con marcado compromiso cognitivo como los trastornos neurocognitivos, se tuvo en cuenta en los criterios de elegibilidad excluir aquellos en fase avanzada que impidiera la comprensión de ordenes sencillas y expresión de síntomas de disfagia.
El EAT-10 evalúa el estado de salud funcional relacionado con la disfagia, es de fácil aplicación e interpretación en cualquier etiología causante de disfagia19, y evalúa la carga de disfagia en las personas6. Los pacientes con NOD del estudio poseen y experimentaron diferentes cargas de disfagia en el tiempo. Es claro que el EAT-10 no es equivalente ni reemplaza la evaluación clínica ni instrumental de la deglución. Es un instrumento clínico que permite identificar y derivar oportunamente a los pacientes a evaluaciones adicionales. La disfagia orofaríngea está frecuentemente asociada con complicaciones secundarias pulmonares y nutricionales22,23.
La disfagia neurogénica es un trastorno de etiología neurológica y neuromuscular que abarca las dificultades para mantener una adecuada tensión muscular en las mejillas y labios, limitaciones en el movimiento de la lengua y mandíbula, incoordinación lingual, movimiento deficiente del paladar blando, pérdidas de sensibilidad en cavidad oral y faringe, y falla en los efectores musculares de la faringe17. Por lo tanto, la sintomatología de NOD es diversa. Aspecto que fue evidenciado mediante las autopercepciones dinámicas en los síntomas de disfagia en los pacientes del estudio mediante el instrumento EAT-10. Sin embargo, se identificaron síntomas cardinales o compatibles con disfagia orofaríngea persistentes en el seguimiento realizado.
En toda la muestra, los síntomas con mayor autopercepción fueron la dificultad para tragar sólidos, sensación de comida pegada en garganta y tos al comer. En los pacientes con seguimiento completo, los síntomas con mayor percepción en el tiempo fueron los mismos. Sin embargo, síntomas como dificultad al tragar líquidos disminuyó su percepción a medida que avanzó el tiempo, y algo contrarío se vio con la dificultad para tragar pastillas, que inició con baja percepción al momento basal, pero aumentó a medida que avanzó el tiempo.
Además de los síntomas más frecuentemente percibidos por los pacientes del estudio, los otros síntomas del EAT-10 referentes a sensación de pérdida de peso, interferencia para comer fuera de casa, afectación del placer de comer y estrés al tragar, excepto la odinofagia, también fueron frecuentemente percibidas. La odinofagia no representó un síntoma frecuentemente auto percibido, ni en el basal ni en el seguimiento de los pacientes. Es difícil establecer una explicación puntual, pero fisiopatológicamente la odinofagia es más usual en procesos inflamatorios de la mucosa faríngea, y no un signo acompañante de procesos neurológicos ni neuromusculares.
En el momento basal, adicional a los síntomas de dificultad para tragar sólidos y pastillas, el síntoma de interferencia para comer fuera de casa fue calificada como problema serio en mayor frecuencia por los pacientes evaluados. En un estudio basado en entrevistas a 360 pacientes mayores con disfagia independiente de su etiología, el 44 % reportaron pérdida de peso en los doce meses previos, el 45 % reportó que comer es una experiencia placentera, 41 % afirmó haber experimentado ansiedad o pánico durante las comidas y el 36 % evitaban comer con otras personas debido a su disfagia24.
Un síntoma cardinal de la disfagia, sin clasificarla por tipo o causa, es la sensación de adherencia y dificultad en el tránsito de los alimentos a través del aparato digestivo y respiratorio superior1,25; y un signo cardinal de disfagia orofaríngea es la dificultad para iniciar la deglución26, aspecto que no hace parte de las preguntas que conforman el EAT-10.
Los pacientes con disfagia orofaríngea experimentan uno o varios de los siguientes síntomas durante su evolución: regurgitación nasal de líquidos al tragar, tos frecuente acompañada o no de asfixia inmediatamente después de tragar y voz húmeda al ingerir líquidos (su aparición es variable), aumento de secreciones orales y sialorrea; retención del bolo en la faringe que origina la sensación de comida pegada en la garganta, pérdida de peso, secreciones crónicas en tracto respiratorio inferior, lentitud al comer u otros cambios en los hábitos alimenticios y ronquera27. Estos síntomas pueden ser resultado de penetración o aspiración laríngea, insuficiencia del paladar blando o por fase oral anormal de la deglución28. Se reporta además la dificultad para tragar en especial sólidos29 y evitar ciertas texturas de los alimentos6 (considerado un síntoma menos obvio de disfagia orofaríngea). Este aspecto se visualizó en el comportamiento registrado con las preguntas sobre esfuerzo extra para tragar comida sólida y pastillas del EAT-10.
No se encontraron diferencias estadísticamente significativas de los puntajes totales del EAT-10 entre mujeres y hombres en ninguno de los tres momentos del estudio. En la literatura revisada el sexo no es una variable que influya sobre la fisiopatología en si de la disfagia orofaríngea, ni hay reportes respecto a que modifique el grado de percepción o aparición de síntomas de disfagia.
Se destaca la importancia de la terapia de deglución en los pacientes con NOD, más la realización de otras terapias según la condición neurológica o neuromuscular de base, ya que permite a los pacientes y sus familias tener una percepción diferente de los problemas para tragar y alimentarse. La terapia de la deglución ofrece pautas de manejo para favorecer el proceso oro motor, mejorar la seguridad durante la deglución y hacer cambios en las texturas de los alimentos. Se observó como en los pacientes que al momento basal estaban recibiendo terapia respiratoria, de la deglución o física el puntaje total del EAT-10 fue más alto, y en el tercer mes de seguimiento fue comparativamente menor, pero el diseño del estudio no permite realizar inferencias respecto al efecto directo o indirecto de las terapias sobre la fisiopatología y clínica de la NOD. No se encontraron trabajos respecto a la modificación o mejoría de los síntomas en pacientes con NOD secundario a recepción de terapias a lo largo de su evolución.
Una limitante del estudio es que el tiempo de seguimiento fue de seis meses y en varios pacientes se vio afectado por la contingencia en salud COVID-19. Posiblemente en aquellos pacientes con NOD que desarrollaron COVID-19 los síntomas de disfagia se pudieron agravar.
Conclusiones
El tamizaje de disfagia, el reconocimiento de disfagia orofaríngea y seguimiento en el tiempo de su evolución deberían ser actividades usuales en la atención integral de pacientes neurológicos, teniendo presente que la percepción de síntomas de disfagia es dinámica. Las enfermedades neurológicas y neuromusculares producen un amplio espectro de síntomas de disfagia, que se pueden reconocer en el campo asistencial por varios profesionales de salud.
Se sugiere la realización de estudios de seguimiento mayor a un año, para entender mejor el comportamiento de los síntomas de disfagia en pacientes con NOD según su etiología en particular (p. ej. síntomas de disfagia y evolución en el tiempo de pacientes con disfagia orofaríngea por EM o por ACV), y estudios centrados en el efecto de las terapias sobre el curso clínico de la NOD.