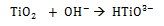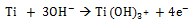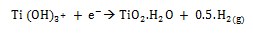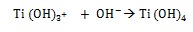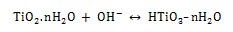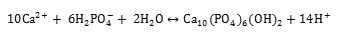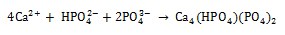I. INTRODUCCIÓN
Los biomateriales son materiales aptos para ser utilizados en el cuerpo humano con fines de tratamiento, alivio de enfermedades, lesiones, sustitución o modificación de su anatomía [1]. La aleación de titanio Ti6Al4V se utiliza ampliamente como material de implantes en ortopedia y odontología debido a su alta relación de resistencia a peso, buena resistencia a la corrosión y buena biocompatibilidad [2]. Aproximadamente una cuarta parte de los dispositivos médicos disponibles comercialmente están hechos de Ti6Al4V. Esto se atribuyó a la biocompatibilidad relativamente mayor de la aleación como resultado de la formación de una capa delgada pasiva, estable y continua de los óxidos de Ti y Al sobre su superficie [3].
Sin embargo, debido a las pobres propiedades osteoconductoras del metal de Ti, el hecho de conferir cerámicas bioactivas a los implantes Ti6Al4V ha recibido una atención considerable para mejorar sus interacciones con el hueso [4]. Estos biocerámicos a menudo están hechos de hidroxiapatita (HA), fosfato tricálcico (TCP), titania (TiO2) y bioglass. Entre ellos, las cerámicas bifásicas de HA y TCP se están estudiando activamente debido a su similitud de estructura y composición química con el hueso humano [5].
El titanato de sodio hidrogel (HA) sobre la aleación de titanio (Ti6Al4V) se ha vuelto mucho más popular que el titanio puro en aplicaciones ortopédicas y dentales debido a sus propiedades mecánicas superiores y su mayor resistencia a la corrosión [6, 7].
Un método para modificar las superficies de los materiales de implantes ortopédicos es la textura por ablasión láser. Este método ha mejorado la adhesión celular de las superficies Ti y Ti6Al4V mediante la creación de patrones en las superficies. Estos patrones se convierten en un método excelente para lograr mejorar la reactividad de la superficie al generar sitios activos que favorecen la formación de apatitas y la adhesión celular [5, 7, 8, 9, 13].
Por tal motivo, el objetivo del presente trabajo de investigación es obtener recubrimientos de hidroxiapatita por el método sol-gel sobre Ti6Al4V ELI; posteriormente realizar un patronamiento de la superficie utilizando la técnica de ablación láser, generando sitios activos que promuevan la nucleación y crecimiento de apatitas.
II. MATERIALES Y MÉTODOS
Muestras de Ti6Al4V ELI de forma cilíndrica con diámetro de 14 mm y espesor de 4 mm fueron preparadas bajo la norma ASTM E3–01 [14]. Posteriormente se realizó un pulido químico en una solución de 20% HNO3, 3% HF y agua destilada durante 5 minutos. Por último, las muestras fueron sometidas a limpieza ultrasónica con acetona durante 8 minutos y secadas al aire.
Con el fin de mejorar la adherencia del recubrimiento de hidroxiapatita inicialmente se llevó a cabo un tratamiento alcalino para lo cual se empleó una solución de NaOH 10 M y se realizó inmersión de los sustratos a 60°C por 24 horas en un baño termostatado. Posteriormente los sustratos tratados se calcinaron a 450°C durante una hora, con una velocidad de calentamiento de 5 °C/min y enfriamiento en el horno [6, 13].
La preparación del sol-gel de hidroxiapatita se siguió el procedimiento sugerido por Wang, D. et al. [15]. Como resultado se obtuvo un sol claro con un pH de 4.5, al cual se le agregó hidróxido de amonio para ajustar el pH a 7.1. Las muestras se recubrieron mediante la técnica de dip-coating. La inmersión de los sustratos se llevó a cabo durante un minuto a una velocidad de 1.5 cm/min. Posteriormente los sustratos recubiertos fueron secados a 70°C, seguido de un tratamiento térmico a 400, 500 y 600°C durante 10 minutos. Con el fin de mejorar la cristalinidad de los recubrimientos.
El patronamiento de la superficie con el recubrimiento se realizó mediante ablación láser, por medio de 3 pulsos, empleando un láser pulsado de Nd: YAG (Quanta-Ray INDI), con una energía de trabajo de 1.3 mJ, el cual emite una longitud de onda de 1064nm [16].
La caracterización de los sustratos se desarrolló empleando microscopia electrónica de barrido utilizando un microscopio FE-SEM Quanta FEG 650, difracción de Rayos X en un difractómetro BRUKER modelo D8 ADVANCE con geometría DaVinci.
Para evaluar la capacidad que tienen los recubrimientos de promover la formación de depósitos de apatita en la superficie, los sustratos fueron inmersos durante 8 días en fluido corporal simulado (SBF) donde se tomaron alícuotas diariamente para llevar el seguimiento de la absorción de calcio antes y después del patronamiento.
III. RESULTADOS Y DISCUSIÓN
En la Figura 1 se observa que el tratamiento alcalino con NaOH modificó las características de la superficie, originando una textura muy rugosa con una topografía irregular en comparación con la superficie inicial. La Figura 1a muestra una estructura amorfa y con tamaño de grano pequeño lo cual está acorde a lo reportado previamente en la literatura [10, 13, 17]. Para mejorar la adhesión de la película de hidrogel al sustrato se realizó un tratamiento térmico debido a que la forma del hidrogel en Ti sin tratamiento térmico es mecánicamente inestable [18]. Durante este proceso la capa de hidrogel se deshidrata, aumenta el tamaño de grano y forma una capa más compacta y densificada como se observa en la Figura 1b.

Fig. 1 Tratamiento alcalino: a) sin tratamiento térmico, y, b) con tratamiento térmico a 450°C por 1 hora
Durante la inmersión en solución de NaOH, el TiO2 se disuelve parcialmente debido al ataque del grupo hidroxilo corrosivo [17] como se describe a continuación:
Esta reacción sucede simultáneamente con la de hidratación del titanio.
A medida que se producen los grupos hidroxilo atacan al TiO2 y genera cargas negativas en la superficie de los sestratos de la siguiente manera:
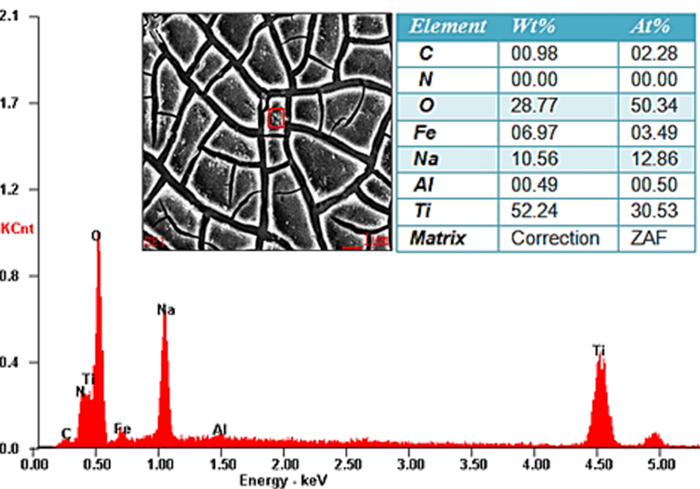
El resultado del microanálisis químico por EDS (ver figura 2), revela la presencia de sodio (Na) y oxígeno (O) sobre la superficie, lo cual corrobora la formación de la capa hidrogel de titanato sódico deshidratada.
Estas especies cargadas negativamente se combinan con iones alcalinos en la solución acuosa, lo que resulta en la formación de una capa de titanato alcalino. El titanato de sodio obtenido es un material cristalino estable y altamente bioactivo (Na2Ti5O11), según el análisis EDS (Figura 2) la concentración de sodio en el titanato obtenido posee un porcentaje atómico de 12.86 %, cercano al valor teórico presente en el titanato de sodio que es del 10% [19].
En el difractograma mostrado en la Figura 3, se observan picos agudos y delgados para cada uno de los recubrimientos tratados térmicamente a diferentes temperaturas, que confirman la presencia de hidroxiapatita con cierto grado de cristalinidad, se observa que el grado de cristalinidad aumenta con el incremento de la temperatura [20, 21], por lo tanto, el recubrimiento tratado térmicamente presentó mayor cristalinidad a 600°C, esto puede ser asociado al transporte de masa debido a la coalescencia de los granos [22]. Se puede apreciar picos característicos ubicados en 2θ = 21.7, 35.42, 40.5, 63.56, 74.82, 78.06 correspondientes a los planos (200), (301), (221), (510), (234), (161) respectivamente, estos concuerdan con los patrones internacionales para la hidroxiapatita, además no se detectó la presencia de fases adicionales, evidenciándose la continuidad de la capa de hidroxiapatita sobre el sustrato metálico. Los perfiles obtenidos se compararon con las difracciones reportadas en la base de datos con número de tarjeta 010-73-1731 del Internacional Center for Diffraction Data.
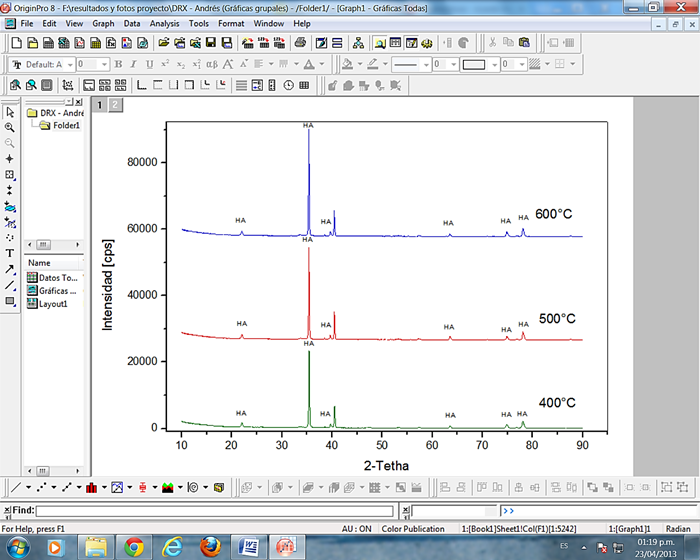
Fig. 3 Difractograma de los sustratos recubiertos por hidroxiapatita tratados térmicamente a 400, 500 y 600°C
En la figura 4 se observa que los recubrimientos se encuentran constituidos por glóbulos distribuidos de manera dispersa sobre la superficie del sustrato y de tamaño variable, la morfología de la hidroxiapatita formada según el tratamiento térmico presenta variación de la porosidad y tienden a ser redondeados con el aumento de la temperatura, al igual se observan ciertos tipos de aglomerados que posteriormente mediante el análisis EDS se comprobó la presencia de hidroxiapatita. La Figura 4a muestra una hidroxiapatita en forma de rosetas, no se evidencia la aparición de poros, su estructura es densa, al observar a 40000x las grietas denotan una profundidad sobre el recubrimiento tratado térmicamente a 400°C, visualmente estas grietas son más oscuras que en los demás recubrimientos; para el recubrimiento tratado a 500°C en la Figura 4b se distinguen poros de un tamaño promedio de 0.128 µm, nódulos redondeados dispersos sobre la superficie del sustrato, mayor número de grietas en las cuales se aprecia la misma porosidad presentada en la superficie; en la Figura 4c se muestra la morfología para el recubrimiento tratado a 600°C, se observa un incremento del tamaño y número de poros, con un tamaño promedio de 0.240 µm.

Fig. 4 Análisis FE-SEM del recubrimiento de hidroxiapatita tratada térmicamente a: a) 400°C, b) 500°C, y, c) 600°C
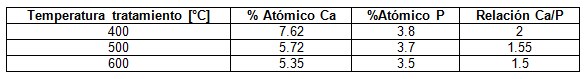
El análisis EDS para el recubrimiento tratado a 400°C muestra la presencia de calcio y fósforo, para una relación del valor máximo de Ca/P=2 (Tabla 1), clasificado como un fosfato tetracálcico, el cual fomenta un mayor crecimiento de apatitas por su alto contenido de Ca. Según el análisis EDS es el recubrimiento que presentó mayores porcentajes de calcio y fósforo. En el recubrimiento tratado a 600°C se obtuvo una relación cercana parecida a la del recubrimiento de 500°C, con una relación de Ca/P=1.5 clasificada como hidroxiapatita deficiente en calcio.
La Figura 5 muestra los recubrimientos mediante ablación láser, donde el impacto de los pulsos láser originó cráteres con diámetros promedios de 35.83 µm y se logró un espaciado en el eje X entre 80 µm - 208 µm y en el eje Y entre 163.2 µm – 287.4 µm aproximadamente.

Fig. 5 Micrografía SEM del recubrimiento de hidroxiapatita patronado por ablación láser, medición de las distancias: a) plano XY, y, b) diámetros de los cráteres
Se obtuvo una morfología del cráter similar para los tres recubrimientos tratados térmicamente a diferentes temperaturas, como se observa en la Figura 6, que suelen no tener límites perfectamente definidos, crestas y material redepositado en los bordes, debido a que la longitud de onda, energía y duración de los pulsos afectan la longitud de penetración o profundidad de los cráteres sobre los recubrimientos [23, 24] .
Los recubrimientos tratados térmicamente e inmersos en SBF presentaron leves modificaciones morfológicas en los recubrimientos a 400 y 500°C, al comparar las micrografías obtenidas antes (Figura 4) y después (Figura 7) de la inmersión, se observa que el cambio originó una estructura laminar; además la muestra tratada térmicamente a 500°C presentó un decremento bastante notorio en sus nódulos de 2.5μm a 1.5μm aproximadamente, debido a los fenómenos de disolución y precipitación ocurridos durante la inmersión en el fluido, aumentando la formación de nódulos con ramificaciones en toda la superficie en comparación con el recubrimiento inicial de la hidroxiapatita deficiente en calcio; por otra parte, la muestra tratada a 600°C presentó un aumento en el tamaño de nódulo de alrededor de tres veces su valor inicial. El recubrimiento tratado térmicamente a 600°C exterioriza una morfología en forma de agujas, la morfología presentada por estos cristales posee características pertenecientes a la familia de los fosfatos de calcio según investigaciones previas [25]. Todos los recubrimientos de hidroxiapatita formaron una capa de apatita sobre su superficie después de inmersión en fluido fisiológico simulado SBF, lo que indica que estos recubrimientos son potencialmente bioactivos.
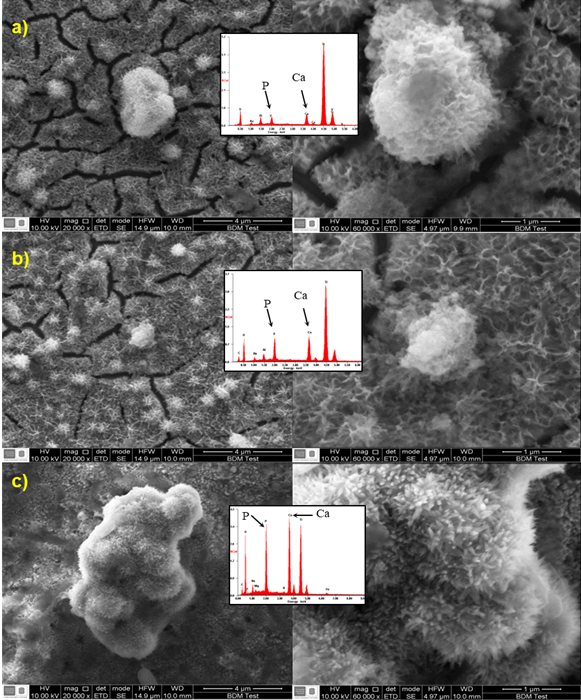
Fig. 7 Análisis SEM con recubrimiento de hidroxiapatita tratada térmicamente: a) 400°C, b) 500°C, y, c) 600°C inmersas en fluido fisiológico SBF
Los análisis EDS confirman la presencia de apatitas con relaciones de calcio y fósforo de 1.11, 1.35 y 1.3 para los recubrimientos tratados térmicamente a 400, 500 y 600°C respectivamente. Por otra parte, la muestra tratada térmicamente a 600°C presentó la mayor bioactividad, pues se observa en las micrografías, una gran cantidad de depósitos de fosfatos de calcio con apariencia de esponja sobre la superficie del recubrimiento, la cual corresponde a una morfología típica de las apatitas crecidas en ensayos in vitro en SBF [26] .
En los ensayos de inmersión en SBF para los recubrimientos patronados mediante ablación láser, se observa que el recubrimiento de hidroxiapatita se encuentra depositado sobre la superficie en forma de aglomerados característicos de apatitas.

Fig. 8 Micrografías SEM: a) morfología característica de los recubrimientos patronados sin inmersión en SBF y b) 400°C, c) 500°C, d) 600°C inmersas en fluido fisiológico SBF
Al comparar las micrografías de las Figuras 7 y 8 se observa que para los recubrimientos patronados se encontraron zonas donde hay gran cantidad de apatita depositada y otras donde hay poca presencia de apatita, lo que indica que ocurrió una nucleación preferencial del fosfato de calcio que activaron ciertas zonas de la superficie del recubrimiento, esto indicaría que el patronamiento favorece la nucleación de apatita sobre la superficie.
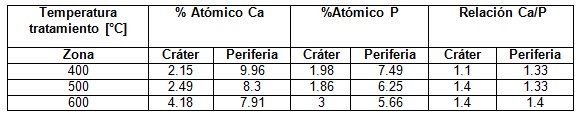
Los análisis EDS registrados a las superficies demuestran la presencia de fosfatos de calcio sobre los recubrimientos, como se puede observar en la Tabla 2. Las relaciones de calcio fosforo tanto en el cráter como en la periferia del mismo son un buen indicador de que el proceso de ablación laser genera sitios activos que favorecen la formación de apatitas.
En la Figura 9a, se muestra que la cantidad de iones Ca2+ inicialmente tienen una concentración de 148 ppm aproximadamente. Para la muestra tratada a 400°C se observa una disolución en las primeras 24 horas de inmersión en fluido fisiológico, mientras que las muestras tratadas a 500 y 600°C muestran un comportamiento de disolución de los iones de Ca2+ provenientes de la hidroxiapatita del recubrimiento en sus primeras 12 horas. Al finalizar el proceso de inmersión, se observa una disminución en las concentraciones de calcio, debido a la formación de precipitados de fosfatos de calcio y al crecimiento de un recubrimiento de apatita en la superficie de la muestras, como sea mencionado en diferentes investigaciones [27, 28, 29] ; esto es atribuido a la carga negativa de la HA cuando es inmersas en fluido fisiológico, “los iones OH- y PO4 -3 que se encuentran en la superficie se combinan selectivamente con los iones Ca2+ que se encuentran en el fluido, para formar un fosfato de calcio rico en calcio; cuando los iones de calcio se acumulan, la superficie adquiere una carga positiva, y entonces, puede combinarse con los iones de carga negativa de fosfato que se encuentran en el medio, para formar un fosfato de calcio amorfo con una relación baja. Esta es una fase metaestable y eventualmente se transforma en una apatita similar a la fase mineral del hueso [22]”.
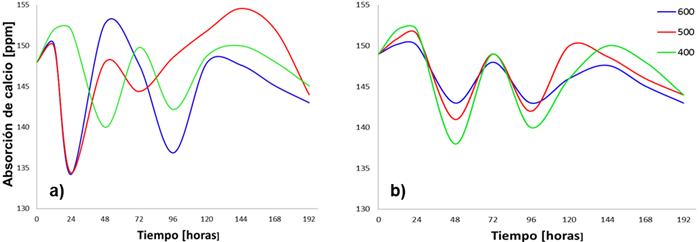
Fig. 9 Concentración de calcio en solución SBF vs. Tiempo de inmersión, para los recubrimientos (a) sin patronar y (b) patronadas
La formación de diferentes fosfatos de calcio en solución SBF se puede describir mediante las siguientes reacciones:
Para las muestras patronadas (Figura 9b), la concentración de la solución en el tiempo cero fue 150 ppm aproximadamente, los procesos de disolución y precipitación se presentan similares para los tres recubrimientos; la mayor precipitación se presentó para el recubrimiento tratado térmicamente a 600°C, esto se evidencia con los anteriores análisis de morfología mediante la técnica FE-SEM y el análisis cuantitativo EDS, se encontró que este recubrimiento es el que presenta más nódulos de apatita al interior de los cráteres y en su periferia, posee altos porcentajes de calcio y fósforo con una relación promedio de 1.4.
Durante toda la inmersión se observa que para la formación de apatitas ocurre simultáneamente la etapa de disolución y precipitación, el SBF se satura en iones Ca y P para luego precipitarse las apatitas. En general los tres recubrimientos patronados generan superficies bioactivas, presentando mayor formación de depósitos de apatita el recubrimiento tratado térmicamente a 600°C luego 500°C y 400°C, lo que revela que a 600°C posee mayor bioactividad en presencia de fluido fisiológico SBF a 37°C por 8 días.
IV. CONCLUSIONES
El uso de la técnica sol-gel permitió obtener recubrimientos de hidroxiapatita sobre los sustratos de Ti6Al4V, los cuales presentaron un incremento en la porosidad con el aumento de la temperatura de tratamiento térmico al cual fueron sometidos.
Al modificar las superficies de hidroxiapatita mediante ablación laser se lograron generar sitios activos que permitieron aumentar la interacción iónica entre el fluido fisiológico y el recubrimiento, lo cual favoreció la nucleación de apatita sobre la superficie.
La evaluación y caracterización de los recubrimientos mediante las técnicas SEM-EDS demostraron que los recubrimientos tratados térmicamente a 600°C antes y después de patronar por ablación láser, presentaron la mejor respuesta a la formación de fosfatos de calcio, induciendo un mayor crecimiento de apatitas durante la inmersión en fluido fisiológico.