I. Introducción
El sector industrial curtidor es considerado como uno de los que más ocasionan contaminación ambiental [1], debido a que los procesos de transformación del cuero para la elaboración de marroquinería generan altas cargas de residuos sólidos, líquidos y gaseosos [2]. Esto trae consigo la necesidad de desarrollar y emplear tecnologías limpias y sostenibles que reduzcan la contaminación causada por la actividad industrial [3] y así disminuir los impactos económicos, sociales y ambientales, debido a que los residuos sólidos y líquidos afectan considerablemente la calidad ambiental del ecosistema [2]. Por tal motivo se busca involucrar alternativas para la minimización o prevención de la contaminación por medio de proyectos de producción más limpia para dicha industria [4]. Los municipios de Villapinzón y Chocontá, del departamento de Cundinamarca, Colombia, poseen bodegas rudimentarias, curtiembres o tenerías en los alrededores del río Bogotá, con el fin de disponer del agua para el proceso o como medio de evacuación de los vertimientos generados dentro del proceso.
Durante el proceso de curtido se producen residuos, como viruta de wet white, residuos de viruta de cuero curtido (wet blue) y subproductos como recortes de piel, carnaza, unche, entre otros [5]. El curtido wet white (WW) es elaborado en la etapa de rebajado de pieles, con glutaraldehído principalmente, agentes aldehídicos, taninos vegetales y sintéticos o con minerales como sales de circonio y aluminio [6], donde, de acuerdo con algunos estudios, el wet white con glutaraldehído resulta ser más efectivo, pues da lugar a la obtención de residuos con mayor facilidad de disposición final y tratamiento que el realizado de forma convencional, lo cual representa menor riesgo para el ambiente, dado que el proceso no tiene metales no esenciales [7], [8]. El proceso de curtido libre de cromo, wet white, se ha llevado a cabo en la industria curtidora con el propósito de emplear nuevas alternativas innovadoras en la fabricación del cuero ecológico libre de cromo, biodegradable y con las mismas características del realizado habitualmente [9], a fin de reducir los niveles de contaminación, cumplir con los requerimientos ambientales y contribuir al mejoramiento continuo del ambiente [10]. Sin embargo, al no desechar o dar el tratamiento pertinente a dichos residuos se puede presentar una problemática ambiental, por lo cual se estudia el tratamiento de las virutas de wet white.
La composición de colágeno representa el 29 % del 33 % de las proteínas estructurales totales presentes en la piel de origen bovino, de las cuales el 2 % es keratina y el 0.3 %, elastina [11]. Por tal razón, es adecuado investigar sobre la extracción de colágeno hidrolizado, el cual es una proteína que brinda estructura, elasticidad, fuerza y forma a los tejidos extracelulares conectores [15], se presenta en los residuos y/o subproductos generados dentro del proceso de curtido y es aplicado en diferentes campos como en medicina, nutrición, cosméticos y fármacos [16], como la elaboración de productos de belleza y cuidado de la piel [12], es decir, champú, acondicionadores, lociones, cremas [13], jabones, cepillos, pinceles, fabricación de alimentos para animales [14], pastas, entre otros productos.
En la actualidad existen alternativas de aprovechamiento y valorización del material por tratar, como la obtención de hidrolizados de colágeno; alternativas que se han enfocado en el tratamiento de las virutas de cuero curtido wet blue a través del proceso de hidrólisis alcalina-enzimática [17], [18]. De igual forma, de los residuos de curtido libre de cromo se extraen virutas (wet white) que pueden ser aprovechadas para la producción de proteínas hidrolizadas, lo cual valoriza el residuo y mitiga el impacto generado, además de favorecer la sostenibilidad económica de la industria curtidora, debido a que puede ser una fuente adicional de recursos del sector. La hidrólisis enzimática asistida con ultrasonido representa una alternativa para la intensificación del proceso de fabricación de proteínas hidrolizadas a partir de residuos generados por el sector curtidor, el cual procura reducir el uso de agentes químicos por efecto de la mejoría en la agitación [19], acelerar el proceso y obtener un mayor rendimiento en la extracción [20], [21]. El proceso se orientó a evaluar una opción para mejorar la productividad de la industria curtidora a partir de la obtención de colágeno hidrolizado como subproducto del proceso.
II. Metodología
A. Materiales
Para la ejecución de los ensayos experimentales en la obtención de colágeno hidrolizado la materia prima fueron virutas de wet white suministrada por una empresa curtidora ubicada en el municipio de Villapinzón. La enzima proteolítica utilizada tiene el nombre comercial Tan G Plus, provista por la empresa MerQuiand, distribuidora de enzimas de la marca Dupont, Gerencor International, empleadas comúnmente en la industria curtidora [20] y en la hidrólisis de proteínas. Puntualmente es seleccionada en la presente investigación debido a que permite el desprendimiento de las fibras de colágeno [21]. Por otro lado, los ensayos de hidrólisis fueron realizados en el baño ultrasónico Wise Clean modelo WUC-D10H de la marca Wisd Laboratory con capacidad de 0.01 m3, temporizador hasta 216.000 segundos, alta frecuencia de 40 kHz, control y rangos de temperatura hasta 353.15 K [22]; dentro del baño fueron dispuestos beakers de vidrio con capacidad de 0.00025 m3, cada uno contenía 0.01 kg de material medido con la balanza analítica, 0.0001 m3 de agua destilada a pH de operación y la cantidad de enzima determinada para la ejecución de los ensayos, equipos dispuestos por los laboratorios de la Universidad Libre sede Bosque Popular.
El diseño experimental implementado fue del tipo central compuesto [23], y consistió en la elaboración de 20 ensayos para los cuales las variables o factores de proceso fueron el pH de la mezcla reactiva, el cual varió entre 6 y 9, la dosis de la enzima TAN G PLUS entre 0.000075 kg y 0.00012 kg por cada 0.01 kg de virutas para hidrolizar, y la potencia del baño ultrasónico fue variada entre el 40 y el 60 % de la máxima capacidad del equipo. Las variables fijas del proceso fueron la masa de material 0.01 kg, el volumen de agua para la reacción 0.0001 m3 y el tiempo de hidrólisis 14.400 segundos. Por otro lado, la variable de respuesta fue la masa de colágeno hidrolizado obtenido. Una vez determinadas las condiciones óptimas de funcionamiento, se realizaron ensayos a diferentes temperaturas y por triplicado, variadas entre 298.15 K, 303.15 K, 308.15 K y 313.15 K, con el propósito de encontrar el efecto de la temperatura sobre la eficiencia en la obtención de colágeno a partir de virutas de wet white.
B. Métodos
El colágeno hidrolizado se obtuvo por hidrólisis enzimática asistida por ultrasonido [19], a partir de virutas de cuero curtido con glutaraldehído (wet white). La cuantificación de colágeno hidrolizado fue realizada por el método de Bradford [24] y electroforesis en gel de SDS-poliacrilamida [25], para verificar y reconocer la pureza de los sustratos o soluciones de colágeno.
1) Caracterización de la proteína obtenida. La determinación de la concentración de proteína presente en las muestras a condiciones de pH y dosis de enzima experimentales en la obtención de colágeno hidrolizado se realizó mediante el método de Bradford [26]. Con la finalidad de verificar la extracción de colágeno a partir de virutas de wet white, se desarrolló la electroforesis en gel de poliacrilamida SDS-PAGE partiendo del método de Laemmli, el cual permite el reconocimiento de las proteínas en alta cantidad mediante la tinción [27]. Se implementó un gel de separación al 12 % y concentrador al 4 %; la preparación de las mezclas fue hecha a partir de Buffer Tris-HCl 1.5M pH 8.8, agua destilada, bis-acrilamida al 30 %, SDS al 30 %, persulfato de amonio (APS), TEMED, Buffer Tris-HCl 0.5M pH 6.8 respectivamente para cada uno de los geles. Para el corrido de las muestras, fueron sembradas en cada celda 20 µL en el equipo Bio-Rad Mini-Protein tetra cell, se ajustó el voltaje a 125 V. En cuanto a la determinación del tipo y pureza de la proteína hidrolizada (colágeno), se tomó como referencia el patrón Opti-Protein XL Marker con peso molecular de 245 kDa [28].
2) Determinación del valor másico porcentual. La ecuación (1) permite ver el porcentaje de recuperación de proteína hidrolizada obtenida en los ensayos.
3) Análisis estadístico. El análisis estadístico de los resultados experimentales es desarrollado mediante la aplicación del método de análisis de varianza (ANOVA) [29] y el método de superficie de respuesta [23], que permiten la evaluación de las variables experimentales y las interacciones entre sí, para, de esa manera, determinar los factores que influyen directamente sobre la cantidad de colágeno hidrolizado obtenido y optimizar el proceso para alcanzar el mayor valor de la variable de interés o de respuesta.
III. Resultados
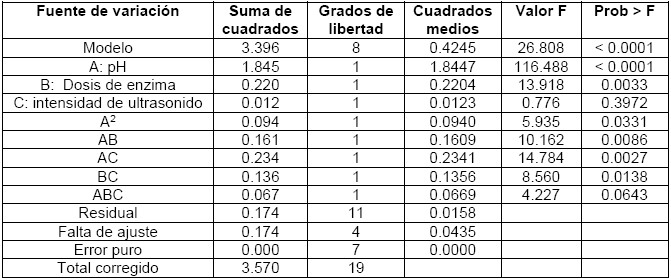
Con el propósito de evaluar dicho proceso, en la Tabla 1 se encuentra el Anova para los experimentos realizados.
Los valores de probabilidad < 0.0001 señalan que las variables pH y dosis de enzima son las más significativas al extraer colágeno hidrolizado. Hecho que permite afirmar que los resultados de los ensayos efectivamente varían dependiendo de los valores de las variables o factores analizados, pero, por otra parte, el efecto de la intensidad del ultrasonido no representa un rol significativo que altere el rendimiento del proceso.
A. Influencia de las variables de reacción
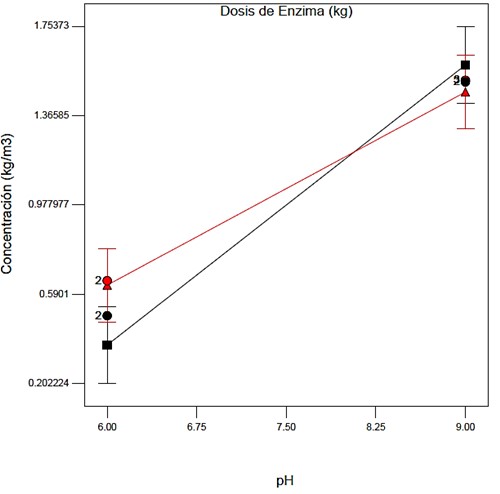
De los resultados experimentales se determinó que el pH y la dosis de enzima Tan G Plus, son las variables con mayor influencia sobre la cantidad de colágeno hidrolizado. La Figura 1 permite observar la interacción pH y dosis de enzima, de modo que para la dosis más alta se logra el mayor rendimiento a pH alcalino [30]. Se aprecia que las variables o factores estudiados interactúan levemente a partir de pH cercano a 8, punto en el cual al aumentar la dosis de enzima aumenta la concentración de proteína en la mezcla reactiva.
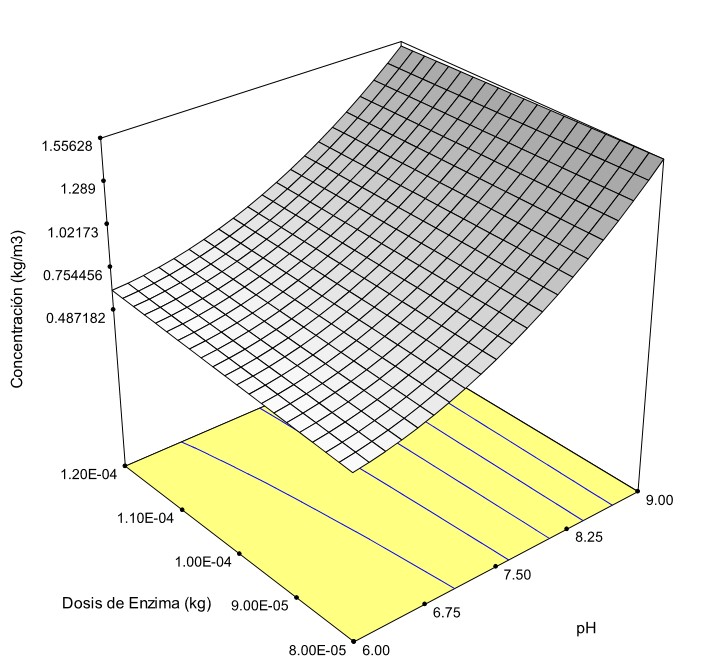
La Figura 2 corresponde a la superficie de respuesta para los experimentos realizados en un tiempo de reacción de 14.400 segundos.
Se advierte en la figura que, a una misma dosis de enzima, el incremento de pH mejora la efectividad de la hidrólisis; por otra parte, el aumento de la dosis de enzima para pH constante no representa una mejoría significativa en el proceso hidrolítico, en términos de concentración de proteína hidrolizada extraída. Además, la intensidad de ultrasonido en la obtención de la proteína hidrolizada no representó una variación significativa en el proceso analizado; sin embargo, para el valor más bajo de la potencia (40 %) resultó ser la variable óptima, en conjunto con las variables pH 9, dosis de enzima 0.00012 kg y tiempo de reacción de 14.400 segundos, que permiten obtener 1.519 kg de proteína / m3 de mezcla a temperatura ambiente. La ecuación (2) corresponde a la superficie de respuesta para la combinación de variables analizada:
El coeficiente de correlación (R2) conseguido del modelo para la superficie de respuesta tiene un valor de 0.9512, lo cual permite afirmar que el ajuste de los datos experimentales es aceptable. A partir de la ecuación anterior se determinó que para pH 9, dosis 0.00012 kg, potencia 40 %, se alcanza la máxima concentración de 1.519 kg/m3 de la mezcla de valores de las variables o factores que permiten alcanzar la mayor cantidad de colágeno hidrolizado.
B. Influencia de la temperatura (K)
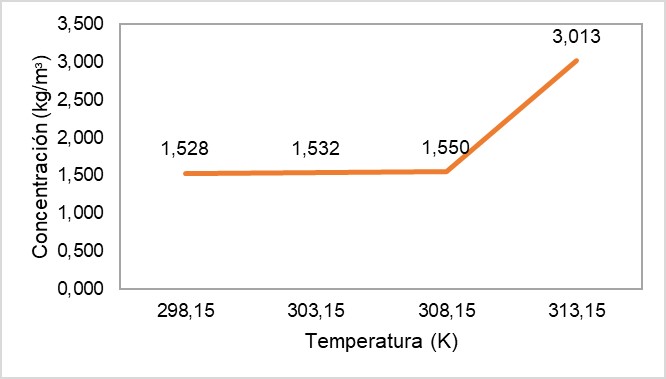
A fin de establecer el efecto de la temperatura sobre la obtención de proteína hidrolizada y agilizar el proceso de extracción [31], se llevó a cabo la hidrólisis a pH 9.0, dosis 0.00012 kg e intensidad de ultrasonido 40 % para temperaturas de 298.15 K, 303.15 K, 308.15 K y 313.15 K. Los resultados de concentración conseguida en estos ensayos se presentan en la Figura 3.
En la Figura 3 se observa que al incrementar la temperatura, la cantidad de proteína hidrolizada aumenta a 313.15 K y se alcanza la mayor concentración en peso de colágeno hidrolizado, 3.013 kg/m3, es decir, una recuperación del 3.0 % de proteína hidrolizada por cada kilogramo de virutas de wet white empleado.
C. Electroforesis en gel de poliacrilamida SDS-PAGE
La Figura 4 corresponde al resultado de la electroforesis en gel SDS-PAGE, para la proteina hidrolizada extraída bajo las condicones óptimas determinadas a partir de la superficie de respuesta. El carril 1 de la figura corresponde al patrón empleado y el carril 2 representa la muestra de proteina hidrolizada. Se pueden señalar las bandas correspondientes a la proteína hidrolizada por encima del valor (245 kDa), lo cual confirma la presencia de colágeno hidrolizado, partiendo del hecho de que al colágeno hidrolizado corresponde una masa molecular de 300 kDa [32], y con base en lo expuesto en otros estudios se puede afirmar que la proteína revelada en esta banda se debe a colágeno hidrolizado tipo I [25].
IV. Discusión y conclusiones
En este estudio se demuestra que las variables de pH y dosis de enzima en su mayor valor permiten la obtención del colágeno en mayor proporción, donde el efecto de la intensidad de ultrasonido no es de gran importancia, debido a que supera los niveles de significancia presentes en el Anova. Por otro lado, la temperatura es una variable condicionante del proceso, ya que al aumentarse, se logra extraer mayor proteína. Sin embargo, debido a que las proteínas son susceptibles a altas temperaturas, estas pueden desnaturalizarse, razón por la cual no es recomendable aumentar más esta variable. De esta manera se logra evidenciar que las variables más significativas que permiten optimizar el proceso de hidrólisis enzimática para la fabricación de colágeno hidrolizado son el pH, dosis de enzima y la temperatura. Además, se demuestra que el pH y la temperatura de operación se deben controlar y mantener dentro del mismo valor a lo largo del tiempo de operación.
Teniendo en cuenta que el proceso de curtido libre de cromo (wet white) es un procedimiento nuevo, no presenta estudios relacionados con la extracción de colágeno hidrolizado a partir de dicho material, por lo que se considera que el 3 % del rendimiento es bueno y permite evidenciar que es posible su aprovechamiento. Dicho proceso se compara con estudios llevados a cabo en virutas de wet blue, ya que se obtienen de la misma etapa de rebajado, y se propone la fabricación del colágeno hidrolizado mediante la hidrólisis enzimática, donde se presenta un rendimiento del 4.5 % con una mayor cantidad de material empleado. Por otra parte, en la electroforesis practicada se determinó la presencia de colágeno hidrolizado mediante la tinción de las bandas, donde los factores pueden afectar la coloración con mayor nitidez son el voltaje del equipo y el pH del medio.
Contribución de los autores
La contribución de los autores en la presente investigación se llevó a cabo con la ejecución de los ensayos experimentales y posterior análisis de resultados por Leidy Yaneth Almonacid Jiménez, Juan Sebastián Vallejo Rodríguez, Diana Paola Ovalle González y Rafael Nikolay Agudelo Valencia; en el análisis de los resultados, por Óscar Leonardo Ortiz Medina; y en la cooperación en la determinación y el análisis de los resultados de concentración y electroforesis en gel, por Javier Adolfo Hernández Fernández.