Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Ciencias
Print version ISSN 0121-1935
rev. cienc. vol.18 no.2 Cali July/Dec. 2014
Polymorphisms of Low Penetrance Genes as Genetic Markers of Risk of Familial Breast Cancer among Colombian Women
Polimorfismos en genes de baja penetrancia como marcadores genéticos de riesgo de cáncer de mama familiar entre mujeres colombianas
David M. Tróchez
Universidad del Valle, Cali - Colombia
E-mail: david.trochez@correounivalle.edu.co
Melissa Solarte
Universidad del Valle, Cali - Colombia
E-mail: melissa.solarte.cadavid@correounivalle.edu.co
Carolina Cortés
Universidad del Valle, Cali - Colombia
E-mail: carolina.cortes@correounivalle.edu.co
Laura Cifuentes
Universidad del Valle, Cali - Colombia
E-mail: lauracifuentes@gmail.com
Guillermo Barreto
Universidad del Valle, Cali - Colombia
E-mail: guillermo.barreto@correounivalle.edu.co
Received: November 7, 2014
Accepted: December 19, 2014
Abstract
Breast cancer is the most common female neoplasia worldwide. It's estimated that most cases are sporadic, though between 10 to 15% of them have a positive family history of the disease. This familial predisposition has been associated with alterations in genes involved in DNA's damage, detection and repair system; such as BRCA 1 and 2 genes, which are present in 25% of the cases and in the remaining 75% the action of alterations in genes with low penetrance is proposed.
Objective: Determine the presence of two polymorphisms (T241M and G135C) in low penetrance genes XRCC3 and RAD51, respectively, and its association with the risk of developing familial breast cancer among Colombian women.
Methodology: During one year (February 2011 - February 2012) an observational case-control study was made, with 53 women with active breast cancer and positive familiar history for the disease and 123 control healthy woman without personal or familiar history of the disease. Determining the presence -RAD51 G135C and XRCC3 T241M polymorphisms was realized by PCR-RFLP technique. For statistical analysis, the test of Hardy-Weinberg equilibrium was performed using 6.2 software GENEALEX and the exact test differentiation of Raymond & Rousset using the ARLEQUIN 3.1 software, in order to establish the existence or not of significant differences for the presence of polymorphisms.
Main Results: Carrying the XRCC3 T241M variant was associated with a 1.7 times more risk of developing this disease. While, the RAD51 G135C gene variant showed no significant differences between cases and controls.
Conclusion: These results suggest the determination of XRCC3 T241M polymorphism as a screening technique for the detection of women at high risk for familial breast cancer.
Keywords: Familial Breast Cancer, Hereditary Breast and Ovarian Cancer Syndrome [C04.588.180.483] Risk Assessment [E05.318.740.600.800.715] Risk Assessment [E05.318.740.600.800.715] Genetic Testing [E01.370.225.562] Polymorphism, Genetic [G05.365.795] XRCC3 T241M, RAD51 G135C.
Resumen
El cáncer de mama es la neoplasia femenina más frecuente a nivel mundial. Se estima que la mayoría de casos son esporádicos, pero entre el 10-15% de ellos tienen historia familiar positiva de la enfermedad. Esta predisposición familiar se ha asociado con mutaciones en genes involucrados en el sistema de detección y reparación de daños en el ADN; tales como los genes BRCA 1 y 2, las cuales se encuentran presentes en el 25% de los casos y en el 75% restante se propone la acción de alteraciones en genes de baja penetrancia.
Objetivo: Determinar la presencia de dos polimorfismos (T241M y G135C) en los genes de baja penetrancia XRCC3 y RAD51, respectivamente, y su asociación con el riesgo de desarrollar cáncer de mama familiar entre mujeres colombianas.
Metodología: Se realizó un estudio observacional de casos y controles, durante 1 año (Febrero 2011 - Febrero 2012), con 53 mujeres diagnosticadas con cáncer de mama e historia familiar positiva para esta neoplasia, y 123 controles sanas y sin historia personal o familiar de la enfermedad. La determinación de la presencia de los polimorfismos XRCC3 T241M y RAD51 G135C se realizó mediante la técnica PCR-RFLPs. Para el análisis estadístico se realizó el test de equilibrio Hardy-Weinberg empleando el software GENEALEX 6.2 y la prueba exacta de diferenciación de Raymond & Rousset utilizando el software ARLEQUIN 3.1, con el fin de establecer la existencia o no de diferencias significativas para la presencia de los polimorfismos.
Principales resultados: Portar la variante T241M-XRCC3, se asoció con un riesgo de 1.7 veces de desarrollar esta patología. La variante G135C del gen RAD51 no mostró diferencias significativas entre casos y controles.
Conclusión: Estos resultados sugieren la determinación del polimorfismo T241M-XRCC3 como técnica de tamización para la detección de mujeres con alto riesgo de desarrollar cáncer de mama de tipo familiar.
Palabras clave: cáncer de mama familiar, síndrome de cáncer de mama y ovario hereditario, evaluación del riesgo, pruebas genéticas, polimorfismo XRCC3 T241M, RAD51 G135C.
1. Introducción
El cáncer de mama es actualmente, el tipo de cáncer femenino más frecuente a nivel mundial, presentando una mayor incidencia en Europa y Norteamérica; sin embargo, en países en desarrollo como Agentina, Uruguay y Brasil su presencia ha incrementado de manera considerable (García et al. 2007, Lacey et al. 2002).
Específicamente, en Colombia el cáncer de mama es el segundo tipo de neoplasia más frecuentemente diagnosticada (670 nuevos casos en el 2010), representando, para este mismo año, la primera causa de muerte en mujeres de acuerdo a las estadísticas del Instituto Nacional de Cancerología (INC, 2010). Los departamentos con mayor diagnóstico de cáncer de mama son Valle del Cauca y Atlántico (INC, 2014)
La evidencia científica ha demostrado que la mayoría de los casos de cáncer de mama son de origen esporádico, asociados a diferentes factores de riesgo como: edad, cambios hormonales, estilo de vida, historia familiar, entre otros (Singletary 2003). Igualmente se conoce que la predisposición familiar está dada por mutaciones germinales en genes reguladores del ciclo celular, tales como los genes BRCA1 y BRCA2, los cuales explican el 25% de los casos de cáncer de mama familiar (Diez et al. 2003). Para el 75% restante, se propone la existencia de mutaciones en genes de baja y moderada penetrancia entre ellos: TP53 y PTEN (Lynch et al. 1997), CHEK 2 1100 del C (Meijers-Heijboer et al. 2002), ATM (Renwick A et al. 2006), los genes de la Anemia de Fanconi BRP1/FANJ y PALB2/FANCN (Seal et al. 2006), RAD51 variable 135G>C y XRCC3 variable T241M (Silva et al. 2010).
Para el gen RAD51 se ha encontrado que el polimorfismo G135C, podría afectar la estabilidad del RNAm y/o la eficiencia de la traducción, alterando de esta forma los niveles de la proteína. Igualmente, para el gen XRCC3 el polimorfismo más frecuente es el T241M, el cual ha sido asociado con un incremento en el riesgo de desarrollar cáncer de mama, ya que los portadores del alelo M presentan niveles más altos de roturas no reparadas en el ADN de linfocitos, en comparación con los homocigotos para el alelo T; lo que indica que el polimorfismo está asociado con baja capacidad de reparación del ADN (Figueroa et al. 2004; Forsti et al. 2004, Smith et al. 2003).
Normalmente el gen XRCC3 forma un complejo con RAD51, el cual es requerido para la reparación de daños del ADN. Su inactivación genera un deterioro en la conformación de dicho complejo y promueve hipersensibilidad a agentes ionizantes, incrementando las aberraciones cromosómicas y aumentando en 5 a 7 veces la probabilidad de endorreduplicaciones, con la consecuente generación de células tetraploides (Yoshihara et al. 2004).
Teniendo en cuenta que para Colombia no existen reportes o estudios en los que se evalúe la asociación de la presencia de mutaciones de genes de baja penetrancia con el riesgo de desarrollar cáncer de mama, la presente investigación se realizó con el objetivo de determinar si la presencia de los polimorfismos T241M en el gen XRCC3 y G135C en RAD51 son un factor de riesgo para el desarrollo de esta neoplasia entre mujeres colombianas con antecedente familiar positivo.
2. Materiales y métodos
Se realizó un estudio analítico observacional, transversal, de casos y controles, en el período Febrero de 2011 a Febrero de 2012, los cuales se obtuvieron de diferentes instituciones y entidades donde habían registros de pacientes diagnosticadas con cáncer de mama, sirviendo de intermediarios para el contacto de casos. En la región del Pacífico, las pacientes fueron contactadas en el Hospital Universitario del Valle "Evaristo García", el Registro Poblacional de Cáncer de Cali, FUNCÃNCER Cali y UNICÃNCER Palmira. En la región Caribe, en la Liga contra el cáncer de Cartagena y la Fundación de apoyo a la mujer con cáncer de seno "Mujeres por sus Senos".
Se estudiaron 53 mujeres (24 de la región Caribe y 29 del Pacífico), sin parentesco familiar, diagnosticadas con cáncer de mama y/u ovario y que al momento de la entrevista se encontraran en tratamiento. Los casos y sus familiares fueron informados sobre el propósito de la investigación, y quienes decidieron participar voluntariamente, firmaron el consentimiento informado. El estudio, de riesgo mínimo para los sujetos, contó con la aprobación del Comité Institucional de Revisión de Ãtica Humana de la Universidad del Valle.
2.1. Criterios de selección de casos
El grupo de casos estuvo constituido por mujeres con cáncer de mama y/u ovario y con historia familiar positiva para esta patología, que cumplieron con los siguientes criterios de inclusión:
- Dos parientes en primer grado afectados con cáncer de mama y/u ovario, y al menos uno de ellos diagnosticado, antes de los 41 años de edad ,para cáncer de mama o con cáncer de ovario a cualquier edad.
-Al menos tres parientes en primer o segundo grado de la misma línea familiar, afectados con cáncer de mama y/u ovario a cualquier edad.
-Al menos un caso de cáncer de mama diagnosticado antes de los 35 años, de preferencia bilateral.
-Al menos un caso de cáncer de ovario diagnosticado antes de los 30 años, de preferenciabilateral.
2.2. Muestra control
El grupo control lo constituyó 123 mujeres sanas, ajustados por edad, sexo y procedencia, con respecto a la muestra de casos y que cumplieran con los siguientes criterios de inclusión:
-No sufrir ni haber sufrido ningún tipo de cáncer.
-No presentar historia familiar de cáncer de mama, ovario y/o próstata.
-Haber nacido en Colombia.
El cumplimiento de estos criterios de inclusión se evaluó mediante una encuesta para la selección de controles. Extracción y cuantificación de ADN A todas las participantes se les tomó una muestra de 5ml de sangre periférica en tubos vacutainer con EDTA, la cual fue almacenada a -4°C para su posterior análisis. La extracción de ADN se realizó a partir de 1 ml de sangre periférica mediante el método de extracción "Salting-out", de acuerdo al protocolo Miller modificado (Miller et al, 1988). El ADN obtenido fue cuantificado por medio del espectrofotómetro Nanodrop ND 2.000, realizándose diluciones hasta una concentración final de 50ng/µl.
2.4. Análisis de genes de baja penetrancia
La identificación de las variantes en genes de baja penetrancia XRCC3 T241M y RAD51 G135C se realizó mediante la metodología de PCR- RFLP's (polymerase chain reaction -estriction fragment length polymorphism).
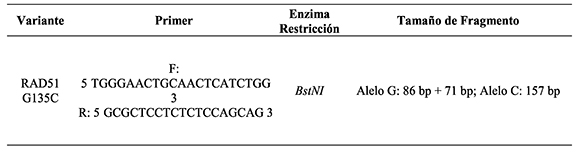
Para la caracterización de la variante T241M se amplificó por PCR el exón 7 del gen XRCC3 utilizando los cebadores reportados por Smith et al (2003), los que se muestran en la Tabla 1. Cada reacción de PCR se realizó en un volumen de 35µl, con 50ng de ADN molde, 1U/µl de Taq polimerasa, 10pmol de primers, 200µM de dNTPs, 2mM de MgCl2, Buffer de reacción 1X y agua ultrapura para completar el volumen final. El programa de amplificación consistió en una etapa inicial a 94°C durante 4 minutos, seguido de 30 ciclos que consisten en 30 segundos de desnaturalización a 95°C, 30 segundos de hibridación a 48°C, 30 segundos de elongación a 72°C y una extensión final a 72°C por 10 minutos en un termociclador Veriti.
Tabla 1. Cebadores, enzima y fragmentos esperados para la variante XRCC3 Thr241M
Una vez realizada la amplificación de esta región por PCR, los productos fueron digeridos con la enzima de restricción NIa III sugerida por Smith et al (2003). Posteriormente, los productos fueron visualizados en gel de poliacrilamida (29:1) al 8% teñido con nitrato de plata.
Para la caracterización de la variante G135C se amplificó la región 5'UTR del gen RAD51 utilizando los cebadores reportados por Levy-Lahad et al. (2001) los que se muestran en la Tabla 2. Los componentes de la reacción de PCR fueron preparados como descrito para el exon7 del gen XRCC3. El programa de amplificación para el gen RAD51 consistió en una etapa inicial a 94 °C durante 5 minutos, seguido de 30 ciclos que consisten en 30 segundos de desnaturalización a 95°C, 30 segundos de hibridación a 57°C, 30 segundos de elongación a 72°C y una extensión final a 72°C por 10 minutos en un termociclador Veriti. Los amplicones obtenidos fueron digeridos mediante la enzima de restricción BstNI sugerida por (Levy-Lahad et al. 2001) y con las mismas condiciones descritas para la endonucleasa Nla III.
Tabla 2. Cebadores, enzima y fragmentos esperados para la variante G135C del gen RAD51
2.5. Análisis Estadístico
El análisis estadístico se realizó empleando el software GENEALEX 6.2 (Peakall & Smouse 2006), con el cual se calcularon las frecuencias alélicas y genotípicas, tanto de casos como de controles. Con el fin de comparar las frecuencias genotípicas observadas con las esperadas en casos y en controles, y de observar si la población se encontraba en equilibrio Hardy-Weinberg se realizó una prueba exacta de Chi-Cuadrado X2. Además, se usó la prueba exacta de diferenciación de Raymond & Rousset análoga a la prueba de Fisher, utilizando el software ARLEQUIN 3.1, para establecer las diferencias significativas para la presencia de los polimorfismos XRCC3 T241M y RAD51-G135C entre casos y controles.
Los Odds Ratio (OR) y sus intervalos de confianza (CI 95%) fueron calculados para estimar el grado de asociación entre presencia de las variantes y aumento del riesgo de desarrollar la neoplasia.
3. Resultados
Se analizaron 29 casos provenientes de la región Pacífico: 11 de Cali, 1 de Tambo, Cauca, 3 de Calima Darién, 4 de Palmira, 1 de Buenaventura, 3 de Florida, 1 de Guapi, 1 de Puerto Tejada, 1 de Cartago, 2 de Restrepo y 1 de la Cumbre; y 24 del Caribe: 3 de Córdoba, 17 de Cartagena, 3 de Barranquilla, 1 de Sucre, y 123 controles provenientes de las dos costas.
3.1 Análisis de variantes en genes de baja penetrancia
Las variantes XRCC3 T241M y RAD51 G135C fueron caracterizadas en 53 casos y 123 controles.
3.1.1. Análisis de la variante RAD51 G135C
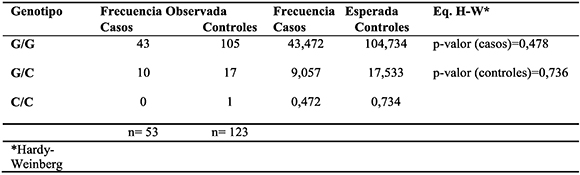
En la Tabla 3 se muestran los hallazgos en relación a la variante RAD51 G135C. Entre los casos, el genotipo más frecuente fue G/G (81.1 %) seguido por G/C (18.9%), y no se detectó ningún caso de genotipo C/C. En la muestra control se observaron los genotipos G/G (85.30 %), seguido de G/C (13.82 %) y de C/C (0.81 %).
Tabla 3. Hardy-Weinberg para la variante G135C del gen RAD51 en casos y controles
Para la variante RAD51 G135C no se encontraron diferencias significativas entre las frecuencias genotípicas observadas y las esperadas en ninguno de los dos grupos de estudio. Por lo tanto, la población se encuentra en equilibrio H-W.
De acuerdo a la prueba exacta de diferenciación de Raymond & Rousset (1995), no se encontraron diferencias significativas entre casos y controles (P= 0.68160±0.0071) con respecto a la presencia de la variante G135C del gen RAD51.
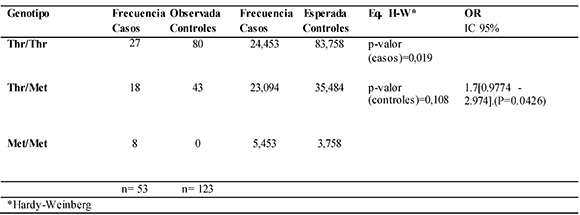
3.1.2. Análisis de la variante XRCC3 T241M
La Tabla 4 muestra los resultados obtenidos para la variante XRCC3 T241M. El genotipo más frecuente en los casos fue Thr/Thr (50.94%), seguido por Thr/Met (33.96%) y por último el genotipo Met/Met (15.09%). En cuanto al grupo control, el genotipo más frecuente fue Thr/Thr (65.04%), seguido de Thr/Met (34.95%) y no se encontraron mujeres con genotipo Met/Met. El análisis del equilibrio Hardy- Weinberg, no arrojó diferencias significativas, entre las frecuencias genotípicas observadas y esperadas para la población de casos, pero sí para la población de controles. Al aplicarse la prueba exacta de diferenciación de Raymond & Rousset, en cuanto a la presencia de la variante T241M del gen XRCC3, se encontró que existen diferencias significativas entre casos y controles (P= 0.00275 ± 0.00093). Observadas estas diferencias en la distribución de las variantes entre casos y controles, se calculó el aumento en el riesgo a desarrollar cáncer de mama y ovario, dando como resultado un OR=1.7 [95% IC=0.9774 - 2.974], con un valor p=0.0426.
Tabla 4. Hardy-Weinberg y OR para la variante T241M del gen XRCC3 en casos y controles
4. Discusión
Actualmente, se conocen alrededor de 20 variantes en 19 genes de baja penetrancia que contribuyen al riesgo de desarrollar cáncer de mama (Zhang et al. 2011). Dentro de estos polimorfismos se han identificado las variantes RAD51 G135C y XRCC3 T241M; sin embargo, en Colombia no existen investigaciones alrededor de este tema. Por tanto, con el fin de determinar la presencia de estos dos polimorfismos y su asociación con el riesgo de desarrollar cáncer de mama familiar entre mujeres colombianas, se realizó un estudio observacional de casos y controles con 53 mujeres con cáncer de mama y con antecedente familiar positivo, y que al momento de la entrevista estaban en tratamiento (casos); y 123 mujeres sanas sin antecedente personal o familiar de esta enfermedad, provenientes de la región Pacífico y Atlántico, las cuales fueron encontradas a partir de la base de datos de varias instituciones donde estaban siendo atendidas, obteniendo un total de 29 casos de la región Pacífico y 24 del Caribe, que se ajustaron con 123 controles equivalentes en edad, sexo y procedencia.
En cuanto a la variante RAD51 G135C, los resultados no mostraron asociación entre casos portadores de la variante y un incremento en el riesgo de cáncer de mama entre casos y controles (P= 0.68160±0.0071). Estos resultados coinciden con los obtenidos por Brooks et al. (2008) en la población de los Estados Unidos, con Lose et al. (2006) en población Australiana, con Dufloth et al (2005) en población Brasilera y con Jara et al. (2010) en población chilena.
Tras evaluar la variante XRCC3 T241M en el presente estudio, los resultados muestran que portar el polimorfismo T241M, incrementa el riesgo de cáncer de mama familiar en 1.7 veces ([95% IC=0.9774 - 2.974; p=0.0426). Al igual que lo hallado por Kuschel et al. (2002), en la población del Reino Unido, con un OR de 1.3 veces; por Han et al. (2004), en un meta-análisis de población europea, afroamericana y asiática, donde reportan incremento en el riesgo 1.14 veces y por Jara et al (2010), quien reporta un OR = 2.44 (P = 0.003, [95%CI 1.34-4.43]) en mujeres chilenas.
Estos hallazgos podrían ser confirmados con futuros estudios en los que se amplíe la muestra evaluada, integrando casos y controles de otras regiones del país. El método de casos y controles es un método efectivo para medir asociación de variables con la patología, por lo que se recomienda adicionalmente estudiar esta asociación para otros genes de predisposición a cáncer de mama.
En conclusión, para las mujeres colombianas, portar el polimorfismo RAD51 G135C no se asocia con incremento en la susceptibilidad de desarrollar cáncer de mama, por lo que no recomendamos este polimorfismo de un solo nucleótido (SNP) como prueba de tamización. En cambio, recomendamos la determinación del polimorfismo XRCC3 T241M a las mujeres con antecedentes familiares de cáncer mamario como una prueba de valoración del riesgo de desarrollar esta patología.
Agradecimientos
A las casos y sus familias, por su participación y colaboración en el desarrollo de este estudio. Al Doctor Luis Eduardo Bravo y a Luz Stella García del Registro Poblacional de cáncer de Cali, al Hospital Universitario del Valle "Evaristo García", a la doctora María Cecilia García Arias de FUNCANCER Cali, a la doctora Sol Milena Guevara de Unicáncer- Palmira, a la doctora Helena Posada Espinosa de la Liga Contra el Cáncer de Cartagena y a la señora Elvia Caravallo de la Fundación "Mujeres por sus senos" de Cartagena, por las facilidades prestadas para la recolección de datos de las historias clínicas y la consecución de los casos.
Financiación
Este proyecto fue financiado por Colciencias código No. 1106-519-29134 y la Universidad del Valle CI 7830.
Referencias
Brooks, J., Shore, R.E., Zeleniuch-Jacquotte, A., Currie, D., Afanasyeva, Y., Koenig, K.L. et al. (2008). Polymorphisms in RAD51, XRCC2, and XRCC3 Are Not Related to Breast Cancer Risk. Cancer Epidemiol Biomarkers Prev., 17 (4), 1016-1019. [DOI:10.1158/1055-9965.EPI-08-0065] [ Links ].
Diez, O., Gutierrez-Enriquez, S., y Ramon, T. (2003). Genes de susceptibilidad al cáncer de mama. Med. Clin. (Barc)., 126 (8), 304-310. [ Links ]
Dufloth, R.M., Costa, S., Schmitt, F., y Zeferino, L.C. (2005). DNA repair gene polymorphisms and susceptibility to familial breast cancer in a group of patients from Campinas, Brazil. Genet Mol. Res., 4(4), 771-782. [ Links ]
Forsti, A., Angelini, S., Festa, F., Sanyal, S., Zhang, Z., Grzybowska, E. et al. (2004). Single nucleotide polymorphisms in breast cancer. Oncol Rep., 11, 917-922. [ Links ]
García, M., Jemal, A., Ward, E.M., Center, M., Hao, Y., Siegel, et al. (2007). Global Cancer Facts & Figures 2007. Atlanta, USA: American Cancer Society (p. 52). [ Links ]
Han, J., Colditz, G., & Samson, L. (2004). Polymorphisms in DNA double-strand break repair genes and skin cancer risk. Cancer Res., 64, 3009-3013. [ Links ]
Instituto Nacional de Cancerología, INC (2010). Estadísticas. Bogotá, Colombia: Ministerio de Protección Social Colombia. Recuperado 10/10/2014 http://www.cancer.gov.co/~incancer/instituto/content/estadisticas [ Links ]
Instituto Nacional de Cancerología. (2010). Magnitud de cáncer en el país-incidencia estimada-departamento. 2014, de Ministerio de Protección Social Colombia Sitio web: http://www.cancer.gov.co/~incancer/instituto/content/estadisticas [ Links ]
Jara, L., Dubois, K., Gaete, D., De Mayo, T., Ratkevicius, N., Bravo, T. et al. (2010). Variants in DNA double-strand break repair genes and risk of familial breast cancer in a South American. Breast Cancer Res Treat., 122 (3), 813-22. [ Links ]
Kuschel, B., Auranen, A., McBride, S., Novik, K., Antoniou, A., Lipscombe, J.M. et al. (2002). Variants in DNA double-strand break repair genes and breast cancer susceptibility. Hum. Mol. Genet., 11 (12), 1399-1407. [ Links ]
Lacey, J.V., Devesa, S.S., & Brinton, L.A. (2002). Recent trends in breast cancer incidence and mortality. Environ Mol Mutagen, 39, 82-88. [ Links ]
Levy-Lahad, E., Lahad, A., Eisenberg, S., Dagan, E., Paperna, T., Kasinetz, L. et al. (2001). A single nucleotide polymorphism in the RAD51 gene modifies cancer risk in BRCA2 but not BRCA1 carriers. Proceedings of the National Academy of Sciences, 98 (6), 3232-3236. [ Links ]
Lose, F., Lovelock, P., Chenevix-Trench, G., Mann, G.J., Pupo, G.M., Spurdle, A. & The Kathleen Cuningham Foundation Consortium For Research Into Familial Breast Cancer. (2006). Variation in the RAD51 gene and familial breast cancer. Breast Cancer Res., 8(3) [DOI:10.1186/bcr1415] [ Links ].
Lynch, E.D., Ostermeyer, E.A., Lee, M.K., Arena, J.F., Ji, H., Dann, J. et al. (1997). Inherited mutations in PTEN that are associated with breast cancer, cowdendisease, and juvenile polyposis. Am J Hum Genet., 61, 1254-1260. [ Links ]
Meijers-Heijboer, H., Van den Ouweland, A., Klijn, J., Wasielewski, M., De Snoo, A., Oldenburg, R., et al. (2002). Low-penetrance susceptibility to breast cancer due to CHEK2*1100delC in noncarriers of BRCA1 or BRCA2 mutations. Nat Genet., 311, 55-59. [ Links ]
Miller, S., Dykes, D., & Polesky, H.F. (1988). A simple salting out procedure for extracting DNA from human nucleated cells. Nucleic Acids Res., 16 (3), 1215. [ Links ]
Peakall, R., & Smouse, P. (2006). GENALEX 6: Genetic analysis in Excel. Population genetic software for teaching and research. Molecular notes, 6(1), 288-295. [ Links ]
Raymond, M.L., & Rousset, F. (1995). An exact test for population differentiation. Evolution, 49, 1280-1283. [ Links ]
Renwick, A., Thompson, D., Seal, S., Kelly, P., Chagtai, T., Ahmed, M. et al. (2006). ATM mutations that cause ataxia-telangiectasia are breast cancer susceptibility alleles. Nat Genet., 38, 873-875. [ Links ]
Seal, S., Thompson, D., Renwick, A., Elliott, A., Kelly, P., Barfoot, R. et al. (2006). Truncating mutations in the Fanconi anemia J gene BRIP1 are low-penetrance breast cancer susceptibility alleles. Nat Genet., 38, 1239-1241. [ Links ]
Silva, S., Tomar, M., Paulo, C., Costa, S., Gomes, B., Azevedo, A. et al. (2010). Breast cancer risk and common single nucleotide polymorphisms in homologous recombination DNA repair pathway genes XRCC2, XRCC3, NBS1 and RAD51. Cancer Epidemiol., 34, 85-92. [ Links ]

Revista de Ciencias por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento 4.0.