Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Ciencias
Print version ISSN 0121-1935
rev. cienc. vol.19 no.1 Cali Jan./June 2015
Embryonic development of the first mandibular molar of the Mus musculus mouse swiss albino strain
Desarrollo embrionario del primer molar mandibular del ratón Mus musculus cepa albino suizo
Jhon Aymer Díaz
Odontólogo, Universidad del Valle, Cali - Colombia
E-mail: jadeuv78@gmail.com
Paola Andrea Sánchez
Odontóloga, Universidad del Valle, Cali - Colombia
E-mail: Paola3515@hotmail.com
Carlos Mejía
Escuela de Odontología, Universidad del Valle, Cali - Colombia
E-mail: camejia@emcali.net.co
Recived: October 31, 2014
Accepted: May 4, 2015
Abstract
Aim: Describing the embryonic development of the first mandibular molar in the mouse Mus musculus of the Swiss albino strain.
Materials and methods: Observational descriptive study of the embryonic development of the mandibular first molar of 22 embryos of mouse Mus musculus Swiss albino strain obtained from the Vivarium of School of Health at Universidad del Valle, aged between eighth and tenth week. The samples were fixed in Bouin solution for 24 hours, embedded in paraffin for obtain sagittal and coronal cuts to 4 microns, and finally stained with hematoxylin-eosin to be analyzed through an optical light microscope.
Results: The process of dental morphogenesis was described from different embryonic stages (E) and it's corresponding with Theiler stages (TS), and observed that the development of the first lower molar begins from the first thickening of the dental lamina in E12; developing tooth bud stage was observed in E12.5; cap stage was observed in dental at E13.5 and E14; and finally dental bell stage was identified in E14.5
Conclusion: According to reports from the previous literature on embryonic developmentof the first lower molar mouse Mus musculus Swiss albino strain at the Vivarium of the School of Health at Universidad del Valle, tooth morphogenesis occurs earlier in parallel to stages of embrionic development.
Keywords: Mouse Mus musculus, developmental biology, Theiler stages, dental morphogenesis, first mandibular molar.
Resumen
Objetivo: Describir el desarrollo embrionario del primer molar mandibular del ratón Mus musculus de la cepa albino suizo.
Materiales y métodos: Estudio observacional de tipo descriptivo sobre el desarrollo embrionariodel primer molar mandibular de 22 embriones de ratón Mus musculus cepa albino suizo obtenidos delBioterio de la Facultad de Salud de la Universidad del Valle, con edades comprendidas entre E10.5 y E18. Los especímenes fueron fijados en solución de Bouin durante 24 horas, incluidas en parafina para obtener cortes sagitales y coronales a 4 micras, y finalmente teñidas con hematoxilina-eosina para ser analizadas a través de un microscopio óptico de luz.
Resultados: Se realizó la descripción del proceso de morfogénesis dental a partir de los diferentesestadios embrionarios (E) y su respectiva correspondencia con los estadios de Theiler (TS), observandoque el desarrollo del primer molar inferior se inicia en E12 a partir de los primeros engrosamientos de la lámina dental. En E12.5 se observa el desarrollo de estadio en yema dental. En E13.5 y E14 se observa el estadio en casquete dental. Finalmente, en E14.5 se identifica el estadio en campana dental.
Conclusiones: Según reportes tomados de la literatura previa sobre el desarrollo embrionario del primer molar mandibular del ratón Mus musculus cepa albino suizo del Bioterio de la Facultad de Salud de la Universidad del Valle, la morfogénesis dental es más temprana en paralelo a los estadios del desarrollo embrionario.
Palabras clave: Ratón Mus musculus, biología del desarrollo, estadios Theiler, morfogénesis dental, primer molar mandibular.
1 Introducción
Los dientes se desarrollan como apéndices ectodérmicos en los embriones de losvertebrados de manera muy similar al desarrollo morfo-genético de otras estructurasectodérmicas como pelos y glándulas, es decir, a partir de interacciones entre el ectodermo y el mesénquima como mecanismo central de regulación (Thesleff & Ã berg, 1999; Thesleff, 2003).
Al revisar la literatura especializada, la mayoría de los estudios sobre morfogénesis dental se han llevado cabo en ratones Mus musculus, ya que son el biomodelo de elecciónen embriología comparada para investigar el desarrollo de los dientes de los mamíferos, debido a su alimentación, su actividad reproductiva (de 2 a 14 meses), a la posibilidad de manipulación genética y por presentar un período corto de gestación de 18 a 21 días (Kolenc-Fusé, 2004).
En los ratones, el desarrollo de la dentición se ha descrito a partir de una secuencia de eventos que empiezan con la determinación regional de la dentición en su conjunto y con la determinación de las subregiones de las clases de dientes (incisivos y molares) (Jernvall & Thesleff, 2000). Estas clases de dientes se encuentran separadas por una zona edéntula o diastema, la cual presenta tres gérmenes dentarios que llegan hasta el estadio de yema y que posteriormente sufren apoptosis (Viriot et al., 2002; Gaete et al., 2004; Prochazka et al., 2010; Keränen et al., 1999). Sin embargo, son los molares como clase, los dientes que por su tamaño y formación radicular son tenidos en cuenta en los estudios sobre morfogénesis dental debido fundamentalmente a que, en los roedores, los incisivos crecen continuamentea lo largo de toda su vida (Tummers & Thesleff, 2003).
El desarrollo dental, la morfogénesis dental o la odontogénesis, ha sido considerado como uno de los modelos evolutivos y embrionarios más interesantes, susceptible de ser estudiado por las interacciones entre dos tejidos embrionarios como son el ectodermo y el mesénquima (3,11-13), los cuales constituyen una serie de estructuras embrionarias que, independiente de su morfología o identidad morfo-funcional, pasan a través de las mismas etapas de desarrollo (organogénesis) y se componen de los mismos tejidos (histogénesis) (Keränen et al., 1999).
1.1 Odontogénesis
Corresponde a un proceso embrionario complejo y coordinado que describe el desarrollo de los dientes. En este proceso morfo-genético participan dos tejidos embrionarios: el epitelio ectodérmico, que origina el esmalte y el ectomesénquima, que forma el complejo dentino-pulpar y el aparato de sustentación a partir del cemento, el ligamento periodontal y el hueso alveolar (Cobourme & Orth, 1999; Gómez de Ferraris y Campos Muñoz, 2002; Mitsiadis et al., 2003; Sharpe, 2003). Para la formación de los dientes u organogénesis, se han descrito tres etapas: la iniciación, en la cual un conjunto de células reciben e interpretan información posicional para iniciar la formación de un órgano en el lugar y momento correctos; la morfogénesis, durante la cual las células forman el esbozo embrionario de un órgano; y la diferenciación, en la que las células forman las estructuras específicas de ese órgano (Peters & Balling, 1999; Goldberg & Farge, 1989; Ten, 1998). El papel inductor de este proceso ocurre en la iniciación y está a cargo del ectomesénquima, denominado asípor derivar del mesénquima cefálico del embrión y de las células de la cresta neural (Peterson & Carlson, 2003). A continuación y durante la morfogénesis, se presenta la diferenciación de la lámina dental o listón dentario a partir del ectodermo que tapiza la cavidad bucal primitiva o estomodeo. Posteriormente, los gérmenes dentarios se diferencian en la lámina dental y pasan por una serie de etapas que de acuerdo a su forma se han descrito como estadio de brote macizo (o yema); estadio de casquete (o caperuza); estadio de campana y estadio de folículo dentario (terminal o maduro) (Provenza, 1974) . La dinámica de la transición del estadio de yema al estadio de casquete se ha descrito en detalle a través de la formación de los molares de los ratones (Kolenc-Fusé, 2004).
De esta forma, la lámina dental que se constituye en la proliferación y engrosamiento del ectodermo del estomodeo, adopta una forma de banda en herradura que se desplaza en el interior del mesénquima subyacente para dar lugar a una serie de yemas dentarias que se corresponden cada una con la formación de un diente (Barbería, 2001). La parte interna de las yemas se curva sobre el mesénquima adquiriendo la forma de caperuza o casquete. En este estado se puede diferenciar el órgano del esmalte procedente del ectodermo, la papila dental y el folículo dental, estos últimos de origen mesodérmico. En el órgano del esmalte se pueden observar cuatro capas: el epitelio dental externo, el retículo estrellado, el estrato intermedio y el epitelio dental interno. Luego, en el estadio de campana las células del epitelio dental interno evolucionan a pre-ameloblastos y posteriormente a ameloblastos, los cuales se encargan de secretar el esmalte dentario. El estímulo de los pre-ameloblastos sobre las células de la papila dental más próximas al epitelio dental interno dan lugar a la diferenciación de las mismas en pre-odontoblastos, los cuales una vez se diferencien a odontoblastos se encargaran de secretar la dentina. Cuando finaliza la formación del esmalte, el asa cervical constituido por la unión del epitelio externo y el epitelio interno prolifera y penetra en el mesénquima formando la vaina epitelial de Hertwing, la cual regulael depósito de dentina radicular que engloba las células de la papila dental que a su vez constituirán la pulpa dental. Asimismo, las células mesenquimatosas que contactan con la vaina de Hertwing se diferenciarán en cementoblastos y las fibras de colágeno darán lugar a las fibras del ligamento periodontal (Barbería, 2001).
En los ratones, desde el día E12.5 hasta E16.5 (TS21 a TS25) se desarrollan las etapas de yema, casquete y campana. Desde el día 16.5 hasta 17.5 (TS25 a TS26) la capa externa de células de la papila dental se diferencia para formar odontoblastos. De esta manera, una vez formado el órgano del esmalte, se da inicio a la formación de pre-dentina, dentina y esmalte dental (una vez). En el día E13.5 (TS22), los primordios del incisivo y del primer molar están bien delimitados, pero solo hasta el día 15.5 (TS24), los centros de osificación del maxilar y la mandíbula que rodean la base de los primordios de los incisivos y molares son visibles (Kaufman & Bard, 1999).
Si bien, se ha identificado que en los ratones Mus musculus el desarrollo del primeromolar mandibular inicia en el día 11, 0 post-coito, la etapa yema se alcanza el día 13,5 y la etapa casquete el día 14,0 (Cohn, 1957). Este estudio tiene como propósito describir el desarrollo embrionario del primer molar inferior del ratón Mus musculus de la cepa albino suizo que seproduce en el Bioterio de la Facultad de Salud de la Universidad del Valle (Cali, Colombia).
2. Materiales y métodos
Este es un estudio observacional de tipo descriptivo que determinó el desarrolloembrionario del primer molar inferior en preparaciones histológicas a 4X y 10X teñidas con hematoxilina-eosina, obtenidas de 24 embriones de ratón Mus musculus cepa AlbinoSuizo. Cabe anotar que el estudio fue avalado por el Comité de Ética en Animales de la Facultad de Salud de la Universidad del Valle (Acta No.CI 1651)
2.1 Manejo de la muestra
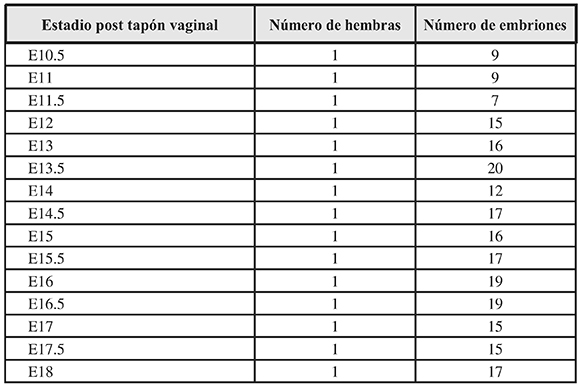
Se emplearon 40 hembras y 5 machos de ratón Mus musculus cepa Albino Suizo del Bioterio de la Facultad de Salud de la Universidad del Valle (Cali, Colombia) para ser apareados. En todo momento las condiciones ambientales fueron controladas (humedad relativa, temperatura ambiente, iluminación, alimentación e hidratación ad libitum). Laaparición del tapón vaginal fue considerado como día E0 y a partir de allíse contaron losdías para cada estadio E. La gestación fue interrumpida con la eutanasia de la hembra desdeel día E10.5, y desde allícada 12 horas hasta el día E18 (Tabla 1).
Tabla 1. Distribución de la muestra.
Para el procedimiento de eutanasia se utilizó lidocaína al 2% vía de administración intraperitoneal (Greenwald & Brown, 2004; Bancroft & Gamble, 2008). La dosis de anestesia del animal varió dependiendo del peso para evitar paro cardiaco y necrosis de tejidos, entre 0.4 mg de anestésico para hembras en estados E iníciales (E10-E13), de 0.6 mg a estadios entre (E13.5-E15.5) y de 0.75mg a estadios finales (E16–E18).
Inmediatamente, se procedió a perfundir a las hembras, inicialmente con 40 ml de solución salina al 37% y posteriormente con 30 ml de formol bufferado. Luego se procedió con la disección de los embriones, los cuales fueron fijados individualmente con solución de Bouin por 24 horas. Posteriormente los embriones fueron pasados por alcohol al 70% con recambio cada 24 horas durante 5 días, hasta eliminar por completo el ácido pícrico de las muestras (Greenwald & Brown, 2004; Bancroft & Gamble, 2008). Finalmente, los embriones se pasaron por solución descalcificadora de Tamayo de 24 a 48 horas y por buffer fosfato durante otras 24 horas para dar inicio a la técnica histológica.
2.2 Técnica histológica
Los embriones fueron procesados y deshidratados en una serie de alcoholes (70%, 80%, 95%, 95%, 100%, 100%, 100%, 100%) aclarados en xilol y fijados en parafina. Posteriormente fueron cortados en sentido sagital y coronal a 4 micras en micrótomo de tejidos blandos, montados en portaobjetos de vidrio de banda mate de 27x76 y finalmente teñidos con hematoxilina-eosina (Greenwald & Brown, 2004; Bancroft & Gamble, 2008) . Las muestras fueron observadas, analizadas y fotografiadas a través de un microscopio óptico de luz Olimpus 2240® a 4X y 10X con una cámara Nikon Coolpix P60000® adaptada a uno de los oculares.
3. Resultados
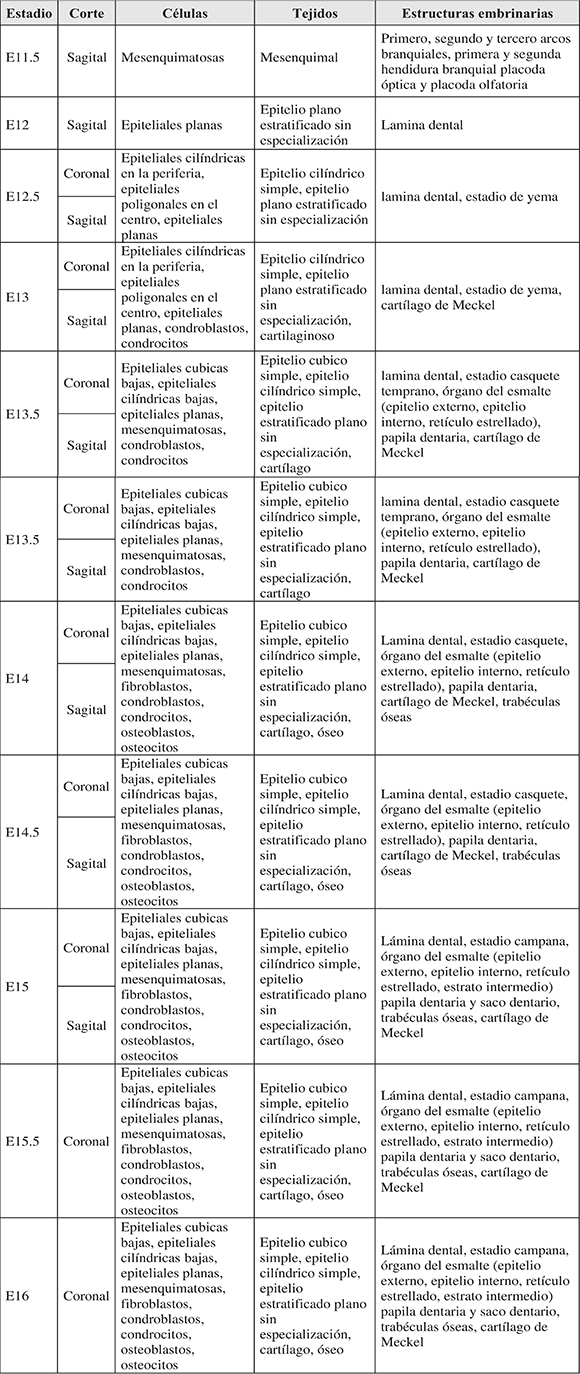
Considerando que en este estudio el inicio gestacional E0 fue considerado como el momento en el que se identificó el tapón vaginal en las hembras, el proceso embrionario de odontogénesis del primer molar mandibular se pudo identificar desde el estadio E12 a partir de los primeros engrosamientos de la lámina dental. En E12.5 se observó la aparición del estadio yema. Entre E13.5 y E14, se observó el estadio de casquete y en E14.5 se observó el estadio de campana. Los resultados del análisis morfológico fueron tabulados por estadios embrionarios, corte, células, tejidos y estructuras embrionarias (Tabla 2; Figuras 1 y 2).
Tabla 2. Análisis morfológico por estadios embrionarios (E).
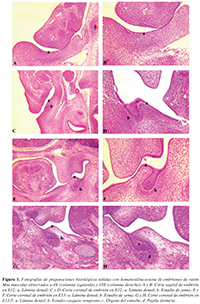
Figura 1. Fotografías de preparaciones histológicas teñidas con hematoxilina-eosina de embriones de ratón Mus musculus observados a 4X (columna izquierda) y 10X (columna derecha). A y B. Corte sagital de embrión en E12: a. Lámina dental; C y D. Corte coronal de embrión en E12: a. Lámina dental, b. Estadio de yema; E y F. Corte coronal de embrión en E13: a. Lámina dental, b. Estadio de yema; G y H. Corte coronal de embrión en E13.5: a. Lámina dental, b. Estadio casquete temprano, c. Órgano del esmalte, d. Papila dentaria.
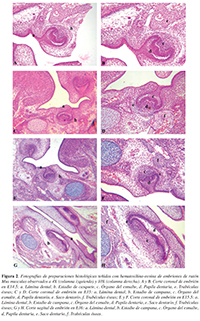
Figura 2. Fotografías de preparaciones histológicas teñidas con hematoxilina-eosina de embriones de ratón Mus musculus observados a 4X (columna izquierda) y 10X (columna derecha). A y B. Corte coronal de embrión en E14.5: a. Lámina dental, b. Estadio de casquete, c. Órgano del esmalte, d. Papila dentaria, e. Trabéculas óseas; C y D. Corte coronal de embrión en E15: a. Lámina dental, b. Estadio de campana, c. Órgano del esmalte, d, Papila dentaria, e. Saco dentario, f. Trabéculas óseas; E y F. Corte coronal de embrión en E15.5: a. Lámina dental, b. Estadio de campana, c. Órgano del esmalte, d. Papila dentaria, e. Saco dentario, f. Trabéculas óseas; G y H. Corte sagital de embrión en E16: a. Lámina dental, b. Estadio de campana, c. Órgano del esmalte, d, Papila dentaria, e. Saco dentario, f. Trabéculas óseas.
Asimismo, se comparó la descripción histológica de la odontogénesis del primer molar mandibular con los estadios de Theiler (TS), los cuales manifiestan el momento de aparición de cada tejido, lo que permite establecer parámetros de embriología comparada entre diferentes especies, razón por la cual en este estudio se realizó la clasificación de estructuras embrionarias de la odontogénesis de acuerdo al estadio E correlacionado con el estadio TS previamente establecido (Tabla 3).
Tabla 3. Homologación de los estadios de Theiler (TS) con los estadios embrionarios (E)
De esta forma, la aparición del primer y segundo arco branquial en TS20 fue equivalente al estadio E11.5; la aparición de la lámina dental, del estadio de yema y del cartílago de Meckel en TS21 fue equivalente al estadio E13; la aparición del estadio de casquete (identificado por el desarrollo de la papila dental) en TS22 fue equivalente al estadio E13.5; y la aparición del estadio de campana (identificado por la aparición del estrato intermedio) fue equivalente al estadio E15.
4. Discusión
De acuerdo a los diferentes reportes, el primer molar mandibular se desarrolla en cuatro o cinco días entre los estadios E11 y E15 del desarrollo prenatal en el ratón, a partir de cuatro etapas morfo-genéticas: aparición de la lámina dentaria, estadio de yema, estadio de casquete y estadio de campana. Estas etapas se desarrollan a través de cinco fenómenos: el crecimiento del germen del diente, el desarrollo del asa cervical, la histogénesis del órgano del esmalte, el plegamiento de la unión epitelio-mesenquimal asociada con la formación de las cúspides, y el cambio de la heterogeneidad celular en el mesénquima (Lesot, 2014). Sin embargo, al contrastar dichos reportes con los resultados de este estudio, es posible determinar que los estadios de desarrollo (E) y los estadios de Theyler (TS) difieren en el tiempo en que ocurren.
Gaete et al (7) describieron el desarrollo del primer molar mandibular en ratones Mus musculus de la cepa ICR/JCL, encontrando que la proliferación de la lámina dental comenzó en el día E12.5, el estadio yema entre los días E13.5 y E14.5, el estadio casquete entre los días E14.5 y E16.5 y el estadio campana temprana en eldía E17.5. Estos resultados demuestran que la odontogénesis en este estudio es más temprana,y siendo que la gestación en el ratón Mus musculus ICR/JCL es de 19 días mientras que la del ratón Mus musculus albino suizo es de 20 días, se puede sugerir que la iniciación de odontogénesis en cada especie puede ser directamente relacionada con el período de la gestación, el tamaño y el peso del animal (Peterka, 2002).
Cohn (1957) describió de forma detallada la odontogénesis del ratón Mus musculus albino suizo en embriones cuyos estadios de desarrollo E fueron separados entre si cada 24 horas (este estudio los separa cada 12 horas). Si bien la aparición de la lámina dentaria fue descritaen el mismo día E13, de allíen adelante la aparición y desarrollo de las otras estructuras embrionarias varían considerablemente. Por ejemplo, en el estudio de Cohen la aparición del estadio de yema ocurre en E14, del estadio de casquete en E15 y del estadio de campanaen E18, mientras en este estudio fueron en E12.5, en E13.5 y en E15 respectivamente.
Lesot et al. (1995) observaron que el primer molar mandibular se forma entre los días E14 y E18 de la embriogénesis del ratón, identificando que los cambios morfogenéticos desde el estadio de casquete en el día E14, pasando por la transición de estadio casquete a estadio campana entre los días E14 y E16, seguido por el desarrollo del estadio de campana temprana entre los días E6 y E17, hasta el desarrollo del estadio de campana tardía en el día E18, ocurre básicamente en cuatro días, al igual que en este estudio, pero con la diferencia de que los eventos inician mas temprano en el desarrollo prenatal.
Al igual que este estudio, diferentes autores han encontrado que el desarrollo delprimer molar mandibular en ratones de la cepa albino suizo generalmente inicia entre los días E11 y E12 con la aparición de la lámina dentaria. De allíen adelante pueden ocurrir variaciones en la expresión de las señales moleculares que controlan los tres estadios de la morfogénesis. Esto ocasiona que en algunos estudios el estadio de campana se pueda identificar entre E15 y E18 (Neubuser et al., 1995; Dassule & MacMahon, 1998; Dassule & MacMahon, 1998)
Estas diferencias pueden ser asociadas a diferentes aspectos epigenéticos que incluyen el medio ambiente de los bioterios (alimentación, temperatura, humedad, altura sobre el nivel del mar) que pueden generar adaptaciones morfogenéticas durante la gestación; o al estrés generado a las hembras antes y durante la gestación (manipulación de los biomodelos,cantidad e intensidad de luz, exposición a ruidos y olores, entre otros), los cuales son factores asociados a parto pre-término, disminución de la circunferencia de cabeza,retrasos del desarrollo, perturbaciones en el comportamiento, retraso de la respuesta al enderezamiento, retraso en la respuesta al sobresalto y retraso a la apertura del oído (34-39).En este mismo sentido, Meek et al realizaron un estudio en el que compararon el desarrollo morfo-fisiológico y comportamental de embriones cuyas progenitoras fueron sometidas a condiciones de estrés, encontrando que la erupción dental resultó tardía en embriones que sufrieron estrés pre-natal (Meek et al., 2000).
5. Conclusiones
De acuerdo a los estadios de desarrollo la aparición de la lámina dental ocurrió en E13.5 (TS 21); del estadio de yema, en E12.5 ((TS21); del estadio de casquete, en E13.5 (TS22) y del estadio de campana, en E15 (TS23).
En el desarrollo embrionario del primer molar mandibular del ratón Mus musculus cepa albino suizo del Bioterio de la Facultad de Salud de la Universidad del Valle, la morfogénesis dental es más temprana en paralelo a los estadios del desarrollo embrionario reportados por otros estudios. Esto puede ser asociado a ciertos componentes epigenéticos de origen multifactorial, como lo es el medio ambiente del bioterio y los diferentes estresores a los que pueden estar sometidas las hembras durante la gestación.
Este estudio contribuye con la estandarización de la embriogénesis del ratón Mus musculus cepa albina suiza del Bioterio de la Facultad de Salud de la Universidad del Valle (Cali, Colombia), respecto a los estadios de desarrollo (E) y a los estadios de Theyler (TS), lo cual será de vital importancia, no solo para los estudios de morfogénesis dental, sino también para cualquier estudio de embriología comparada.
Agradecimientos
Los autores agradecen al profesor Oscar Tamayo y al grupo de Investigación de tejidos Blandos y Mineralizados de la Universidad del Valle (Cali, Colombia) por su apoyo en el procesamiento histológico de los embriones. Este estudio fue financiado por la Convocatoria Interna de la Vicerrectoría de Investigaciones de la Universidad del Valle -2009
Conflicto de intereses
Los autores del artículo hacen constar que no existe, de manera directa o indirecta, ningún tipo de conflicto de intereses que pueda poner en peligro la validez de lo comunicado.
Referencias
Bancroft, J. D., & Gamble, M. (2008). Theory and practice of histological techniques (ed. 6). New York, USA: Churchill Livingston Elsevier. [ Links ]
Barbería, E. (2001). Erupción dentaria: prevención y tratamiento de sus alteraciones. Pediatr Integral, 6(3), 229-40. [ Links ]
Barlow, S. M., Knight, A. F., & Sullivan, F. M. (1978). Delay in postnatal growth and development of offspring produced by maternal restraint stress during pregnancy in the rat. Teratology, 18, 211-8. [ Links ]
Butter, P. M. (1995). Odontogenic aspect of dental evolution. Int. Journal of Developmental Biology, 39, 25-34. [ Links ]
Cobourme, M., & Orth, M. (1999). The genetic control of early odontogénesis. British Journal of Orthodontics, 26, 21-28. [ Links ]
Cohn, S.A. (1957). Development of the molar teeth in the albino mouse. Am J Anat, 101, 295-320. [ Links ]
Dassule, H. R., & MacMahon, A. P. (1998). Analysis of epithelial-mesenchymalinteractions in the initial morphogenesis of the mammalian tooth. Dev Biol, 202, 215-27. [ Links ]
Fride, E., & Weinstock, M. (1984). The effects of prenatal exposure to predictable or unpredictable stress on early development in the rat. Dev Psycho boil, 17, 651-60. [ Links ]
Gaete, M., Lobos, N., & Torres-Quintana, M. A. (2004) Mouse tooth development timesequence determination for the ICR/Jcl strain. J Oral Sci, 46(3), 135-44. [ Links ]
Goldberg, M., & Farge, P. (1989). Manuel d'histologie et de biologiebuccale; ladentersestissus de soutien. Paris, France: Masson (p. 140). [ Links ]
Gómez de Ferraris, M. E., y Campos Muñoz, A. (2002) Histología y Embriologíabucodental (ed. 2). Madrid, España: Editorial Médica Panamericana. (pp. 85-109). [ Links ]
Greenwald, S. E., & Brown, A. G. (2004). Histology and staining. In, G. Zouridakis & J. Moore (Eds.) BiomedicalTechnology and Devices Handbook. London, UK: CRC Press. [ Links ]
Jernvall, J., & Thesleff, I. (2000). Reiterative signalling and patterning during mammalian tooth morphogenesis. Mech Dev, 92, 19-29. [ Links ]
Kaufman, M. H., & Bard, J. B. L. (1999). The anatomical basis of mouse development (ed. 1). San Diego, USA: Academic Press. (pp. 156-70). [ Links ]
Keränen, S. V., Kettunen, P., Åberg, T., Thesleff, I., & Jernvall, J. (1999) Gene expression patterns associated with suppression of odontogenesis in mouse and vole diastema regions. Dev Genes Evol, 209, 495-506. [ Links ]
Kolenc-Fusé, F. J. (2004). Agenesias dentarias: en busca de las alteraciones genéticas responsables de la falta de desarrollo. Medicina Oral, Patología Oral y Cirugía Bucal, 9(5), 385-395. [ Links ]
Lesot, H., Hovorakova, M. Peterka, M. & Peterkova, R. (2014). Three-dimensional analysis of molar development in the mouse from the cap to bell stage. Aust Dent J, 59 (1 Suppl), 81-100. [ Links ]
Lesot, H., Peterkova, R., Schmitt, R., Meyer, J. M., Viriot, L., Vonesch, J. L. et al. (1999). Initial features of the inner dental epitheliumhistomorphogenesis in the first lower molar in mouse. Int J Dev Biol, 43, 245-54. [ Links ]
Lou, H. C., Hansen, D., Nordentoft, M., Pryds, O. M., Jensen, F., Nim, J., et al. (1994). Prenatal stressors of human life affect fetal brain development. Dev Med Child Neurol, 36(9), 826-32. [ Links ]
Meek, L. R., Burda, K. M., & Paster, E. (2000). Effects of prenatal stress on developmentin mice: maturation and learning. Physiology & Behavior, 71(5), 543-9. [ Links ]
Mitsiadis, T. A., Chéraud, Y., Sharpe, P., & Fontaine-Pérus, J. (2003). Development of teeth in chick embryos after mouse neural crest transplantations. Proceedings of the National Academy of Sciences, 100(11), 6541-6545. [ Links ]
Neubuser, A., Koseki, H., & Balling, R. (1995). Characterization and developmental expression of Pax 9, a paired-box-containing gene related to Pax 1. Dev Biol, 170, 701-16. [ Links ]
Newton, R. W., & Hunt, L. P. (1984). Psychosocial stress in pregnancy and its relation to low birth weight. British Medical Journal, 288, 1191-4. [ Links ]
Peterka, M., Lesot, H., & Peterkova, R. (2002). Body weight in mouse embryos specifiesstaging of tooth development. Connect Tissue Res, 43, 186-190. [ Links ]
Peterkova, R., Peterka, M., Viriot, L., Lesot, H. (2000). Dentition development and budding morphogenesis. Journal of Craniofacial Genetic Developmental Biology, 20, 158-172. [ Links ]
Peters, H., & Balling, R. (1999). Teeth: Where and how to make them. Trends Genet, 15 (2), 59-65. [ Links ]
Peterson, L.J., & Carlson, E. (2003) Contemporary oral and maxillofacial surgery, (ed. 4). Michigan, USA: Mosby. (pp. 575-96). [ Links ]
Prochazka, J., Pantalacci, S., Churava, S., Rothova, M., Lambert, A., Lesot, H. et al. (2010). Patterning by heritage in mouse molar row development. Proceedings of the National Academy of Sciences, 107(35), 15497-15502. [ Links ]
Provenza, V. (1974) Histología y embriología odontológicas, (ed. 1). Ciudad de México, México: Interamericana. (p.72-5). [ Links ]
Ruch, J.V., Lesot, H., Peterkova, R., & Peterka, M. (1997) Evolving rodent dentition. Bioessays, 19(11), 1041. [ Links ]
Rugh, R. (1991). The mouse: Its reproduction and development (ed. 2). New York, USA: Oxford University Press. [ Links ]
Sharpe, P. T. (2001). Neural crest and a tooth morphogenesis. Adv Dent Res, 15, 4-7. [ Links ]
Shiota, K., & Kayamura, T. (1989). Effects of prenatal heat stress on postnatal growth, behavior and learning capacity in mice. Biol Neonate, 56, 6-14. [ Links ]
Smith, M. M., & Johanson, Z. (2003) Separate evolutionary origins of teeth from evidence in fossil jawed vertebrates. Science, 299(5610), 1235-6. [ Links ]
Stott, D. H. (1973). Follow-up study from birth of the effects of prenatal stresses. Dev Med Child Neurol, 15, 770- 87. [ Links ]
Ten, R. (1998). Oral histology: development structure and function (ed. 5). St Louis, USA: Mosby (p. 497). [ Links ]
Thesleff, I. (2003). Epithelial-mesenchymal signalling regulating tooth morphogenesis. J. of Cell Sci, 116, 1647-1648. [ Links ]
Thesleff, I., & Åberg, T. (1999). Molecular Regulation of Tooth Development. Bone, 25 (1), 123-5. [ Links ]
Tummers, M., & Thesleff, I. (2003). Root or crown: a developmental choice orchestratedby the differential regulation of the epithelial stem cell niche in the tooth of two rodent species. Development, 130, 1049-57. [ Links ]
Viriot, L., Peterkova, R., Peterka, M., & Lesot, H. (2002) Evolutionary implications of the occurrence of two vestigial tooth germs during early odontogenesis in the mouse lower jaw. Connective Tissue Res, 43(2), 129-133. [ Links ]

Revista de Ciencias por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento 4.0.