Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Ciencias
Print version ISSN 0121-1935
rev. cienc. vol.19 no.1 Cali Jan./June 2015
Algae Communities as Bioindicators of Environmental Quality on a Rocky Shore of Mediterranean (S. E. Iberian Peninsula)
Comunidades de algas como bioindicadores de calidad ambiental en la costa rocosa del Mediterráneo (S. E. Península Ibérica)
David L. Herrera-Paz
Departamento de Biología, Universidad de Valle, Cali - Colombia
E-mail: david.herrera@correounivalle.edu.co
Daril de la Nuez
Departamento de Ciencias del Mar y Biología Aplicada, Universitat d'Alacant, Alicante - España
E-mail: darildelanuez@gmail.com
Juan M. Valero-Rodríguez
Sustainable Aquaculture Laboratory - Temperate and Tropical (SALTT) Department of Zoology; School of Bioscience, University of Melbourne, Melbourne - Australia
E-mail: juanma.valero87@gmail.com
Recived: October 31, 2014
Accepted: June 10, 2015
Abstract
Ecological tools are commonly used to monitor ecosystems and improve their evaluation and management. Bioindicadors are a good option to use for this purpose. Macroalgae stand out as good bioindicators of environmental quality. In the present study, algal communities were comparedbetween protected and unprotected marine areas. We compared algal cover in relation with the areas under study, and calculated similarity values to determine the most relevant species and to those, we applied multi-dimensional scaling tests. In total, we identified 13 algal species. The cover of Cystoseiramediterranea and Ellisolandia elongata was higher in the protected area, while Ulva intestinalis and Caulerpa racemosa were predominant in the unprotected area. The latter two species are considered bioindicators of impacted areas.
Keywords: Marine Protected Areas (MPAs), MDS, bioindicators, algae coverage, anthropogenic effects, Mediterranean Sea.
Resumen
En el seguimiento de los ecosistemas es frecuente el uso de herramientas ecológicas del medio para su evaluación y gestión, motivo por el cual los bioindicadores constituyen un elemento fiable paratal fin. Las algas se destacan por ser buenos bioindicadores de la calidad ambiental, por ello en este estudio se compararon las comunidades de algas de un área marina protegida y una no protegida. Se realizaron análisis comparando la cobertura algal en relación con las áreas estudiadas y se obtuvieron valores de similitud donde se destacaron las especies más relevantes para posteriormente aplicarles pruebas de escalamiento multidimensional. Se identificaron 13 especies de algas, donde se observó que la cobertura de Cystoseira mediterranea y Ellisolandia elongata fue mayor en el área protegida,mientras que Ulva intestinalis y Caulerpa racemosa predominaron en la zona no protegida. Estas últimas se consideran como especies indicadoras de áreas impactadas.
Palabras clave: Área Marina Protegida (AMP), MDS, bioindicadores, cobertura de algas, efecto antrópico, Mar Mediterráneo.
Introducción
En un mundo cada vez más antropizado, los recursos extraídos de las zonas marinas son muy utilizados como nuevas fuentes de energía y materias primas (Viêgas et al., 2015).Muchas veces, los procedimientos usados en las actividades humanas propician efectos secundarios que derivan en una pérdida alarmante de biodiversidad (Sternberg et al.,2014). Las causas de estas pérdidas de biodiversidad han suscitado desde siempre mucha investigación y debate (Feng et al., 2004; Hooper et al., 2005; Wang & Wang, 2007; Zhang et al., 2009; Gao & Chen, 2012; Herrera-Paz et al., 2013). Lo que ha promovido la creación de algunas áreas marinas protegidas, sin embargo, la decisión de proteger o no algunas está ligada muchas veces por motivos económicos en vez de por los beneficios intrínsecos que supone un ecosistema saludable (Diaz et al., 2015). Un ejemplo claro de estos beneficios es que una mayor riqueza de organismos incrementa notablemente las capacidades básicas delecosistema como lo son la productividad, la resistencia a especies invasoras o la resiliencia a otro tipo de impactos (Loreau et al., 2001; Cardinale et al., 2012; Londoño-Cruz et al.,2014; Hodapp et al., 2015).
Es conocido que determinadas acciones, que ocasionan alteraciones en las funciones ecológicas pueden estar influenciadas por cambios en las asociaciones específicas de la zona (Hughes, 2005). Por ello es urgente examinar las implicaciones de la pérdida de la biodiversidad marina desde el punto de vista de la conservación de especies, sobre todo hablando de productores primarios (algas) por ser especialmente sensibles en determinadoscasos y en términos de la sostenibilidad de los ecosistemas (Cardinale et al., 2011, 2012).
A este respecto, las Áreas Marinas Protegidas son una herramienta primaria indiscutiblepara la conservación de la diversidad in situ en el mundo (Ravenel & Redford, 2005) con más de 100.000 ejemplos en su haber, aproximadamente un 11.7 % de la superficie del planeta y alrededor del 1% del medio marino (Bishop et al., 2004).
No obstante, algunas de estas áreas marinas, particularmente en el Mediterráneo, se encuentran próximas a asentamientos humanos, y teniendo en cuenta los niveles de contaminación normalmente asociados a las mismas, se hace necesario establecer criterios de calidad que permitan valorar el estado de los recursos naturales. En este sentido, con el ánimo de proporcionar un baremo adecuado, a lo largo de las últimas décadas se han establecido pautas de análisis de la calidad ecosistémica tomando una serie de parámetros establecidos en función de ciertos indicadores biológicos (Kangwe, 1999; Chaudhuri et al., 2007; Chakraborty et al., 2014). Dichos indicadores ecológicos pueden facilitar una gestión adaptativa, pero sólo si se determinan niveles aceptables para estos, definiendo los parámetros suficientemente para que los datos recogidos puedan ser interpretados (Smyth et al., 2007).
En un sentido general se puede decir que las especies bioindicadoras son aquellas en las que dependiendo de factores como su abundancia, estructura poblacional y distribución,pueden ser usadas para evaluar la condición de un ecosistema (Vandermeulen, 1998). Si estas especies bioindicadoras son seleccionadas cuidadosamente, entonces el procedimientoy las normas para establecer dichos niveles pueden tener considerable mérito, máxime si el contexto del ecosistema expone una situación de gran importancia para la biocenosis en general.
Entre los más efectivos bioindicadores de contaminación ampliamente utilizadosse encuentran los moluscos (e.g. ostiones, mejillones y almejas), los balanos y las algas (Rainbow & Phillips, 1993; Orescanin et al., 2006; Chakraborty et al., 2014; Kristan et al.,2014). Estas últimas son de gran importancia y se pueden dividir en tres grupos atendiendo a sus características ecológicas: i) Competidores, los cuales ocupan hábitats de bajo estrés ypocas perturbaciones; ii) Tolerantes de estrés, capacitados para soportar varias condiciones desfavorables, y iii) Oportunistas, que ocupan áreas altamente modificadas. Las primeras se intercambian poco a poco con las siguientes conviviendo o no con distintas especies animales según cambien periodos de tiempo o aumenten los gradientes de parámetrosdesfavorables como el oleaje o la disminución de luz (Grime, 1977; Benincà et al., 2015).
El estudio de este tipo de comunidades bentónicas muestra un gran potencial a la hora de revelar efectos acumulativos de perturbaciones marinas en la biota dado que,en los organismos bentónicos, se pueden integrar los efectos de una exposición a largo plazo de factores antropogénicos y naturales (Borowitzka, 1972). La mayoría de lasinvestigaciones sobre bioacumulación en algas se han realizado primordialmente conmicroalgas (fitoplancton) y los contaminantes más estudiados han sido los metales pesados e hidrocarburos organoclorados (plaguicidas). Sin embargo, son menos frecuentes lostrabajos que utilizan las macroalgas bentónicas como bioindicadoras, por lo que se destacanlos trabajos de Knutzen y Sortland (1982); Binark et al. (2000); Páez-Osuna et al. (2000)y Peña et al. (2005).
Partiendo de estos hechos, el presente estudio, centrado en la comunidad de macroalgas,presenta sin lugar a dudas un gran interés. Además, la vigilancia y la efectividad de los métodos de gestión de un Área Marina Protegida tienen mucha importancia partiendo del hecho del capital invertido en su creación y conservación. Por ello, el objetivo del presente estudio es el de identificar las comunidades algales de dos áreas marinas muestreadas, un Área Marina Protegida (AMP) como lo es la reserva marina Tabarca y un Área Marina no-Protegida como es el litoral en las inmediaciones del centro de investigaciones marinas de la Universidad de Alicante (CIMAR) en la costa de la Provincia de Alicante, con el propósito de desglosar tanto las especies ubicuas en las dos áreas de estudio, como las quesolo se encuentran en una de ellas, para asíevidenciar las especies que podrían considerarsecomo buenos indicadores del efecto reserva constituyendo una herramienta que ayuden en la gestión, análisis y la toma de decisiones futuras en áreas marinas.
2 Materiales y métodos
Sitio de muestreo
El muestreo se hizo durante el mes de mayo de 2012 en la Provincia de Alicante, concretamente, en la Isla de Nueva Tabarca (38º 10' 00" N y 0º 28' 00" O) y en los alrededoresdel Centro de Investigaciones Marinas de Santa Pola, CIMAR (38º 12' 43,33" N y 0º 30'26,72" O), ambas en el litoral mediterráneo.
El grupo de investigación realizó la campaña cerca del CIMAR en un punto situado en el Cabo de Santa Pola, que se encuentra cerca de la Reserva Marina de Tabarca (4 km), y al centro urbano de Santa Pola, enclave de un importante puerto pesquero. El Cabo en este punto hace de rompeolas natural, lo que contribuye a la baja tasa de renovación de lasaguas hacia cada localización elegida.
Por su parte, en el área marina protegida (AMP) Isla de Nueva Tabarca se eligió la localización de la cantera al Oeste del pueblo, por tener una mayor posibilidad de encontrar un sitio donde la afluencia de turismo es más restringido por políticas de manejo en esta AMP, además de su aislamiento geográfico y orientación norte proporciona una buena ubicación para el recambio de agua por corrientes renovando la oxigenación de la zona.
De esta manera se aporta un enfoque típico de zona predispuesta a las mejorescondiciones posibles dentro de la reserva.
Diseño de muestreo
Como primera medida se establecieron dos áreas de estudio con niveles de protección contrastantes (P: Área Marina Protegida y NP: Área Marina no-protegida). En cada unade las dos zonas de estudio (P y NP) se procedió a la realización de 4 transeptos (T1, T2, T3 y T4) de 10 m, a su vez se determinaron puntos cada 2 metros de dicho transepto perpendicular y desde la línea de la costa en dirección al mar, hasta realizar un total de 5 puntos. En cada punto se realizaron 3 réplicas con el cuadrante de 1600cm2 para determinarla cobertura y estructura comunitaria de las algas. Como método de estandarización, la cobertura se determinó contando los cuadros donde aparecían las especies de algas, dando una relación de proporción según el área (1600cm2), en total se registraron 120 cuadrantes durante todo el estudio.
Adicionalmente se identificaron las especies de algas con ayuda de claves taxonómicaspara dicho fin, y se verificó la vigencia de los nombres científicos con base a los listados de la página WoRMS (2015).
Análisis estadístico
Los datos fueron registrados y organizados en matrices donde se les asignó un código de identificación en función del lugar muestreado y de los códigos descritos en el diseño de muestreo. Posteriormente se hizo una matriz de similitud de Bray-Curtis para observar la distribución de las muestras. El proceso se realizó sin estandarizar los datos ni aplicar transformaciones a los mismos (Clarke & Warwick, 1994).
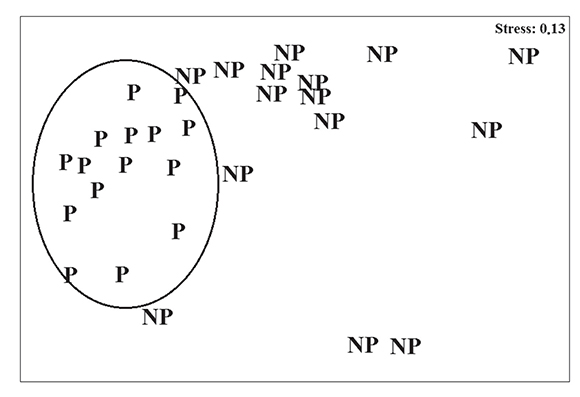
En primer lugar se obtuvieron los resultados de un MDS (multi-dimensional scaling), un análisis multivariado a partir de la matriz de similitud obtenida con 30 permutaciones correlacionales basales. Se procedió a situar en un espacio bidimensional la posición de las muestras en función de su similitud. El resultado obtenido mostró una buena medida de stress (0.13), esto es, un ajuste que indica la fiabilidad del acercamiento a las muestras.
Posteriormente, se hizo una prueba SIMPER (porcentaje de similitud) a las áreas analizadas (Protegida y no-Protegida) para ver las especies que influyen en la semejanza entre ambas áreas y asídescartarlas como bioindicadores, dada su ubiquidad. Para hacer este SIMPER primero se añadió el factor Área y se dividieron las muestras según las áreas: protegidas (AMP Tabarca como zona con buen estado del ecosistema) y no protegidas (CIMAR Santa Pola como zonas de afección ecosistémica).
Identificaron las especies predominantes en cada área y se analizó su abundancia segúnpatrones gráficos con un histograma.
3. Resultados
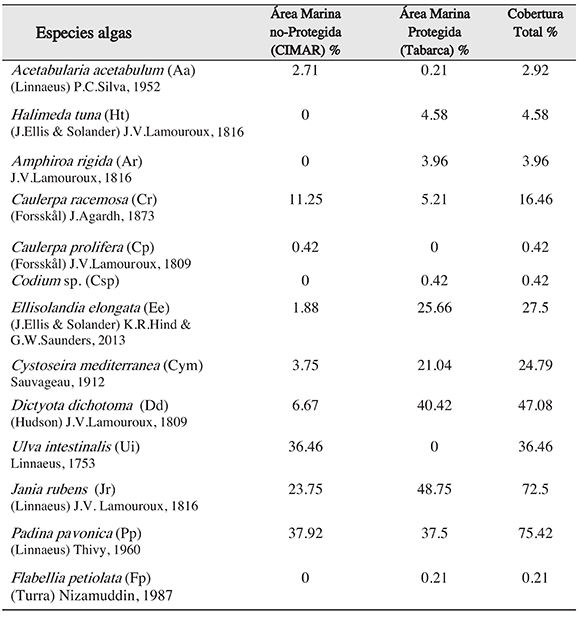
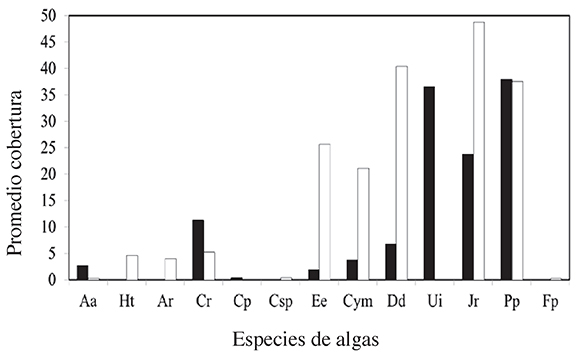
Durante los muestreos de algas en el litoral rocoso de CIMAR y Tabarca se encontraron13 géneros de algas (Figura 1) de las cuales se destacan Padina pavonica, Jania rubens,Dictyota dichotoma y Ulva intestinalis sp., por presentar las mayores coberturas totales (75.42%, 72.5%, 47.08% y 36.46% respectivamente), sin embargo, se observaron de forma descriptiva diferencias entre las coberturas de algunos géneros de algas en relación con las áreas (Tabla 1). Dos géneros de las algas (Caulerpa racemosa, Caulerpa prolifera y Ulva intestinalis), se encontraron exclusivamente en la zona no protegida (CIMAR), mientras que para en el área protegida (Tabarca) se contabilizaron 4 géneros de algas, que aparecieron únicamente en esta área marina (Halimeda tuna, Amphiroa rigida, Codium sp. y Flabellia petiolata).
Tabla 1. Lista de especies con el promedio total de cobertura de las diferentes especies de algas encontradas en el litoral rocoso de Tabarca y el CIMAR, expresado en porcentajes.
Figura 1. Promedio total de la cobertura las especies de algas encontradas en área marina protegida de Tabarca (barras blancas) y el área marina no-protegida del CIMAR (barras negras)
Por otra parte, para la cobertura total de las áreas se observó que los géneros de algas de mayor presencia para la zona no protegida son Padina pavonica y Ulva intestinalis, concoberturas en el litoral rocoso de 37.92% y 36.46 % respectivamente, mientras que para la zona protegida los géneros con más cobertura fueron Jania rubens (48.75%) y Dictyotadichotoma (40.42%). Aunque en las dos áreas comparten géneros, las coberturas de estos fueron muy diferentes en ambos casos con excepción de Padina pavonica (Figura 1), quemuestra en el CIMAR una cobertura de 37.92% y en Tabarca de 37.5%. .
Prueba de similitud de la comunidad de algas de CIMAR y Tabarca
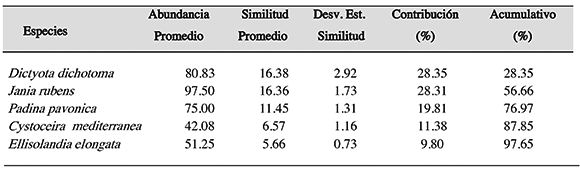
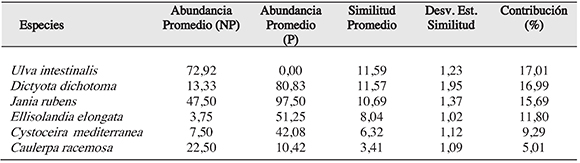
En Tabarca se observó una similitud del 57.78% entre sus puntos de muestreo, siendo las algas mas representativas en cobertura entre los puntos de muestreo en esta zonaDictyota dichotoma (80.83%), Jania rubens (97.50%), Padina pavonica (75%), Cystoceiramediterranea (42.08%), Ellisolandia elongata (51.25%) y en relación a la similitud entre los puntos de muestreo, se observó una contribución de Dictyota dichotoma 28.35%, Jania rubens 28.31%, Padina pavonica 19.81%, Cystoceira mediterranea 11.38%, Ellisolandia elongata 9.80% (Tabla 2).
Tabla 2. Porcentaje de similitud en los puntos de muestreo en Tabarca (área marina protegida) según la comunidad de algas asociada al litoral rocoso, con una medida de similitud de 57.78%.
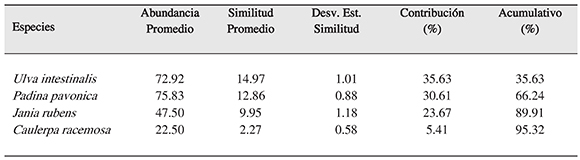
Por otro lado, en el área no protegida (CIMAR) se observó una similitud del 42.01% entre sus puntos de muestreo, y la comunidad de algas de esta zona está compuestaprincipalmente por las especies Ulva intestinalis con una cobertura de 72.92%, Padina pavonica de 75.83%, Jania rubens con 47.50%, Caulerpa racemosa de 22.50%. En la contribución de estos géneros para la similitud entre los puntos de la zona se observó que Ulva intestinalis contribuye con un 35.63% de similitud, Padina pavonica con 30.61%, Jania rubens con 23.67%, Caulerpa racemosa con 5.41% (Tabla 3).
Tabla 3. Porcentaje de similitud en los puntos de muestreo en CIMAR (área marina no protegida) según la comunidad algal, con las especies más representativas asociada al litoral rocoso, con una medida de similitud de 42.01%
Al comparar la zona no protegida con la zona protegida se observó que presentan una disimilitud significativa del 68.10%; diferencias principalmente aportadas por la cobertura y contribución de los géneros (en orden según su contribución) Ulva intestinalis, Dictyotadichotoma, Jania rubens, Ellisolandia elongata, Cystoseira mediterranea, Caulerpa racemosa (Tabla 4).
Tabla 4. Porcentaje de disimilitud entre las áreas marinas protegidas y no protegida (P y NP respectivamente) según la comunidad algal, con las especies más representativas, asociadas al litoral rocoso de estas.
Pruebas MDS de la comunidad de algas de CIMAR y Tabarca
En el MDS hecho para comparar las dos áreas marinas en relación con la cobertura de las comunidades de algas (Figura 2) se observó que los puntos de muestreos de Tabarca se organizan en la misma esquina siguiendo un patrón de distribución, mientras que en el CIMAR, los puntos de muestreos están más disgregados y algunos muestran patrones de distribución dentro de MDS diferentes a los de Tabarca.
Figura 2. MDS de los diferentes puntos de muestreos comparando la estructura de la comunidad algal con relaciónal nivel de protección, donde P: Área Marina Protegida (Tabarca) y NP: Área Marina no-Protegida (CIMAR), con base al índice de similitud de Bray Curtis
Esta comparación permite vislumbrar que estos géneros podrían estar indicando la calidad de los ecosistemas de las zonas muestreadas. Para esto se tomaron las especies más representativas y se organizaron en una serie de MDS donde encontramos que algunos géneros como Ulva intestinalis y Caulerpa racemosa predominan en mayor proporción (en el caso de Ulva exclusivamente), en áreas donde se considera baja la calidad del ecosistema(CIMAR), mientras los géneros Dictyota dichotoma, Padina pavonica, Jania rubens,Ellisolandia elongata, Cystoseira mediterranea, se encontraron en mayor proporción en el AMP Tabarca (Figura 3).
Figura 3. MDS donde se muestra la distribución de las especies más representativas en el estudio con relación al nivel de protección, donde los círculos en gris indican la proporción de individuos, la P: zona protegida (Tabarca) NP: es la zona no protegida (CIMAR), y donde a: Ulva intestinalis, b: Dictyota dichotoma, c: Padina pavonica,d: Jania rubens, e: Ellisolandia elongata, f: Cystoseira mediterranea, g: Caulerpa racemosa.
4. Discusión
Aunque todo organismo es indicador de las condiciones del medio donde se desarrolla, un indicador biológico acuático se ha considerado como aquel cuya presencia y abundanciaseñala un proceso o estado del sistema en el cual habita (Pinilla, 2000).
Los bioindicadores ideales son las especies relativamente fáciles de observar, colectar, reconocer, y suficientemente abundantes para permitir el muestreo repetible. Aunque las formas microscópicas son generalmente más abundantes en los ecosistemas y más fáciles de muestrear que las formas macroscópicas, para identificar y cuantificar organismosmuy pequeños se requieren equipos considerablemente sofisticados. De acuerdo con esto, los buenos indicadores son posiblemente los organismos macroscópicos, con movilidad limitada y de distribución bastante amplia, de fácil recolección y cuantificación, asícomo relacionados con el efecto que se quiere indicar, además, debe existir suficiente informaciónbiológica y ecológica sobre ellos (Wilson, 1994).
Las comunidades de algas responden por lo general a los impactos antropogénicos como exceso de nutrientes y sustancias tóxicas, convirtiéndose en buenos indicadores en la calidad del agua (Wang & Lewis, 1997). Son fácilmente muestreables, y algunas de sus características, como sus ciclos de vida cortos, las hacen indicadoras adecuadas de impactos a corto plazo. Además, la capacidad de fijación de la mayoría de las especies hace que sean afectadas directamente por los cambios físicos y químicos en la columna de agua y al ser productores primarios, son sensibles a contaminantes que no tienen efectos sobre otros organismos heterotróficos (Costa & Liss, 1999; Schiewer & Wong, 2000). En la Reserva Marina de Tabarca, dada su protección, puede ser considerada un sitio donde el agua y los ecosistemas son de buena calidad. Esto se puede observar en la abundancia de especies de algas encontradas en este estudio, donde se destacan por su amplia cobertura especies como Cystoseira mediterranea y Ellisolandia elongata (Figura 3), las cuales son indicadoras de buena calidad dada sus características y necesidades biológicas. Sin embargo,Cystoseira mediterranea, aunque está considerada entre las más importantes especies de algas formadoras de hábitat en las aguas someras del Mediterráneo (Giaccone, 1973), ha experimentado un decline muy importante en años recientes (Serio et al., 2006).
No obstante, el grado de desarrollo de las poblaciones del genero Cystoseira spp. (e.g. C. mediterranea, C. amentacea v. stricta, Cystoseira compressa) en los litorales rocosos se ha utilizado para evaluar la calidad ecológica de los cuerpos de agua de las zonas costeras (Ballesteros et al., 2007; Pinedo et al., 2007). Sin embargo, la posible utilidad de este género como indicador en entornos protegidos no se ha abordado lo suficiente, aunque la información existente (Cormaci & Furnari, 1999; Thibaut et al., 2005) sugiere que laspoblaciones son más saludables en aguas limpias. Además, en zonas donde los niveles de urbanización son altos y la presión antrópica es mayor, las poblaciones tienden a decrecer o desaparecer (Boyle, 1984; Soltan et al., 2001; Arévalo et al., 2007; Pinedo et al., 2007; Sales & Ballesteros, 2009). Por lo tanto, este género estaría indicando que las aguas de la Reserva Marina de Tabarca son limpias, con muy bajos niveles de contaminación.
Por su parte, Ellisolandia elongata también fue muy abundante durante los muestreos en el AMP. Esta alga también se considera sensible a la contaminación, sobre todo a mediosenriquecidos por ortofostatos, asociados por lo general a detergentes. En presencia deestos, suele disminuir considerablemente su abundancia, ya que son sustancias que inhiben la calcificación, uno de los procesos fisiológicos más importantes asociados a esta alga articulada (Brown et al., 1977).
En contraste, en el Área Marina no-Protegida muestreada (CIMAR), predominaron Ulva intestinalis y Caulerpa racemosa, consideradas especies oportunistas. La primera, es un género de alga frecuente en sitios perturbados y su tolerancia a sustancias tóxicas como los metales pesados ha hecho que sea considerada una especie indicadora de la calidad de los cuerpos de agua costeros. Zbikowski et al. (2007) demostraron que acumula eficientementemetales como plomo, cinc y cobre en sus células. Esta tolerancia permitiría que dichas algas prevalezcan en sitios contaminados, donde muchas otras especies no sobrevivirían (Haritonidis & Malea, 1999; Wang & Dei, 1999; Hayden et al., 2003; Gaudry et al., 2007 Wang et al., 2010).
Para C. racemosa se obtuvo el doble de cozzbertura en el área sin protección en relación a la protegida. Esta es una especie que está considerada uno de los macrófitos más invasivos en el mar Mediterráneo (Klein & Verlaque, 2008). Su amenaza es sumamente seria ya que al colonizar interfiere con las comunidades nativas al ser fuertes competidoras, reproduciéndose rápidamente y además, pueden producir sustancias tóxicas. Es por tanto una especie oportunista cuyo desarrollo se potenciaría en los aquellos sitios perturbados por algunas actividades humanas (Dumay et al., 2002; Verlaque et al., 2004). Aunque se ha incrementado notablemente su presencia en proximidades a las grandes ciudades industriales (Ballesteros et al., 1999; Mifsud & Lanfranco, 2007), no se ha demostrado que exista una afinidad por la especie con sitios contaminados, y su abundancia en los puertos ha sido asociada más con su mecanismo de dispersión secundaria (facilidad de adherencia a superficies), el cual se ve favorecido por el tráfico marítimo (Klein & Verlaque, 2008).
Otras dos especies con una amplia cobertura en ambos sitios fueron Dictyota dichotoma y Jania rubens, aunque fue en el sitio protegido donde se observó la mayor cobertura de las dos. No obstante, las diferencias en Jania rubens, podrían deberse más a variaciones en elhidrodinamismo entre ambos sitios que a la contaminación, como lo observaron Rodríguez-Prieto y Polo (1996) y Rull-Lluch y Gómez-Garreta (1990), en los que no se encontró una sensibilidad particular de esta especie a los niveles de polución.
Con respecto a Dictyota dichotoma ha sido recientemente catalogada como una buena especie para estudiar la presencia de metales como el zinc, el cadmio, el cromo entre otras enlas aguas, ya que tolera vivir en ambientes con niveles de contaminación moderados y tienecapacidad fisiológica para acumular estos metales en sus células (Laib & Leghouchi, 2012).En otro estudio Bellou et al. (2009) encontraron que D. dichotoma fue encontrada poblando las estructuras artificiales en un sitio contaminado del mar Egeo (Grecia), mientras que en los sitios control estuvo ausente. Sin embargo, en contraste a los resultados obtenidos en este estudio, esta especie no sería un buen bioindicador de calidad del agua.
En general, esta comparación permite vislumbrar cuales géneros podrían estar indicandola calidad del agua y los ecosistemas en las áreas marinas muestreadas, asumiendo que los ecosistemas de Tabarca, por estar protegidos, son de buena calidad. La representación bidimensional del MDS mostró que el conjunto de especies encontradas en el área protegidasiguen un patrón de distribución diferente al de la zona no protegida, por lo que se puedeconcluir que los géneros y especies Cystoseira mediterranea y Ellisolandia elongata son bioindicadores de buena calidad ambiental, mientras que algas como Ulva intestinalis yCaulerpa racemosa, indican un alto grado de perturbación según su cobertura.
Agradecimientos
Los autores agradecen a la Universitat d'Alacant y a su centro de investigacionesmarinas (CIMAR) por acogernos en su programa de posgrado MAGEM el cual apoyo la ejecución de esta investigación.
Dr Sc. Carlos Valle Pérez (profesor de la Universitat d'Alacant). Grupo de investigaciónde ecosistemas rocosos intermareales y submareales (LITHOS) de la Universidad del Valle.
Referencias
Arévalo, R., Pinedo, S., & Ballesteros, E. (2007). Changes in the composition and structure of Mediterranean rocky-shore communities following a gradient of nutrientenrichment: descriptive study and test of proposed methods to assess water quality regarding macroalgae. Mar. Pollut. Bull., 55, 104-113. [ Links ]
Ballesteros, E., Grau, M., & Riera, F. (1999). Caulerpa racemosa (Forsska°l) J.Agardh (Caulerpales, Chlorophyta) a Mallorca. Palma de Mallorca: Bolletí de la Societat d'Història Natural de les Balears, 42, 63-68. [ Links ]
Ballesteros, E., Torras, X., Pinedo, S., Garcia, M., Mangialajo, L., & de Torres, M. (2007). Anew methodology based on littoral community cartography for the implementation of the European Water Framework Directive. Mar. Pollut. Bull., 55, 172-180. [ Links ]
Bellou, N., Canning-Clode, J., Tsiamis, K., & Pancucci-Papadopoulo, M. A. (2009, May). Diversity of fouling communities grown on artificial substrata deployed in a polluted and an unpolluted site in the Aegean Sea (Greece). In, 9th Hellenic Symposium of Oceanography & Fisheries, (n. 1) (pp. 633-638). Patras, Grecia. [ Links ]
Benincà, E., Ballantine, B., Ellner, S. P., & Huisman, J. (2015). Species fluctuations sustained by a cyclic succession at the edge of chaos. Proceedings of the National Academy of Sciences, 112(20), 6389-6394. [ Links ]
Binark, N., Güven, K. C., Gezgin, T. & Unlu, S. (2000). Oil Pollution of Marine Algae. Bull. Environ. Cont. Tox., 64, 866-872. [ Links ]
Bishop, K., Dudley, N., Phillips, A., & Stolton, S. (2004). Speaking a CommonLanguage: the Uses and Performance of the IUCN System of Management Categoriesfor Protected Areas. Cardiff Wales, UK: Cardiff University, IUCN - The WorldConservation Union and UNEP - World Conservation Monitoring Centre. [ Links ]
Borowitzka, M. A. (1972). Intertidal algal species diversity and the effect of pollution. Aust. J. Mar. Freshwat. Res., 23(2), 73-84. [ Links ]
Boyle, T. P. (1984). The effect of environmental contaminants on aquatic algae. In, L. E. Shubert (Ed.) Algae as Ecological Indicators (pp. 237-256). London, England: Academic Press. [ Links ]
Brown, V., Ducker, S. C., & Rowan, K. S. (1977). The effect of orthophosphate concentration on the growth of articulated coralline algae (Rhodophyta). Phycologia, 16(2), 125-131. [ Links ]
Cardinale, B. J., Matulich, K. L., Hooper, D. U., Byrnes, J. E., Duffy, E., Gamfeldt, L. et al. (2011). The functional role of producer diversity in ecosystems. American journal of botany, 98(3), 572-592. [ Links ]
Cardinale, B. J., Duffy, J. E., Gonzalez, A., Hooper, D. U. et al. (2012). Biodiversityloss and its impact on humanity. Nature, 486, 59-67. [ Links ]
Chakraborty, S., Bhattacharya, T., Singh, G., & Maity, J. P. (2014). Benthic macroalgaeas biological indicators of heavy metal pollution in the marine environments: Abiomonitoring approach for pollution assessment. Ecotoxi. Environ. Safety, 100, 61-68. [ Links ]
Chaudhuri, A., Mitra, M., Havrilla, C., Waguespack, Y., & Schwarz, J. (2007). Heavy metal biomonitoring by seaweeds on the Delmarva Peninsula, east coast of the USA. Bot. Mar., 50, 151-158. [ Links ]
Clarke, K. R., & Warwick, R. M. (1994). Change in Marine Communities: Anapproach to statistical analysis and interpretation. Plymouth, UK: PlymouthMarine Laboratory. [ Links ]
Cormaci, M., & Furnari, G. (1999). Changes of the benthic algal flora of the Tremiti Islands (southern Adriatic) Italy. Hydrobiologia, 398, 75-79. [ Links ]
Costa, M., & Liss, P. S. (1999). Photoreduction of mercury in sea water and its possibleimplications for Hg0 air-sea fluxes. Mar. Chem., 68, 87-95. [ Links ]
Diaz, M., Mora, V., Pedrozo, F., Nichela, D., & Baffico, G. (2015). Evaluation of nativeacidophilic algae species as potential indicators of polycyclic aromatic hydrocarbon (PAH) soil contamination. J of App. Phyco., 27(1), 321-325. [ Links ]
Dumay, O., Pergent, G., Pergent-Martini, C., & Amade, P. (2002). Variations incaulerpenyne contents in Caulerpa taxifolia and Caulerpa racemosa. J. Chem. Ecol., 28(2), 343-352. [ Links ]
Feng, H., Han, X., Zhang, W. & Yu, L. (2004). A preliminary study of heavy metal contamination in Yangtze River intertidal zone due to urbanization. Mar.Pollut. Bull. 49, 910-915. [ Links ]
Gaudry, A., Zeroual, S., Gaie-Levrel, F., Moskura, M., Boujrhal, F. Z., Cherkaoui, R., et al. (2007). Heavy Metals Pollution of the Atlantic Marine Environment by the Moroccan Phosphate Industry, as Observed through their Bioaccumulation in Ulva lactuca. Water Air Soil Poll, 178, 267-285. [ Links ]
Gao, X., & Chen, C. T. (2012). Heavy metal pollution status in surface sediments of the coastal Bohai Bay. Water Res., 46, 1901-1911. [ Links ]
Giaccone, G. (1973). Écologie et chorologie des Cystoseira de Méditerranée. France. Rapp. Comm. Int. Mer Médit., 22, 49-50. [ Links ]
Grime, J. P. (1977). Evidence for the existence of three primary strategies in plants and its relevance to ecological and evolutionary theory. Am. Nat., 111 (982), 1169-1194. [ Links ]
Haritonidis, S., & Malea, P. (1999). Bioaccumulation of metals by the green alga Ulva rigida from Thermaikos Gulf, Greece. Environ. Pollut., 104(3), 365-372. [ Links ]
Hayden, H. S., Blomster, J., Maggs, C. A., Silva, P. C., Stanhope, M.J., & Waaland, J. R. (2003). Linnaeus was right all along: Ulva and Ulva are not distinct genera. Euro. J. Phyco., 38, 277-294. [ Links ]
Herrera-Paz, D. L., Londoño-Cruz, E., & Blanco-Libreros, J. F. (2013). Distribución espacial del ensamblaje de macroinvertebrados asociada al litoral rocoso del PNN Ensenada de Utría, Pacífico Colombiano. Revista de Ciencias Univalle, 17(2), 137-149. [ Links ]
Hodapp, D., Meier, S., Muijsers, F., Badewien, T. H., & Hillebrand, H. (2015). Structural equation modeling approach to the diversity- productivity relationship of Wadden Sea phytoplankton. Mar Ecol Prog Ser., 523, 31-40. [ Links ]
Hooper, D. U., Chapin, F. S., Ewel, J. J., Hector, A., Inchausti, P., Lavorel, S. et al. (2005). Effects of biodiversity on ecosystem functioning: a consensus of current knowledge. Ecol. Monogr., 75, 3-35. [ Links ]
Hughes, T. P., Bellwood, D. R., Folke, C., Steneck, R. S., & Wilson, J. (2005). New paradigms for supporting the resilience of marine ecosystems. Trends. Ecol. Evol., 20(7), 380-386. [ Links ]
Klein, J., & Verlaque, M. (2008). The Caulerpa racemosa invasion: a critical review. Mar. Pollut. Bull., 56(2), 205-225. [ Links ]
Kangwe, J. W. (1999). The effects of land-based pollution on reef building calcareousalgae in the reefs near Zanzibar town. (M.Sc. thesis). University of Dar es Salaam, University of Dar es Salaam, Tanzania. [ Links ]
Knutzen, J., & Sortland, B. (1982). Polycyclic Aromatic Hydrocarbons (PAH) in somealgae and invertebrates from moderately polluted parts of the coast of Norway. Water Res., 16(4), 421- 428. [ Links ]
Kristan, U., Kanduč, T., Osterc, A., Šlejkovec, Z., Ramšak, A., & Stibilj, V. (2014). Assessment of pollution level using Mytilus galloprovincialis as a bioindicatorspecies: The case of the Gulf of Trieste Mar. Pollut. Bull., 89(1), 455-463. [ Links ]
Laib, E., & Leghouchi, E. (2012). Cd, Cr, Cu, Pb, and Zn concentrations in Ulva lactuca, Codium fragile, Jania rubens, and Dictyota dichotoma from Rabta Bay, Jijel (Algeria). Environ. Monit. Assess., 184(3), 1711-1718. [ Links ]
Londoño-Cruz, E., López de Mesa-Agudelo, L. A., Arias-Galvez, F., Herrera-Paz, D.L., Prado, A., Cuellar, L. et al. (2014). Distribution of macroinvertebrates on intertidal rocky shores in Gorgona Island, Colombia (Tropical Eastern Pacific). Rev. Bio. Trop., 62(1), 189-198. [ Links ]
Loreau, M., Naeem, S., Inchausti, P., Bengtsson, J., Grime, J. P., Hector, A. et al. (2001). Ecology biodiversity and ecosystem functioning: current knowledge and futurechallenges. Science, 294, 804-808. [ Links ]
Mifsud, C., & Lanfranco, E. (2007). Caulerpa racemosa (Chlorophyta, Caulerpales) in the Maltese Islands (Central Mediterranean). In, United Nations Environment Programme (Ed.) 3rd Mediterranean Symposium on Marine Vegetation, (pp.285-287). Marseilles-Tunis, France-Tunisia: Regional Activity Centre for Specially Protected Areas. [ Links ]
Orescanin, V., Lovrencic, I., Mikelic, L., Barisic, D., Matasin, Z., Lulic, S. et al. (2006). Biomonitoring of heavy metals and arsenic on the coast of the Middle Adriatic Sea using Mytilus galloprovincialis. Nucl. Instr. Meth. Phys. Res. B., 245, 495-500. [ Links ]
Páez-Osuna, F., Ochoa-Izaguirre, M. J., Bojórquez-Leyva, H., & Michel-Reynoso, I. L. (2000). Macroalgae as Biomonitors of Heavy Metal Availability in coastal Lagoons from the Subtropical Pacific of Mexico. Bull. Environ. Contam. Tox., 64(6), 846-851. [ Links ]
Peña, E. J., Palacios, M. L., & Ospina, N. (2005). Algas como indicadores ambientales. Cali, Colombia: Programa Editorial Universidad del Valle. [ Links ]
Pinedo, S., García, M., Satta, M. P., de Torres, M., & Ballesteros, E. (2007). Rockyshore communities as indicators of water quality: a case study in the Northwestern Mediterranean. Mar. Pollut. Bull., 55, 126-135. [ Links ]
Pinilla, G. A. (2000). Indicadores biológicos en ecosistemas acuáticos continentales de Colombia. Bogotá, Colombia. Fundación Universidad de Bogotá Jorge Tadeo Lozano (p. 67). [ Links ]
Rainbow, P. S., & Phillips, D. J. H. (1993). Cosmopolitan biomonitors of trace metals. Mar. Pollut. Bull., 26(11), 593-601. [ Links ]
Ravenel, R. M., & Redford, K. H. (2005). Understanding IUCN protected areacategories. Nat. Area. J., 25(4), 381-389. [ Links ]
Rodríguez-Prieto, C., & Polo, L. (1996). Effects of sewage pollution in the structure and dynamics of the community of Cystoseira mediterranea (Fucales, Phaeophyceae). Sci. Mar., 60(2-3), 253-263. [ Links ]
Rull-Lluch, J., y Gómez-Garreta, A. (1990). Estudio de la comunidad de Cystoseiramediterranea de dos localidades de la península del Cabo de Creus (Alt Empordá, Nordeste de España). Collect. Botanica, 18, 5-19. [ Links ]
Sales, M. & Ballesteros, E. (2009). Shallow Cystoseira (Fucales: Ochrophyta)assemblages thriving in sheltered areas from Menorca (NW Mediterranean):Relationships with environmental factors and anthropogenic pressures. Estuar. Coast. Shelf. Sci., 84(4), 476-482. [ Links ]
Schiewer, S. & Wong, M. H. (2000). Ionic strength effects in biosportion of metals by marine algae. Chemosphere, 41, 271-282. [ Links ]
Serio, D., Alongi, G., Catra, M., Cormaci, M., & Furnari, G. (2006). Changes in the benthicalgal flora of Linosa Island (Straits of Sicily, Mediterranean Sea). Bot. Mar., 49, 135-144. [ Links ]
Smyth, R. L., Watzin, M. C., & Manning, R. E. (2007). Defining Acceptable Levels for Ecological Indicators: An Approach for Considering Social Values. Environ. Manage., 39, 301-315. [ Links ]
Soltan, D., Verlaque, M., Boudouresque, C. F., & Francour, P. (2001). Changes in macroalgal communities in the vicinity of a Mediterranean sewage outfall after the setting up of a treatment plant. Mar. Pollut. Bull., 42, 59-70. [ Links ]
Sternberg, M., Gabay, O., Angel, D., Barneah, O., Gafny, S., Gasith, A. et al. (2015). Impacts of climate change on biodiversity in Israel: an expert assessment approach. Regional Environmental Change, 15(5), 895-906. [ Links ]
Thibaut, T., Pinedo, S., Torras, X., & Ballesteros, E. (2005). Long-term decline of the populations of Fucales (Cystoseira spp. and Sargassum spp.) in the Albères coast (France, North-western Mediterranean). Mar. Pollut. Bull., 50, 1472-1489. [ Links ]
Vandermeulen, H. (1998). The development of marine indicators for coastal zone management. Ocean Coast. Manage., 39, 63-71. [ Links ]
Verlaque, M., Afonso-Carrillo, J., Gil-Rodriguez, M. C., Durand, C., Boudouresque, C. F., & Le Parco, Y. (2004). Blitzkrieg in a marine invasion: Caulerpa racemosavar. cylindracea (Bryopsidales, Chlorophyta) reaches the Canary Islands (North-EastAtlantic). Biol. Inv., 6, 269-281. [ Links ]
Viêgas, C. V., Hachemi, I., Freitas, S. P., Mäki-Arvela, P., Aho, A., Hemming, J. et al. (2015). A route to produce renewable diesel from algae: Synthesis and characterization of biodiesel via in situ transesterification of Chlorella alga and its catalytic deoxygenation to renewable diesel. Fuel, 155, 144-154. [ Links ]
Wang, S. F., Jia, Y. F., Wang, S. Y., Wang, X., Wang, H., Zhao, Z. et al. (2010). Fractionation of heavy metals in shallow marine sediments from Jinzhou Bay, China. J. Environ. Sci., 22, 23-31. [ Links ]
Wang, W. X., & Dei, R. C. H. (1999) Kinetic measurements of metal accumulationin two marine macroalgae. Mar. Biol., 135, 11-23. [ Links ]
Wang, W., & Lewis, M. A. (1997). Metal accumulation by aquatic macrophytes. En W.-C. Wang, J. W. Gorsuch & J. S. Hughes (Eds.) Plants for Environmental Studies, (pp. 367-416) Boca Ratón, USA: CRC Press. [ Links ]
Wang, C. Y., & Wang, X. L. (2007). Spatial distribution of dissolved Pb, Hg, Cd, Cu and as in the Bohai sea. Journal of Environmental Sciences, 19(9), 1061-1066. [ Links ]
Wilson, J. G. (1994). The role of bioindicators in estuarine management. Estuaries, 17(1A), 94-101. [ Links ]
WoRMS Editorial Board (2015). World register of marine species. Recovered 10/06/2015 http://www.marinespecies.org/ [ Links ]
Zhang, W., Feng, H., Chang, J., Qu, J., Xie, H., & Yu, L. (2009). Heavy metal contamination in surface sediments of Yangtze River intertidal zone: an assessment from different indexes. Environ. Pollut., 157, 1533-1543. [ Links ]
Zbikowski, R., Szefer, P., & Latala, A. (2007). Comparison of green algae Cladophorasp. and Ulva sp. as potential biomonitors of chemical elements in the southern Baltic. Sci. Total. Environ., 387, 320-332. [ Links ]

Revista de Ciencias por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento 4.0.