Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Ciencias
Print version ISSN 0121-1935
rev. cienc. vol.19 no.1 Cali Jan./June 2015
Optimización de una metodología para el aislamiento y detección molecular de huevos de Toxocara canis en muestras de suelo
Optimization a Methodology for the Isolation and the MolecularDetection of Toxocara Canis Eggs in Soil Samples
Dary Luz Mendoza Meza
Programa de Química, Universidad del Atlántico, Barranquilla - Colombia
E-mail: darymendoza@mail.uniatlantico.edu.co
Humberto Maldonado Santana
Programa de Biología, Universidad del Atlántico, Barranquilla - Colombia
E-mail: maldonadohjs@gmail.com
Recived: October 31, 2014
Accepted: February 23, 2015
Resumen
La toxocariasis es una zoonosis común en países en desarrollo, como Colombia. La ingesta accidental de huevos de Toxocara sp representa la principal vía de transmisión al humano, por tanto, la vigilancia de la contaminación ambiental es una de las principales estrategias en la prevención de la toxocariasis. El objetivo fue optimizar una metodología para evaluar la contaminación del suelo porhuevos de Toxocara canis. Las muestras de suelo se colectaron en un parque público en la ciudad de Barranquilla (Colombia). Los huevos de Toxocara se aislaron mediante centrifugación/floculación con MgSO4 (r=1,20), ZnSO4 (r=1,18), NaCl (r=1,18) y solución de Sheather (r=1,27). El ADN del parásito se extrajo y se identificó mediante amplificación del ITS-2-ADNr (PCR-ITS-2) del T. canis y posterior secuenciación de nucleótidos. El análisis ANOVA indicó diferencia estadísticamentesignificativa (p <0,05) entre las concentraciones de ADN obtenidos con las soluciones de floculación utilizadas para aislar los huevos. Los resultados del test de Tukey sugieren que la solución modificadade Sheathers es la mejor para la floculación. El análisis PCR-ITS-2 mostró resultado positivo para T. canis en 7 de 13 muestras examinadas (53,84%). En conclusión, se demuestra que el método propuestoes eficiente por la detección de T. canis en muestras de campo.
Palabras clave: Toxocara canis, toxocariasis, contaminación ambiental, ITS-2.
Abstract
Toxocariasis is a common zoonosis in developing countries, such as Colombia. Accidental ingestion of Toxocara sp. eggs represents the principal form of transmission in humans. Therefore, monitoring of environmental contamination is the better strategy for preventing the toxocariasis. The objective was to optimize a methodology for assessing soil contamination caused by Toxocara canis eggs. The soil samples were collected from a public park in the city of Barranquilla (Colombia). The Toxocara eggs were isolated by centrifugation/flocculation with MgSO4 (r = 1.20), ZnSO4(r= 1.18), NaCl (r= 1.18) and Sheather solution (r= 1.27). The parasite DNA was extracted and identified through amplification of ITS-2- DNAr (PCR-ITS-2) of T. canis and subsequent nucleotidesequencing. ANOVA analysis indicates a statistically significant difference (p <0.05) between the DNA concentrations obtained with the flocculation solutions used to isolate eggs. Tukey test results suggest that the modified Sheather´s solution is better for the flocculation. The PCR-ITS-2 analysis showed positive results for T. canis in 7 out of 13 samples examined (53.84 %). In conclusion, it is shown that the proposed method is efficient for the detection of T. canis in field samples.
Keywords: Toxocara canis, toxocariasis, environmental contamination, ITS-2.
1 Introducción
Toxocara canis es un ascárido que parasita al sistema digestivo de los perrosconstituyéndose en uno de los endoparásitos más prevalentes en la población canina, a nivelmundial (Macpherson, 2013). Desde el punto de vista epidemiológico, T. canis es de importancia zoonótica por ser el agente causante de la toxocariosis humana, una enfermedad considerada unproblema de salud pública en varios países (Despommier, 2003).
Las manifestaciones clínicas más frecuentes asociadas con la infección por Toxocara canis se clasifican de acuerdo a los órganos afectados. Se conocen dos síndromes principales:larva migrans visceral (VLM), que abarca las enfermedades asociadas con los órganos mayores (riñones, bazo, cerebro) y larva migrans ocular (OLM), en el que la patología y losefectos en el hospedador se limitan al ojo y el nervio óptico (Glickman & Shofer, 1987; Good, 2004). Síndromes menos graves se han descrito, como toxocariasis encubierta y toxocariasis común (Despommier, 2003). La infección por T. canis, en los hospedadores naturales (perros) ocurre por la ingesta de huevos embrionadosviables desde el suelo, o pueden adquirirse por vía transplacentaria. En el huésped paraténico(seres humanos), la infección es dependiente de la contaminación del medio ambiente con huevos infectantes presentes en las heces depositadas por los cánidos (Glickman et al., 1979; Fahrion, 2008).
A pesar del aumento de la población canina en Colombia, son pocas las investigacionessobre la contaminación ambiental por huevos de T. canis en áreas de acceso público. Uno delos problemas de estos estudios radica en que los métodos para el aislamiento y detección delos huevos del parásito, desde el suelo, son dispendiosos y difíciles de realizar cuando se tratade un gran número de muestras (Uga et al., 2000). Adicionalmente, la microscopía óptica, que es el métodotradicional para la identificación de parásitos en muestras de suelo, es considerada poco eficiente para diferenciar entre los huevos de Toxocara y de otros ascaridos, debido a su altasimilitud morfológica (Uga, 1989). Por lo anterior, se han desarrollado algunos métodos molecularespara la identificación precisa y el diagnóstico de estos nematodos, utilizando marcadores ribosomales y mitocondriales. No obstante, una de las limitantes de estos métodos es la estandarización de un protocolo de preparación de la muestra que sea rápido, económico y confiable, para la obtención de un ADN de alta calidad y en cantidades adecuadas para su aplicación en las pruebas moleculares (Krämer et al., 2002).
El propósito de esta investigación fue optimizar una metodología para el aislamiento y detección de huevos de T. canis en muestras de suelo, mediante amplificación del transcrito interno (ITS-2) del ADN ribosomal (ADNr) del parásito.
2 Materiales y métodos
2.1 Tipo de estudio
Para establecer la metodología más eficiente para el aislamiento y la detección de huevos de T. canis en muestras de suelo, se realizó un estudio analítico experimental.
2.2 Muestras
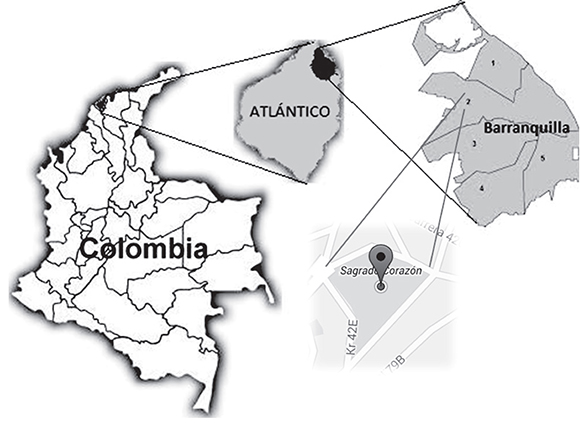
Se recolectaron muestras de suelo en el parque Sagrado Corazón de Jesús de la ciudad de Barranquilla, departamento de Atlántico (10°59'36"N y 74°49'5"W), durante el mes dediciembre de 2013 (Figura 1). El cálculo del tamaño de la muestra se basó en función del área verde aproximada del parque (1,3 hectáreas), recolectándose una muestra cada 100 m2 para un total de 13 muestras. Para la recolección del suelo se realizó un muestreo aleatorio estratificado, definiéndose como unidad de muestreo el volumen de suelo resultante de recoger con una pala una parte de éste, constituida por un área de 10 cm de largo x 10 cm de ancho x 3 cm de profundidad. Las muestras recogidas se guardaron en bolsas plásticas, las cuales fueron selladas y almacenadas a 4°C.
Figura 1. Ubicación geográfica de la zona de estudio. Humberto Maldonado Santana
2.3 Aislamiento de huevos de Toxocara sp desde el suelo
Las muestras de suelo fueron cernidas a través de un tamiz de 4 mm, para eliminar hierbas y otro material particulado. La separación de los huevos del Toxocara sp se realizó mediante centrifugación/floculación utilizando las siguientes soluciones: MgSO4 (r = 1,2g/mL), ZnSO4 (r = 1,18 g/mL), NaCl (r = 1,18 g/mL) y solución modificada de Sheather (azúcar granulada, agua destilada y 1% de formaldehido) (r = 1,27 g/mL).
La centrifugación/floculación se realizó de acuerdo a la metodología descrita por Drydeny colaboradores en 2005 [10], con algunas modificaciones. Brevemente, una muestra de 50 g de suelo se lavó con 60 mL de solución salina (NaCl 0,9 % p/v) y se filtró a través de gasa estéril; el residuo obtenido se descarto y el sobrenadante se distribuyó en tubos de 15 mL quefueron centrifugados por 5 min a 1500 x g. El sedimento se separó y se lavó varias veces hastaque el sobrenadante quedó transparente. Seguido, se le adicionó la solución de flotación.
La mezcla se agitó y se centrifugó por 5 min a 2000 x g. Los huevos de parásitos que quedaron en la superficie del líquido fueron recuperados mediante aspiración con una pipeta Pasteur y se lavaron con solución salina usando la siguiente relación: 1 mL de suspensión de huevos más 14 mL de solución salina (1:15, v/v). La mezcla se centrifugó por 5 min a 2000 x g, el sobrenadante se descartó y el sedimento conteniendo los huevos se mezcló con 1 mL de solución salina. La presencia de huevos de Toxocara sp en esta suspensión se confirmó por microscopía.
2.4 Extracción de ADN
Esta etapa involucró la ruptura de la cubierta de los huevos de T. canis, extracción y análisis espectrofometrico del ADN. Para debilitar y/o eliminar la cubierta del huevo del parásito se utilizó choque térmico [11] así: la muestra se congeló a -80 °C por 10 min e inmediatamente se calentó a 100 °C por 2 min. El ciclo de congelación/calentamiento se repitió cuatro veces. Posteriormente, un volumen de 100 μL de la suspensión anterior se extrajo con buffer de lisis compuesto por NaCl 100 mM, EDTA 1 mM, Tris- HCl 10 mM, Triton 100 al 2%, SDS 0,5 % y proteinasa K (30 µL). Las muestras se centrifugaron por 3 min a 10000 x g. El ADN se extrajo con 250 μL de la mezcla fenol/cloroformo/alcohol isoamilico (25:24:1), seguido de precipitación con etanol absoluto frío. El ADN precipitadose diluyó con 50 μL de buffer TE (Tris-EDTA) 1X. La calidad y cantidad del ADN obtenidose determinó mediante análisis espectrofotométrico (relación absorbancia 260/280),empleando un equipo NanoDrop 2000 (Thermo Scientific, West Palm Beach, EE.UU).
2.5 Amplificación (PCR-ITS-2) de T. canis
Se seleccionó el segundo espaciador del transcrito interno del ADNr de T. canis como marcador molecular para la identificación del parásito, usando la reacción encadena de la polimerasa (PCR-ITS-2). Se utilizaron iniciadores especie-específicos,diseñados para las regiones 5,8s y 28s del ADNr, los cuales fueron descritospreviamente (12): sentido NC13: 5¢-ATCGATGAAGAACGCAGC-3¢; antisentido NC2: 5¢-TTAGTTTCTTTTCCTCCGCT-3¢. El tamaño esperado para el fragmento amplificado fue de 533 pb. La composición de la mezcla de reacción de PCR fue: 12,5 µL de Master Mix PCR 100 2X (Corpogen), compuesta por 20 mM de Tris-HCl (pH 8,5), 100 mM de KCl, 3,0 mM de MgCl2 y 400 mM de cada dNTPs; 2,5 µL de cada primer (100 pmol); 5 µL ADN (10- 50 ng); 2U de Taq polimerasa y 2,5 µL de agua libre de ADNsa y ARNsa. Las condiciones de amplificación fueron: desnaturalización inicial a 94°C por 3 min; 35 ciclos de 94°C 1 min, 55°C 1 min y 72°C 1 min; extensión final a 72°C por 5 min en un equipo MJ Research PTC-200 Thermal Cyclerâ. El control positivo de la reacción de PCR fue ADN de huevos de T. canis, obtenido previamente. El control negativo fue agua libre de ADNasa y ARNasa.
La detección de los productos de PCR se realizó mediante electroforesis en geles de agarosa al 1,5 % p/v, en un equipo horizontal Mini-Sub Cell GT™ BioRad. La corrida electroforética se realizó a 100 voltios durante 60 min, utilizando buffer TBE 1X. Los geles de agarosa se tiñeron con solución de Bromuro de Etidio (10 mg/mL) y se visualizaron en un Fotodocumentador Gel Doc-It2 310â con luz UV. El tamaño del producto de PCR se calculó usando como referencia un marcador de peso molecular (Ladder 100 pb).
2.6 Secuenciación
Uno de los amplificados que mostró buena resolución en la electroforesis fueanalizado mediante la técnica de secuenciación por extensión del iniciador, en ambossentidos, con el equipo 3730XL DNA Analyzer (Applied Biosystems™), usando el kit comercial BigDye® Terminator (Applied Biosystems™) y los iniciadores NC13 y NC2. Las secuencias consensos se derivaron de las obtenidas de cada hebra de ADN, utilizando el programa MEGA 5.05. Con la herramienta BLASTN (http://www.blast.ncbi.nlm.nih.gov) se determinó el porcentaje de similitud de las secuencias obtenidas con respecto a las reportadas en la base de datos del Genbank.
2.7 Análisis de los resultados
La eficiencia de cada solución de floculación para aislar los huevos de T. canis desde suelo, se determinó en función de la concentración y la pureza del ADN extraído. Los datos obtenidos se sometieron, inicialmente a un análisis de varianza (ANOVA). Los análisis entre grupos fueron hechos con el test de comparaciones múltiples de Tukey, un valor de p < 0,05 fue considerado estadísticamente significativo. Todas las pruebas se realizaron con el paquete estadístico SPSS versión 21.0 para Windows (SPSS, Inc., Chicago).
3. Resultados
3.1 Aislamiento de huevos de Toxocara sp desde el suelo
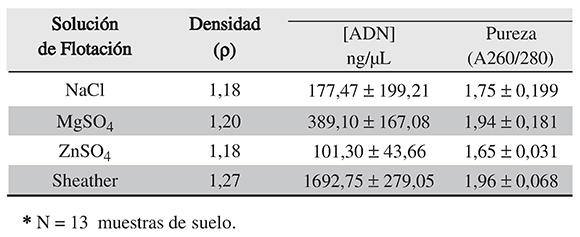
Los resultados indican que la solución modificada de Sheather (r= 1,27 g/mL) y la solución de MgCl2 (r= 1,20 g/mL) fueron las mejores para la separación de huevos de T. canis desde el suelo analizado, lo cual fue evidenciado por la concentración y pureza del ADN obtenido. El valor de la media de la concentración de ADN de las 13 muestras de suelo, incluidas en el estudio, se presenta en la Tabla 1.
Tabla 1. Concentración y pureza del ADN de huevos de parásitos recuperados del suelo.
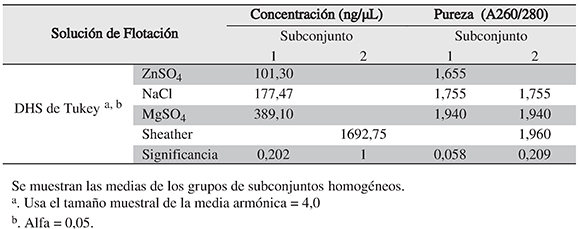
El análisis de varianza indica que existe diferencia estadísticamente significativa entre las concentraciones de ADN extraídas, sugiriendo que la solución de flotación influye en la recuperación de los huevos de parásitos desde el suelo (p < 0,05). La prueba de comparaciónmúltiple entre medias (test de Tukey) sugiere que las concentraciones de ADN obtenidas con la solución modificada de Sheather (r= 1,27 g/mL) son estadísticamente diferentes a lasobtenidas con las otras soluciones. En cuanto a la variable pureza del ADN, no se observó diferencia significativa entre las soluciones de flotación ensayadas (Tabla 2).
Tabla 2. Resultados del test de comparación de Tukey para la concentración y pureza del ADN
En este estudio sólo se visualizaron los huevos de Toxocara spp., en el suelo tratado con solución modificada de Sheather. Por microscopia, 5 de 13 muestras (38,5%) fueron positivas, lo que sugiere una mayor eficiencia de esta solución. El aislamiento de huevos y larvas del T. canis, desde muestras ambientales, es uno de los pasos fundamentales en la evaluación de la contaminación por geohelmintos de importancia zoonótica. La bibliografíareporta una gran variedad de metodologías que comparan técnicas de recuperación de loshuevos de Toxocara desde suelo. Sin embargo, los resultados que se describen son muy variables (Dada, 1979; Oge S. & Oge H. 2000). Actualmente se reconoce que existen muchos factores que influyen de manera directa en la tasa de recuperación de huevos de Toxocara. Algunos de los más relevantes son: el tipo de suelo, el tamizado de pre-tratamiento, el lavado y resuspensión de sedimentos, y la densidad específica de las soluciones de flotación (Dryden et al., 2005; Ruiz de Ybáñez et al, 2000; Santarém et al., 2009).
Varios estudios coinciden en que la solución de floculación de los huevos del parásito esun factor determinante en las evaluaciones de contaminación por geohelmintos en muestrasde campo. Ruiz de Ybañez y col., en 2000 (Ruiz de Ybáñez, 2000) describieron tasas de recuperación de T. canis entre 3,21% a 99,98 %, al emplear la solución modificada de Sheather (r entre 1,20 y 1,27 g/mL). Estos investigadores, y otros más, también describieron tasas menores de recuperación de huevos de Toxocara, usando soluciones de floculación compuestas por NaCl (r= 1,209 g/mL) y ZnSO4 (r= 1,09 a 1,27 g/mL) (Quinn, 1980; Santarém, 2010).
3.2 Amplificación (PCR-ITS-2) de T. canis
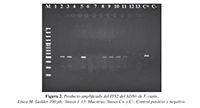
La reacción de PCR permitió confirmar la identidad del ADN extraído desde lasuspensión de huevos de Toxocara separados con la solución modificada de Sheather,obteniéndose amplificados del tamaño esperado (533 pb). Siete (53,84%) de las 13 muestrasde suelo recolectadas en el Parque Sagrado Corazón de Jesús de la ciudad de Barranquilla fueron positivas para T. canis (Figura 2).
Figura 2. Producto amplificado del ITS2 del ADNr de T. canis Linea M; Ladder 100 pb; líneas 1-13: Muestras; líneas C+ y C-: Control positivo y negativo
Se observó qye el porcentaje de muestras positivas por PCR fue mayor al obtenido en la evaluación microscopía (38,5%). Esta diferencia podría explicarse por la alta sensibilidad de la PCR, la cual es capaz de detectar hasta 2 parásitos por muestra (dato no mostrado). Adicionalmente, el resultado de la secuenciación de nucleótidos, de uno de los amplificados, mostró un porcentaje de similitud de 99% con el ITS2 del ADNr de T. canis (GenBank: AB110032.1) (Figura 3).
Figura 3. Alineamiento básico de la secuencia de nucleótidos del amplificado del ITS2 del ADNr de T. Canis
http://www.blast.ncbi.nlm.nih.gov
La contaminación del suelo por formas infectantes del nemátodo T. canis ha sido descrita en parques públicos de algunos países en Europa (Bojar & KÅapeÄ, 2012; Dado et al., 2012), Asia (Khademvatan, 2014; Fajutag & Paller, 2013) y América Latina (Sprenger et al., 2014; Romero et al., 2010; Armstrong et al., 2011; Iannacone, 2012). En la mayoría de estas investigaciones, la metodología usada para detección de T. canis involucró un paso inicial de aislamiento de los huevos por la técnica de flotación, seguido de identificación por microscopía con base a caracteres morfológicos y tamaño típico.
En Colombia, la contaminación con huevos de Toxocara y otros parásitos zoonóticos fue descrita en parques de la localidad de Suba, Bogotá (Polo, 2007) y en el municipio de Bucaramanga,Santander (Cala, 2010). En ambos estudios se empleó la técnica de flotación para el aislamiento de los huevos del Toxocara, seguido de identificación por microscopía, reportándoseporcentajes de positividad del 0,90% y 3,77%, respectivamente. Estos resultados podrían estar subestimando la frecuencia real de este parásito en el suelo de parques públicos, comolo sugiere el alto porcentaje de cachorros infectados con T. canis, reportados en Bogotá,durante 1987-1988 (43,6%) y en el año 2000 (66,7%) (Agudelo et al., 1990; Acero et al., 2001). Apesar de que la microscopíaes considerada la prueba de oro para la identificación de huevos de Toxocara spp en suelo, desde hace algunos años se están empleando técnicas alternativas más sensibles y específicascomo la PCR. Un estudio publicado recientemente por Khademvatana y colaboradores (2014), describe una mayor eficiencia de la técnica PCR-ITS-2 para la detección dehuevos de T. canis en muestras de suelo colectadas en plazas, calles, parques públicos, y vertederos de basura de la población de Ahvaz, en el suroeste de Irán. En este estudio los huevos de Toxocara fueron aislados por floculación con solución de NaNO3 (r= 1,3 g/mL)y el ADN usado para la PCR fue extraído con el estuche comercial QIAamp DNA Mini, previa digestión con proteinasa K [21]. Nuestro estudio presenta una estrategia similar, sin embargo, la extracción del ADN se realizó con un buffer de lisis, lo cual disminuiría los costos al aplicarse este procedimiento en estudios epidemiológicos, donde se procesa un gran volumen de muestras.
4 Conclusión
A pesar de que el tamaño de la muestra en el presente estudio fue bajo (N = 13), se observó que la estrategia de aislamiento de los huevos del parásito por floculación con solución modificada de Sheather y posterior amplificación del transcrito interno (ITS-2) del ADN ribosomal (ADNr) de T. canis (PCR-ITS-2), es una metodología eficiente para evaluar la contaminación de suelo por huevos de este nemátodo. Esta metodología podría aplicarse en estudios epidemiológicos que evalúen el riesgo de Toxocariasis en la población susceptible que acude a los parques públicos en Colombia.
Referencias
Acero, M., Muñoz, M., Flórez, A. S., y Nicholls, R. (2001). Seroprevalencia de anticuerpos contra Toxocara canis y factores de riesgo en niños, Ciudad Bolívar. Bogotá, D.C., 2000. Biomédica, 21, 256-63. [ Links ]
Agudelo, C., Villareal, E., Cáceres, E., López, C., Eljach, J., Ramírez, N. et al. (1990). Human and dogs Toxocara canis infection in a poorneighborhood in Bogota. Mem Inst Oswaldo Cruz, 85(1), 75-8. [ Links ]
Armstrong, A., Oberg, C., y Orellana, J. (2011). Presencia de huevos de parásitos con potencial zoonótico en parques y plazas públicas de la ciudad de Temuco, Región de La Araucanía, Chile. Archivos de medicina veterinaria, 43, 127-134. [ Links ]
Bojar, H., & Kłapeć, T. (2012) Contamination of soil with eggs of geohelminths in recreational areas in the Lublin region of Poland. Annals of Agricultural and Environmental Medicine, 19(2), 267-270. [ Links ]
Cala, F., Duran, L. F., y Gómez, C. (2010). Determinación de la presencia de estados inmaduros (huevos, larvas) de parásitos nematodos zoonóticos (Toxocara spp., Uncinaria spp. y Strongyloides spp.) en los parques públicos urbanos del municipio de Bucaramanga, Santander. Revista Spei Domus, 6, 27-31. [ Links ]
Dada, O. (1979). A new technique for the recovery of Toxocara eggs from soil. Journal Helminthology, 53, 141-144. [ Links ]
Dado, D., Izquierdo, F., Vera, O., Montoya, A., Mateo, M., & Fenoy, S. (2012). Detection of zoonotic intestinal parasites in public parks of Spain. Potentialepidemiological role of microsporidia. Zoonoses Public Health, 59(1), 23-8. [ Links ]
Despommier, D. (2003). Toxocariasis: clinical aspects epidemiology, medical ecology, and molecular aspects. Clinical Microbiology Journal, 16, 265-272. [ Links ]
Dryden, M., Payne, P., Ridley, R., & Smith, V. (2005) Comparison of common fecal flotation techniques for the recovery of parasite eggs and oocysts. Veterinary Therapeutics, 6(1), 1-17. [ Links ]
Fahrion, A., Staebler, S., & Deplazes, P. (2008). Patent Toxocara canis infections in previously exposed and in helminth-free dogs after infection with low numbers of embryonated eggs. Veterinary Parasitology, 152, 108-115. [ Links ]
Fajutag, A., & Paller, V. (2013). Toxocara egg soil contamination and itsseroprevalence among public school children in Los Baños, Laguna, Philippines. The Southeast Asian Journal of Tropical Medicine and Public Health, 44(4), 551-560. [ Links ]
Glickman, T., & Shofer, S. (1987) Zoonotic visceral and ocular larva migrans. Veterinary Clinics of North America: Small Animal Practice, 17(1), 39-53. [ Links ]
Glickman, T., Schantz, M., & Cypess, R. (1979) Canine and human toxocariasis: review of transmission, pathogenesis and clinical disease. Journal Am Veterinary Medic Association, 175, 1265-1269. [ Links ]
Good, B. (2004). Ocular toxocariasis in school children. Clinical Infectious Disease, 39, 173-178. [ Links ]
Iannacone, J., Alvariño, L., y Cárdenas, J. (2012). Contaminación de los suelos con huevos de Toxocara canis en parques públicos de Santiago de Surco, Lima, Perú, 2007-2008. Neotropical Helminthology, 6, 97- 108. [ Links ]
Jacobs, D., Zhu, X., Gasser, R., & Chilton, N. (1997) PCR-based methods for identification of potentially zoonotic ascaridoid parasites of the dog fox and cat. Acta Tropica, 68, 191-200. [ Links ]
Khademvatan, S., Abdizadeh, R., & Tavalla, M. (2014) Molecular characterization of Toxocara spp. from soil of public areas in Ahvaz southwestern Iran. Acta Tropica, 135(1), 50-4. [ Links ]
Krämer, F., Vollrath, T., Schnieder, T., & Epe, C. (2002). Improved detection of endoparasite DNA in soil sample PCR by the use of anti-inhibitory substances. Veterinary Parasitology, 108(3), 217-226. [ Links ]
Macpherson, CN. (2013). The epidemiology and public health importance of toxocariasis: a zoonosis of global importance. International Journal for Parasitology, 43, 999-1008. [ Links ]
Mikaeili, F., Kia, E., Sharbatkhori, M., Sharifdini, M., Jalalizand, N., Heidari, Z. et al. (2013) Comparison of six simple methods for extracting ribosomal and mitochondrial DNA from Toxocara and Toxascarisnematodes. Experimental Parasitology, 134, 155-159. [ Links ]
Oge, S., & Oge, H. (2000). Prevalence of Toxocara spp. eggs in the soil of public parks in Ankara, Turkey. Dtsch Tierarztl Wochenschr, 92, 75-79. [ Links ]
Polo, L., Córtes, J., Villanil, L., & Prieto, E. (2007). Contaminación de los parques públicos de la localidad de Suba, Bogotá con nemátodos zoonóticos. Revista de Salud Pública, 9, 550-557. [ Links ]
Quinn, R., Smith, H., Bruce, G., & Girdwood, A. (1980). Studies on the incidence of Toxocara and Toxascaris spp. ova in the environment. A comparison of flotation procedures for recovering Toxocara spp. ova from soil. Journal Helminthology, 84, 83-89. [ Links ]
Romero, C., Mendoza, G., Bustamante, L., Yánez, S., & Ramírez, N. (2010). Contamination and viability of Toxocara sp. in feces collected from public parks, streets and dogs in Tejepilco at the subhumid tropic of Mexico. Journal of Animal and Veterinary Advances, 9, 2996-2999. [ Links ]
Ruiz de Ybáñez, R., Garijo, M., Goyena, M., & Alonso, D. (2000). Improvedmethods for recovering eggs of Toxocara canis from soil. Journal Helminthology, 74, 349-353. [ Links ]
Santarém, V., Felix, A., Rodenas, R., Assis, A., y da Silva, A. (2010). Contaminação por ovos de Toxocara spp. em praças públicas das regiões central e periurbana de Mirante do Paranapanema, São Paulo, Brasil. Veterinária e Zootecnia, 17(1), 47-53. [ Links ]
Santarém, V., Magoti, L., & Sichieri, T. (2009) Influence of variables on centrifugeflotation technique for recovery of Toxocara canis eggs from soil. Revista do Institutode Medicina Tropical de São Paulo, 51(3), 163-167. [ Links ]
Sprenger, L. K., Green, K. T., & Molento, M. B. (2014). Geohelminth contamination ofpublic areas and epidemiological risk factors in Curitiba, Brazil. Revista Brasileira de Parasitologia Veterinária, 23, 69-73. [ Links ]
Uga, S., Matsumura, T., Aoki, N., & Kataoka, N. (1989). Prevalence of Toxocara species eggs in the sandpits of public parks in Hyogo Prefecture, Japan. Japanese Journal of Parasitology, 38, 280-284. [ Links ]
Uga, S., Matsuo, J., Kimura, D., Rai, K., Koshino, Y., & Igarashi, K. (2000). Differentiation of T. canis and T. cati eggs by light and scanning electron microscopy. Veterinary Parasitology, 92, 287-294. [ Links ]

Revista de Ciencias por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento 4.0.