Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Ciencias
Print version ISSN 0121-1935
rev. cienc. vol.19 no.1 Cali Jan./June 2015
Influencia de campos magnétivos en el crecimiento de E. coli y S. cerevisiae y la capacidad de solubilizar fósforo en Pseudomonas sp y Bacillus sp de uso industrial
Magnetic Field Influence in E. coli and S. cerevisiae Growth and the Ability of Pseudomoanas sp and Bacillus sp to be Phosphorus Solubilizers for Industrial Usage
Sandra Johana Hernández Jiménez
Facultad de Tecnologías, Universidad Tecnológica de Pereira, Pereira - Colombia
E-mail: sajohernandez@utp.edu.co
Estefanía Lucero Domínguez Toro
Facultad de Tecnologías, Universidad Tecnológica de Pereira, Pereira - Colombia
E-mail: eldominguez@utp.edu.co
Luis Gonzaga Gutiérrez
Facultad de Ciencias Ambientales, Universidad Tecnológica de Pereira, Pereira - Colombia
E-mail: luisgon@utp.edu.co
Recived: October 31, 2014
Accepted: March 19, 2015
Resumen
La estimulación magnética de microorganismos ha sido de interés investigativo debido a sus aplicaciones industriales. Además, el crecimiento celular es el parámetro más importante propiedades de los microorganismos, tales como el metabolismo y la producción de sustancias de Escherichia coli, el microorganismo más estudiado por habitar en ambientes cotidianos para el ser humano,y Saccharomyces cerevisiae con aplicaciones en la industria alimenticia. Por otra parte, los microorganismos solubilizadores de fosfatos son de gran importancia para la industria agrícola. Gracias a ellos las plantas pueden asimilar el fósforo que no logran procesar por símismas, ayudando asía su crecimiento. En esta revisión se profundiza en Pseudomonas sp y Bacillus sp por ser buenossolubilizadores de fósforo y por su capacidad para degradar los sustratos. De ahí, que sea importante recopilar la información científica disponible, donde se describen los mecanismos por los cuales las microbios se reproducen y/o solubilizan fósforo, y la respuesta de Escherichia coli, Saccharomyces cerevisiae, Pseudomonas sp y Bacillus sp, a campos magnéticos con densidades variables.
Palabras clave: Crecimiento celular, solubilizadores de fosfatos, Escherichia coli, Saccharomyces cerevisiae, Pseudomonas sp y Bacillus sp.
Abstract
Magnetic stimulation of microorganisms has been investigated because of its industrial applications. Furthermore, the cellular growth is the most important parameter in the microbiological microorganisms, such as the metabolism and the production of substances of scientific and Escherichia coli is described, for being the most studied micro-organism due to living in daily human habitats, and Saccharomyces cerevisiae for its applications in the food processing industry. Moreover, microorganisms solubilizers of phosphates are really important for the agricultural industry. They make possible for plants to assimilate the phosphorus that they cannot process by themselves, helping them grow. In this review we will deepen on Pseudomonas sp and Bacillus sp for being good solubilizers of phosphorus and for its aptitude to degrade the substratum. Hence, it is important to compile the and solubilizing phosphorus, and the response of Escherichia coli, Saccharomyces cerevisiae, Pseudomonas sp and Bacillus sp.
Keywords: Cellular growth, solubilizers of phosphorus, Escherichia coli, Saccharomyces cerevisiae, Pseudomonas sp y Bacillus sp.
1. Introducción
1.1 Estimulación Magnética y Crecimiento Microbiano
Escherichia coli
Es el microorganismo más estudiado por el ser humano. Su descubrimiento se remonta a 1885, gracias al pediatra Theodor Escherich (1857-1911) quien aisló la bacteria de las heces de uno de sus pacientes (Johnson, 2001). Se reproduce con facilidad en ambientes cotidianos para el hombre y animales tales como tierra, agua y plantas, ya que, su temperatura óptima de crecimiento se encuentra en 37ºC (Allauca y Villacres, 2005), lo que la hace pertenecer al grupo de los mesófilos. Dicha característica vuelve a este bacilo un ser habitual en los intestinos grueso y delgado, por ello es el microorganismo más relacionado con enfermedades gastrointestinales (Koneman y Allen, 2008).
Se identifica por ser miembro de la familia enterobacteriaceae. Es un bacilo gram negativo, aerobio facultativo que mide 1 x 2 mm; goza de una sola cadena en espiral de ADN, se mueve mediante flagelos perítricos, no produce esporas y forma fimbrias y pilis (Sánchez & Trejo, 2006). E. coli es fermentadora de lactosa y a partir de glucosa fermenta manitol; además es positiva para indol y descarboxilasa de lisina. También, es motivo de investigación su resistencia a antimicrobianos y la capacidad de producir toxinas (Romero, 2007).
En lo referente a la estimulación magnética E. coli ha sido objeto de varios estudios, entre ellos se ha observado la respuesta del crecimiento del bacilo. Según Shin-ichiro et al. (2002) y Zhang et al. (2002), E. coli fue expuesta a campos magnéticos de intensidad variable, durante el periodo de crecimiento exponencial resultando en muerte bacterial al presentarsedisminución de células, en comparación con el control, por lo que, los investigadoressugieren que la estimulación ocasiona cambios en el metabolismo de la célula y varia el pH del medio Luria Bertani a básico, porque E. coli toma los aminoácidos y los transforma en sustancias como el amoniaco. Además, al afectar la proliferación del microorganismo también existe interferencia en la actividad oxido-reductiva y esa variación se incrementa a medida que aumenta el tiempo de exposición (Strasák, 2002).
Asimismo, mediante un ensayo, Fojt et al. (2004) comparan los efectos de la estimulación magnética con la viabilidad del bacilo, mediante conteo de Unidades Formadoras de Colonias(UFC). En esta ocasión E. coli fue expuesta al campo magnético de 10 mT y 30 minutosen la fase logarítmica, encontrando que el número de unidades disminuye, en equivalencia con el control, de manera exponencial al aumentar dos variables: tiempo de exposición y densidad de flujo magnético. La causa de muerte bacterial no es clara, pero se presume, se debe a posibles cambios biológicos como es la alteración en el transporte de iones y formación de radicales libres producidos por la estimulación electromagnética. Además, hallaron que dicho efecto empieza desde el momento en que se enciende el campo magnético.
De la misma forma, Wenjin et al. (2009) encontraron como el número de UFC se ve afectado negativamente cuando incrementa el tiempo de estimulación electromagnética y aumenta la temperatura a la que es realizado este ensayo (25 a 40 °C), produciéndose daño en la superficie de las células implicadas. Sin embargo, una vez E. coli ha logrado adaptarseal ambiente hostil, empieza a disminuir la cantidad de bacterias inhibidas. Según Filipicet al. (2012) E. coli responde dependiendo la densidad de flujo magnético, por ejemplo, a 17 mT se afectó el crecimiento de manera negativa, pero a 5 y 50 mT la influencia fue menos pronunciada. Aun así, la estimulación magnética aumentó los niveles de ATP y la actividad enzimática, que se presume es manifestada al luchar E. coli por adaptarse al entorno, porla presencia del campo magnético.
En otro caso, Bajpai et al. (2014) demostraron como utilizar la estimulación magnética añadiendo un sustrato con propiedades de magnetización, la cual afecta el crecimiento de la población bacteriana, pues los resultados revelaron inhibición en un 83 % al pasar 4 h de exposición. No obstante, confirmaron que sin implementar el sustrato también se influye negativamente en la propagación de E. coli porque causa daño en su membrana desintegrándola y produciendo liberación de material intracelular (Bajpai et al., 2012). Asimismo, según Kamel et al. (2013), a 40, 80, 120 y 160 mT se produce disminución de células viables y variaciones en la sensibilidad a ciertos antibióticos.
Debido a los resultados, Belyaeva (2011) afirmó que tales efectos dependen directamente de las variables físicas y biológicas que forman parte del entorno que envuelve almicroorganismo al ser estimulado magnéticamente. Por tal razón, E. coli disminuye la tasade crecimiento cuando es tratada a 2 mT y con tiempos de exposición de 4,6 y 8 horas, y pasadas 24 horas el número de células bacterianas aumenta, por lo que, los investigadores opinan que el microorganismo posee capacidad de adaptarse al campo magnético (Segatore 2012).
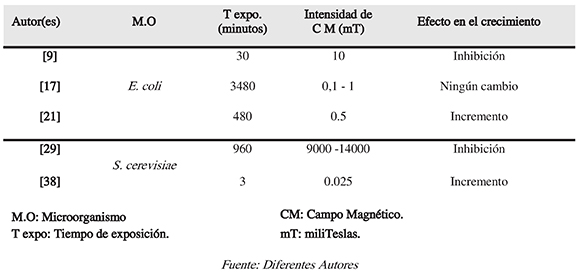
Por otro lado, según la densidad de flujo magnético y el tiempo de exposición, será el efecto en las células expuestas (Tabla 1). Muestra de ello, es que en algunos casos E. coli sometida a este tipo de estimulación electromagnética no ha sufrido ningún tipo de transformación en su capacidad de multiplicarse como lo afirman Del Re et al. (2003). Y Según Esmekaya et al. (2013), a 2 mT y 24 horas la exposición al campo no produce cambio en la viabilidad de las células, pero síafecta su morfología al formarse poros y desintegrar la membrana.
Por el contrario, Nawrotek et al. (2014) y Fijałkowski et al. (2014) encontraron que la exposición al campo magnético incrementa la reproducción celular de E. coli. Del mismo modo, un estudio realizado por Nascimento et al. (2003) mostró que la magneto-estimulaciónpuede influir positivamente la multiplicación en presencia de glucosa, al incrementar la entrada del azúcar por la membrana celular, disminuir la fase estacionaria y aumentar el tiempo que E. coli permanece en periodo de crecimiento logarítmico.
Es evidente que los resultados cambian dependiendo del campo magnético aplicado. Por tal razón, Babushkina et al. (2005) aseguran que utilizar frecuencias bajas produceincremento de la proliferación bacteriana. También, Gaafar et al. (2006) concluyeron que el tiempo de exposición hace variar drásticamente el crecimiento de este bacilo, por lo que, depende en mucho del tiempo como factor clave. Por ello, Rodríguez et al. (2006), hallaron modificación en el crecimiento bacterial a 0,1 T y 6,5 horas, al manifestarse incremento de 100 % comparándolo con el control no estimulado.
Saccharomyces cerevisiaeEl género Saccharomyces fue expuesto por primera vez en 1838 por Meyer. Saccharomyces cerevisiae es eucariota, anaerobia facultativa, la forma de su célula eselipsoidal de aproximadamente 5 mm de diámetro, posee una temperatura optima decrecimiento entre 37-40 ºC y se reproduce por gemación multilateral, más o menos cada 90 minutos. Además, la levadura puede propagarse como haploide o diploide y sufrir mitosis (Dickinson & Schweizer, 2004). Por otra parte, las levaduras han sido de interés investigativo porque son eucariotas unicelulares, fáciles de manipular y con capacidad de reproducirse de manera rápida. Además, S. cerevisiae es extensamente estudiada por su uso en alimentos, entre ellos vino y pan, por lo que se considerada muy útil en la elaboración de diferentes tiposde víveres que enriquecen las mesas de muchos hogares (Blackburn, 2006). Esto es posible, debido a que son utilizadas en sustancias de desecho que provienen de la fermentación alcohólica, tales como etanol y dióxido de carbono, y contribuyen en la producción de comestibles (Tortora et al., 2007).
La estimulación magnética de S. cerevisiae ha mostrado resultados variables. Novák et al. (2007) y Otabe et al. (2009), encontraron que el campo magnético además de disminuir el número de UFC, retarda el crecimiento de esta levadura cuando elimina parte de ella, mientras otras células, se adaptan al ambiente adverso en el que se encuentran. Por ello, Iwasaka et al. (2004) afirman que la exposición al campo magnético tiene efecto bactericida. También, Markkanen et al. (2001) hallan como la radiación UV, junto con este tipo deestimulación electromagnética, tiene mayor capacidad de disminuir la cantidad de células presentes de S. cerevisiae, comparándolo con la falta de electro-estimulación.
Por otro lado, según Egami et al. (2010) el efecto depende del tiempo y la intensidad delcampo magnético suministrado. En vista de ello, Anton-Leberre et al. (2010) afirman que lainteracción con el campo magnético a 16 T y 8 horas, no produce cambios en la forma en que se propaga S. cerevisiae o su sistema biológico. Al igual, Ruiz et al. (2004) hallan que el crecimiento de S. cerevisiae puede ejecutarse sin ninguna variación. Además, El-Gaddar et al. (2013) y Ruiz et al. (2010) concordaron que las células expuestas siguen su ciclo natural.
Motta et al. (2001) observaron a S. cerevisiae antes, durante y después de la estimulación magnética, concluyendo que existe un ligero incremento en la proliferación de esta levaduraresultando positivo para su propagación. También, han implementado densidades de campodiferentes, resultando que a 20 mG y 30 segundos de exposición magnética la concentracióncelular aumento 30% con respecto al control (Zapata et al., 2002). Según Zapata et al. (2005), en un estudiodesarrollado en Medellín, Colombia, hallaron que el cultivo de S. cerevisiae puede superar elefecto inhibitorio del campo magnético y aprovechar mejor el sustrato (miel virgen de caña),por lo que, fue observado un aumento en el volumen celular en un 14%, en comparación con el control, con menor consumo de miel virgen.
Asimismo, mostrando como este tipo de estimulación magnética intensifica el número de individuos, a 25 mT se obtuvo aumento en el crecimiento de S. cerevisiae entre 8.7 a 43.1 %, encontrando que el volumen celular depende del tiempo de exposición al campo (Oliveira et al., 2010), y con este incremento de la población, mejorar la producción de etanol (Deutmeyer et al., 2011). En la siguiente tabla se describe la respuesta de S. cerevisiae y E. coli al ser sometida a diferentes campos magnéticos:
Tabla 1. Resumen de algunos parámetros utilizados para estimular magnéticamente E. coli y S. cerevisiae
Fuente: Diferentes Autores
Estimulación magnética y capacidad de solubilizar fósforo
Existen bacterias que poseen la capacidad de solubilizar compuestos ricos en fósforo. Estos organismos toman este elemento que no está disponible para las plantas y mediante su actividad fisiológica secretan ácidos orgánicos y enzimas denominadas fosfatasas, lo queproduce liberación del fósforo para aprovecharlo por las plantas. Además, estas bacterias tienen la facultad de promover el crecimiento vegetal a través de la síntesis de hormonas reguladoras del crecimiento, como el ácido indolacético, asícomo de inhibir el crecimiento e incidencia de patógenos de hábito radical, mediante la secreción de sustancias de tipo antibióticas. El estudio sobre este fenómeno ha permitido entender cómo las bacteriaspueden superar la estrategia terapéutica mediante intercambio genético, generando asíun aumento en la capacidad de solubilizar fósforo (Sánchez & Trejo, 2006).
Pseudomonas sp
Pseudomonas sp. es un Bacilo Gram negativo, aerobio, no formador de esporas. Puedepresentar de 1.5 a 5 µm de largo y un diámetro de 0.5 a 1 µm. Las especies de este género son móviles, debido a las presencia de 1 o más flagelos polares. Es oxidasa y catalasa positiva, no fermentadores de lactosa. La mayoría de especies del género, no crecen bajo condiciones ácidas (pH 4.5 o menor). El género Pseudomonas es bien conocido por su versatilidad metabólica y plasticidad genética. Las especies de Pseudomonas, en general,crecen rápidamente y presentan habilidad para metabolizar una gran variedad de sustratos (Ruiz, 2007).
En lo referente a estimulación magnética, investigadores pasaron a Pseudomonas sp. por imanes para estimulación magnética de microorganismos. Se inoculó una muestra de bacterias tratada en el intervalo de 0.01-0.16 T junto a antígenos de B. cereus y P. aeruginosa.El incremento de la proliferación microbiana ha permitido proponer su uso como ayudante inmunológico para la obtención de sueros policlonales antibacterianos y sugerir su empleo en otros inmunobiológicos (Martínezet al., 2004).
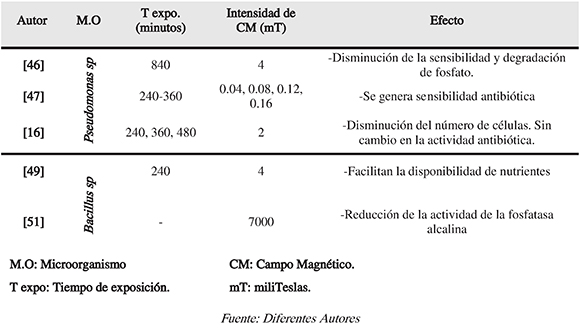
Según Anaya et al. (2011), al someter Pseudomonas sp. a campos magnéticos de 0.015, 0.03 y 0.06mTy diferentes tiempos de exposición, se evidencia un aumento en el crecimiento bacteriano. Ibraheim et al. (2013) concluyeron que al someter P. aeruginosa a un campo magnético controlado de 4 mT y 50 Hz hubo una disminución en la sensibilidad de las células expuestas a los campos magnéticos. Los resultados indican que la viabilidad de las células tratadas magnéticamente durante 14 horas disminuyó en comparación con las células no expuestas. Se evidenció un incremento en la sensibilidad de las células estudiadas a norfloxacina y la ciprofloxacina. También las células estimuladas a 14 h se hicieron más resistentes a estos antibióticos. Todo esto indica que hay efectos del campo electromagnético utilizado en la acción del medicamento sobre la célula bacteriana a través de la inhibición de la síntesis de proteínas, síntesis de la pared celular, la transcripción de ARN y la replicación de ADN, la síntesis de proteínas y con ello, aumento en la solubilización de fósforo (Tabla 2).
Tabla 2. Resumen de algunos parámetros utilizados para estimular magnéticamente Pseudomonas sp y Bacillus sp
Por otra parte, la fuerza magnética alta en P. aeruginosa generó sensibilidad a losantibióticos durante un corto período de tiempo (4-6 horas) y aumentó su resistencia al mismoantibiótico a largo plazo de exposición (18-20 h) mostrando, por lo tanto, efecto positivo en la capacidad del microorganismo de degradar fósforo insoluble. Además, las enzimas bacterianas como TDA (Triptófano desaminasa), GLU (glutamato), ARA (angiotensina), se efectúan por el campo magnético (Kamel et al., 2013).
Segatore et al. (2012) observaron que los efectos de la exposición a campos magnéticos de baja frecuencia (2 mT; 50 Hz) sobre la tasa de crecimiento y la sensibilidad a losantibióticos de P. aeruginosa influenció la tasa de la cepa cuando se incubó en presencia de concentraciones subinhibitorias de amikacina. En particular, a las 4, 6, y 8 h de incubación el número de células disminuyó significativamente en las bacterias expuestas a campos electromagnéticos, y de la misma manera la solubilización de fósforo. Además, a las 24 h de incubación, el porcentaje de células de Pseudomonas aureginosa aumentó en los grupos tratados con respecto al control.
Bacillus sp
El género Bacillus pertenece a la familia Bacilliaceae, e incluye más de 60 especies de bacilos. Son gram positivos, anaerobios o aerobios facultativos, quimioheterotrofos, formadores de endosporas, móviles, rodeados de flagelos períticos y catalasa positiva.El tamaño de las células bacterianas varía entre 0,5- 2,5 µm x 1,2-10 µm. Se encuentra usualmente en plantas y suelos donde desempeña un papel importante en ciclo del carbono y el nitrógeno (Cuervo, 2010).
Estimular magnéticamente Bacillus sp facilitó la disponibilidad de los nutrientes.Algunas especies del género son capaces de solubilizar el fósforo encontrado encompuestos no asequibles, mejorando por ende, la concentración fosfórica de los suelos. Para la aplicación de esta tecnología, una muestra de Bacillus sp es sometida al campo electromagnético de 4 mT con frecuencia de 25 Hz durante 2 h (Zúñiga et al., 2011) (Tabla 2).
Según Nakamura et al. (1997), se desarrolló un biosistema implementando un imán superconductor, que puede proporcionar campos magnéticos de 0,5-7 T, donde las reacciones biológicas se llevan a cabo bajo condiciones de temperatura controlada. El crecimiento aeróbico de B. subtilis se investigó bajo campos magnéticos homogéneos y no homogéneos.
En la fase estacionaria, el número de células en un campo magnético no homogéneo fue aproximadamente dos veces mayor que la referencia no estimulada, lo que indica que la disminución en el número de células se produjo por el campo magnético de alta densidad.La inhibición de la formación de esporas a partir de las células vegetativas también se observó en un campo magnético, que se refleja en la reducción de la actividad de la fosfatasa alcalina. Transformada genéticamente, B. subtilis produce una mayor concentración de un antibiótico lipopéptido surfactina, y por lo tanto aumenta la capacidad de degradar fosfatoen la fase estacionaria en un campo magnético no homogéneo, debido al mayor número de células alteradas por la magneto-estimulación.
Por otra parte, Gu et al. [49] demostraron que al someter Bacillus subtilis a densidades de campos magnéticos altos (5.2 -6.1T) y frecuencia de 0 -0.03 Hz se inhibió completamenteel crecimiento ocasionando la muerte y con ello afectando la acción de B. subtilis sobre el fósforo. De la misma forma, estudios realizados por Raichenko et al. (2012) dieron comoresultado, en todos los casos, un retardo en el crecimiento en Bacillus cereus durante el período de 1 - 2 días, seguido de la restauración del crecimiento de la población al someterlosa un campo magnético de 30 - 50mT durante 2 a 15 minutos.
Según Jin et al. (2009) B. subtilis fue expuesto a campos magnéticos de 0,085 a 0,092T durante 12h en agar nutritivo, generando resultados diferentes en cada etapa. El cultivo se comparó con el grupo control del campo geomagnético normal. El valor experimentalde densidad óptica de este aerobio fue significativamente más alto que el del control de 3h a 9h. Sin embargo, después de 11 h, no hubo diferencia notable con respecto a los valores de densidad óptica entre los dos grupos. Los resultados mostraron que los camposferromagnéticos aumentaron significativamente el contenido de oxígeno disuelto en agarnutritivo. En la siguiente tabla se describe la respuesta de de Pseudomonas sp y Bacillus sp al ser sometida a diferentes campos magnéticos (Ver Tabla 2).
3. Discusión general
La magneto-estimulación de E.coli y S. cerevisiae son ejemplos de la influencia que tiene el campo magnético en el crecimiento de las bacterias. El tiempo que permanece el microorganismo bajo el magnetismo, la temperatura y la intensidad de este, son factores importantes, pues de ellos dependerá en gran medida el efecto del campo magnético sobre las células (Tabla 1). Cuando el campo magnético produce muerte bacterial, siempre va acompañado de cambios en el entorno o la estructura del microorganismo produciendotales efectos. Después de la estimulación magnética, E. coli presenta algunas diferenciascomo: alteración en el transporte de iones debido a que cambia la velocidad de reproduccióncelular, la variación del metabolismo lo que ocasiona en el medio de cultivo aumento del pH a básico, afectando el crecimiento y con ello, la desintegración de la pared celular, produciendo liberación del material interno porque se forman poros que permiten la salida del mismo.
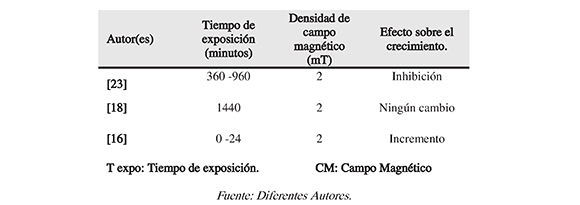
Por otra parte, en el caso de S. cerevisae se destacan algunos aspectos con respecto asu respuesta a la estimulación electromagnética. La levadura sometida al campo magnético sufrió inhibición del crecimiento celular, aunque tiene la capacidad de adaptarse al ambientecon magnetismo. También es notable que utilizar radiación UV y electromagnetismo para inhibir la proliferación de microorganismos es una alternativa viable, pues presenta resultados más eficaces. Al igual que E.coli, la levadura S. cerevisiae puede incrementarel volumen celular tras ser sometida a campos magnéticos, notándose aumentos de 8.7 hasta 43.1% lo que es de gran utilidad en la industria alimentaria y en la producción de etanol, pues se conoce a este organismo unicelular como ayudante en la fabricación de diferentes productos. La Tabla 3 refleja la dependencia del crecimiento con otras variables. Aunque en los tres casos E.coli fue sometida a 2 mT, el tiempo de exposición electromagnética fue diferente para cada estimulación, afectado el crecimiento de forma distinta.
Tabla 3. E.coli sometida a 2 mT
Por otro lado, el fósforo soluble es un elemento esencial para las plantas ya que restringela producción de los cultivos, por ello, el suelo se vale del ciclo del P para recircularel nutriente. Existen bacterias solubilizadoras de fosfatos que tienen la capacidad deproducir sustancias antibióticas, por lo tanto esas propiedades están relacionadas. Cuando Pseudomonas sp es sometida a la estimulación magnética, incrementa su resistencia a los antibióticos, concluyendo que su capacidad de solubilizar fósforo aumenta. También se presenta el caso contrario, disminución de la oposición al agente, notando que todos los resultados van ligados al tiempo y la intensidad de campo magnético suministrado (Tabla 2).
La exposición magnética de colonias del género Bacillus sp. ha mostrado el doble de crecimiento comparándolo con el microorganismo no estimulado, produciendo mayor concentración de antibióticos, y en consecuencia, superior capacidad de solubilizar el fósforopara ser asimilado por las plantas, revelando que el campo magnético altera esta propiedad en Bacillus sp. Muestra de ello es que la magneto-estimulación produce que el bacilo tenga una fase de muerte más lenta, aunque inhibe la formación de endosporas.
En la industria es posible aprovechar la estimulación magnética de microorganismos. Implementarlo en el sector alimenticio es viable debido a que produce inhibición celular, por lo que los microorganismos no contaminaran los alimentos. Además, utilizarlo para esterilizar artículos que no pueden ser sometidos a altas temperaturas ahorraría parte del dinero invertido en utensilios microbiológicos desechables u otros elementos que deben mantenerse inocuos. Otras ventajas de la técnica es que disminuye el impacto negativo de los productos químicos en el medio ambiente, pues los agentes tóxicos serán utilizados en menor medida al ser remplazados por la electro-estimulación; también los microorganismosestimulados pueden ayudar a la absorción de nutrientes de las plantas para la agroindustria.
Agradecimientos
Al Profesor Fernando Areiza de la Universidad Tecnológica de Pereira, quien fue el autor de la idea original, la cual se convirtió en monografía.
Referencias
Allauca, V., y Villacres, E. (2005). Desarrollo de la tecnología de elaboración de chochogerminado fresco para aumentar el valor nutritivo de grano. Riobamba, Ecuador: INIAP. [ Links ]
Anaya, M., Guzmán, T. M., y Acea, C. M. (2011). El campo magnético aplicado a la industria alimentaria. Buenos Aires, Argentina: Publitec. [ Links ]
Anton-Leberre, V., Haanappel, E., Marsaud, N., Trouilh, L., Benbadis, L., Boucherie, H. et al. (2010). Exposure to high static or pulsed magneticfields does not affect cellular processes in the yeast Saccharomyces cerevisiae. Bioelectromagnetics, 31, 28-38. [ Links ]
Babushkina, I.V., Borodulin, V. B., Shmetkova, N. A., Morrison, V. V., Usanov, A. D., Skripal, A. V., & Usanov, D. (2005). The Influence of Alternating Magnetic Field on Escherichia coli Bacterial Cells. Pharmaceutical Chemistry Journal, 39, 398-400. [ Links ]
Bajpai, I., Balani, K., & Basu, B. (2014). Synergistic effect of static magnetic field andHA-Fe3 O4 magnetic composites on viability of S. aureus and E. coli bacteria. Journal of biomedical materials research: Part B, Applied biomaterials, 102, 524- 532. [ Links ]
Bajpai, I., Saha, N., & Basu, B. (2012). Moderate intensity static magnetic field has bactericidal effect on E. coli and S. epidermidis on sintered hydroxyapatite. Journal of Biomedical Materials Research. Part B, Applied Biomaterials, 100, 1206- 1217. [ Links ]
Belyaeva, I. (2011) Toxicity and SOS-response to ELF magnetic fields and nalidixic acid in E. coli cells. Mutation Research, 722, 56-61. [ Links ]
Blackburn, C. (2006). Food Spoilage Microorganisms. Abington, USA: Woodhead Publishing. [ Links ]
Cuervo, J. P. (2010). Aislamiento y Caracterización de Bacillus spp como FijadoresBiológicos de Nitrógeno y Solubilizadores de Fosfatos en Dos Muestras deBiofertilizantes Comerciales. Bogotá. Colombia: Pontificia Universidad Javeriana. [ Links ]
Del-Re, B., Garoia, F., Mesirca, P., Agostini, C., Bersani, F., & Giorgi, G. (2003). Extremely low frequency magnetic fields affect transposition activity in Escherichia coli. Radiat Environ Biophys, 42, 113-118. [ Links ]
Deutmeyer, A., Raman, R., Murphy, P., & Pandey, S. (2011). Effect of magnetic field on the fermentation kinetics of Saccharomyces cerevisiae. Advances in Bioscience and Biotechnology, 2, 207-213. [ Links ]
Dickinson, J. R., & Schweizer, M. (2004). Metabolism and Molecular Physiology of Saccharomyces Cerevisiae, (ed. 2). Philadelphia, USA: Grupo Taylor & Francis. [ Links ]
Egami, S., Naruse, Y., & Watarai, H. (2010). Effect of static magnetic fields on the budding of yeast cells. Bioelectromagnetics, 31, 622 -629. [ Links ]
El-Gaddar, A., Frénéa-Robin, M., Voyer, D., Aka, H., Haddour, N., & Krähenbühl, L. (2013). Assessment of 0.5 T Static Field Exposure Effect on Yeast and HEK Cells Using Electrorotation. Biophysical Journal, 104. 1805-1811. [ Links ]
Esmekaya, MA., Acar, SI., Kiran, F., Canseven, AG., Osmanagaoglu, O., & Seyhan, N. (2013). Effects of ELF Magnetic Field in Combination with Iron (III) Chloride (FeCl3) on Cellular Growth and Surface Morphology of Escherichia coli (E. coli). Appl Biochem Biotechnol, 169, 2341-2349. [ Links ]
Fijałkowski, K., Nawrotek, P., Struk, M., Kordas, M., & Rakoczy, R. (2014). Effectsof rotating magnetic field exposure on the functional parameters of different species of bacteria. Electromagn Biol Med, 1 -8. [ Links ]
Filipic, J., Kraigher, B., Tepus, B., Kokol, V., & Mandic-Mulec, I. (2012) Effects oflow-density static magnetic fields on the growth and activities of wastewater bacteriaEscherichia coli and Pseudomonas putida. Bioresource Technology, 120, 225-232. [ Links ]
Fojt, L., Strasák, L., Vetterl, V., & Smarda, J. (2004) Comparison of the low-frequency magnetic field effects on bacteria Escherichia coli, Leclercia adecarboxylata and Staphylococcus aureus. Bioelectrochemestry, 63, 337- 371. [ Links ]
Gaafar, E. A., Hanafy, M. S., Tohamy, E. Y., & Ibrahim, M. H. (2006). Stimulation and control of E.coli by using an extremely low frequency magnetic field. Romanian J. Biophys, 16, 283-296. [ Links ]
Gu, S., Lu, G., Wu, Y., Li, S., & Zhao, K. (2012) A Study of the Interaction betweenELF-EMF and Bacteria. Advances in Electric and Electronics, 155, 243- 254. [ Links ]
Ibraheim, M. H., & El-Din, D. B. (2013). 50 Hz Frequency Magnetic Field Effects on Pseudomonas Aeruginosa and Bacillus Subtilis Bacteria. IOSR Journal of Applied Physics, 3, 49-56. [ Links ]
Iwasaka, M., Ikehatab, M., Miyakoshic, J., & Ueno, S. (2004). Strong static magnetic field effects on yeast proliferation and distribution. Bioelectrochemistry, 65, 59-68. [ Links ]
Jin, F., Liu, T., Li, F., & El, J. (2009). Effects of Static Magnetic Fields on Aerobes: Escherichia coli, Staphylococcus aureus and Bacillus subtilis. Journal of Biomedical Engineering, 26, 757-760. [ Links ]
Johnson, T. J. (2011). Impacts of fecal bacteria on human and animal health-pathogens and virulence genes. In, The Fecal Bacteria, (pp. 135 -164). Washington D.C., USA: ASM Press. [ Links ]
Kamel, F. H., Amin, A. M., Salih, K. K., & Qader, S. S. (2013). ComparativeStudy of the Static Magnetic Field Effects on Growth Rate with Relative Antibiotic Susceptibility in Escherichia coli. Journal of Life Sciences, 7, 690-694. [ Links ]
Kamel, F. H., Saeed, C. H., & Qader, S. S. (2013). The static magnetic field effect on Pseudomonas Aeruginosa. DAMA International, 2, 32-35. [ Links ]
Koneman, E. W., y Allen, S. (2008). Diagnostico Microbiológico, (ed. 6). Madrid, España: Médica Panamericana. [ Links ]
Markkanen, A., Juutilainen, J., Lang, S., Pelkonen, J., Rytömaa, T., & Naarala, J. (2001). Effects of 50 Hz magnetic field on cell cycle kinetics and the colony forming ability of budding yeast exposed to ultraviolet radiation. Bioelectromagnetics, 22, 345-350. [ Links ]
Martínez, C. E., Pérez, I., Morris, H., y Fontainer, R. (2004). Efectos de la solución de sales CM-95 tratada magnéticamente sobre células mononucleares. Biotecnología Aplicada, 21, 224- 228. [ Links ]
Motta, M. A., Montenegro, E. J., Stamford, T. L., Silva, A. R., & Silva, F. R. (2001). Changes in Saccharomyces cerevisiae development induced by magnetic fields. Biotechnol Prog., 17, 970-973. [ Links ]
Nakamura, K., Kazumasa, O., Takashi, A., & Makoto, S. (1997). Effect of high magnetic field on the growth of Bacillus subtilis measured in a newly developedsuperconducting magnet biosystem. Bioelectrochemistry and Bioenergetics, 43, 123-128. [ Links ]
Nascimento, L. F., Botura, G. J., & Mota, R. P. (2003). Glucose consume and growthof E. coli under electromagnetic field. Revista do Instituto de Medicina, Tropical de São Paulo, 45, 65 -67. [ Links ]
Nawrotek, P., Fijałkowski, K., Struk, M., Kordas, M., & Rakoczy, R. (2014). Effectsof 50 hz rotating magnetic field on the viability of Escherichia coli and Staphylococcus aureus. Electromagn Biol and Med., 33, 29-34. [ Links ]
Novák, J., Strasák, L., Fojt, L., Slaninová, I., & Vetterl, V. (2007). Effects of low-frequency magnetic fields on the viability of yeast Saccharomyces cerevisiae. Bioelectrochemistry, 70, 115-121. [ Links ]
Oliveira, L., Monte Alegre, R., Garcia-Diego, C., & Cuellar, J. (2010). Effects of magnetic fields on biomass and glutathione production by the yeast Saccharomyces cerevisiae. Process Biochemistry, 45, 1362-1367. [ Links ]
Otabe, E. S., Kuroki, S., Nikawa, J., Matsumoto, Y., Ooba, T., Kiso, K., & Hayashi, H. (2009). Yeast cells proliferation on various strong static magnetic fields andtemperatures. Journal of Physics, 156, 1-8. [ Links ]
Raichenko, O. I., Mosienko, V. S., Shlyakhovenko, V. O., Derev'yanko, O. V., Yanish, Y. V., & Karnaushenko, O. V. (2012). Combined action of low temperature and magnetic field of different intensities on growth of some bacterial species in vitro. Health, 4, 249-252. [ Links ]
Rodríguez, O., Haber, V., Chacón, D., & Monte Alegre, R. (2006) Growth ofEscherichia coli under Extremely Low-Frequency Electromagnetic Fields. Applied Biochemistry and Biotechnology, 134, 155 -163. [ Links ]
Romero, R. (2007). Microbiología y parasitología humana: Bases etiológicas de las enfermedades infecciosas y parasitarias. (ed. 3). México D.F., México: Médica Panamericana S.A. [ Links ]
Ruiz, L. (2007). Pseudomonas aeruginosa: aportación al crecimiento de su estructuray al de los mecanismos que contribuyen a su resistencia a los antimicrobianos. Barcelona, España: Universidad de Barcelona. [ Links ]
Ruiz, M. J., Prieto, M. I., Ristori, E., & Martínez, M. (2004). Static and 50 Hz magnetic fields of 0.35 and 2.45 mT have no effect on the growth of Saccharomyces cerevisiae. Bioelectrochemistry, 64, 151-155. [ Links ]
Ruiz, M. J., Prieto, M. I., Ristori, E., & Martínez, M. (2010). No evidence of cellularalterations by MilliTesla-level static and 50 Hz magnetic fields on S. cerevisiae. Electromagnetic biology and medicine, 29, 154-164. [ Links ]
Sánchez, D. J., & Trejo, N. I. (2006). Evolución y Diversidad de Los Seres Vivos. Biología celular y molecular, 243. México DF, México: Alfil. [ Links ]
Segatore, B., Setacci, D., Bennato, F., Cardino, R., Amicosante, G., & Iorio, R. (2012). Evaluations of the Effects of Extremely Low-Frequency Electromagnetic Fields on Growth and Antibiotic Susceptibility of Escherichia coli and Pseudomonas aeruginosa. International Journal of Microbiology, 2012, 1- 7. Recovered 15/10/215 http://downloads.hindawi.com/journals/ijmb/2012/587293.pdf [ Links ]
Shin-ichiro, H., Yoshimasa, I., Kazumasa, O., Takashi, A., & Makoto, S. (2002). Change in broth culture is associated with significant suppression of Escherichia coli death under high magnetic field. Bioelectrochemistry, 57, 139-144. [ Links ]
Strasák, L., Vetterl, V., & Smarda, J. (2002) Effects of low-frequency magnetic fields on bacteria Escherichia coli. Bioelectrochemestry, 55, 161-164. [ Links ]
Tortora, G. J., Funke, B. R., & Case, C. L. (2007). Introducción a la microbiología, (ed. 9). Buenos Aires, Argentina: Médica Panamericana. [ Links ]
Wenjin, J., Huimin, H., Aihua, D., & Chunyang, P. (2009) Effects of static magneticfields on Escherichia coli. Micron., 40, 894-898. [ Links ]
Zapata, J. E., Hoyos, M., & Moreno, G. (2005). Acción de un campo magnéticosobre un cultivo aireado de Saccharomyces cerevisiae. Interciencia, 30, 409-413. [ Links ]
Zapata, J. E., Moreno, G., & Márquez, E. J. (2002). Efectos de los camposmagnéticos sobre el crecimiento de Saccharomyces cerevisiae. Interciencia, 10, 544- 550. [ Links ]
Zhang, S., Wei, W., Zhang, J., Mao, Y., & Liu, S. (2002) Effect of static magnetic field on growth of Escherichia coli and relative response model of series piezoelectric quartz crystal. The Analyst, 127, 373- 377. [ Links ]
Zúñiga, O., Cuero, R., & Peña, J. A. (2011). Estimulación con campo electromagnéticovariable de microorganismos benéficos aplicados a la cachaza para mejorar su uso como biofertilizante. Biotecnología en el Sector Agropecuario y Agroindustrial, 9, 150-158. [ Links ]

Revista de Ciencias por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento 4.0.