Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Ciencias
Print version ISSN 0121-1935
rev. cienc. vol.19 no.2 Cali July/Dec. 2015
Determinación de la viabilidad de semillas de orquídeas utilizando la prueba de Tetrazolio e Índigo Carmín
Determining the Viability of Orchid seeds using the Tetrazolio and Carmín Índigo Tests
Seir Antonio Salazar Mercado
Facultad de Ciencias Agrarias y del Medio Ambiente, Universidad Francisco de Paula Santander, San José de Cúcuta - Colombia
E-mail: salazar663@hotmail.com
Javier Darío Gélvez Manrique
Facultad de Educación, Universidad Simón Bolívar, San José de Cúcuta - Colombia
E-mail: jdgelvezm@gmail.com
Received: June 22, 2015
Accepted: December 1, 2015
Resumen
Algunas especies de orquídeas se encuentran en peligro de extinción a nivel mundial, debido a la intervención antrópica. Por consiguiente, se hace necesario analizar la capacidad germinativa (viabilidad) de las semillas de orquídeas como paso fundamental para la conservación de orquídeas. En este trabajo se determinó la viabilidad de las semillas de las especies de orquídeas Elleanthus arauntiacum, Epidendrum sp, Maxillaria sp, Odontoglossum lindenii, Prosthechea sp, Telipogon dubios, Stelis sp, Elleanthus sp, Epidendrum elongatum y Cyrtochilum sp, utilizando la prueba de Tetrazolio e Índigo Carmín. Se realizaron diferentes salidas de campo en la vereda El Escorial en Norte de Santander para la colección de las cápsulas maduras de las diferentes especies de orquídeas. Posteriormente, se evaluó la viabilidad de las semillas con la prueba de Tetrazolio e Índigo Carmín, seguidamente se evaluaron los datos arrojados de las dos pruebas trabajadas. El coef ciente de correlación entre la prueba de Tetrazolio e Índigo Carmín fue de 0,419, indicando una relación débil en las dos pruebas con diferencias estadísticamente signif cativas de P:0.05. Se encontró que la prueba de Tetrazolio fue la más ef ciente para determinar la viabilidad de las semillas de orquídeas objeto de estudio.
Palabras clave: Cyrtochilum sp, Elleanthus arauntiacum, Epidendrum elongatum, Odontoglossum lindenii, Orquidaceae, Telipogon dubios.
Abstract
Orchid species are endangered worldwide due to human intervention. Therefore, it is necessary to analyze the germination capacity (viability) of orchids' seeds as essencial step for its conservation. This research determined the viability of the seeds species of orchids Elleanthus arauntiacum, Epidendrum sp, Maxillaria sp, Odontoglossum lindenii, Prosthechea sp, Telipogon dubios, Stelis sp, Elleanthus sp, Epidendrum elongatum y Cyrtochilum sp, using the Tetrazolium and Indigo carmin tests. Several f eld trips to the province of El Escorial in Norte de Santander, Colombia were done for collection of mature capsules of the different species of orchids. Then, was the seeds' viability by using the tetrazolium and Indigo Carmine tests. Subsequently, the data obtained from the two tests was evaluated. The correlation coeff cient between the Tetrazolium and Indigo Carmine tests was 0.419, indicating a weak relationship between the two trials with statistically signif cant differences P:0.05. It was found that the tetrazolium test was the most eff cient to determine the viability of orchid seeds being studied.
Keywords: Cyrtochilum sp, Elleanthus arauntiacum, Epidendrum elongatum, Odontoglossum lindenii, Orquidaceae, Telipogon dubios.
Introducción
La familia Orquidaceae es de las más ricas en especies y con mayor riesgo de extinción del reino Plantae en el mundo (Zhang et al., 2015). Posee alrededor de 25.000 a 30.000 especies distribuidas en 880 géneros (Thorpe & Yeung, 2011). Son conocidas por sus fores hermosas y duraderas, crecen en una amplia gama de hábitats; que van desde epíftas, terrestres y rupícolas (Niknejad et al., 2011; Vij & Pathak, 2012). Colombia reporta 4010 especies, agrupadas en 260 géneros (Mejía & Pino, 2010). En Norte de Santander se han registrado 37 géneros y 105 Especies (Díaz et al., 2004).
Las orquídeas son extremadamente susceptibles a la alteración de sus hábitats en comparación con otras plantas (Díaz et al., 2004; Mweetwa et al., 2008), lo cual ha llevado a la disminución de sus poblaciones debido a la pérdida de hábitat y la excesiva recolección para el ornamento (Basker & Bai, 2010; Huang, 2011). Actualmente la intervención del hombre ha aumentado la desaparición y fragmentación de los bosques tropicales, sometiendo en riesgo una gran variedad de especies de orquídeas (Pérez et al., 2009). En la región de Pam plona, Norte de Santander, las orquídeas se han visto perjudicadas por la disminución de sus hábitats, ocasionada por la actividad agrícola, gana dera y de desarrollo urbano (Díaz et al., 2004), de tal manera, varias especies han sido reportadas en el libro rojo de las plantas de Colombia (Calderón, 2007). Además, las semillas se caracterizan por ser muy pequeñas: 1.0-2.0 mm de largo y 0.5-1.0 mm de ancho (Arditti y Ernst, 1993), la tasa de germinación es muy limitada ya que la semilla tiene poca reserva alimenticia, por lo que se hace necesario que existan asociaciones simbióticas con un hongo formador de micorrizas para lograr su germinación en condiciones naturales (Rasmussen et al., 1995; Chen & Chen, 2007; Murdad et al., 2010). Por tal motivo, se hace necesario analizar la capacidad germinativa (viabilidad) de las semillas de orquídeas, considerando la situación de peligro de extinción y su papel importante en el ecosistema (Orta et al., 2011). Para determinar la viabilidad de semillas se han desarrollado diferentes métodos bioquímicos, dentro los cuales encontramos: índigo carmín y tetrazolio (Prieto et al., 2011; Lallana y Garcia, 2013; Cerna et al., 2014).
La prueba de índigo carmín no es aceptada por la International Seed Testing Association (ISTA), Sin embrago, se ha utilizado para evaluar la viabilidad en un determinado grupo de plantas (Benitoet al., 2004; Marrero et al., 2007; Jyoti & Malik, 2013). Esta prueba produce una coloración diferencial de los tejidos vivos y muertos del embrión. Así, se tiñen de azul las semillas muertas por el aumento en la permeabilidad de la membrana y las no viables permanecen incoloras (Prieto et al., 2011).
En orquídeas la prueba más utilizada es la de tetrazolio (Vujanovic et al., 2000; Ossenbach et al., 2007; Muñozy Jimènez, 2008; Billard et al., 2014), la cual es aprobada por el ISTA (1985). Esta prueba refeja la actividad de las enzimas deshidrogenasas que intervienen en la respiración celular (Lauzer et al., 2007; Canuto, 2012; Soares et al., 2014), dando como resultado una coloración roja a las semillas viables, mientras que las no viables quedan del color natural de la semilla (Chen & Chen, 2007). En el presente estudio se determina la viabilidad de las semillas de las especies de orquídeas Elleanthus arauntiacum, Epidendrum sp, Maxillaria sp, Odontoglossum lindenii, Prosthechea sp, Telipogon dubios, Stelis sp, Elleanthus sp, Epidendrum elongatum y Cyrtochilum sp, utilizando la prueba de Tetrazolio e Índigo Carmín.
2 Materiales y métodos
2.1 Material Vegetal
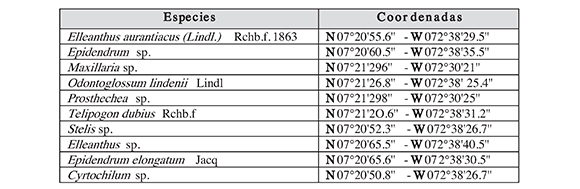
Las cápsulas maduras de las especies de orquídeas fueron colectadas en la vereda El Escorial en Norte de Santander, Colombia (Tabla 1; Figuras 1 y 2), donde se realizó una breve descripción del hábitat de las especies de orquídeas encontradas. Para identifcar las cápsulas maduras se observó la transición de color verde a amarillo (Kitsaki et al., 2004). El método de colección de orquídeas con cápsulas se realizó al azar, debido a que no existe un método determinado que permita hacer una colección que origine datos para un análisis estadístico (Díaz et al., 2004). Seguidamente fueron extraídas las semillas para ser almacenadas en sobres de papel kraft a 4 ºC en un recipiente plástico al cual se le aplicó 10 g de sílica gel durante dos días para evitar que las semillas se deterioren por la humedad (Dutraet al., 2008; Vogel & Macedo, 2011; Salazar-Mercado y Cancino, 2012).
Tabla 1. Coordenadas geográfcas de las especies de orquídeas encontradas en la vereda el Escorial en Norte de Santander, Colombia
Figura 1. Flores de las especies de orquídeas encontradas en la vereda El Escorial Pamplona Norte de Santander-Colombia. (A) Telipogon dubios (B) Odontoglossum lindenii (C) Maxillaria sp. (D) Cyrtochilum sp. (E) Epidendrum elongatum (F) Stelis sp. (G) Elleanthus arauntiacum (H) Elleanthus sp. (I) Prosthechea sp. (J) Epidendrum sp.
Figura 2. Flor y capsula de la especie Telipogon dubios, encontrada en la vereda El Escorial Pamplona Norte de Santander - Colombia
2.2 Viabilidad de Semillas
Prueba de Tetrazolio (2, 3, 5-cloruro trifenil tetrazolio: solución incolora). Se sumergieron 100 semillas de cada especie de orquídea en la solución de tetrazolio al 1% con un pH de 6.5, durante 24 horas en la oscuridad, seguidamente se realizó la evaluación de la viabilidad en el microscopio estereoscopio (Leica EZ4: 350X). Se hicieron 5 réplicas del proceso de viabi lidad por especie de orquídea. Las semillas viables se tiñeron de rojo, debido a la reducción del tetrazolio por la actividad respiratoria de las células (International Seed Testing Association, 1985; Canuto, 2012; Castilho et al., 2012).
Prueba de Índigo Carmín (3,3-dioxo-2,2-bi-indolilideno-5,5-disulfonato disódico: solución de color azul). Se sometieron 100 semillas de cada especie de orquídea en la solución de índigo carmín al 0.15% con un pH de 6.5, durante 3 horas en la oscuridad. Posteriormente, se lavaron con agua destilada y luego se examinaron al microscopio estereoscopio (Leica EZ4: 350X) para evaluar la viabilidad de las semillas de orquídeas. Se hicieron 5 réplicas del proceso de viabi lidad por especie de orquídea. En ésta técnica, las semillas no viables tiñen azul, debido a que la permeabilidad de la membrana aumenta en las células muertas (Marrero et al., 2007).
2.3 Diseño experimental y análisis estadístico
El diseño experimental utilizado, consistió en un modelo factorial 2x10 (2 pruebas x 10 especies) completamente al azar con 5 repeticiones de 100 semillas de orquídeas por especie y un total de 100 unidades experimentales. Los datos se analizaron utilizando la varianza (Anova). Seguidamente, las medias se compararon utilizando la prueba de rangos múltiples de HSD (Ho nestly Signifcant Difference) de Tukey para determi nar las diferencias signifcativas a un nivel de P:0.05 (Tukey, 1994). Además, se realizó el coefciente de correlación entre la prueba de Tetrazolio e Índigo Carmín. Para el análisis estadístico se utilizó el software Statgraphic Centurion® versión 16.
3. Resultados y discusión
El rango de altura donde se encontraron orquídeas con cápsulas maduras en la vereda El Escorial en Norte de Santander; fue de 2500 a 2920 m.s.n.m, corresponde a una cuchilla con laderas de pendientes pronunciadas, excepto en la parte más alta donde forma un pequeño domo. En su parte baja presenta actividades económicas como ganadería y agricultura, el cual ejerce presión extensiva sobre estas pequeñas manchas de bosque. En esta zona se colectaron cápsulas sobre la franja de vegetación arbustiva con matorrales altos, predominan pequeños árboles de Roupala colombiana, Tovomita parvifora, Clusia multifora, Myrsine coriaceae, Clethra ovaliiolia; arbustos de Bejaria glauca, Psamisa sp, Myrciantes leucoxyla, Hesperomeles heterophylla. Presenta suelos arenoso-arcillosos con presencia de rocas de gran tamaño, con vegetación arbustiva rala y herbácea (Bejaria, sphyrospermum, Gaultheria); helechos de los géneros Lophosoria, Pteridium y polypodium [6]. En ésta vegetación se encontraron las siguientes especies de orquídeas con disponibilidad de cápsulas: en ambiente terrestre (Elleanthus arauntiacum Maxillaria sp.), semiterrestre (Telipogon dubios), epiftas (Elleanthus arauntiacum, Odontoglossum lindenii, Prosthechea sp.).
En la parte alta del Escorial se presenta manchas de bosques primarios poco intervenidos, predominando la vegetación arbórea como: Weinmannia tometosa, Clusia sp. (tampacos), Alnus acuminata, Scheifera velutina. Las especies de orquídeas con cápsulas encontradas fueron: en ambiente terrestre, (Epidendrum sp, Elleanthus arauntiacum), litofítica (Elleanthus arauntiacum), epiftas (Odontoglossum lindenii, Stelis sp. y Cyrtochilum sp).
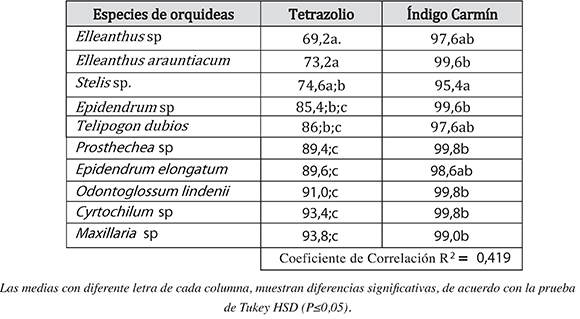
Los porcentajes de viabilidad utilizando la prueba de tetrazolio fueron muy variables, se encontró que las especies Maxillaria sp (93,8%), Cyrtochilum sp (93,4%) y Odontoglossum lindenii (91,0%) tuvieron un alto porcentaje de viabilidad. A diferencia, Elleanthus sp (69,2%) y Elleantus arauntiacum (73,2%) se encontraron porcentajes de viabilidad bajo (Tabla 2 y Figura 3).
Tabla 2. Porcentaje de la Viabilidad de semillas de orquídeas utilizando la prueba de Tretrazolio e Índigo Carmín
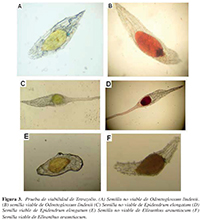
Figura 3. Prueba de viabilidad de Tetrazolio. (A) Semilla no viable de Odontoglossum lindenii (B) semilla viable de Odontoglossum lindenii (C) Semilla no viable de Epidendrum elongatum (D) Semilla viable de Epidendrum elongatum (E) Semilla no viable de Elleanthus arauntiacum (F) Semilla viable de Elleanthus arauntiacum.
En la prueba de viabilidad de índigo carmín los porcentajes fueron muy altos (95,6 a 99,8) en todas las especies de orquídeas trabajadas (Tabla 2). Estos resultados muestran que la prueba de índigo carmín arrojó resultados muy positivos en cuanto a la viabilidad de las semillas.
Al analizar el coefciente de correlación (R2=0,419; Tabla 2) entre la prueba de tetrazolio e índigo carmín se encontró una relación relativamente débil entre las pruebas, con diferencias estadísticamente signifcativas de P:0.05. Estos resultados refejan los altos porcentajes que se obtuvieron en la prueba de vialidad de índigo carmín en todas las especies trabajadas. Si se analiza el principio de esta prueba, donde las semillas no viables se tornan azul, debido al aumento de la permeabilidad de la membrana en células muertas (Marrero et al. 2007), se pueden encontrar falsos positivos por exceso de colorante, es decir, semillas no viables se pueden identifcar como viables, difcultando la evaluación de la viabilidad en semillas de orquídeas. Según Benito et al., 2004 y Marrero, (2007), la prueba de índigo Carmín se utiliza con éxito para determinar la viabilidad en las semillas de especies forestales y arbustivas respectivamente. Además, otros autores indican que el método del índigo carmín tiene ciertas ventajas en relación con el método de tretrazolio en la especie herbácea Hordeum distichon L, ya que es más económico y en solución acuosa es más estable, garantizando la durabilidad de la solución. (Prieto et al., 2011). Sin embargo, en esta investigación demostró que en orquídeas la efcacia es baja, por los falsos positivos y el tamaño pequeño de las semillas. En la prueba de tretrazolio los resultados son más confables debido a la fácil identifcación de las semillas viables, las cuales toman una coloración roja (Fig. 3) por la reducción del tetrazolio a formazan, lo que indica que hay actividad respiratoria en la célula y, consecuentemente, que la semilla es viable (Canuto, 2012; Salazar-Mercado, 2012; Salazar-Mercado et al. 2013). Otras investigaciones han utilizado la prueba de tetrazolio en las semillas de orquídeas de una forma exitosa (Soares et al., 2014; Salazar-Mercado y Cancino, G. (2012); Thompsonet al., 2006; Moraet al., 2008), aunque, la concentración de la solución de tretazolio puede variar de acuerdo a la especie de orquídea trabajada.
4. Conclusiones
La prueba de tetrazolio es confable para la determi nación de la viabilidad de las semillas de Elleanthus arauntiacum, Epidendrum sp, Maxillaria sp, Odontoglossum lindenii, Prosthechea sp, Telipogon dubios, Stelis sp, Elleanthus sp, Epidendrum elongatum y Cyrtochilum sp, debido a que es una solución incolora que puede penetrar fácilmente las semillas. Por el contrario, la prueba de Indigo Carmin no es recomendable para predecir la capacidad germinativa de las semillas de orquídeas. Se recomienda implementar diferentes metodologías que puedan ayudar a la conservación de orquídeas.
Agradecimientos
A la Universidad Francisco de Paula Santander por su valiosa colaboración.
Referencias
Arditti, J., y Ernst, R. (1993). Micropropagation of Orchids. New York, USA: John Wiley & Sons. [ Links ]
Basker, S., & Bai, N. (2010). In vitro propagation of an epiphytic and rare orchid Eria bambusifolia Lindl. Research in Biotechnology, 1, 15-20. [ Links ]
Benito, M., Sierra, H., Jiménez, I., y Peñuelas, J. (2004). Aplicación de métodos colorimétricos para la determinación de la viabilidad en semillas de "Pinus Pinae": test de tetrazolio e índigo carmín. Cuadernos de la Sociedad Española de Ciencias Forestales, 17, 23-28. [ Links ]
Billard, C., Dalzotto, C., y Lallana, V. (2014). Desinfección y siembra asimbiótica de semillas de dos especies y una variedad de orquídeas del género Oncidium. Polibotánica, 38, 145-157. [ Links ]
Calderón, E. (2007). Libro Rojo de plantas de Colombia, v. 6. Bogotá D. C., Colombia: Instituto Alexander von Humboldt - Ministerio de Ambiente, Vivienda y Desarrollo Territorial. [ Links ]
Canuto, R. (2012). Dehydrogenases. In Tech Design Team. Zagreb, Croatia (p. 366). [ Links ]
Castilho, C., Damasceno, R., y Machado, N. (2012). Imagens digitalizadas na interpretao do teste de tetrazólio em sementes de Brachiaria brizantha. Revista Brasileira de Sementes, 34(2), 334 - 341. [ Links ]
Cerna, M., Cárdenas, S., Cruz, A., y Jácome, I. (2014). Colección de germoplasma de especies de la familia Orchidaceae Del Cantón Santiago De Méndez - Morona Santiago, Ecuador. La granja. Revista de ciencias de la vida, 20(2), 5-19. [doi: 10.17163.lgr.n20.2014.01] [ Links ].
Chen, W-H., & Chen, H-H. (2007). Orchid Biotechnology. London, UK: World Scientifc. [ Links ]
Díaz, J., Solano, F., Sánchez, L., y Espinosa, F. (2004). Riqueza y distribución de las orquideaceae en la provincia de Pamplona. Bistua, 2(1), 106-112. [ Links ]
Dutra, D., Johnson, T., Kauth, P., Stewart, S., & Kane, M. (2008). Asymbiotic seed germination, in vitro seedling development, and greenhouse acclimatization of the threatened terrestrial orchid Bletia purpurea. Plant Cell Tissue and Organ Culture, 94, 11-21. [ Links ]
Huang, H. (2011). Plant diversity and conservation in China: planning a strategic bioresource for a sustainable future. Botanical Journal of the Linnean Society, 166, 282-300. [ Links ]
International Seed Testing Association. (1985). International rules for seed testing. Seed Science and Technology. (pp. 300-520). [ Links ]
Jcquemyn, H., Honnay, O., & Pailler, T. (2007). Range size variation, nestedness and species turnover of orchid species along an altitudinal gradient on Réunion Island: implications for conservation. Biological Conservation, 136, 388-397. [ Links ]
Jyoti, C. & Malik, C.P. (2013). Seed deterioration: A review. International Journal of Life Sciences Biotechnology and Pharma Research, 2(3), 373-385. [ Links ]
Kitsaki, C., Zygouraki, S., Ziobora, M., & Chintziest, S. (2004). In vitro germination, protocorm formation and plantlet development of mature versus immature seeds from several Ophrys species (Orchidaceae). Plant Cell Reports, 23(5), 284-290. [ Links ]
Lallana, V., y Garcia, L. (2013). Efecto de pretratamientos en la prueba de viabilidad de semillas de Trichocentrum jonesianum (Orchidaceae). Investigación Agraria, 15(2), 129-132. [ Links ]
Lauzer, D., Renaut, S., Arnaud, & Barabé, D. (2007). In vitro Asymbiotic Germination, Protocorm Development, and Plantlet Acclimatization of Aplectrum hyemale (Muhl. Ex Willd.) Torr. (Orchidaceae). The Journal of the Torrey Botanical Society, 134(3), 344-348. [ Links ]
Marrero, P., David, P., Valdés, F., & Nogales, M. (2007). Comparison of three chemical tests to assess seed viability: the seed dispersal system of the Macaronesian endemic plant Rubia fruticosa (Rubiaceae) as an example. Chemoecology, 17, 47-50. [ Links ]
Mejía, H., & Pino, T. (2010). Diversity of Orchids Epiphytes in a Tropical Rain Forest (Bh-T) of Departament Chocó, Colombia. Acta Biológica Colombiana, 15(2), 37-46. [ Links ]
Mora, F., Letícia, M., Scapim, C., Nunes, E., & Pires, M. (2008). Generalized lineal models for the analysis of binary data from propagation experiments of Brazilian orchids. Brazilian Archives of Biology and Technology, 51(5), 963-970. [doi: http://dx.doi.org/10.1590/S1516-89132008000500013] [ Links ].
Muñoz, M., & Jiménez, V. (2008). Capsule development, in vitro germination and plantlet acclimatization in Phragmipedium humboldtii, P. longifolium and P. pearcei. Lankesteriana, 8(2), 23-31. [ Links ]
Murdad, R., Latip, M., Aziz, Z., & Ripin, R. (2010). Effects of carbon source and potato homogenate on in vitro growth and develop ment of Sabah's Endangered orchid: Phalaenopsis gigantean. Asia-Pacifc Journal oi Molecular Biology and Biotechnology, 18(1), 199-202. [ Links ]
Mweetwa, A., Welbaum, G., y Tay, D. (2008). Effects of development, temperature, and calcium hypochlorite treatment on in vitro germinability of Phalaenopsis seeds. Scientia Horticulturae, 117, 257-262. [ Links ]
Niknejad, A., Kadir, M., & Kadzimin, B. (2011). In vitro plant regeneration from protocorms-like bodies (PLBs) and callus of Phalaenopsis gigantea (Epidendroideae: Orchidaceae). African Journal of Biotechnology, 10(56), 11808-11816. [ Links ]
Orta, S., López, J., Chile, T., Perez, I., y Blanco, P. (2011). Conservación de las orquídeas cubanas con enfoque desde la ciencia, la tecnología y la sociedad. Revista Iberoamericana CTS, 1(1), 1-18. [ Links ]
Ossenbach, C., Arce, J., & Warner, J. (2007). Almacenamiento de semillas de diferentes especies de orquídeas para su conservación en un banco de germoplasma: Deshidratación, almacenamiento y pruebas de viabilidad de las semillas. Tierra Tropical, 3(1), 47-59. [ Links ]
Pérez, O., Sánchez, E., y Ortiz, P. (2009). Inventario orquideológico de la Reserva Bosque de Yotoco, Valle del Cauca. Acta Agronómica, 58(3), 189-196. [ Links ]
Prieto, J., Prieto, F., Hernández, N., Cervantes, J., Domínguez, M., y Alma, D. (2011). Métodos comparativos del poder germinativo en Hordeum distichon L. calidad maltera. Multiciencias, 11(2), 121-128. [ Links ]
Rasmussen, H. (1995). Terrestrial orchids, from seed to mycotrophic plant. Cambridge, UK: Cambridge University Press. [ Links ]
Salazar-Mercado, S. A. (2012). Germinación asimbiótica de semillas y desarrollo in vitro de plántulas de Cattleya mendelii Dombrain (Orchidaceae). Acta Agronómica, 61(1), 69-78. [ Links ]
Salazar-Mercado, S. A., y Cancino, G. (2012). Evaluación del efecto de dos suplementos orgánicos en la germinación in vitro de orquídeas nativas de la provincia de Pamplona, Colombia. Revista Colombiana de Biotecnología, 14(1), 53-59. [ Links ]
Salazar-Mercado, S. A., Zulay, A., & Barrientos, F. (2013). Evaluation of different in vitro culture media in the development of Phalaenopsis hybrid (Orchidaceae). Revista Colombiana de Biotecnología, 15(2), 97-105. [doi: http://dx.doi.org/10.15446/rev.colomb.biote.v15n2.41268] [ Links ].
Soares, J., Chaim, Y., Bento, M., Sorgato, J., y Soares, C. (2014). Identifca<ao da viabilidade de sementes de orquídeas pelo teste de tetrazólio. Semina: Ciencias Agrárias, 35(5), 2275-2284. [ Links ]
Thompson, D., Trevor, J., & Van, J. (2006). Evaluating asymbiotic seed culture methods and establishing Disa (Orchidaceae) germina bility in vitro: relationships, requirements and frst-time reports. Plant Growth Regulation, 49(2), 269-284. [ Links ]
Thorpe, T., & Yeung, E. (2011). Plant Embryo Culture: Methods and Protocols, Methods in Molecular Biology. Springer Science+Business Media, 710. [doi: http:// dx.doi.org/10.1016/j.biocon.2014.10.026] [ Links ].
Tukey, J. (1994). The problem of multiple comparisons. En, H. L. Braun (Ed.). The collected works of John W. Tukey, (pp. 300). New York, USA: Chapman and Hall. [ Links ]
Vij, S., & Pathak, P. (2012). Orchid Diversity: Conservation and Utilization. Proceedings of the National Academy of Sciences. India Section B: Biological Sciences, 82(2), 295-300. [ Links ]
Vogel, I., & Macedo, A. (2011). Infuence of IAA, TDZ, and light quality on asymbiotic germination, protocorm formation, and plantlet development of Cyrtopodium glutiniferum Raddical medicinal orchid. Plant Cell Tissue and Organ Culture, 104, 147-155. [ Links ]
Vujanovic, V., Arnaud, M., Barabe, D., & Thibeault, G. (2000). Viability testing of orchid seed and the promotion of colouration and germination. Annals of Botany, 86, 79-86. [ Links ]
Zhang, Z., Yan, Y., Tian, Y., Li, J., He, J. S., & Tang, Z. (2015). Distribution and conservation of orchid species richness in China. Biological Conservation, 181, 64-72. [doi: http://dx.doi.org/10.1016/j.biocon.2014.10.026] [ Links ].

Revista de Ciencias por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento 4.0.