Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Ciencias
Print version ISSN 0121-1935
rev. cienc. vol.19 no.2 Cali July/Dec. 2015
Caracterización morfológica y molecular de Phytophthora en ají(Capsicum frutescens var. Tabasco), Valle del Cauca
Morphological and Molecular Characterization of Phytophthora in Pepper (Capsicum frutescens var. Tabasco), Valle del Cauca
Natalia Aristizábal Castillo
Departamento de Biología, Universidad del Valle, Cali - Colombia
nacsui88@gmail.com
Celina Torres G.
Departamento de Biología, Universidad del Valle, Cali - Colombia
E-mail: jhcelina.torres@correounivalle.edu.co
Received: November 3, 2015
Accepted: December 17, 2015
Resumen
El objetivo de este trabajo fue la caracterización de posibles especies diferentes de Phytophthora en un terreno que apenas comenzaría a ser usado para la producción de ajítabasco (Capsicum frutescens Var. Tabasco) de calidad de exportación en una zona productora del Valle del Cauca. Phytophthora es un Oomiceto f topatógeno que ataca gran variedad de plantas, desde hortalizas hasta árboles maderables y tiene varias especies que se han encontrado en estudios del tizón tardío, moho polvoso y putrefacción de la raíz del ají. El ajítabasco es una de las variedades de mayor demanda en el mercado, y por ello es preciso profundizar en los estudios referentes a la prevención y control de las enfermedades que atacan este cultivo. Para esta investigación se hizo una colecta aleatoria de suelo del cultivo de ajítabasco dentro de un perímetro de 20cm alrededor de la plántula y dentro del canal entre camas de siembra. Se aislaron dos morfotipos de Phytophthora a los que se extrajo ADN con el kit PowerSoil® DNA Isolation Kit (laboratorios MO-BIO Inc.), y se corrió una PCR, demostrando diferencia en el tamaño de las bandas. Al comparar las secuencias de las regiones ITS1 e ITS4, se encontró una similitud del 99% entre aislamiento PI y Phytophthora cinnamomi; el caso del aislamiento P2 tuvo una estrecha relación con el grupo perteneciente a Phytophtora infestans, P. nicotianae y P.tentaculata.
Palabras clave: Phytophthora, Capsicum frutescens, ftopatógeno, patogenicidad, PCR, suelo.
Abstract
The purpose of this work was the characterization of possible different species of Phytophtho in a f eld that ust begun to be used for the production of Tabasco pepper (Capsicum frutescens Var. Tabasco) of exporting quality, in a growing area of Valle del Cauca. Phytophthora is a phytopathogen oomycete which attacks wide variety of plants, from vegetables to timber trees, and has several species that have been found in studies of pepper's late blight, powdery mildew and root rot. The Tabasco pepper is one of the most demanded varieties in the market, and for this reason, it is necessary to deepen the studies on the prevention and control of diseases that attack the crop. For this investigation, a random collection of soil was made from the Tabasco pepper crop, within a perimeter of 20cm around the seedling and inside the channel between planting beds. Two Phytophthora morphotypes were isolated to which DNA was extracted with the PowerSoil® DNA Isolation Kit (MO-BIO Laboratories Inc.), and a PCR was run, showing different band sizes. By comparing the sequences of the ITSI and ITS4 regions, a similarity of 99% was found between isolation PI and Phytophthora cinnamomi; the isolation P2 (80%) had a close relationship with the group belonging to Phytophthora infestans, P. nicotianae and P.tentaculata.
Keywords: Phytophthora, Capsicum frutescens, plant pathogen, pathogenicity, PCR, soil.
1. Introducción
El ajíes un fruto perteneciente al género Capsicum l., el cual incluye aproximadamente 30 especies provenientes de zonas comprendidas entre el sur de Estados Unidos y Chile. Ocupa el primer lugar en importancia dentro de los frutos y hortalizas que se cultivan en países de Latinoamérica, principalmente México, Perú, Bolivia, Chile y Colombia. Se puede decir que tanto los a íes y chiles, como los pimientos (pertenecientes al mismo género) vienen siendo utilizados en América desde hace miles de años (según yacimientos arqueológicos en México y Perú) y han perdurado hasta llegar a tal infuencia que hoy en día se puede ver refe ada en el cultivo, comercialización y consumo en países muy le anos a su procedencia. A partir del siglo XVI el cultivo del pimiento, en sus variados tipos dulces o picantes, de carne gruesa o delgada, como especia o como hortaliza, aparece ampliamente distribuido por toda Europa y por todo el mundo (López-Riquelme 2003).
Dentro del género Capsicum hay cinco especies domesticadas y 26 especies salvajes y del total sólo 12, incluyendo algunas variedades, son empleadas por el hombre (López-Riquelme 2003). En Colombia se cultivan diferentes especies de ají, entre las que se destacan el ajídulce, el ajítopito dulce y el ajípicante, principalmente semillas foráneas de variedades e híbridos tales como tabasco, cayena, habanero y alapeño en menor escala y el chivato (Análisis de agro negocios alianza productiva y comercial a í. Proyecto Apoyo Alianzas Productivas). Como representante de las especies domesticadas picantes se encuentra el a ítabasco (Capsicum frutescens var. Tabasco) el cual es originario del estado Tabasco (de ahísu nombre), México (Salazar y Vargas, I977), aunque la OECD (2006) afrma que su centro es el este amazónico. Ésta variedad tiene un gran reconocimiento alrededor del mundo por su palatabilidad, su variado uso culinario, el cual es producido y consumido tanto fresco como procesado y desde hace 145 años es conocida particularmente por la famosa "salsa Tabasco" de la empresa de Mc Ilhenny Co. Louisiana, Estados Unidos (Sánchez et al., 1998).
Colombia tiene condiciones espectaculares para la siembra del ají, con lo que ha alcanzado 70 ton/ha en invernadero (Organization for Economic Co-operation and Development - OECD, 2006) y el departamento del Valle del Cauca ha registrado altos niveles de producción desde 2006 hasta 2011. Sin embargo, hacia 2012 su producción sufrió una reducción considerable unto con la producción nacional (una caída del 7%) (Lamour, et.al (2006). Esto se debió tanto a factores ftosanitarios como de la producción en sí. Según la Corporación Colombiana Internacional (CCI) los principales destinos de las exportaciones colombianas de a íhasta el año 2005 fueron Estados Unidos (52 %), Arabia Saudita (46%), Canadá y las Antillas Holandesas (I% c/u). A pesar de que el mayor importador de a ítanto en seco como verde es Estados Unidos, es importante destacar que el ajícolombiano en fresco no tiene acceso autorizado a éste país por no tener el Análisis de Riesgo de Plagas (ARP) requerido por las estrictas medidas sanitarias y ftosanitarias, lo que le resta un gran porcenta e del capital de ingreso a Colombia (Corporación Colombia Internacional, 2007).
La inocuidad alimentaria es uno de los grandes puntos que Colombia debe acometer en los próximos años para alcanzar más rápidamente objetivos de competitividad de comercio internacional ya que, según el Plan de Negocios del Ají(Instituto Colombiano Agropecuario, 2013) se presenta una carencia importante desde el punto de vista del estatus ftosanitario y de inocuidad en las cadenas de frutas y hortalizas que puede condicionar la exportación de las mismas. Esto se puede evidenciar en la reducción del número de pedidos registrados por el Instituto Colombiano Agropecuario (ICA) en cuanto a exportación, especialmente de a í, cebolla cabezona y fresa (Instituto Colombiano Agropecuario, 2013).
Un factor importante en el cultivo de plantas de ají, es la susceptibilidad a diferentes tipos de enfermedades y plagas, lo que resulta en billones de dólares en daños y pérdidas al año en este cultivo (Ribeiro, 1978). Entre las enfermedades que afectan el ají, se pueden resaltar el gusano Marggot y los nematodos, bacterias como Erwinia y Xantomonas, hongos del género Fusarium y también virus. Otro grupo de organismos que causa graves daños al ajíes el Oomycota (Ribeiro, 1978), el cual es excluido del grupo de los hongos verdaderos e incluido en el reino Chromista de acuerdo a una nueva clasifcación debido a que la mayor parte de su ciclo de vida es diploide mientras que los otros hongos son haploides (Ko 1998).
La especie que más se cita al momento de hablar del tizón en chiles o ajíes, es P. capsici (Bartual et al., 1991; Babadoost, 2004; Hurtado-Tenorio, 2010). Sin embargo muchos otros estudios denotan otras especies que también afectan los chiles o ajíes, tales como P. cinnamomi y P. infestans. De esta manera, no es posible defnir si es una sola especie de Phytophthora o varias a la vez las que generan la afección y esto complica el control de la enfermedad.
Las especies del género Phytophthora son fitopatógenos devastadores tanto en agroecosistemas como en ecosistemas naturales (Blair et al., 2008). El género Phytophthora es responsable de algunas de las más serias enfermedades en plantas (Cooke et al., 2007), tales como la putrefacción de la raíz de la soya (Tang et al., 2011), la putrefacción de raíz del tomate, la marchitez de la pimienta (Waterhouse, 1963), la marchitez del chile (Ogundiwin et al., 2005) y la muerte repentina del roble (Martin & Tooley, 2003). Debido a su signifcativo impacto económico y ambiental, el interés por los aspectos genéticos y genómicos de estos Oomycetes ha aumentado. De igual manera, se han incrementado los esfuerzos por recopilar la información fenotípica y genotípica de este género (Blair et al., 2008).
La mayoría de las especies de Phytophthora son invasoras primarias de tejidos sanos de plantas con capacidad saprofítica limitada; muchas de las cuales son responsables de enfermedades de hortalizas de importancia económica o causantes de daños a las comunidades vegetales de los ecosistemas naturales (Cooke et al, 2007).
Phytophthora es un patógeno con un mecanismo de acción efciente debido a que puede sobrevivir en los residuos de cosecha eliminados y/o abandonados en un campo que ha sido destruido por la enfermedad. Bajo condiciones ambientales favorables, produce esporangios, los cuales se diseminan por el aire o por el suelo a otros cultivos. El patógeno inicia su desarrollo y los esporangios pueden infectar, a través del suelo, del agua de riego y del aire, las raíces, los tallos y el follaje sanos. El patógeno se incrementa en las plantas infectadas, luego invade plantas del mismo campo y posteriormente, constituye un foco de infección para otros campos. Las oosporas, las cuales se encuentran en los residuos vegetales y/o en el suelo y tienen una viabilidad hasta de 2 años, constituyen otra fuente de infección (Biles et al, 1995).
El mecanismo de infección se da cuando las estructuras reproductivas se establecen en las ho as y/o en el lugar de inserción de la ho a con el tallo. La infección en las ho as se produce en el ápice y en los bordes de los foliolos, donde casi siempre existe una película de agua. La infección en campo normalmente ocurre bajo condiciones de temperatura y humedad relativa alta, por encima de los 25°C y 90-95% de humedad relativa. Los esporangios penetran a través de los estomas o directamente por la cutícula. Finalmente, las células mueren, los tejidos se necrosan y las hojas infectadas muestran manchas negras
o marrones. El desarrollo del patógeno continúa dentro de los tejidos a lo largo de los espacios intercelulares y también dentro de las células. Otro mecanismo de infección es a través del suelo. La humedad, la cantidad de esporangios viables que caen, la temperatura del suelo y probablemente la condición supresiva de los suelos y la susceptibilidad de la especie favorecen la infección en el campo (Erwin & Ribeiro, 1996; Godinez-Regalado y Rosales-Jimenez, 2008).
Este fto-patógeno puede infectar las raíces, fores, tallos, ho as y frutos del a íprovocando el tizón foliar, la putrefacción de frutos y la putrefacción de la raíz y del tallo, en cualquier etapa del desarrollo de las plantas (Waterhouse 1963). Las etapas iniciales de infección son biotrófcas ya que a menudo no muestran síntomas. Dependiendo de la temperatura, existe un período de incubación de 24 h antes de que las primeras lesiones necróticas sean visibles. Aunque Phytophthora es considerado como un patógeno del suelo, puede existir una abundante putrefacción de estructuras reproductivas en la superfcie del suelo, en material vegetal en descomposición. Los frutos infectados pueden ser considerados como agentes de dispersión, ya que solamente requieren de lluvia o agua de riego para que ocurra una dispersión masiva de zoosporas (Waterhouse 1963). Este patógeno puede producir pérdidas hasta del 80% en la producción de ají(Martin & Tooley, 2003).
Phytophthora es un patógeno con un mecanismo de acción efciente debido a que puede sobrevivir en los residuos de cosecha eliminados y/o abandonados en un campo que ha sido destruido por la enfermedad. Bajo condiciones ambientales favorables, produce esporangios, los cuales se diseminan por el aire o por el suelo a otros cultivos. El patógeno inicia su desarrollo y los esporangios pueden infectar, a través del suelo, del agua de riego y el aire, las raíces, tallos y follaje sanos. El patógeno se incrementa en las plantas infectadas, luego invade plantas del mismo campo y posteriormente, constituyen un foco de infección para otros campos. Las oosporas, las cuales se encuentran en los residuos vegetales y/o en el suelo y tienen una viabilidad hasta de 2 años, constituyen otra fuente de infección (Biles et al., 1995).
El mecanismo de infección se da cuando las estructuras reproductivas se establecen en las ho as y/o en el lugar de inserción de la ho a con el tallo. La infección en las ho as se produce en el ápice y en los bordes de los foliolos, donde casi siempre existe una película de agua. La infección en campo normalmente ocurre bajo condiciones de temperatura y humedad relativa alta, por encima de los 25°C y 90-95% de humedad relativa. Los esporangios penetran a través de los estomas o directamente por la cutícula. Finalmente las células mueren, los tejidos se necrosan y las hojas infectadas muestran manchas negras o marrones. El desarrollo del patógeno continúa dentro de los tejidos a lo largo de los espacios intercelulares y también dentro de las células. Otro mecanismo de infección se produce a través del suelo. La humedad, la cantidad de esporangios viables que caen, la temperatura del suelo y probablemente la condición supresiva de los suelos y la susceptibilidad de la especie favorecen la infección en el campo (Erwin y Ribeiro, 1996; Godinez-Regalado y Rosales-Jimenez, 2008).
Phytophthora capsici incluye aislados obtenidos de pimienta negra (Piper nigrum) (Bosland & Lindsey, 1991); se considera el agente causal de más de 50 especies de plantas, entre ellas, el causante de la marchitez del chile (Capsicum annuum) en Nuevo México. (Lamour, et. al., 2006; Ordoñez et al., 2000; Truong et al., 2010) encontraron esta especie como la responsable de daños de importancia económica en solanáceas como el chile, el tomate y la berenjena, y cucurbitáceas como el pepino, la calabaza, y el melón, alrededor del mundo.
Recientemente, se le ha encontrado atacando cultivos de habas (Vicia faba) y habichuelas (Phaseolus lunatus), plantas que previamente se había demostrado no eran hospedantes viables de este patógeno (Shea et al., 1980). Este patógeno es responsable de grandes pérdidas a nivel mundial (Ordoñez, 2000). En muchas partes del mundo, P. capsici es el factor limitante más importante de producción vegetal (Lamour, 2006), actualmente, se le considera el factor ftosanitario más importante para la producción de ajíen México (Ezziyyania 2005).
Como complemento del diagnóstico y caracterización de los patógenos de mayor importancia económica, se deben buscar alternativas de control con el propósito de saber con exactitud las especies de los patógenos que se encuentran en las áreas de siembra, en las plantas enfermas o en los viveros, para determinar el uso de una tecnología, con un enfoque más defnido hacia el patógeno en particular y que evite dañar las características del suelo y de los microorganismos benéfcos en los sustratos. Este traba o buscó, mediante técnicas básicas de ftopatología, evaluar el estado ftosanitario de un terreno en inicio con un cultivo de ajítabasco (Capsicum frutescens var. Tabasco) de calidad de exportación, donde se propuso encontrar posibles estados quiescentes de Phytophthora con alto potencial perjudicial para la producción y por medio de técnicas moleculares complementarias se determinó la especie de Phytophthora que está específcamente en los terrenos de cultivo.
2. Metodología
2.1 Zona de muestreo
Las muestras de suelo fueron colectadas en el cultivo que se encuentra en los terrenos de una fnca destinada únicamente a la siembra de a ítabasco, ubicada en el corregimiento de Rozo, a 20 minutos de la cabecera municipal de Palmira (Departamento del Valle del Cauca), coordenadas 03°37'35,5"N, 76°25'02,5"W, una altitud de 974 m.s.n.m, temperatura promedio 25°C, 83% de humedad relativa, suelos FrA, con un pH de 7.5.
Recolección y procesamiento de muestras
Dejando un margen de un metro desde el borde del cultivo se tomó como referencia dos zonas para la toma de muestra: la primera, por debajo del plástico de protección dentro de un perímetro de 20 cm alrededor de la plántula y la segunda, dentro del canal entre camas de siembra, tomando dos muestras aleatorias de cada zona. Se tomaron 300 gramos de suelo y se llevaron a laboratorio. Se preparó una solución inicial con 100g de suelo en 100mL de agua destilada estéril. Con esta muestra, se realizó un seriado de diluciones desde I0-2 hasta I0-7. Se tomaron las últimas cuatro diluciones (I0-4 a I0-7) y se sembraron en medio de cultivo Rosa Bengala vertiendo 1 ml. de la dilución y extendiéndolo por todo el medio con un asa Drigalsky de vidrio. Por cada dilución se hicieron 3 repeticiones.
2.3 Identifcación macroscópica y aislamiento de Phytophthora spp.
Después de 7 días de incubación a 25°C, los hongos que crecieron sobre Rosa Bengala (ARB) se aislaron sembrándolos en medio de Papa-Dextrosa-Agar (PDA). Las colonias obtenidas luego de 4 días de crecimiento en PDA se clasifcaron por medio de una selección visual preliminar con base en las características de las colonias (Erwin & Rubeiro, 1996) y la identifcación de estructuras reproductivas y vegetativas (Rytkonen, 2011; Shea et al., 1980).
Para las características microscópicas se hicieron montajes de micelio con tinción de azul de lactofenol en placas porta objetos y se observaron bajo un microscopio Nikon® Eclipse E200 con aumento de 100x. Las imágenes fueron tomadas con una cámara de la serie Optikam® Pro instalada en el microscopio y analizadas con el software Optika Visión® Pro 5 para realizar la medición de las estructuras encontradas.
Siguiendo las claves de identificación y guías de características morfológicas de Phytophthora (Hurtado-Tenorio, 2010; Godinez-Regalado y Rosales-Jimenez, 2008; Biles et al., 1995; Bartual et al., 1991), se seleccionaron los hongos con colonias de color blanco o crema con crecimiento distintivo, presencia de hifas coraloides, hifas con hinchamientos, esporangios ovalados, oogonios y clamidosporas intercalares. Una vez identifcados morfológicamente como Phytophthora, se sembraron en medio Agar Avena (A.A), Agar ugo V8 (V8A) y medio liquido de ugo V8 (V8L) para la formación de estructuras reproductivas mejor desarrolladas y hacer otras comparaciones con la literatura que cita características en otros medios de cultivo.
2.4 Evaluación patológica
2.4.1 Plantas a evaluar y pre-tratamiento
Para realizar las pruebas patogenicidad, se tomaron plantas de ajítabasco de 3 meses de edad con 6 a 8 hojas verdaderas y se sometieron a un pre-tratamiento en cámara húmeda por 48 horas. Para lograr este efecto, se regó el sustrato y se cubrieron las plantas con bolsas plásticas transparentes, (Figura 1a). El propósito de este pre-tratamiento fue crear un microclima propicio para el desarrollo de la enfermedad; una emulación de las condiciones que se dan en el campo después de una lluvia o en temporada húmeda, donde los patógenos desarrollan síntomas de las enfermedades.
Figura 1. Evaluación patológica. A) pre-tratamiento de las plantas, B) puntas de palillos cubiertas por el hongo, C) inoculación, D) registro fotográfico y E) re-aislamiento
2.4.2 Preparación del inoculo
Con la ayuda de un sacabocados #3, se tomaron discos de 5 mm de diámetro del borde de las colonias de Phytophthora aislados de las muestras de suelo y se sembraron por separado en medio de cultivo Agar Avena (medio A.Av.) con puntas estériles de palillos, incubándolos a 25°C hasta que el hongo colonizara por completo las puntas. (Figura 1b).
2.4.3 Inoculación
Una vez terminado el pre-tratamiento de las plantas, se realizó la inoculación siguiendo la metodología de inoculación de corona propuesta por Pochard et al. (I976) y Bartual et al. (I99I) (Longo, 2013; Ezziyyania et al., 2005; Engelhard & Ploetz, 1979; Lefebvre & Palloix, 1996) y modifcándola según la inoculación con palillos propuesta por Salazar et al. (I977) y De La Torre et al. (2009) (Hurtadi-Tenorio, 2010). Se realizó un corte transversal en el área inter-nodal entre la sexta y séptima hoja madura, donde se insertó la punta del palillo colonizado con micelio del patógeno. Se cubrió con cinta Paraflm®M (Laboratory Film - National American CanTM) para evitar la desecación del inóculo (Figura 1c).
2.4.4 Evaluación
A partir del tercer día de inoculación se procedió a llevar un registro del área afectada durante 20 días. Se evaluó la variable Avance Progresivo de la Infección (en milímetros) producido por el hongo en los días 3, 7, 10, 14, 17 y 21 posteriores a la inoculación (Bartualet al., 1991), (Lefebvre y Palloix, 1996). Se realizó registro fotográfco de la zona de inoculación, (Figura 1d). Las fotos fueron procesadas con el software ImageJ® para medir el avance de la enfermedad. Se realizó un análisis de varianza ANOVA de los datos obtenidos con un intervalo de confanza del 95% en el programa Statistica® v7 para encontrar diferencias signifcativas entre los dos aislamientos a través del tiempo.
2.4.5 Re-aislamiento
Se realizó re-aislamiento de los hongos inoculados para confrmar la etiología de la enfermedad mediante los postulados de Koch siguiendo la metodología de Lucas et al. (2002), (Figura 1e). Los hongos que crecieron fueron observados al microscopio para comprobar que fueran Phytophthora.
2.6. Identifcación molecular
Para la extracción del ADN genómico se empleó el PowerSoil DNA Isolation Kit (MO BIO). El ADN extraído se amplifcó empleando los cebadores ITSI y ITS4 (Tang et al., 2011). El coctel de la PCR se preparó con base en las concentraciones finales: buffer (I0x), MgCl2 (I.75 ¡m), dntp's (20 ¡m cada), primer (4 ¡m cada uno), taq polimerasa (I unidad). El programa utilizado en el termociclador fue: Fase de desnaturalización 95ºC 5 min, fase de extensión (- 95°C 30 seg; - 54°C 40 seg: - 72°C 40 seg) y extensión fnal de 72°C por un período de I0 min. El programa fue igual para ITS, sólo se modifcó la temperatura de 54°C a 52 °C.
Las secuencias obtenidas fueron comparadas directamente con las secuencias depositadas en las bases de datos del GenBank, usando la herramienta de búsqueda de alineación local básica, editadas de forma manual con el programa Bioedit Sequence Alignment Editor (Hall, 1999) con el objetivo de eliminar y corregir los errores que se pudieran presentar en el proceso de secuenciación automática. La clasifcación flogenética fue inferida mediante el método de máxima verosimilitud con el software PAUP versión 4.0b10. Se realizó una búsqueda heurística con diez repeticiones, el algoritmo de TBR (Tree-Bisection-Reconnection) fue usado para rea ustar la topología (Branch-swapping), usando la herramienta BLAST.
3. Resultados
3.1 Identifcación y aislamiento de Phytophthora
A partir de las colonias que crecieron de la siembra de diluciones de suelo en Agar Rosa Bengala, se lograron aislar 32 hongos en medio PDA. Se realizó la clasifcación preliminar con base en las características de las colonias y las estructuras observadas al microscopio. Se encontraron dos hongos con características afnes a Phytophthora: El primero se aisló de la concentración 10-4 de la muestra #1 de la zona del canal entre camas de siembra, denominado P1 y el segundo, en la misma concentración, pero de la muestra #2 de la zona dentro del perímetro de la plántula, denominado P2.
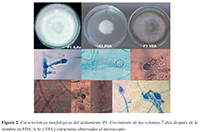
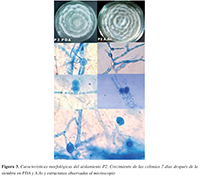
El aislamiento P1 mostró un crecimiento algodonoso no muy elevado, con circunferencias concéntricas que a medida que maduraba eran menos visibles hasta que la colonia quedaba algodonosa sin evidencia de circunferencias (Figura 2). En el caso de P2, la colonia mostró un crecimiento arrosetado o en forma de crisantemo, concéntrico bien defnido con puntas protuberantes (Figura 3). La velocidad de crecimiento en los medios de cultivo (ARB, PDA, A.Av, V8A) siempre fue más rápida para P2, con un máximo de 7 mm por día, mientras PI tuvo un máximo de crecimiento de 4mm por día.
Figura 2. Características morfológicas del aislamiento P1. Crecimiento de las colonias 7 días después de la siembra en PDA, A.Av y V8A y estructuras observadas al microscopio
Figura 3. Características morfológicas del aislamiento P2. Crecimiento de las colonias 7 días después de la siembra en PDA y A.Av y estructuras observadas al microscopio
Del hongo P1 se obtuvieron esporangios ovoides alargados papilados con un promedio de 29,3 /m de largo y I4/m de ancho, con Oogonios de entre 9 a I3 /m de diámetro y clamidosporas con pared delgada. Por otro lado, el hongo P2 generó esporangios ovoides no muy alargados alimonados y medianamente papilados, con longitudes de II a 54 /m de largo y de 9 a 36 /m de ancho, clamidosporas alrededor de 9,5 /m de diámetro y oogonios con oosferas con media de 37,3 /m de diámetro.
3.2 Evaluación patológica
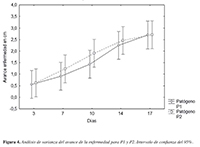
El Avance de la enfermedad fue ligeramente diferente entre las cepas aisladas (PI y P2), por ende el análisis estadístico no reveló diferencias signifcativas entre los dos Phytophthora (Figura 4). De manera cualitativa, PI mostró un comportamiento más homogéneo, con lesiones de 5 mm inicialmente en todas las repeticiones (RI- R4) y avanzando regularmente hasta llegar al desecamiento del tallo con lesiones de 2I,5 a 33,4 mm (Figura 5a). Por otro lado, las plantas inoculadas con el hongo P2 mostraron diferentes longitudes del avance de la enfermedad desde el primer día de evaluación (día 3 post inoculación), con necrosis iniciales de 2 a 12 mm, hasta llegar a valores donde la diferencia máxima entre repeticiones fue de 2I mm (Figura 5b).
Figura 4. Análisis de varianza del avance de la enfermedad para P1 y P2. Intervalo de confianza del 95%
Figura 5. Gráfica del avance de la enfermedad para A) P1 y B) P2, duarnte los cinco días de evaluación. Cada hongo con 4 repeticiones (R1 - R4)
3.3 Identifcación molecular
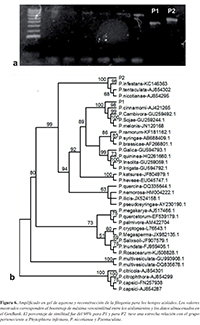
El ADN amplifcado con los cebadores ITSI e ITS4, se visualizó en geles de agarosa al I %, los fragmentos amplifcados mostraron diferentes tamaños: una de 530pb para PI y 642pb para P2 (Figura 6a). Una vez determinadas, comparadas y alineadas las secuencias, se comprobó la relación de los hongos aislados con los datos de los representantes del género Phytophthora almacenados en GenBank. Se construyó un árbol de máxima verosimilitud tomando secuencias pertenecientes a diferentes especies del género Phytophthora, las cuales estaban representadas en los diferentes clados reportados para esta especie. El modelo de sustitución nucleotídica utilizado fue GTR+G con 0.3370 como parámetro alfa de la distribución gamma, las frecuencias nucleotídicas fueron T = 0.2942, C = 0.2189, A = 0.2225 y G = 0.2645.
Figura 6. Amplificado en el gel de agarosa y reconstrucción de la filogenia para los hongos aislados. Los valores mostrados corresponden al bootstrap de máxima verosimilitud entre los aislamientos y los datos almacenados en el GenBank. El porcentaje de similitud fue del 98% para P1 y para P2 tuvo una estrecha relación con el grupo perteneciente a Phytophtora infestans, P. nicotianae y P.tentaculata
El ADN amplifcado con los cebadores ITSI e ITS4 se visualizó en geles de agarosa al I%, donde se presentaron dos bandas bien defnidas y de diferentes tamaños: una de 530pb para PI y 642pb para P2 (Figura 6a). Una vez determinadas, comparadas y alineadas las secuencias, se comprobó la relación de los hongos aislados con los datos de los representantes del género Phytophthora almacenados en GenBank, con lo que se generó el árbol de máxima verosimilitud, mostrando una relación del 99% con Phytophthora cinnamomi para PI, y para P2 una relación entre Phytophthora infestans, tentaculata y nicotinianae (Figura 6b).
4. Discusión
Por sus características de crecimiento en medio de cultivo, se pudo evidenciar una diferencia entre los dos hongos aislados, pero el mayor contraste se dio al comparar posteriormente sus estructuras al microscopio. Las características y mediciones de las colonias (Tabasco Mc Ilhenny Corporation Web site, 2015; Shea et al., 1980) y de los esporangios (Pochardet al., 1976; Erwin & Ribeiro, 1996) son regularmente usadas para hacer la identifcación de las especies de Phytophthora. Sin embargo, se encontraron varias discordancias entre la identifcación dada únicamente con las características morfológicas y la identifcación usando las claves con las características microscópicas (Ho, 1992). Estos resultados demostraron la necesidad de hacer un acople de estas dos referencias junto con el análisis molecular. Aunque se han publicado varias claves sinópticas para identifcar las especies de Phytophthora (Erwin & Ribeiro, 1996; Ho, 1981) como la de la de Gallegly & Hong (2008), que compila 60 especies conocidas de Phytophthora junto con sus fotografías y pruebas de ADN, la identifcación por morfología se considera difícil debido a las características variables que a menudo se superponen dentro y entre las especies (Truonget al., 2010). Adicional a esto, hay que tener en cuenta que en el análisis de muestras vegetales y de suelo algunas especies de Phytophthora pueden no crecer en medios de cultivo, pero ser positivas en PCR y viceversa, como lo reportaron Blomquist et al. (2005) y Donahoo et al. (2006), atribuyéndole este suceso a que la PCR también podría detectar esporas que no son viables o que están en algún estado de dormancia.
En cuanto a las características macroscópicas de P1, su forma algodonosa, con crecimiento en aros concéntricos, se asemeja mucho a las características de P. cinnamomi, P. megasperma, P, cambivora y P. nicotianae, pero sus características microscópicas se acercan más a las tres primeras. Aunque se describe como no papilado, en el registro fotográfco de las observaciones al microscopio se puede diferenciar un engrosamiento apical que puede dar una apariencia de esporangios semipapilado, lo cual es aceptado para la clasifcación. También puede verse una estructura que, aunque en un principio se consideró como una papila, en el movimiento de enfoque se precisó como una posible germinación o la liberación de una zoospora (Figura 3). Con el uso de las herramientas moleculares se logró relacionar a P1 con P. cinnamomi, consiguiendo separar P1 de P. cambivora con quien comparte muchas características y que, de hecho, se encuentra en el mismo clado que P. cinnamomi (Programa de Transformación Productiva (PTP), 2013), (Blair et al. 2008). Aunque la especie más reportada que afecta el ajíes P. capsici (Donahoo et al., 2006; Bosland & Lindsey, 1991; Small, 2009), P. cinnamomi tiene el rango de huéspedes más amplio de cualquier especie de Phytophthora (Programa de Transformación Productiva - PTP, 2013), ésta es especialmente asociada con enfermedades de las raíces de eucaliptos, robles, castaños, pinos y los miembros de la Ericaceae, asícomo diversos cultivos agrícolas. La severidad causada por P. cinnamomi no sólo se limita a la agricultura y horticultura, también se han visto afectados ecosistemas naturales de países como Australia, donde no se ha podido controlar desde que fue reportada por Zentmyer (I983). Los síntomas van desde la mortalidad de raíces fnas que conduce a la disminución gradual del árbol a la ampliación de chancros basales, a menudo con "bleeding cankers" y muerte de los árboles. Sumando esto a la cualidad heterotálica de P. cinnamom, no se puede pasar por alto la probabilidad de estar implicadas en las enfermedades que se puedan dar en el cultivo de ají. La especie PI (P. infestans) se encontró en suelo.
Para el caso del aislamiento P2, el registro fotográfco de las estructuras observadas al microscopio evidenció una condición de alta producción de estructuras de reproducción y de resistencia, que le aporta un carácter de alta patogenicidad. Las clamidosporas actúan como semillas de propagación y son resistentes a condiciones adversas del ambiente como sequías, temperaturas bajas, falta de alimento, etc. Esto concuerda con las características ftopatológicas de las tres especies de Phytophthora a las que está emparentado en el árbol generado por el análisis molecular.
Para la cepa P2, que se encuentra en suelo con alta producción de estructuras de reproducción y de resistencia con características altamente patógenas, aunque se procuró hacer un análisis más detallado de los resultados microscópicos y moleculares, no se pudo establecer una especie defnitiva para esta cepa, ya que la secuenciación no siempre resulta en distinciones claras cuando se analizan especies que están relacionadas estrechamente y otras pruebas moleculares podrían no ser específcas para una especie (Cooke et al., 2007). Phytophthora es un ftopatógeno muy importante que ataca una gran variedad de cultivos, árboles maderables y arbustos en el mundo entero (Waterhouse, 1963; Leonian, 1922). La condición heterotálica de muchas especies es el mayor problema al que se enfrenta un investigador que pretende hacer un reconocimiento taxonómico de este grupo ftopatógeno. El cruce intra e inter especifco genera diferentes aislamientos y variedades, a la vez que reafrma la resistencia a los diferentes métodos de control.
P2 se relaciona cercanamente a P. infestans, a la que se le atribuyen dos grandes desastres a nivel agrícola: la devastación de la papa (Cox & Large, 1960; Fry et al., 1993; Martin & Tooley, 2003) y el tizón tardío en cultivos de tomate. Aunque generalmente se considera que tienen una gama de hospedadores limitada y que es un patógeno casi biotrófco, se ha reportado que P. infestans causa la infección en un gran número de especies. Erwin y Ribeiro (I996) enlistaron 89 especies hospederas, pero más del 25% de éstas se incluyeron porque las inoculaciones artifciales resultaron en lesiones. En la agricultura, los dos hospederos más importantes son las papas y los tomates, pertenecientes a la misma familia del ají(Solanaceae), lo que abre la duda de su posible susceptibilidad a P. Infestans. Aislamientos de Phytophthora relacionados cercanamente con P. infestans también se han encontrado en Sur América en otras solanáceas, como el tomate de árbol (Solanum betaceum) y especies silvestres (Oelke et al., 2003). Estos aislamientos son morfológicamente idénticos a P. infestans, pero representan genotipos nuevos basados en análisis de marcadores genéticos neutrales. Por esta razón, la taxonomía de estos aislamientos es indefnida, como podría ser el caso de P2.
Los resultados de este trabajo demostraron que a pesar de que la zona era relativamente nueva para el cultivo, en el suelo había presencia de estas dos especies de Phytophthora (P1 y P2) lo que podría considerarse como una gran amenaza a mediano y largo plazos, no solo para el cultivo de ajíya sembrado, sino para otras especies vegetales reconocidas por su susceptibilidad a este patógeno. Es importante considerar la posibilidad de contaminación cruzada por el movimiento que se puede dar de las estructuras de dispersión del patógeno (oosporas y zoosporas). Como lo han registrado varios autores (Robin et al., 2012; Kanaskie et al., 2007; White et al., 1990), la mayoría de las especies de Phytophthora soportan un estado de quiescencia de hasta 6 años, en forma de micelio en suelos húmedos y como clamidosporas mientras el suelo tenga más de un 3% de humedad. También pueden sobrevivir como sapróftos con material vegetal en descomposición (sobrevivencia infuenciada por el potencial de la matriz del suelo) y pueden sobrevivir en este sustrato por largos periodos (Salazar y Vargas, 1977). Todo lo anterior hace de estos dos aislamientos de Phytophthora una amenaza latente para el cultivo ya presente y los posibles cultivos que le subsigan.
Agradecimientos
Los autores agradecen al Sistema General de Regalías por la financiación de esta investigación, la cual estuvo enmarcada en el macroproyecto "Desarrollo de un Sistema Agroindustrial Rural Competitivo a Partir de Cultivos Promisorios en una Bioregión del Valle del Cauca CI 767943" y al personal del Laboratorio de Investigaciones Microbiológicas del Departamento de Biología de la Universidad del Valle.
Referencias
Babadoost, M. (2004). Phytophthora blight: A serious threat to cucurbit industries. Recuperado de http://www.apsnet.org/publications/apsnetfeatures/Pages/PhytophthoraBlight.aspx [ Links ]
Bartual, R., Marsal, J. I., Carbonell, E. A., Tello, J. C., y Campos, T. (1991). Genética de la resistencia a Phytophthora capsici Leonian en pimiento. Boletín de Sanidad Vegetal, Plagas, 17(1), 3-124. [ Links ]
Biles, C. L., Bruton, B. D., Wall, M. M., & Rivas, M. (1995). Phytophthora capsici: zoospore infection of pepper fruit in various physical environments. Proceedings of the Oklahoma Academy of Science, 75, 1-5. [ Links ]
Blair, J. E., Coffey, M. D., Park, S. Y., Geiser, D. M., & Kang, S. (2008). A multilocus phylogeny for Phytophthora utilizing markers derived from complete genome sequences. Fungal Genetics and Biology, 45, 266-277. [ Links ]
Blomquist, C., Irving, T., Osterbauer, N., & Reeser, P. (2005). Phytophthora hibernalis: A New Pathogen on Rhododendron and Evidence of Cross Amplification with Two PCR Detection Assays for Phytophthora ramorum. Recuperado de 15/12/2016 https://www.plantmanagementnetwork.org/php/elements/sum.aspx?id=4891&photo=2496 [ Links ]
Bosland, P. W., & Lindsey, D. L. (1991). A seedling screen for Phytophthora Root rot of pepper, Capsicum annum. Plant Disease, 75, 1048-1050. [ Links ]
Candole, B. L., Conner, P. J., & Ji, P. (2012). Evaluation of Phytophthora root rotresistant Capsicum annum accessions for resistance to Phytophthora foliar blight and Phytophthora stem blight. Agricultural Sciences, 3(5), 732-737. [ Links ]
Cooke, D. E. L., Schena, L., & Cacciola, S. O. (2007). Tools for detecting, identifying, and monitoring Phytophthora species in natural ecosystems. Journal of Plant Patholology, 89, 13-28. [ Links ]
Corporación Colombia Internacional (CCI) (2007). Ají colombiano: Grandes oportunidades de mercado. Sembremos, 1, 7. [ Links ]
Cox, A. E., & Large, E. C. (1960). Potato late blight epidemics throughout the world. Agriculture Handbook, 174, 230. [ Links ]
De La Torre-Almaráz, R., Cota-Trujillo, F. M., García-Rojas, J. L., Campos, J. E., y San-Martín, F. (2009). Etiología de la muerte descendente del Mezquite (Prosopis laevigata L.) en la reserva de la biosfera del Valle de Zapotitlán, México. Agrociencia, 43(2), 197-208. [ Links ]
Donahoo, R., Blomquist, C. L., Thomas, S. L., Moulton, J. K., Cooke, D. E. L., & Lamour, K. H. (2006). Phytophthora foliorum sp. nov., a new species causing leaf blight of azalea. Mycological Research, 110, 1309-1322. [ Links ]
Engelhard, A. W., & Ploetz, R. C. (1979). Phytophthora crown and stem rot, an important new disease of poinsettia (Euphorbia pulcherrima). Proceedings of the Florida State Horticultural Society, 92, 348-350. [ Links ]
Erwin, D. C., & Ribeiro, O. K. (1996). Phytophthora Diseases Worldwide. American Phytopathological Society Press (p. 562). [ Links ]
Ezziyyania, M., Requena, M. E., Pérez-Sánchez, C., y Candela, M. E. (2005). Efecto del sustrato y la temperatura en el control biológico de Phytophthora capsici en pimiento (Capsicum annuum L.). Anales de Biología, 27, 119-126. [ Links ]
Fry, W. E., Goodwin, S. B., Dyer, A. T., Matuszak, J. M., Drenth, A., Tooley, P. W. et al. (1993). Historical and recent migrations of Phytophthora infestans: chronology, pathways, and implications. Plant Disease, 77(7), 653-661. [ Links ]
Gallegly, M. E., & Hong, C. (2008). Phytophthora: Identifying Species by Morphology and DNA Fingerprints. American Phytopathological Society Press. [ Links ]
Godinez-Regalado, L., y Rosales-Jimenez, V. (2008). Determinación de la Patogenicidad de Cepas de Phytophthora cinnamomi en Plántulas de Aguacate Raza Mexicana. Tesis de posgrado, Universidad Michoacana de San Nicolás de Hidalgo, Michoacán, México. [ Links ]
Hall, T. (1999). BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic Acids Symposium Series, 41, 95-98. [ Links ]
Ho, H. H. (1981). Synoptic keys to the species of Phytophthora. Micología, 73, 705-714. [ Links ]
Ho, H. H. (1992). Key to Species of Phytophthora in Taiwan. Plant Pathology Bulletin, 1, 104-109. [ Links ]
Hurtado-Tenorio, I. (2010). Búsqueda de Resistencia a Phytophthora capsici Leonian en Germoplasma de Capsicum spp. Tesis de maestría, Universidad Nacional de Colombia, Palmira, Colombia. [ Links ]
Instituto Colombiano Agropecuario (ICA) (2011). Elaboración y Acompañamiento del Plan de Negocios para el Sector Hortofrutícola en Colombia, Fase IV, Plan de Negocios de Aguacate, Programa de Transformación Productiva, Fase 3: Diagnóstico del Sector en Colombia, Noviembre, 2013. Recuperado 15/10/2016 www.ptp.com.co/ [ Links ]
Kanaskie, A., McWilliams, M., Goheen, E., Hansen, E., Sutton, W., & Reeser, P. (2007, March). Eradication of Phytophthora ramorum from Oregon Forests: Status after six years. In, Sudden Oak Death Science Symposium III, (pp. 5-9). Santa Rosa, California. [ Links ]
Ko, W. (1998). Chemical stimulation of sexual reproduction in Phytophthora and Pythium. Botanical Bulletin, 39, 81-86. [ Links ]
Lamour, et. al. (2006). A New species causing leaf blight of Rhododendron. Mycological Research, 10, 1309-1322. [ Links ]
Lefebvre, V., y Palloix, A. (1996). Both epistatic and additive effects of QTLs are involved in polygenic induced resistance to disease: A case study the interaction pepper - Phytophthora capsici Leonian. Theoretical Applied Genetics, 93, 503-511. [ Links ]
Leonian, L. H. (1922). Stem and fruit blight of peppers caused by Phytophthora capsici sp. nov. Phytopathology, 12, 401-408. [ Links ]
Longo, L., Galli, M., Haegi, A., Proietti, P., & Belisario, A. (2013). First Report of Phytophthora nicotianae causing wilting and desiccation on Buxus sempervirens in Italy. New Disease Report, 28, 5. [ Links ]
López-Riquelme, O. G. (2003). Chilli: La especia del nuevo mundo. Ciencias, 69, 66-75. [ Links ]
Lucas, A., Colquhoun, I. J., Mc Comb, J. A., & Hardy, G. E. St. J. (2002). A New Rapid and Non-invasive technique to inoculate plants with Phytophthora cinnamomi. Australian Plant Pathology, 31(1), 27-30. [ Links ]
Martin, F. N., & Tooley, P. W. (2003). Phylogenetic relationships of Phytophthora ramorum, P. nemorosa, and P. pseudosyringae, three species recovered from areas in California with sudden oak death. Mycological Research, 107, 1379-1391. [ Links ]
Oelke, L., Bosland, P. & Steiner, R. (2003). Differentiation of race specifc resistance to Phytophthora root rot and foliar blight in Capsicum annuum. Journal of the American Society for Horticultural Science, 128, 213-218. [ Links ]
Ogundiwin, E. A., Berke, T. F., Massoudi, M., Black, L. L., Huestis, G., Choi, D. et al. (2005). Construction of 2 intraespecifc linkage maps and identifcation of resistance QTLs for Phytophthora capsici root-rot and foliar-blight diseases of pepper (Capsicum annuum L.). Genome, 48, 698-711. [ Links ]
Ordoñez, M. E., Hohl, H. R., Velasco, J. A., Ramon, M. P., Oyarzun, P. J., Smart, C. D. et al. (2000). A novel population of Phytophthora, similar to P. infestans, attacks wild Solanum species in Ecuador. Phytopathology, 90(2), 197-202. [ Links ]
Organization for Economic Co-operation and Development (OECD) (2006). Safety assessment of transgenic organisms. OECD Publishing (p. 821). [ Links ]
Pochard, E., Clereau, M., y Pitrat, M. (1976). La résistance du piment, Capsicum annuum L., a Phytophthora capsici Leon. I. Mise en évidence d'une induction progressive de la résistance. Annual of Amélior Plantes, 26, 35-50. [ Links ]
Programa de Transformación Productiva (PTP) (2013). Elaboración y Acompañamiento del Plan de Negocios para el Sector Hortofrutícola en Colombia, Fase IV, Plan de Negocios del Ají, Noviembre 2013. Recuperado 15/10/2016 www.ptp.com.co/ [ Links ]
Ribeiro, O. K. (Ed.). (1978). A source book of the genus Phytophthora. Vaduz, Lichtenstein, Germany: J. Cramer & Cornell University. [ Links ]
Robin, C., Smith, I., & Hansen, E.M. (2012). Phythophthora cinnamomi. Forest Phytophthoras, 2(I). [doi: I0.5399/osu/fp.2.I.304I] [ Links ].
Rossman, A. Y., & Palm, M. E. (2006). Why are Phytophthora and other oomycota not true fungi?, ASDA Agricultural Research Service, ASDA Animal and Plant Health Inspection Service Systematic Botany & Mycology Laboratory. American Phytopathology Society Press. [ Links ]
Rytkonen, A. (2011). Phytophthora in Finnish nurseries. Dissertationes Forestales 137. Helsinki, Finlandia: Department of Forest Ecology, Faculty of Agriculture and Forestry, University of Helsinki. Recovered 15/10/2016 www.helsinki.fi/fdpps/PhD%20theses/Rytkonen.pdf [ Links ]
Salazar, F., y Vargas, E. (1977). Métodos de evaluación y niveles de resistencia en maíz a la pudrición de la mazorca causado por Fusarium moniliforme. Agronomía Costarricense, 1(2), 93-99. [ Links ]
Sánchez, M. E., Ruiz, D., Pérez, A., Blanco, M.A., & Trapero, A. (1998). Occurence and etiology of death of young olive trees in southern of Spain. European Journal of Plant Pathology, 104, 347-357. [ Links ]
Shea, S. R., Gillen, K. J., & Leppard, W. I. (1980). Seasonal variation in population levels of Phytophthora cinnamomi Rands in soil in diseased, freely-drained Eucalyptus marginata Sm. sites in the northern jarrah forests of south-western Australia. Protection Ecology, 2, 135-156. [ Links ]
Small, E. (2009). Top 100 food plants. NRC Research Press (p. 636). [ Links ]
Stamps, D. J., Waterhouse, G. M., Newhook, F., & Hall, G. S. (1990). Revised Tabular Key to the Species of Phytophthora. Mycological Papers, 162. [ Links ]
Tabasco Mc Ilhenny Corporation Web site (02/02/2015). How we make original red sauce. Recovered 15/10/2016 http://www.tabasco.com/tabasco-products/how-its-made/making-original-tabasco-sauce [ Links ]
Tang, Q., Cui, L., Li, D., Dai, T., Yin, W., Dong, S. et al. (2011). Resistance evaluation of soybean germplasm from Huanghuai region to Phytophthora root rot. Agricultural Sciences in China, 10, 246-251. [ Links ]
Truong, N., Liew, E., & Burgess, L. (2010). Characterization of Phytophthora capsici isolates from black pepper in Vietnam. Fungal Biology, 114, 160-170. [ Links ]
Valdez, V. (1994). Cultivo de ají. Boletín Centro de Información Fundación de Desarrollo Agropecuario - FDA, (20), 22. [ Links ]
Waterhouse, G. M. (1963). Key to the species of Phytophthora de Bary. Mycological Papers, 92. [ Links ]
White, T. J., Bruns, T., Lee, S., & Taylor, J. W. (1990). Amplifcation and direct sequencing of fungal ribosomal RNA genes for phylogenetics. En, M.A. Innis, D. H. Gelfand, J.J. Sninsky y T.J. White (Ed.). PCR protocols: A guide to methods and applications (pp. 315-322). New York, USA: Academic Press, Inc. [ Links ]
Widmer, T. L. (2010). Differentiating Phytophthora ramorum and P. kernoviae from other species isolated from foliage of rhododendrons. Plant Health Progress. doi:10.1094/PHP-2010-0317-01-RS. [ Links ]
Williams, N., Hardy, G. E. St. J., & O'Brien, P.A. (2009). Analysis of the distribution of Phytophthora cinnamomi in soil at a disease site in Western Australia using nested PCR. Forest Pathology, 39(2), 95-109. [ Links ]
Zentmyer, G. A. (1983). The world of Phytophthora. In, D.C. Erwin, S. Bartnicki-Garcia & P.H. Tsao (Ed.). Phytophthora: Its Biology, Taxonomy, Ecology, and Pathology,(pp. 392). St. Paul (MN), USA: The American Phytopathological Society Press. [ Links ]
Zentmyer, G. A., & Mircetich, S. M. (1966). Saprophytism and persistence in soil by Phytophthora cinnamomi. Phytopathology, 56, 710-712. [ Links ]

Revista de Ciencias por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento 4.0.