Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Ciencias
Print version ISSN 0121-1935
rev. cienc. vol.20 no.1 Cali Jan./June 2016
Obtención de una diada electroactiva tipo dumbell con fullereno C60, con un espaciador J - conjugado de piridina - f uoreno separados por una unidad acetilénica
Obtention of a Electroactive Dumbbell Compound with Fullerene C60 Linked to a Ï- Conjugated wire of Pyridine-flourene between an Acethylenic Unit
Alejandro Ortiz G.
Departamento de Química, Universidad del Valle, Cali-Colombia
E-mail: alejandro.ortiz@correounivalle.edu.co
Jorge I. Castro C.
Departamento de Química, Universidad del Valle, Cali-Colombia
E-mail: jorge.castro@correounivalle.edu.co
Braulio Insuasty O.
Departamento de Química, Universidad del Valle, Cali-Colombia
E-mail: braulio.insuasty@correounivalle.edu.co
Received: May 20, 2016
Accepted: June 27, 2016
Resumen
Se reporta la obtención y caracterización estructural de un nuevo sistema orgánico foto- y electroactivo tipo dumbell JIC1. Este nuevo compuesto se sintetizó en una primera etapa por medio de una reacción de acoplamiento cruzado tipo Sonogashira entre el 6-etinil-2-piridincarboxaldehído 4 y el 7-Bromo-9,9-dioctil-9H-f uoreno-2-carbaldehído 2, con el propósito de obtener el cable molecular J -conjugado 5 con dos grupos formilo en los extremos del mismo. Este ltimo compuesto se sometió a una cicloadición 1,3-dipolar con 2 equivalentes de fullereno (C60) obteniéndose la molécula objetivo JIC1, se determinaron sus propiedades electrónicas por medio de medidas espectroscópicas de absorción y f uorescencia, además se realizaron experimentos de voltametría cíclica. Finalmente se realizaron cálculos computacionales a nivel RPM3, para determinar la geometría del estado fundamental y describir los fenómenos de transferencia de carga en el estado excitado.
Palabras clave: Fullereno C60, f uoreno, piridina, transferencia electrónica fotoinducida, dumbell.
Abstract
In this research we describe the synthesis and structural characterization of a new photo- and electro-active type dumbbell-type organic system JIC1. This new compound was synthesized in a f rst stage by a Sonogashira coupling reaction from 6-ethynyl-2-pyridinecarboxaldehyde 4 and 7-Bromo-9,9-dioctyl-9H-f uorene-2-carbaldehyde 2 to obtain the J-conjugated molecular wire 5 with two aldehyde groups at the ends thereof. The latter compound, then, underwent a 1,3-dipolar cycloaddition with 2 equivalents of fullerene (C60) to give the target molecule JIC1. Additionally their electronic properties were determined by means of spectroscopic measurements of absorption and f uorescence. Further experiments were conducted by cyclic voltammetry. Finally, theoretical calculations at RPM3 level were performed to determine the geometry of the ground state and describing the phenomena of charge transfer in the excited state.
Keywords: Fullerene C60, Fluorene, Pyridine, electron-transfer, dumbbell.
1. Introducción
El desarrollo de nuevas rutas sintéticas para la obtención de moléculas con propiedades electrónicas no convencionales es un tema importante dado que estas moléculas han despertado gran interés en el campo de la química de materiales orgánicos. En ellos se encuentran incluidos los diodos emisores de luz OLEDS (Du et al., 2013) celdas fotovoltaicas OFV (Lee et al., 2010), transistores de efecto de campo OFET (Facchetti, 2007) y óptica no lineal ONL [4](Wanget al., 2011). Estos compuestos toman como modelo, procesos biológicos de transferencia de carga como es la fotosíntesis. Estos dispositivos han sido ampliamente estudiados por su gran aplicabilidad en ciencia de nuevos materiales. El diseño molecular más frecuente para los sistemas mencionados es la unión covalente de especies químicas electro-activas, ya sean electro-donadoras o electro-aceptoras, directamente o través de un cable molecular J-conjugado. Estos ltimos desempeñan un papel fundamental en los sistemas moleculares para la conversión de energía solar; además, son tiles para estudiar conceptos novedosos para aplicaciones electrónicas y fotovoltaicas modernas, que requieren un transporte rápido y efciente de carga.
El fullereno C60 es conocido en materiales foto- y electro-activos como un buen electro-aceptor. Años de investigación han demostrado que puede ser considerado como un bloque de construcción de gran alcance para el uso en la ciencia de materiales y en la química medicinal (Guldi et al., 2000). Gracias a su propiedad más importante como es la baja energía de reorganización, la cual permite que se aceleren los procesos de transferencia electrónica y desaceleren los procesos de recombinación de carga, son ampliamente utilizados en la obtención de sistemas del tipo D-J-A. Además, sus atractivas propiedades de absorción y emisión hacen del fullereno C60 un bloque sintético atractivo (Echegoyen & Echegoyen, 1998; Atienza et al., 2005).
2. Resultados y discusión
De esta manera, se plantea la obtención de un sistema tipo dumbell (JIC1), por medio de una metodología sintética convergente (esquema 1). Para el compuesto obtenido, se realizaron medidas de absorción y emisión. También, se hicieron experimentos de voltametría cíclica, para determinar y entender las propiedades de los procesos de transferencia electrónica fotoinducida. Finalmente se realizaron cálculos teóricos a nivel RPM3 que permitió describir dichos procesos. La ruta sintética utilizada para preparar el compuesto JIC1 se presenta en el esquema 1. Inicialmente, se realizó la síntesis del compuesto 1 donde se partió del 2,7-dibromofuoreno (comercial), el cual se sometió a una reacción de alquilación mediante un proceso de transferencia de fase, utilizando como reactivos, una solución de NaOH 50% como base fuerte para desprotonar los hidrógenos acídicos del carbono 9 del 2,7-dibromofuoreno, TBAB (Bromuro de tetrabutilamonio) como reactivo de transferencia de fase, n-bromooctano como agente alquilante y tolueno como disolvente, obteniendo el 85% de rendimiento. Posteriormente, se realizó una reacción de monoformilación del compuesto 1, a través del intermediario litiado. Esta reacción se llevó a cabo a -78 oC con n-BuLi y DMF como agente formilante, utilizando como disolvente éter etílico, para obtener el compuesto 2.
Esquema 1. condiciones de reacción: i) n-bromooctano, NaOH 50%, tolueno, TBAB, 80 °C; ii) n-BuLi, DMF, éter etílico (seco), Ar, -78 °C; iii) CuI, Pd(PPh)34, diisopropilamina, trimetilsililacetileno, tolueno (seco), Ar, t.a.; iv) 4, K2CO3, THF, MeOH, t.a, v) CuI, Pd(PPh3)4, diisopropilamina, tolueno (seco), Ar, 100 °C; vi) C60', N-octilglicina, tolueno, refujo, Dean-Stark
El compuesto 4 se obtuvo por medio de una reacción de acoplamiento cruzado de tipo Sonogashira catalizada por Pd, en la que el catalizador Pd(PPh3)4 se oxida por la adición del compuesto halogenado (6-bromo-2-piridincarbaldehido). Posteriormente, ocurre una transmetalación entre el producto de la adición oxidativa y el trimetilsililacetileno modifcado por la acción del CuI y una amina terciaria como la diisopropilamina para dar el respectivo acetiluro unido al catalizador. Al fnal por medio de una eliminación reductiva, se obtiene el producto esperado 3 con un 75% de rendimiento. A continuación, el producto 3 se somete a una desprotección con K2CO3 disuelto en una mezcla 1:1 metanol/THF, para obtener el derivado acetilénico libre 4.
Para la síntesis del cable molecular p-conjugado 5, los compuestos 2 y 4 se someten a una reacción de Sonogashira catalizada por Pd(PPh3)4 por calentamiento convencional a refujo. De esta manera, se obtuvo el compuesto 5 con un 33% de rendimiento.
Todos los compuestos obtenidos se caracterizaron por medio de técnicas espectroscópicas de FT-IR, RMN 1H, 13C, DEPT-135 y espectrometría de masas, (ver Parte Experimental). En el espectro de RMN-1H para el compuesto 5, se observan las señales de los protones de los grupos n-octilo a campo alto entre 0.92-2.0 ppm. Las señales en la región comprendida entre 7.69-7.93 ppm evidencian la presencia de los protones de los anillos de fuoreno y piridina, como señales importantes se encuentran dos singletes a 10.11 y 10.19 ppm las cuales corresponden a los protones de los dos grupos formilo no equivalentes. En el espectro de RMN-13C, es importante señalar la presencia de dos señales a 88.4 y 91.4 ppm, las cuales pertenecen a los carbonos cuaternarios del fragmento acetilénico.
En la ltima etapa de la síntesis, el compuesto 5 experimenta una adición nucleofílica por parte del grupo amino de la N-octilglicina en exceso, sobre los grupos formilo para la formación de iones iminio. Esta especie sufre por calentamiento una descarboxilación la cual conduce a la formación de la especie reactiva 1,3-dipolar que reaccionará con fullereno C60 mediante una ciclo-adición y, de esta manera, formar el compuesto JIC1, el cual se purifcó por cromatografía de columna en silica gel, utilizando CS2 como fase móvil, obteniendo un sólido marrón con 31 % de rendimiento.
El espectro RMN-1H para el compuesto JIC1 exhibe las señales características para los protones de dos sistemas fulleropirrolidínicos, donde se observan dos singletes, uno alrededor de 5.48 ppm y el otro en 4.45 ppm, que corresponden a los protones unidos a los carbonos estereogénicos de los anillos de pirrolidina; además, se observan las señales de los protones diasterotópicos del anillo de la pirrolidina solapados entre síalrededor de 5.14-5.14 ppm. Con respecto a RMN-13C, el número de carbonos coincide con la estructura planteada, lo que se corrobora con el experimento DEPT-135, donde las señales de los grupos CH2 se observan en fase reversa y no se observan las señales de los carbonos cuaternarios.
La funcionalización de C60 en diferentes tipos de moléculas y el estudio del estado excitado de los derivados funcionalizados, constituyen una gran herramienta para la detección de procesos de transferencia electrónica fotoinducida en sistemas electro- y foto-activos [6, 10, 11].
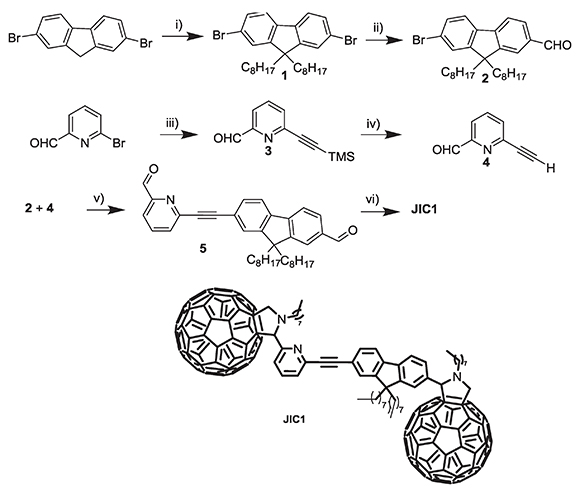
De esta manera, se midieron los espectros de absorción para el compuesto JIC1 y para cada cromóforo que lo conforma estructuralmente (Figura 1). Las medidas se llevaron a cabo a una concentración de 1x10-5M en cloroformo como disolvente.
Figura 1. Espectros de absorción para las diferentes especies electro-activas
En el espectro UV-vis para el compuesto JIC1, se observa que las bandas características de absorción corresponden a la combinación lineal de las bandas de absorción de los cromóforos 2, 4 y C60 por separado; esto indica que no existe interacción electrónica en el estado fundamental. Es importante destacar la presencia de una nueva banda a 355 nm la cual se atribuye a un proceso de transferencia de carga intramolecular (ICT); adicionalmente la banda débil a 430 nm es característica de los monoaductos de C60 sustituidos en el enlace [6,6] que coincide con estudios ya realizados (de Lucas et al., 1996; Caporossi et al., 2009). Los datos de estos experimentos se resumen en la tabla 1.
Tabla 1. Datos de absorción Uv-vis para los compuestos JIC1, C60, 4 y 2.
Las propiedades del estado excitado de los derivados funcionalizados del fullereno C60 son herramientas que constituyen la base para el estudio y detección de procesos de transferencia electrónica en sistemas fotoactivos. Cuando se irradia con luz UV o luz visible se genera un estado singlete excitado, cuya vida media dura alrededor de los nanosegundos. Estos evolucionan rápidamente dentro de los microsegundos a un estado triplete excitado con rendimientos cuánticos alrededor de la unidad. La desactivación de cada estado excitado se produce por medio de fuorescencia, volviendo al estado fundamental (Guldi et al., 2000).
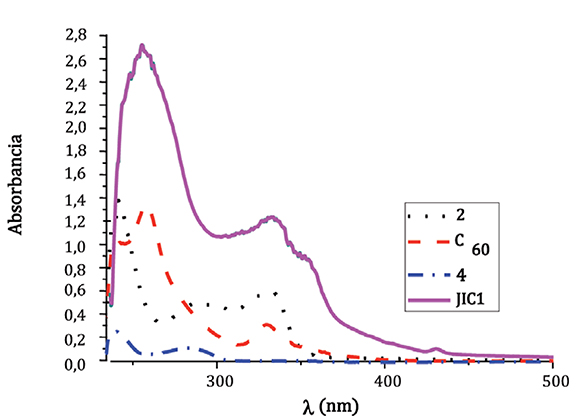
Con el fn de estudiar las propiedades foto-físicas del derivado JIC1, se midieron las características de fuorescencia (Figura 2), las medidas se hicieron en cloroformo/hexano variando su proporción con el propósito de variar la polaridad del medio.
Figura 2. Espectros de fuorescencia del compuesto fIC1, en diferentes proporciones de cloroformo/hexano
Las características de los espectros obtenidos en cada disolución presentan un mismo camino de desactivación por fuorescencia, pero, como se puede apreciar en la figura 2, la desactivación por fuorescencia es apreciable al aumentar la polaridad del sistema de disolventes, es decir, que hay una competencia entre la desactivación por fuorescencia y el proceso de separación de carga, donde se evidencia que este último está favorecido en el caso del compuesto JIC1. Esto se debe a que cuando un disolvente es más polar puede solvatar más fácilmente el estado de separación de carga que un disolvente apolar, es decir, el estado excitado del compuesto JIC1 favorece el proceso de transferencia electrónica intramolecular sobre la desactivación por emisión.
Las propiedades Redox del compuesto JIC1 fueron estudiadas por voltametría cíclica. Estas medidas electroquímicas se llevaron a cabo a una velocidad de barrido de 0.1 V/s en una celda convencional con un arreglo de tres electrodos, compuesto por un electrodo de trabajo de carbono vitrifcado de 1 mm de diámetro, un electrodo de pseudo-referencia de platino y un contra-electrodo de platino. Las medidas se realizaron a temperatura ambiente utilizando argón. Estas medidas se realizaron en una disolución 0.1 M de electrolito soporte hexafuorofosfato de tetrabutilamonio (TBAPF6) en una mezcla de disolventes tolueno/acetonitrilo 4:1.
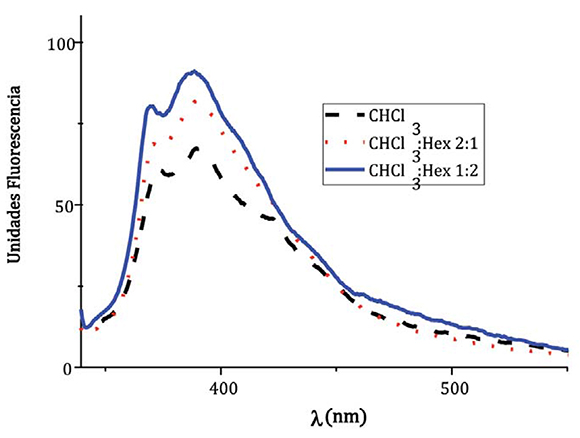
En la Figura 3, se muestra el voltamperograma cíclico normalizado correspondiente al compuesto JIC1. En este experimento no se evidenció ningún proceso de oxidación, lo que demuestra que los potenciales de oxidación para el cable molecular son bastante altos y éste probablemente no interviene directamente en el proceso de transferencia electrónica intramolecular descrito en los experimentos de absorción y emisión. En la zona catódica se observan 3 ondas de reducción reversibles y otro potencial adicional irreversible (los valores de los potenciales se encuentran registrados en la Tabla 2). Estos procesos de reducción se atribuyen a los cuatro primeros potenciales de reducción del fullereno C60, el cual, es capaz de aceptar seis electrones de manera secuencial reversiblemente.
Figura 3. Voltamperograma cíclico del compuesto JIC1
Tabla 2. Potenciales de reducción para el compuesto JIC1 y C60
El desplazamiento de los picos a potenciales catódicos, como se muestra en la tabla 2, se debe a que en el anillo de fullereno C60 está aumentado la energía del LUMO por la saturación de uno de sus dobles enlaces cambiando la conformación piramidal planar con hibridación sp2 a una conformación trigonal con hibridación sp3 .
Además, las cuatro reducciones indican una falta de interacción electrónica entre los núcleos de fullereno en el estado fundamental, que es consistente con estudios previos de otros C60 tipo dumbell (Martín & Sánchez, 2007; la Rosa et al., 2014). Por ltimo, el desplazamiento de los picos a potenciales catódicos evidencia la formación de un sistema de cargas separadas en las cuales no hay una diferencia en el comportamiento electrónico en cada unidad fulleropirrolidiníca, dado que se presentan exactamente el perfl de reducción, en el cual se puede interpretar que una unidad de C60 dona la misma proporción de carga que la otra acepta de manera reversible.
Para describir los aspectos de los anteriores experimentos, se realizó un modelamiento computacional a nivel de RPM3 del compuesto JIC1, con el propósito de obtener más información de sus propiedades electrónicas.
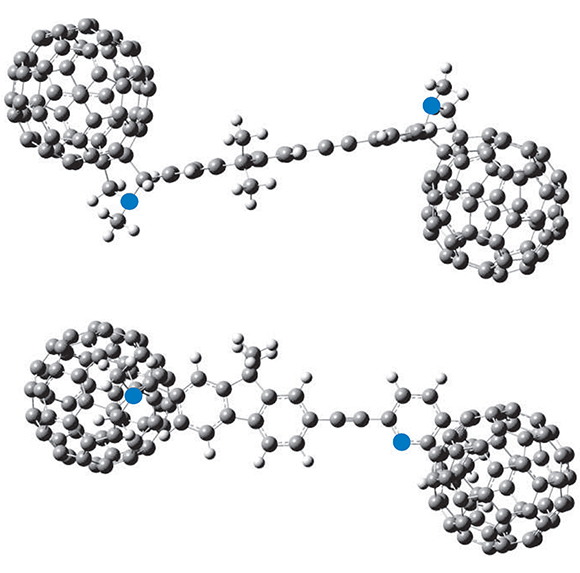
En la Figura 4 se muestra la geometría optimizada para la molécula JIC1. Como se puede ver, el cable molecular es totalmente planar lo que quiere decir que su conformación es adecuada para los procesos de transferencia electrónica intramolecular, asimismo, se puede ver que su energía es adecuada y convencional para compuestos en los que la deslocalización entre sus electrones p es completa, (energía de deslocalización).
Figura 4. Estructura de más baja energía para el compuesto JIC1
Por otra parte, se puede ver que no hay impedimento estérico entre la unidad del fuoreno y la piridina ya que el grupo de anclaje, en este caso el grupo etinílico, no posee hidrógenos que puedan alterar su alto grado de planaridad; lo que signifca que con este espaciador se presenta una alta conjugación, requisito indispensable para una efectiva comunicación; hechos soportados en los experimentos de fuorescencia y electroquímica.
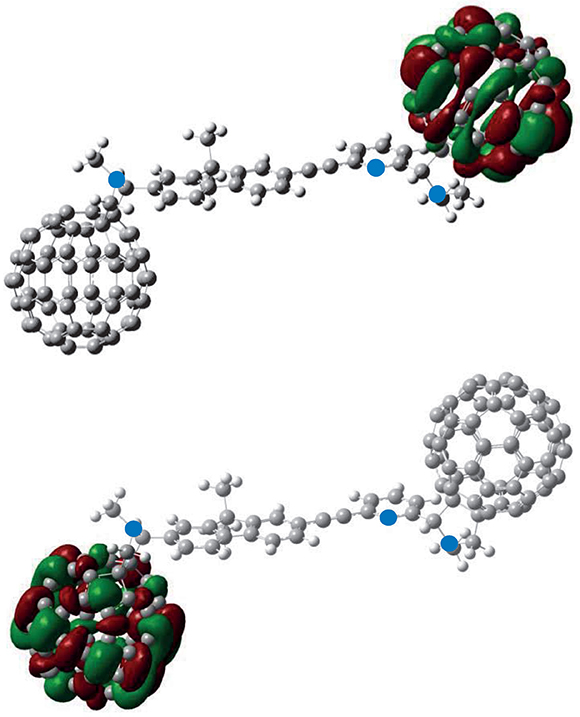
El estudio de los orbitales de frontera del compuesto JIC1 mediante un modelo de SCF, tanto en el vacío como en cloroformo (método PCM), se evidenció que el orbital HOMO se encuentra localizado exclusivamente en la unidad de C60 adyacente al fuoreno, mientras que el orbital LUMO se encuentra localizado sobre la unidad de C60 unida a la piridina (ver Figura 5). Estas particularidades se deben a que el C60, unido al fragmento de fuoreno tiene características electrónicas J-excedentes, mientras que la unidad de C60 adyacente a la unidad de piridina presenta características J-defcientes. Si tenemos en cuenta que las unidades mencionadas anteriormente están separadas por un puente de tipo acetilénico, estas mismas se pueden estimar como dos entidades separadas, aunque formen parte de la misma molécula. Por tanto, cuando se somete a foto-excitación, el estado excitado experimenta un fenómeno de transferencia de carga desde el fragmento J-defciente hasta el fragmento J-excedente, con una participación poco signifcativa del espaciador J-conjugado.
Figura 5. Contorno de densidades electrónicas para los orbitales de frontera para el compuesto JIC1
3. Parte experimental
El control de los avances de reacción se realizó por TLC en placas comerciales de sílica Merck en soporte de aluminio 60 F254. Los espectros de RMN se tomaron en un espectrómetro Bruker Avance 400Hz con CDCl3 como disolvente. Los espectros de masas se tomaron en un espectrómetro Shimadzu GCMS-QP2010 mediante la inserción por sonda directa a 70 eV. Los espectros FT-IR se tomaron en un espectrómetro Shimadzu FT-IR IRAffnity-1; y los espectros de UV-vis, en un espectrómetro Shimadzu PharmaSpec 1700 usando diclorometano como disolvente a una concentración aproximada a 1x10-5M. Los espectros de emisión (fuorescencia) se tomaron en un espectrofuorímetro Jasco FP-8500 usando diclorometano y hexano como disolventes, la longitud de excitación se escogió de acuerdo al máximo de absorción establecido para el sistema. La voltamperometría cíclica se llevó a cabo en un potenciostato-galvanostato METRON AUTOLAB 300N usando un sistema de confguración de tres electrodos. Las mediciones se hicieron en una mezcla de acetonitrilo y tolueno usando como electrolito soporte una solución de TBAPF6 al 0.1 M. El sistema de tres electrodos fue compuesto por un electrodo de carbono vitrifcado como electrodo de trabajo, un electrodo de pseudo referencia de platino y un contra-electrodo de platino.
3.1. 2,7-Dibromo-9,9-dioctilfuoreno (1)
En un balón se pesaron (6.90 g, 21.4 mmol) de 2,7-dibromofuoreno, (0.339 g, 1.03 mmol) de bromuro de tetrabutilamonio y (8.27 g, 42.8 mmol) de n-bromooctano en una mezcla heterogénea de disolventes: tolueno (40 mL) y una solución al 50% de NaOH (40 mL). La mezcla de reacción se agitó y se calentó a 60 oC toda la noche; posteriormente, se separó la fase orgánica, se lavó con agua (200 mL) y se secó con sulfato de magnesio. El disolvente se destiló a presión reducida hasta la sequedad, el crudo se purifcó por cromatografía de columna en silica gel, se utilizó hexano/CH2Cl2 10:1 como eluyente y se obtuvo un sólido amarillo, con 85% de rendimiento, p.f. 87 oC.
FT-IR (ATR) u = 3011, 2993, 2867, 1546, 1432, 1322 cm-1; RMN-1H (CDCl3, 400 MHz). 6 = 0.62-0.84 (m, 4H), 0.85 (t, J = 10.5 Hz, 6H), 1.18-1.89 (m, 23H), 1.92 (c, J = 4.5 Hz, 4H), 7.45-7.54 (m, 6H) ppm; RMN-13C (CDCl3, 100 MHz).6 = 14.5, 23.0, 23.1, 24.0, 28.6, 29.2, 29.6, 29.6, 30.3, 32.2, 33.3, 34.4, 40.6, 56.1, 62.6, 77.0, 77.4, 77.9, 120.6, 121.5, 121.9, 126.6, 127.7, 130.6, 132.4, 139.5, 148.9, 153.0 ppm; MS (EI): m/z 542 [M+].
3.2. 2-Bromo-7-formil-9,9-dioctilfuoreno (2)
En un matraz de dos bocas previamente fameado, se disolvieron (5.20 g, 9.48 mmol) del compuesto 1 en (50 mL) de éter etílico anhidro. Posteriormente se adicionó, gota a gota, una solución de n-BuLi 1.6 M en hexano (3.98 mL, 9.95 mmol) a -78 oC y bajo atmósfera de argón. La solución se agitó por media hora, se dejó alcanzar temperatura ambiente y se continuó agitando por otra media hora. Luego, se enfrió de nuevo a -78oC y se adicionó (1.1 mL, 9.48 mmol) de DMF y se agitó toda la noche. Posteriormente, se adicionó una solución de HCl 2.0 M (20 mL) y se agitó por dos horas más. La fase orgánica se separó y la acuosa se lavó con éter (20 mL), se combinaron las fases orgánicas y se secaron en sulfato de magnesio. El crudo se purifcó por cromatografía de columna en silica gel con hexano/CH2Cl2 10/1 como eluyente y se obtuvo un sólido amarillo, con 76% de rendimiento, p.f. 102 oC.
FT-IR (ATR) u = 3041, 2923, 2843, 1701, 1566, 1532, 1452, 1320 cm-1; RMN-1H (CDCl3, 400 MHz). 6 = 0.58-0.76 (m, 4H), 0.80 (t, J = 14.1 Hz, 6H), 1.05-1.88 (m, 23H), 1.99 (c, J = 9.6 Hz, 4H), 7.52 (dd, J1 = 8.4 Hz, J2 = 1.2 Hz, 2H), 7.65 (d, J = 8.4 Hz, 1H), 7.87-7.99 (m, 3H), 10.07 (s, 1H) ppm; RMN-13C (CDCl3, 100 MHz). 6 = 13.6, 22.1, 23.1, 28.7, 29.3, 31.2, 39.6, 55.0, 94.4, 119.6, 122.0, 130.0, 131.8, 135.2, 135.8, 138.7, 146.0 150.4, 153.9, 191.6 ppm; MS (EI): m/z 496 [M+].
3.3. 6-((trimetilsilil)etinil)-2-piridincarboxaldehído (3)
En un balón de dos bocas previamente seco, se pesó (1.0 g, 3 mmol) de 6-bromopicolinaldehido. Posteriormente, se adicionaron (0.068 g, 0.15 mmol) de CuI,
(0.310 g, 0.15 mmol) de Pd(PPh3)4, en 15.42 mL de tolueno y 5.2 mL de diisopropilamina. La solución se agitó y se purgó con argón por 20min. Terminado este tiempo, se adicionaron (1.1 mL, 4 mmol) de trimetilsililacetileno gota a gota y se continuó el fujo de argón a 100 °C toda la noche. Después la solución se extrajo con CH2Cl2, y se lavó con una solución acuosa de NH4Cl y una solución saturada de sal. La fase orgánica se secó con MgSO4. El disolvente se evaporó a presión reducida. El crudo de reacción se purifcó por cromatografía de columna en silica gel, se utilizó hexano/CH2Cl2 1:4 como eluyente, se obtuvo un sólido amarillo, con 75% de rendimiento.
FT-IR (ATR) u = 3059, 2150, 1707, 1251 cm-1; RMN-1H (CDCl3, 400 MHz). 6 = 0.33 (s, 9H), 7.70 (d, J = 7.59 Hz, 1H), 7.87 (t, J = 7.68 Hz, 1H), 7.93 (d, J = 7.74 Hz, 1H), 10.10 (s, 1H) ppm; RMN-13C (CDCl3, 100 MHz). 6 = 0.32, 96.8, 102.4, 120.6, 131.4, 137.3, 143.7, 152.9, 192.9 ppm; MS (EI): m/z 117 [M+].
3.4. 6-etinil-2-piridincarboxaldehído (4)
Se pesaron (0.6 g, 2.8 mol) de 3 y (4.0 g, 2.8 mmol) de K2CO3. Estos sólidos se disolvieron en 20 mL de una solución 1:1 CH3OH/THF, la mezcla se agitó por 30min a temperatura ambiente. Posteriormente, el crudo de reacción se lavó con agua y luego, se extrajo con CH2Cl2. La fase orgánica se separó y se secó sobre MgSO4, después, se evaporó a presión reducida. El crudo de reacción se purifcó por cromatografía de columna en silica gel. Se utilizó CH2Cl2/hexano 4:1 como eluyente, se obtuvo un sólido amarillo claro, con 30% de rendimiento.
FT-IR (ATR) u = 3408, 2956, 2200, 1707, 1448, 1251, 935 cm-1; RMN-1H (CDCl3, 400 MHz). 6 = 3.30 (s, 1H), 7.73 (dd, J1 = 1.21 Hz, J2 = 7.63 Hz, 1H), 7.91 (t, J2 = 7.63 Hz, 1H), 7.98 (dd, J1 = 1.20 Hz, J2 = 7.78 Hz, 1H), 10.10 (d, J = 0.67 Hz, 1H) ppm; RMN13C (CDCl3, 100 MHz). 6 = 78.6, 121.0, 131.4, 136.4, 137.5, 142.9, 153.0, 192.8 ppm; MS (EI): m/z 102 [M+].
3.5. 6-((7-formil-9,9-dioctil-9H-fuoren-2 il)etinil)piridincarboxaldehído (5) En un balón de dos bocas previamente seco, se pesaron (0.05 g, 0.2 mmol) de 4 y (0.23 g, 0.24 mmol) de 2. La mezcla se purgó con argón. Posteriormente, se adicionaron (0.068 g, 0.15 mmol) de CuI, (0.310 g, 0.15 mmol) de Pd(PPh3)4 en 10 mL de tolueno seco. La solución se agitó y se purgó con argón por 20 min, luego se adicionaron 5 mL de diisopropilamina. Se continuó calentando a 100 °C toda la noche. Después, la mezcla de reacción se extrajo con 25 mL de CH2Cl2, y se lavó con 15 mL de una solución acuosa de NH4Cl y una solución saturada de sal. La fase orgánica se secó con MgSO4. Posteriormente, el disolvente se destiló a presión reducida hasta la sequedad. El crudo de reacción se purifcó por cromatografía de columna en silica gel, se utilizó hexano/CH2Cl2 1:4 como eluyente y se obtuvo un sólido naranja, con 33% de rendimiento.
FT-IR (ATR) u = 2924, 2852, 2210, 1695, 1604, 1575, 1458, 1207, 1184, 819 cm-1; RMN-1H (CDCl3, 400 MHz). 6 = 0.62-0.77 (m, 4H), 0.85 (t, J = 10.5 Hz, 6H), 1.18-1.50 (m, 23H), 1.92 (c, J = 4.5 Hz, 4H), 7.69-7.73 (m, 2H), 7.82-7.88 (m, 3H), 7.93-7.97 (m, 5H), 10.11 (s, 1H), 10.16 (s, 1H), ppm; RMN-13C (CDCl3, 100 MHz). 6 = 14.1, 22.6, 23.8, 29.2, 29.9, 31.8, 40.2, 55.5, 63.6, 88.4, 91.4, 120.6, 121.0, 123.2, 126.9, 130.5, 131.1, 131.4, 135.9, 137.5, 152.0, 152.3, 153.1, 192.2, 192.9 ppm; MS (EI): m/z 322 [M+].
3.6 Compuesto JIC1
En un balón de dos bocas previamente seco se disolvieron, (0.026 g, 1 mmol) del compuesto 5, (0.140 g, 4.0 mmol) de C60 y (0.053 g, 6.0 mmol) de N-octilglicina en 46 mL de tolueno. La solución se calentó hasta ebullición, utilizando una trampa de Dean-Stark y en atmósfera de argón durante 24 h. El crudo de reacción se purifcó por cromatografía de columna en sílica gel, se utilizó disulfuro de carbono como eluyente y se obtuvo un sólido marrón, con 31% de rendimiento.
RMN-1H (CDCl3, 400 MHz). 6 = 1.65-2.06 (m, 68H), 2.69 (d, J = 32.83 Hz, 1H), 3.17-3.33 (m, 1H), 4.20 (dd, J1 = 11.74, J2 = 23.29 Hz, 1H), 4.45 (s, 1H), 5.15 (dd, J1 = 3.62, J2 = 10.14 Hz, 1H), 5.46 (s, 1H), 7.56-7.62 (m, 4H), 7.67 (d, J = 8.21 Hz, 3H), 7.83 (t, J = 7.83 Hz, 1H), 8.08 (d, J = 7.93 Hz, 1H) ppm; RMN-13C (CDCl3, 100 MHz) . 6 = 14.2, 22.6, 27.6, 28.4, 28.5, 29.3, 29.4, 29.6, 30.4, 31.4, 31.9, 32.0, 53.5, 55.3, 68.1, 69.0, 69.2, 83.1, 99.8, 126.9, 141.6, 141.9, 144.6, 145.0, 146.0, 147.3, 153.6.
4. Conclusiones
Se llevó a cabo la síntesis de un compuesto tipo D-p-A, basado en fuoreno, piridina y fullereno, utilizando, como unión entre las diferentes unidades, un enlace acetilénico. Tanto los datos teóricos como los experimentales muestran una buena comunicación y por ende, una transferencia electrónica efectiva.
Asímismo, estos resultados mostraron que no hay una competencia electrónica entre las dos unidades fullerénicas, por el contrario, la unidad acoplada al fuoreno act a como especie electro-donadora con su distribución electrónica ubicada en el HOMO y la unidad acoplada a la piridina act a como especie electro-aceptora con su distribución electrónica ubicada en el LUMO, lo cual es un comportamiento muy usual en moléculas tipo dumbell asimétricas.
Agradecimientos
Los autores agradecen a COLCIENCIAS (Colombia) y a la Universidad del Valle (Colombia) por la fnanciación de este trabajo de investigación.
Referencias [ Links ]
Atienza, C., Insuasty, B., Seoane, C., Martín, N., Ramey, J., Rahman, G. M. A. et al. (2005). Connecting Two C60 Stoppers to Molecular Wires: Ultrafast Intramolecular Deactivation Reactions. Journal of Materials Chemistry, 15(1), 124. [ Links ]
Caporossi, F., Floris, B., Galloni, P., Gatto, E., Venanzi, M., Mozzi, A. F. et al. (2009). Fluorene-fullerene Dyads: Modulation of Interaction. Synthetic Metals, 159(14), 1403-1408. [ Links ]
de Lucas, A. I., Martin, N., Sánchez, L., & Seoane, C. (1996). The frst Dumbbelltype C60 Dimer Connected by a Double Donor Spacer. Tetrahedron Letters, 37(52), 9391-9394. [ Links ]
Du, B., Wang, L., Yuan, S.-C., Lei, T., Pei, J., & Cao, Y. (2013). Indeno[2,1-C]fuorene-Based Blue Fluorescent Oligomers and Polymers: Synthesis, Structure, Photophysical and Electroluminescence Properties. Polymer, 54(12), 2935-2944. [ Links ]
Echegoyen, L. & Echegoyen, L. E. (1998). Electrochemistry of Fullerenes and Their Derivatives. Accounts of chemical research, 4842 (97), 593-601. [ Links ]
Facchetti, A. (2007). Semiconductors for Organic Transistors. Materials Today, 10(3), 28-37. [ Links ]
Guldi, D. M., Prato, M., & Farmaceutiche, S. (2000). Excited-State Properties of C 60 Fullerene Derivatives. Accounts of chemical research, 33(10), 695-703. [ Links ]
Haddon, R. C., Brus, L. E., & Raghavachari, K. (1986). Electronic structure and bonding in icosahedral C 60. Chemical Physic Letter, 125, 459-464. [ Links ]
La Rosa, A., Gillemot, K., Leary, E., Evangeli, C., Filippone, S., Rubio-bollinger, G. et al. (2014). Does a Cyclopropane Ring Enhance the Electronic Communication in Dumbbell-Type C 60 Dimers. Journal of Organic Chemistry, 79, 4871-4877. [ Links ]
Langa, F., Gomez-Escalonilla, M. J., Rueff, J.-M., Figueira Duarte, T. M., Nierengarten, J.-F., Palermo, V. et al. (2005). Pyrazolino[60]fullerene-Oligophenylenevinylene Dumbbell-Shaped Arrays: Synthesis, Electrochemistry, Photophysics, and Self-Assembly on Surfaces. Chemistry a European Journal, 11(15), 4405-4415. [ Links ]
Lee, W.-Y., Cheng, K.-F., Wang, T.-F., Chen, W. C., & Tsai, F.-Y. (2010). Photovoltaic Properties of Low Band-Gap Fluorene-Based Donor-acceptor Copolymers. Thin Solid Films, 518(8), 2119-2123. [ Links ]
Martín, N., & Sánchez, L. (2007). Electronic Communication in Tetrathiafulvalene ( TTF )/ C 60 Systems: Toward Molecular Solar Energy Conversion Materials. Accounts of chemical research, 40(10), 1015-1024. [ Links ]
Wang, Y., Huang, J., Zhou, H., Ma, G., Qian, S., & Zhu, X. (2011). Synthesis, Optical Properties and Ultrafast Dynamics of a 2 , 1 , 3-Benzothiadiazole- Based Red Emitter with Intense Fluorescence and Large Two-Photon Absorption. Dyes and Pigments, 92(1), 573-579. [ Links ]
Xie, Q., Perez-Cordero, E., & Echegoyen, L. J. (1992). Electro-chemical detection of C606-and C706-: Enhanced stability of fullerides in solution. Journal of the American Chemical Society, 114, 3978-3980. [ Links ]

Revista de Ciencias por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento 4.0.