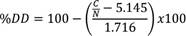1 Introducción
El quitosano es un polisacárido conformado por unidades de 2-amino-2-deoxi-β-D- glucopiranosa y 2-acetamida-2-deoxi-β-D-glucopiranosa, que se obtiene a partir de la quitina mediante procesos de desacetilación y es hoy en día uno de los materiales a la vanguardia en aplicaciones biomédicas 1,2 debido a su biocompatibilidad, biodegradabilidad y abundancia, teniendo en cuenta que la quitina es el segundo polisacárido más abundante en la naturaleza después de la celulosa. Existe un gran número de investigaciones relacionadas con las aplicaciones biomédicas del quitosano, entre ellas, suturas biodegradables a partir de fibras de celulosa recubiertas con quitosano, aprovechando su propiedad antibacterial que evita efectos secundarios como irritaciones e inflamaciones. Adicionalmente, este polisacárido se ha empleado para la preparación de páncreas artificial mediante islotes pancreáticos compuestos de alginato-quitosano 3. Mediante el entrecruzamiento de sus cadenas, el quitosano se puede usar para desarrollar hidrogeles 4,5, es decir, redes tridimensionales poliméricas que tienen aplicaciones como: crecimiento de fibroblastos humanos, tratamiento de quemaduras y patologías epidérmicas 6, liberación controlada y dirigida de medicamentos como la insulina 7 y la inmovilización de enzimas 8.
Los productos para aplicaciones en diagnóstico clínico y rehabilitación física hacen parte del desarrollo tecnológico necesario para mejorar la calidad de vida. Mediante la formación de geles y membranas de quitosano, se generan materiales que permiten el transporte tanto pasivo como facilitado de diferentes especies químicas a través de su matriz polimérica 9. Ese transporte incluye la migración de iones mediante reacciones de intercambio iónico bajo un gradiente de potencial electroquímico alto (debido a la presencia de grupos ionizables como los grupos amino) y que tiene una dependencia del pH 10. Es decir, que se pueden obtener biomateriales a base de quitosano con propiedades electroconductoras, de manera similar al trabajo realizado en nuestro grupo de investigación donde se usó alginato como material de partida. Estos geles conductores y de origen natural pueden llegar a ser útiles en electroterapia. En este reporte se presentan los primeros resultados de la investigación en geles conductores que se adelanta en la Universidad del Valle. Se llevó a cabo la preparación de geles a base de quitosano mediante el entrecruzamiento químico de sus cadenas y su posterior caracterización fisicoquímica, mediante medidas de viscosidad, conductividad eléctrica y pH. Estos resultados se compararon frente a un gel de formulación comercial.
2. Parte experimental
2.1 Materiales
Quitosano comercial de mediano peso molecular (con grado de deacetilación de 75- 85%, Sigma - Aldrich, SL, USA); glutaraldehído (25% p/p en agua, Panreac, Barcelona, España); ácido acético (99.8% p/p, Sigma - Aldrich, SL, USA); bromuro de potasio anhidro (Sigma - Aldrich, SL, USA).
2.2 Preparación de los geles
Para la preparación de los geles se utilizó solución de quitosano con una concentración de 2% p/v en ácido acético al 2% v/v de acuerdo con lo reportado previamente por Schuetz et al11. Este parámetro se mantuvo constante en todas las muestras. A la solución de quitosano se le adicionó una solución de glutaraldehído al 25% como agente entrecruzante. Con el fin de obtener diferentes grados de entrecruzamiento, se adicionaron diferentes cantidades de glutaraldehído en solución, obteniendo concentraciones del agente entrecruzante de 0.093, 0.106 y 0.112% v/v. Las concentraciones de glutaraldehído empleadas en este estudio son aquellas a las que fue posible obtener geles de quitosano con viscosidades similares a las de los productos actualmente disponibles para aplicaciones en diagnóstico clínico.
2.3 Caracterización fisicoquímica del quitosano y los geles formados
El quitosano como material de partida se caracterizó por análisis elemental usando un analizador elemental CHN AnalyzerTM Flash EA 1112 Series. El peso molecular viscoso se determinó a 25° C, usando un viscosímetro capilar tipo Ostwald tamaño 300, para lo cual se prepararon soluciones de quitosano con concentraciones entre 1.0x10-2 y 8.0x10-3 gmL-1 en ácido acético al 1% v/v. El quitosano y los geles formados a partir de éste fueron caracterizados por espectroscopia infrarroja con transformada de Fourier (FTIR) en un espectrofotómetro Nicolet® 6700 empleando pastillas de KBr en el rango de 400-4000 cm-1.
La caracterización fisicoquímica de los geles se realizó evaluando la viscosidad absoluta, la conductividad eléctrica y el pH de los mismos. La viscosidad absoluta se determinó por medio de un viscosímetro de cizallamiento digital Brookfield™ Modelo LVDV-I PRIME a temperatura ambiente. La medición de la viscosidad de las muestras se hizo por ensayo y error, siguiendo el procedimiento reportado por Brookfield Engineering Laboratories, Inc 12,13. La conductividad eléctrica y el pH se determinaron, usando un medidor multiparámetros Eijkelkamp con electrodo de pH de membrana de vidrio con compensación de temperatura y celda de conductividad.
3. Resultados y discusión
Inicialmente se caracterizó el quitosano a utilizar como material de partida con el fin de conocer su peso molecular promedio viscoso Mv y su grado de desacetilación (DD), parámetros que permiten hacer una adecuada relación entre el polímero y el agente entrecruzante. Para conocer el peso molecular del quitosano, se utilizó la expresión de Mark-Houwink-Sakurada (Ecuación 1), donde K y α son valores constantes que dependen del sistema polímero-solvente bajo estudio y [η] que es la viscosidad intrínseca del material. Para el sistema quitosano-ácido acetico al 1% v/v las constantes K = 4.74x10-3 mLg-1 y α = 0.72 han sido reportadas previamente por Kasaai 14 y colaboradores, obteniendo así un peso molecular promedio viscoso de 208 kDa. Este resultado está entre las especificaciones del fabricante que reporta un valor entre 190 kDa y 310 kDa, clasificándolo como quitosano de mediano peso molecular.
[η ]=KMv (
Mediante análisis elemental se obtuvo la siguiente composición elemental: C, 39.2%; H, 7.22%; N, 7.19%. A partir de estos valores y utilizando la Ecuación 2 en la cual se observa la relación C/N en la muestra de quitosano, se obtuvo un DD promedio del 81.2%.
Los ensayos preliminares para determinar los valores de concentración de quitosano en ácido acético para la preparación de los geles mostraron viscosidades muy altas para los geles obtenidos con concentraciones de quitosano superiores al 2% p/v. Este resultado es consistente con el reportado por Schuetz et al. 11, quienes mostraron que una solución de quitosano al 2% p/v es adecuada para la preparación de geles debido a que permite una agitación homogénea de la mezcla de reacción. La viscosidad de la solución está también asociada con el peso molecular del polímero, ya que para muestras de quitosano de mediano y alto peso molecular se obtienen soluciones altamente viscosas. El quitosano empleado en esta investigación presentó un peso molecular de 208 kDa. Por lo tanto, se decidió utilizar soluciones al 2% p/v para la preparación de los geles conductores.
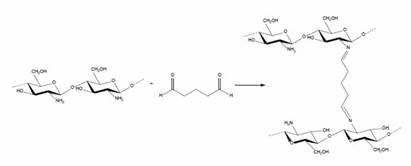
La reacción de entrecruzamiento de las cadenas de quitosano ocurre en medio acuoso por la formación de enlaces covalentes tipo imina vía reacción de Schiff 15, en la cual intervienen los grupos formilo del agente entrecruzante y el grupo amino del quitosano como se muestra en la Figura 1.
La modificación estructural de la red polimérica del quitosano se evidenció por la aparición en el espectro IR de las bandas debidas al estiramiento del enlace C=O, alrededor de 1,700 cm-1. Del mismo modo, se observaron vibraciones de estiramiento del C-O en la región entre 1,200-1,300 cm-1 y la deformación del C-O-H entre 1,350 y 1,450 cm-1. La Figura 2 presenta el espectro obtenido para el quitosano comercial y para muestras del quitosano con diferentes grados de entrecruzamiento. En la Tabla 1 se presentan los resultados espectroscópicos obtenidos en este trabajo y se comparan con los resultados reportados previamente en la literatura por Monteiro et al. 16

Figura 2 Espectros FTIR del quitosano con diferentes grados de entrecruzamiento. (a) Intervalo de 4,000 a 600 cm-1 (b) Intervalo de 2,000 a 600 cm-1.
Tabla 1 Caracterización por espectroscopia infrarroja FT-IR de geles entrecruzadas de quitosano.
| Grupos funcionales | Números de onda (cm -1 ) | Valor obtenido (cm -1 ) | Valor reportado por Monteiro et al. (16)(cm -1 ) |
|---|---|---|---|
| C=N | - | 1,660 | 1,655 |
| C=C | Alrededor de 1,600 | - | 1,562 |
| CHO | Alrededor de 1,720 | 1,720 | 1,720 |
| -OH | Alrededor de 1,420 | 1,421.27 | 1,400 |
Para realizar el análisis de las medidas de viscosidad absoluta, se prepararon varias muestras con diferentes cantidades de glutaraldehído, acotando el máximo a un valor de 0.112% v/v de glutaraldehído en solución. En la literatura consultada no se encontraron reportes de datos experimentales sobre la caracterización reológica para geles de quitosano comercial en términos de la viscosidad absoluta y tampoco de geles entrecruzados con glutaraldehído. Sin embargo, los geles obtenidos con quitosano comercial y una concentración de 0.093% v/v de glutaraldehído presentaron una viscosidad absoluta de 365 x103 cP, lo cual se acerca razonablemente al valor del gel comercial Acuagel® usado como producto de referencia. En la Tabla 2 se reportan los valores de viscosidad absoluta, conductividad y pH de los geles preparados y del gel comercial. Al comparar los valores de viscosidad del quitosano sin modificar con los valores de los geles obtenidos, se observa un incremento considerable en la viscosidad debido al proceso de entrecruzamiento de las cadenas del quitosano.
Tabla 2 Resultados de valores medios de conductividad iónica (κ) y pH de geles de quitosano entrecruzado con glutaraldehído.
| Cantidad de entrecruzante (%v/v) | Viscosidad (μ) x10 3 (cP) | Conductividad (κ) (Sm -1 ) | pH | T (°C) |
|---|---|---|---|---|
| 0.112 | 326±1 | 0.2560 | 3.5 | 26.3 |
| 0.106 | 345±1 | 0.2417 | 3.5 | 26.2 |
| 0.093 | 365±1 | 0.2140 | 3.5 | 26.4 |
| 0.000 | 0.976±0.01 | 0.2039 | 3.4 | 24.8 |
| Acuagel® | 373±1 | 0.0790 | 6.7 | 25.3 |
Los resultados observados en la tabla anterior muestran que las conductividades de los geles a base de quitosano son altas respecto al gel comercial Acuagel®, debido al contenido de ácido acético en el medio que libera parcialmente iones (H+) aumentando la conductividad. Los valores de conductividad estuvieron en el intervalo entre 0.214 y 0.256 Sm-1, valores menores que los reportados por Li et al. 17, (0.35 Sm-1 a 1.5% p/v) quien además ha estudiado la conductividad con otros ácidos débiles como el ácido fórmico y propanóico.
Los geles obtenidos no presentan valores de pH neutros, sin embargo aplicaciones de estos materiales con valores de pH ácidos han sido reportadas para la fabricación de membranas 18 donde el entrecruzamiento de quitosano en solución de alcohol polivinílico (PVA) con glutaraldehído para la preparación de membranas se facilita en intervalos de pH de 4.00 ± 0.05, un valor ligeramente más alto que el valor de los experimentos de entrecruzamiento del quitosano en el presente trabajo.
Se estudió el efecto de la temperatura en los valores de conductividad y pH para los geles obtenidos con quitosano, encontrando un incremento proporcional al aumento de temperatura, pasando de 0.26 Sm-1 a 0.31 Sm-1 cuando la temperatura se incrementó de 26 a 40° C. Probablemente al aumentar la temperatura se produce una mayor movilidad de los iones en un medio menos viscoso. En este estudio no se observaron variaciones significativas de pH con el cambio de temperatura.
4. Conclusiones
Los resultados obtenidos mostraron que es posible obtener geles conductores a partir de polímeros biodegradables y biocompatibles como el quitosano, con valores de viscosidad y conductividad cercanos a los de las formulaciones comerciales. Se observó una correlación entre los valores de viscosidad y conductividad con el grado de entrecruzamiento del biomaterial. Sin embargo, los valores de pH para los geles obtenidos fueron inferiores a los encontrados en el producto comercial de referencia, por lo que se requieren nuevos estudios encaminados a obtener geles de este tipo con valores de pH menos ácidos, donde se evalúe también la estabilidad de estos materiales.