1 Introducción
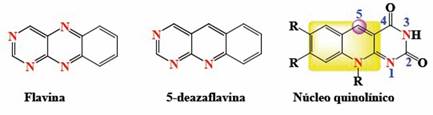
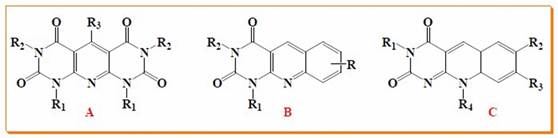
Las deazaflavinas y análogos han sido estudiadas desde el punto de vista químico, biológico y farmacéutico. 1,5 Las 5-deazaflavinas (Figura 1) no son más que estructuras análogas a las flavinas cuya diferencia radica en el reemplazo del nitrógeno en la posición 5 por un átomo de carbono.
Las investigaciones y reportes, en síntesis, funcionalidad y propiedades biológicas de deazaflavinas, han aumentado, no solo para estudios de mecanismo enzimático en flavoproteínas, sino también, en reacciones catalizadas por flavinas y potencial bioreductivo en sistemas biológicos. Además, de numerosos reportes de las propiedades biológicas que han presentado. 1,13 A pesar de la similitud estructural con la riboflavina, las 5-deazaflavinas, tienen propiedades electroquímicas y fotoquímica distintivas y de utilidad biológica, como resultado del grado y naturaleza de los sustituyentes. 14
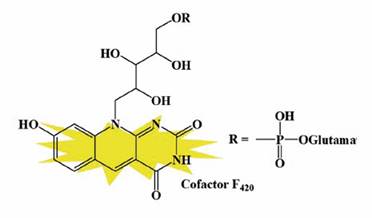
Los derivados de 5-deazaflavinas se han preparado y evaluado como potenciales antagonistas de las riboflavinas y se ha descubierto su multifuncionalidad y reactividad como cofactor de varias flavinas que se hallan en la naturaleza, como el cofactor F420 involucrado en reacciones redox, químicamente exigentes a nivel biológico 15 (Figura 2).
También han sido atractivos para aplicaciones fotofísicas ya que presentan alta fluorescencia en solución y en estado sólido, cuando son expuestos a luz blanca, propiedades que hacen a estos sistemas, apropiados para el diseño de materiales electroluminiscentes, tales como los diodos orgánicos emisores de luz (OLEDs) 16,19.
2 Flavinas deazaflavinas: potencial redox
Las flavinas (del latín flavus, “amarillo”) son un grupo de compuestos orgánicos basados en pteridinas, formados por un sistema tricíclico heteronuclear, la fuente bioquímica es la vitamina riboflavina. La unidad estructural de la flavinas está frecuentemente unida a una adenoisina difosfato para formar flavin adenina dinucleótido (FAD) y, de otras circunstancias, se encuentra como flavin mononucleótido (o FMN), una forma fosforilada de la riboflavina. En una u otra forma, se encuentra presente la unidad estructural de la flavina como grupo prostético en flavoproteínas, como una coenzima y cataliza reacciones de óxido - reducción en sistemas biológicos, en donde el grupo flavina es el agente oxidante o reductor (Esquema 1). 20,26
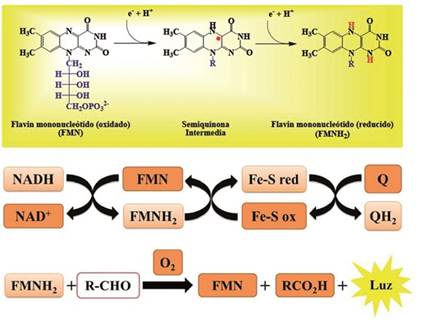
Esquema 1 Producción de luz mediante la oxidación catalítica en presencia de FMN-reductasa, dodecilaldehído y oxígeno.
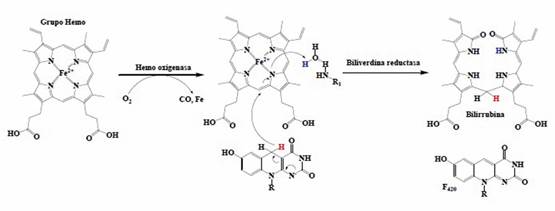
Además, la oxidación catalítica de NADH en presencia de flavin mononucleotido (FMN) reductasas produce luz. Es así, como la bioluminiscencia de organismos como la luciferase bacterial puede ser adecuada para determinar el conteo bacteriano tomando el NADPH como base para la detección 27 (Esquema 1) o como marcadores para estudios de interacción DNA-Proteína. 28,29. En actinobacterias aeróbicas, el factor F420 se sintetiza a partir de riboflavina 24 que, posteriormente, es reducida por la enzima F420-dependiente glucosa-6-fosfato deshidrogenasa (Fgd). F420H2-dependiente reductasa, acopla la re-oxidación de F420H2 para la reducción de un rango de compuestos orgánicos insaturados. Es así como el cofactor F420 está asociado en la persistencia micobacterial donde es requerido para reaccionar con sustancias oxigenadas y nitrogenadas (Esquema 2). 30,39.
2.1 Modelo de interacción de flavinas con proteínas
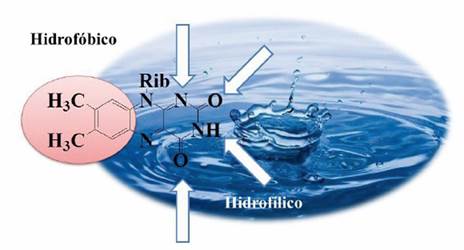
La selección por la cual esta variedad de funciones es llevada a cabo por enzimas particulares, está claramente dada por las interacciones de los núcleos de las isoaloxacinas de las flavinas con las proteínas. El núcleo de la isoaloxacina es la parte de la molécula que está involucrada en la catálisis. Ésta ofrece posibilidades de interacción con proteínas debido a su carácter anfipático; por ejemplo, el xileno es hidrofóbico y propenso a interactuar con áreas hidrofóbicas de las proteínas, mientras que el anillo pirimidínico es relativamente electrón-deficiente e hidrofílico y es comparable con las bases pirimidínicas en su capacidad para formar puentes de hidrógeno (Figura 3).
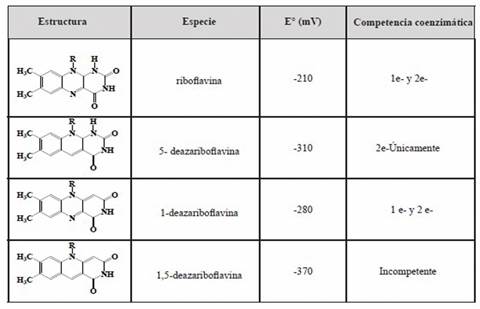
La riboflavina (vitamina B2) isoaloxacina tricíclica es quizás el agente biológico más versátil. En sus formas coenzimática 5’-fosfato (FMN) y 5’-ADP (FAD), participa en muchas reacciones redox como un intercambiador redox 1e-/2e-. La habilidad de la riboflavina para actuar en la interfase entre agentes de transferencia de 2 electrones (NADH) y agentes de transferencia de un electrón (ejemplo: hierro u oxígeno molecular) es el resultado de la accesibilidad cinética y termodinámica bajo condiciones biológicas. El análisis de competencia redox entre los análogos de riboflavinas sintéticas tales como 5-carba-5-deazariboflavina, 1-carba-1-deazaflavinas (incompetente en procesos redox) se muestra en la Tabla 1.
La sustitución en la posición 5, del sistema heterocíclico, es determinante para el proceso redox, dado que la sustitución de carbono por nitrógeno restringe al sistema 5-deaza en lo que respecta a la transferencia electrónica. Por contraste, el 1-carba análogo convierte al anillo uracilo a deazauracilo y hace que el heterociclo sea más difícil de reducir, pero le confiere la habilidad de llevar a cabo reacciones redox tanto de dos como de un electrón. 14,15
3 Rutas sintéticas para la obtención de derivados de 5 deazaflavinas
3.1 Deazaflavinas sintetizadas a partir de ácido barbitúrico y derivados
Los ácidos barbitúricos y análogos (Figura 4) son sustratos esenciales para la formación de deazaflavinas. Los reportes de reacciones que conducen a la obtención de deazaflavinas a partir de ácido barbitúrico y análogos parten de la construcción del anillo quinolínico a través de estrategias sintéticas simples a protocolos complejos. Una de las reacciones sencillas para obtención de deazaflavinas a partir de ácido barbitúrico, es una secuencia condensación tipo Knoevenagel, adición de Michael y ciclodeshidratación con aldehído aromáticos (Esquema 3) 41
La reacción procede cuando una parte de las moléculas se adiciona al aldehído aromático vía reacción de condensación de Knoevenagel, seguido de la adición de Michael de la segunda molécula de ácido barbitúrico. La etapa final es un proceso de heterociclación, bajo una fuente de nitrógeno. Las variaciones a esta metodología permiten explorar condiciones y reactantes. Por ejemplo, el uso de anilinas, incluyendo naftilaminas, como fuente de nitrógeno, generan estructuras con variedad de sustituyentes (Esquema 4). 42 Estos derivados se pueden obtener mediante la reacción tri-componente entre ácido barbitúrico, naftilamina y heteroaldehídos sustituidos con grupos electrodonantes.
La secuencia de reacción es vía formación del aducto de Knoevenagel, una arilidenpirimiditriona, que reacciona con la amina. La 2-naftilamina, tiene alta densidad de carga sobre el átomo Cα adyacente al grupo amino, facilitando la reacción de adición al doble enlace del aducto formado.
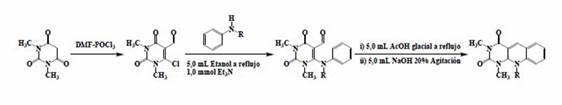
Explorando el alcance de la reacción, la diversidad en la sustitución de los derivados de deazaflavinas puede lograrse a través de derivados del ácido barbitúrico. La formilación del ácido 1,3-dimetilbarbitúrico o análogos pirimidínicos, con el reactivo de Vilsmeier- Haack, incorpora la funcionalidad halovinil-aldehído, que experimenta reacciones de sustitución nucleofílica con anilinas N-sustituidas, 43, además de las reacciones clásicas para el grupo funcional carbaldehído. Este procedimiento permite obtener derivados con complejidad estructural, a través de la reacción de cicloadición de Bradsher (Esquema 5), también conocida como reacción de ciclación de Bradsher.44
3.2 Síntesis de deazaflavinas a partir de uracilo y derivados
La explotación sintética del carbono nucleofílico de uracilos se ha convertido en un campo importante debido a la variedad de potenciales productos y aplicaciones, [45-50]. La química de los derivados de uracilo, estudios y procedimientos sintéticos, se incrementó desde los años 80’s, debido a las interesantes actividades y propiedades farmacológicas, es más, aún continúa la búsqueda de nuevos enfoques para la síntesis de derivados sustituidos de uracilo. 46
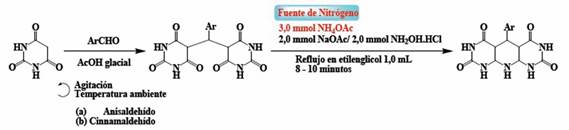
A partir de derivados sustituidos de uracilos, la obtención de deazaflavinas se basa en el principio director de la síntesis de Hantzsch. Compuestos 1,3-dicarbonílicos, como el uracilo y derivados, en reacción con aldehídos y anilinas, generan sistemas tricíclicos con características estructurales en el producto final. La síntesis de piridinas de Hantzsch, descrita en 1881 por Arthur Rudolph Hantzsch, incluyendo sus variaciones, es uno de los métodos más comunes para la síntesis de piridinas sustituidas. En este proceso se combinan dos equivalentes de un compuesto 1,3-dicarbonílico, un aldehído y una fuente de nitrógeno, como amoniaco o acetato de amonio, para dar una 1,4-dihidropiridina (DHP’s). Este precursor, conocido como intermediario o éster de Hantzsch, se transforma en el producto aromático en una posterior etapa de oxidación, en un proceso que implica reactivos para transferencia de hidruro o hidrógeno. Estas reacciones incluyen varias versiones de síntesis asimétrica del proceso de transferencia de H con altos niveles de enantioselectividad. Así, la química de DHPs ha llamado el interés sobre estos derivados y, en consecuencia, se reportan y describen metodologías y condiciones para la síntesis de estos importantes compuestos. A pesar del gran número de metodologías disponibles para la síntesis de DHPs, el mecanismo de Hantzsch sigue siendo objeto de debates científicos. 51-53
En lo que respecta a la obtención de deazaflavinas, partiendo del principio director de la síntesis de Hantzsch, las metodologías se centran en la construcción del anillo piridínico sobre el uracilo o derivado. La variación estructural, el grado y tipo de sustitución, dependerán del uracilo derivado y la anilina.
3.2 Como referencia en la síntesis de 5-deazaflavinas se tienen:
1. Obtención de 5-deazaflavinas con sustitución en el C8.
La síntesis de 5-deazaflavinas, con sustitución en la posición 8, inicia con la reacción entre un derivado uracilo, benzaldehído y dietilazodicarboxilato (DAD) como grupo nitrogenado (Esquema 6) 54
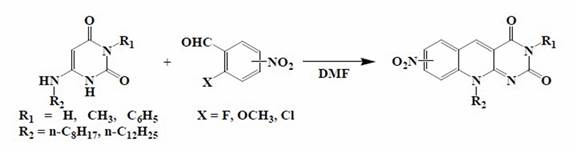
2. Obtención de deazaflavinas nitro sustituidas.
También se ha reportado la síntesis de una serie 5-deazaflavinas nitro sustituidas en posiciónC-6yC-9.Lasecuenciadereacciónessimpleeiniciaconlareaccióndecondensación de 6-dodecilaminouracilo con nitro aldehídos (2-fluoro-6-nitrobenzaldehido, 2-metoxi-5- nitrobenzaldehido, 3-cloro-4-nitrobenzaldehido y 2-metoxi-3-nitrobenzaldehido), para producir 6-nitro-y 9-nitro-5-deazaflavina respectivamente con un rendimiento entre 70-85% [55 -57] (Esquema 7). Los aldehídos aromáticos contienen átomos o grupos convenientemente ubicados y susceptibles a reacción de sustitución aromática.
3. Síntesis de híbridos esteroidal de deazaflavinas.
La síntesis de deazaflavin-colestano-(3’,8’-disustituido-5’-deazacolesto-2,4- dieno[2,3-g]pteridino-2’,4’(3’H,8’H)-dionas, un hibrido esteroidal, se lleva a cabo a partir de la reacción de condensación entre 6-aminopirimidin-2,4(1H,3H)-dionas y 2-hidroxi-metileno-coleste-4-eno-3-ona, en presencia de ácido p-toluenosulfónico monohidratado (Esquema 8) 58
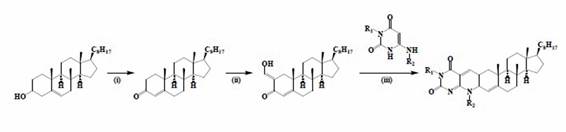
Esquema 8 Procedimiento para la preparación de deazaflavin-colestano (3’,8’-disustituido-5’-deazacolesto- 2,4-dieno[2,3-g]pteridino-2’,4’(3’H,8’H)-dionas. Reactivos y condiciones de reacción: i) Al(i-PrO)3, acetona, tolueno, 85° C, 8 h, 79%; (ii) HCOOEt, NaH, tolueno, 3 días, rt, 92%; (iii) 0.01 equiv p-TsOH, Ph2O, 180°C, 45 min.
Este trabajo refleja el interés de este tipo de fragmento unido a sistemas macrocíclicos complejos, tipo esteroides, con potencial aplicación farmacológica y menos citotoxicidad. 59
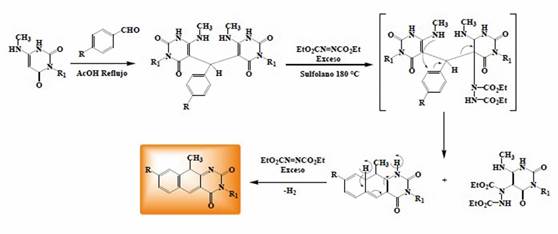
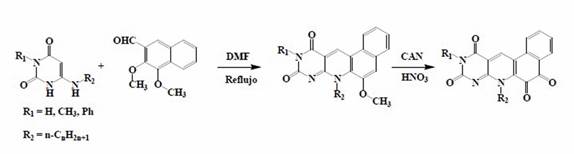
4. Síntesis de 5-Deazaflavinas que contienen fragmentos quinonas.
La reacción de condensación entre 6-alquilamino-uracilo, sustituido en posición 3 y 2,3-dimetoxinaftaldehído (Esquema 9) en DMF a reflujo, produce un derivado angular. El aldehído fue preparado de 2,3-dihidroxinaftaleno por formilación con el reactivo de Vilsmeier- Haack (POCl3, DMF, 90° C por 8 horas) con subsecuente metilación con yoduro de metilo y carbonato de potasio. Las 11-metoxi-5-deazaflavinas, bajo condiciones de oxidación, usando CAN en presencia de ácido nítrico, generan las respectivas o-quinonas 60. El interés en este tipo de derivados radica en la incorporación del fragmento quinona con potencial actividad biológica, efecto de los sustituyentes alquílicos y actividad redox.
5. Síntesis de derivados de 5-deazaflavina a partir de 2,4,6-triclopirimidina.
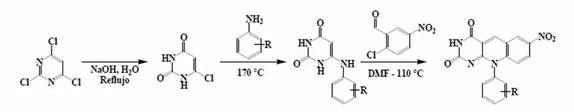
La reacción de 2,4,6-tricloropirimidina con hidróxido de sodio, genera 6-clorouracilo, compuesto clave como elemento 1,3-dicarbonilico, que reacciona con anilinas disustituidas formándose una enamina, que posteriormente reacciona con un aldehído nitro sustituido (Esquema 10) 61
6. Síntesis de deazaflavinas a partir de triaminopirimidina.
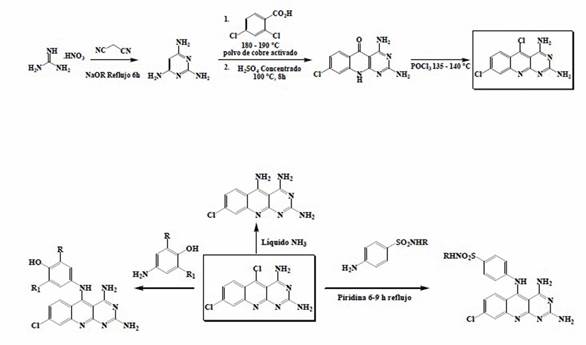
Otra variación sintética, usando un precursor similar al tricloropirimidínico, es triaminopirimidina. En esta ocasión, el anillo de pirimidina actúa como amina en la reacción de SNAr con o-halocarboxílibencenos 62. Un átomo de cloro es una potencial opción de diversificación molecular, al incorporar sustituyentes estructuralmente complejos. Por ejemplo, el derivado 5-Clorodeazaflavina, presenta versatilidad sintética para incluir aminas de diferente naturaleza (Esquema 11). 63
7. Síntesis de 5-deazaflavinas a partir de anillos quinolínicos.
Esta alternativa es contraria a las antes descritas. En esta estrategia, la síntesis de deazaflavinas se basa en la construcción del anillo quinolínico sobre el pirimidínico. La obtención del anillo quinolínico como material de partida y con la apropiada sustitución, permite acceder a 2-amino-4-metilquinolin-3-carbonitrilos. Convenientemente se dispone de dos grupos -NH2 y -CN que experimentan subsecuentes reacciones de reducción y sustitución (Esquema 12). 64
8. Reportes de formación de azometinos a partir de uracilos 6-amino o 6-alquil(o aril) aminosustituidos
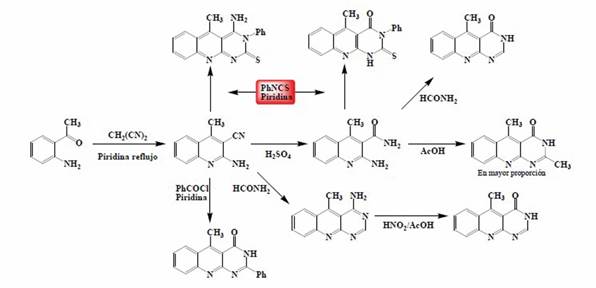
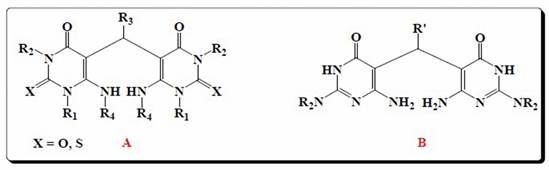
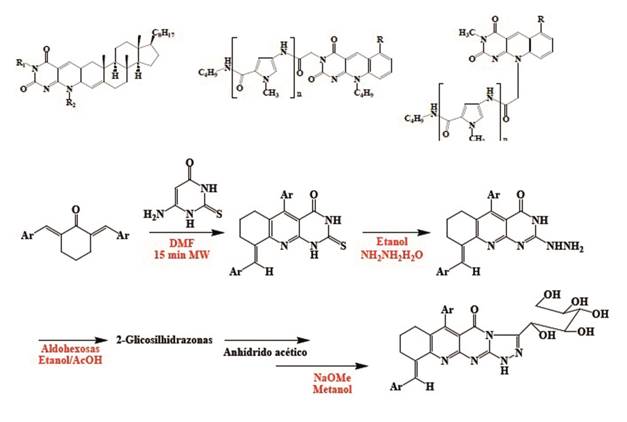
Los reportes de procedimientos sintéticos de 5-deazaflavinas, vía intermediarios azometinos, son escasos. Generalmente estos intermediarios son obtenidos a partir de un proceso tricomponente entre 6-aminouracilos, aldehídos alifáticos o aromáticos (incluyendo formaldehído y benzaldehído). 65 En secuencia de trabajos reportados, se describe la obtención de intermediarios azometino, con diferentes fuentes de metino (DAD = Dietilazodicarboxilado 54, etil-(hidroxi)-etoxiacetato o D-arabinosa, 65-74 entre otros, que generan los respectivos 5,5’-metino-bis-(6-aminouracilos) (Figura 5A). Partiendo de 2,6-diaminopirimidin-4(3H)-onas, aldehídos aromáticos y heteroaromáticos o sus respectivos acetales y D-arabinosa, en agua, generan los correspondientes 5,5’metinobispirimidinas (Figura 5B).
Los azometinos tipo A, sustituidos con grupos amino primarios y N-alquilados sobre el anillo pirimidínico, en ausencia de un agente oxidante y calentamiento, experimentan ciclación a bispirimidinas (Figura 6A). 68. Al contrario, bajo condiciones oxidantes, se observa la eliminación de uno de los anillos pirimidínicos, con formación del anillo piridínico, facilitado por el carbono en posición orto (Co) del anillo del benceno (cuando R4 = H, R3 = Arilo) (Figura 6B). 54 . Cuando se tienen uracilos 6-alquil(o aril)aminosustituido R4 ≠ H) el producto es una 10-R4-5-deazaflavina (Figura 6C). (69,70, 73,74)
En general, derivados 6-(aril, alquil, aril-alquil)-aminouracilos en reacción con aldehídos o-halogenados u o-alcoxilados, son procesos apropiados para la construcción de deazaflavinas por procedimientos sintéticos simples de SNAr y ciclocondensación, que es la secuencia común reportada en la literatura. 56,57,62
3.4 Síntesis de 5-deazaflavinas a partir de formilpirimidinas
El reactivo de Vilsmeier-Haack es eficiente, económico y reacciona bajo condiciones moderadas. Este reactivo es usado como poderosa herramienta sintética para la construcción de diversos compuestos heterocíclicos funcionalizados. 75-77. Por otro lado, la construcción de compuestos heterocíclicos que contengan la funcionalidad aldehído o cetona en una posición adecuada, permite acceder a sistemas fusionados, por tratamiento con ácidos vía ciclodeshidratación, dando como resultado la formación de un doble enlace conjugado con el anillo heteroaromático de partida. 43,44,61,78,79
Procedente con la reacción de Vilsmeier- Haack, los derivados del uracilo y aminopirimidínicos reaccionan con DMF-POCl3 para obtener un derivado del uracilo con un sistema cloro vinil aldehído. Este derivado reacciona con anilinas N-sustituidas, vía reacción de SNAr, para generar los respectivos amino derivados. Bajo condiciones ácidas e induciendo la reacción por calentamiento convencional o no convencional, experimenta una reacción de ciclación intramolecular, produciendo las respectivas 5-deazaflavinas. La reacción de Vilsmeier-Haack involucra: sustitución nucleofílica de un anillo heteroaromático activado para producir la correspondiente especie iminio, la cual facilita el ataque nucleofílico a grupos carbonílicos (Esquema 13). 44,69-72
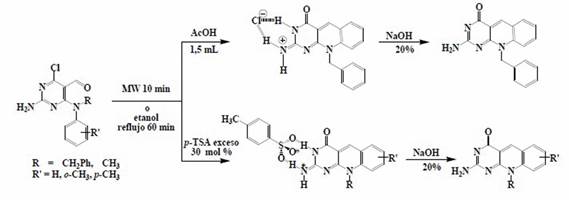
Esquema 13 5-Deazaflavinas preparadas vía reacción de ciclación intramolecular de N4-R-2,4-diamino-6- cloropirimidin-5-carbaldehído.
En este trabajo la síntesis es inducida por calentamiento no convencional, involucrando radiación MW, con los beneficios de la simplicidad en operación, tiempos de reacción cortos y buenos rendimientos en los productos. Bajo condiciones ácidas, este tipo de reacciones experimenta la sustitución del átomo de cloro por un grupo OH, probablemente a la generación de agua. 44,79-82
En un trabajo extenso, se reportó la síntesis secuencial de una serie de 5-deazaflavinas, a partir de aminopirimidinas sustituidas e incluyendo procesos de formilación. Comercialmente, se dispone de una serie de aminopirimidinas sustituidas en posición 2, bajo condiciones de sustitución nucleofílica aromática. Pueden variarse los sustituyentes en esta posición, lo que permite ampliar la biblioteca de materiales de partida. Otra opción de incluir sustituyentes en los derivados 5-deazaflavinas, es mediante la modificación de anilinas comercialmente disponibles. El procedimiento general se realiza en dos pasos:
(1) reacción de la anilina con formiato de etilo, en calentamiento a reflujo, para generar
N-arilformamidas; (2) seguido por la reducción usando LiAlH4 en THF, que conlleva a la correspondiente anilina N-monometilada. 83
Considerando estos protocolos de derivación de precursores, junto a las secuencias de reacción simple, SNAr y ciclocondensación, la biblioteca de derivados 5-deazaflavinas es amplia y el trabajo es complementado con análisis biológicos, específicamente ensayos “in vitro” en evaluaciones como agentes antitumorales. De esta manera, se reportan estudios que incluyen diseño, síntesis, evaluación de la actividad antitumoral y AutoDock de 5-deazaflavinas con potenciales aplicaciones como agentes antitumorales (Esquema 14). 84-86.
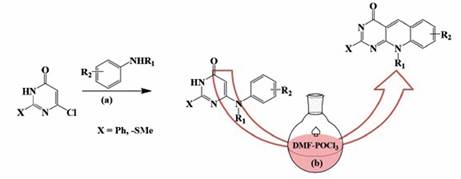
Esquema 14 Obtención de 5-deazaflavinas a través de una ciclocondensación intramolecular, previa funcionalización con el reactivo de Vilsmeier-Haack. Reactivos y condiciones: (a) en fusión con la apropiada amina a temperaturas entre 180-200° C por 0.5-5 h y bajo atmósfera de nitrógeno N2; (b) reactivo de Vilsmeier-Haack (DMF-POCl3) a 90° C por 1-4 h.
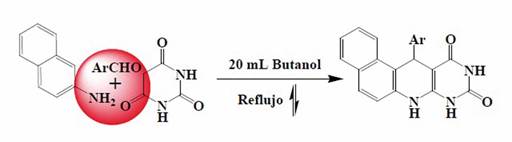
Los derivados tipo 10-alquil-2-deoxo-2-fenil-5-deazaflavinas, preparados de acuerdo al esquema 15 (Usando anilinas p-sustituidas), experimentan reacción de sustitución en la posición C5 con tratamiento de la respectiva amina, en presencia de Et3N y calentamiento 86. Generalmente, las reacciones de sustitución se llevan a cabo por fusión directa, pero en el caso de derivados tipo 10-alquil-2-deoxo-2-fenil-
5-deazaflavinas, reaccionando con arilaminas, se requiere de condiciones un poco más fuertes, usando butanol como medio de la reacción a 135° C y Et3N como catalizador, probablemente debido a factores estéricos (Esquema 15).
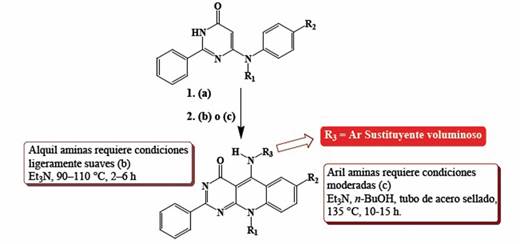
Esquema 15. Obtención de derivados tipo 10-alquil-2-deoxo-2-fenil-5-deazaflavinas con sustitución en el C5. Reactivos y condiciones: (a) funcionalización con el reactivo de Vilsmeier-Haack (DMF-POCl3), a una temperatura de 90° C, durante 2-4 h; (b) Reacción de sustitución con alquil aminas, en presencia de Et3N, a temperaturas entre 90-110° C, durante 2-6 h; (c) para sustitución con aril aminas, en presencia de Et3N y n-BuOH, en un tubo de acero sellado, a una temperatura de 135° C, durante 10-15 h.
Explorando el alcance de las reacciones y de los derivados 5-deazaflavinas, convenientemente sustituidos, se obtienen una serie de derivados tipo 2-deoxo-2- fenilflavin-5-oxidos, vía reacción de nitrosación-ciclación, usando un exceso de NaO2 en ácido acético (Esquema 16). 84,87
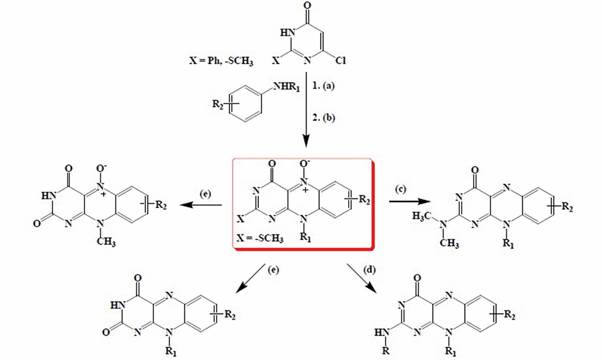
Esquema 16 Obtención de derivados tipo 2-deoxo-2-fenilflavin-5-oxidos. Reactivos y condiciones (a) En reacción de fusión con la apropiada amina, a temperatura entre 180-200° C, durante 0.5-5 h, en atmosfera de N2; (b) reacción de nitrosación-ciclación con un exceso de NaNO2, AcOH, controlando la temperatura entre 10-15° C, durante 2-5 h; (c) Desoxigenación con 50% acuoso NH(Me)2, en tubo sellado de acero, a temperaturas entre 160-165° C, durante 4 h; (d) sustitución con la apropiada amina, en n-BuOH a reflujo durante 15 min; (e) sustitución en presencia de HCl 5N, calentamiento a reflujo, durante 7-12 h.
A la vez, los anillos 2-metitiopirimidínicos son ampliamente usados en química heterocíclica a fin de incorporar aminas primarias y secundarias en esta posición. La naturaleza electro-deficiente del C2, en el anillo pirimidínico, permite llevar a cabo reacciones de sustitución, para remplazar el grupo tiometilo (-SCH3) por aminas apropiadas, generando derivados tipo 2-amino- y 2-alquil(o aril)amino (Esquema 17). 85
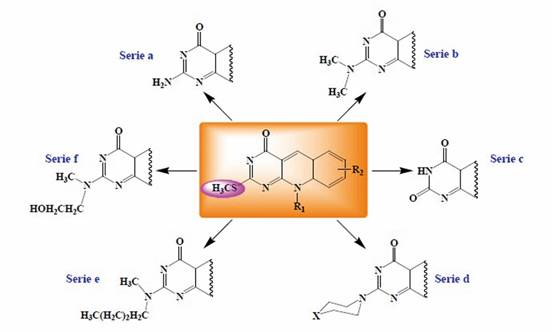
Esquema 17 Descripción general para la preparación de 10-alquil-2-amino-2-deoxo-5-deazaflavinas. Reactivos y condiciones: Serie a: reacción de aminación usando CH3CO2NH4, como fuente de N, a temperaturas entre 160-165° C, durante 0,5-3 h; Serie b: reacción de sustitución, usando NHMe2 50% acuoso, en tubo sellado, a una temperatura de 135° C, durante 4 h; Serie c: Reacción de hidroxilación con HCl 5N, en calentamiento a reflujo, durante 3-5 h; Serie d-e: reacción de sustitución con la apropiada amina en n-butanol, calentamiento a reflujo, durante 2-5 h; Serie f: Reacción con acetato de n-Butilamonio, en fusión directa, a temperaturas entre 150-165° C, durante 1-3 h.
3.5 Derivatización de deazaflavinas
A fin de potenciar las propiedades biológicas que han presentado las deazaflavinas sintetizadas y la exploración de nuevos efectos específicos en fenotipos biológicos, se han reportado trabajos introduciendo sustituyentes complejos (a diferencia de los átomos y grupos en las diferentes posiciones, descritas en sesiones anteriores). Algunos de estos análogos han sido diseñados a nivel computacional (58,84-87 y para los protocolos sintéticos, la combinación con técnicas MCRs inducidas por fuentes de energía no convencionales permiten el acceso rápido y simple a bibliotecas moleculares de sistemas heterocíclicos policondensados (Esquema 18) 58,88-90
4. Conclusiones
El interés en la preparación y evaluación de la actividad biológica de los análogos de 5-deazaflavina, viene de su similitud estructural con las flavinas, y de las propiedades electroquímicas y fotoquímicas relacionadas con la naturaleza y grado de sustitución. Es así, como estos compuestos están involucrados en procesos bioluminiscentes, de transferencia de energía y catalizan o participan en reacciones de transferencia de hidruros a nivel enzimático, en una gran variedad de microorganismos. La química sobre la preparación y transformación de 5-deazaflavinas se basa en protocolos generales y simples. La disponibilidad comercial de los principales precursores (aldehídos, aminas, pirimidinas, etc.), así como, las metodologías para sintetizar los que no son comerciales permiten ampliar la biblioteca molecular de los análogos de deazaflavinas. Las reacciones asistidas por microondas, usando o no, catalizadores y los protocolos de bajo impacto ambiental, también se han involucrado en estos procedimientos. Los diferentes procedimientos sintéticos reportados para la obtención de 5-deazaflavinas no implican innovación sintética, son una combinación de variaciones a las reacciones previamente reportadas. Las modificaciones a las condiciones, en pasos claves de la reacción van desde análisis de la influencia del solvente y alternativas de precursores nucleofílicos con ERG o EWG para ajustar las propiedades electroquímicas de la 5-deazaflavina análoga. Los retos están en la incorporación de sustituyentes apropiados, capaces de inducir un efecto específico en fenotipos biológicos.
El objetivo de esta revisión es cubrir la parte sintética, sin embargo, falta avanzar en las aplicaciones sintéticas en combinación con la química computacional, para el diseño de síntesis racional, análisis in silico y biológico de 5-deazaflavinas. De estas observaciones, se destaca la importancia del núcleo 5-deazaflavina, continuar explorando su versatilidad y posibles aplicaciones, en busca de resolver problemas de salud, dado el incremento de reportes de este tipo de heterociclo en el campo farmacéutico.