1 Introducción
La piperina (1-piperoilpiperidina), sustancia picante nitrogenada, es un alcaloide presente en especies de la familia Piperaceae. Ésta se encuentra presente en la especie vegetal pipilongo (Piper tuberculatum) la cual se utiliza comúnmente como especia en el hogar ya sea como aditivo alimentario o condimento 1. La estructura química de la piperina (Figura 1) la sitúa en el grupo de cinamamidas lo cual le confiere varias actividades biológicas útiles 2,3.
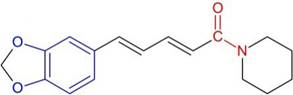
Figura 1 Estructura química de la piperina (1-[5-(1,3-benzodioxol-5-il)-1-oxo-2,4-pentadienil]piperidina).
La piperina no posee una actividad antioxidante significativa una vez es separada del extracto de la planta proveniente 1, además puede ser fotosensible y degradarse fácilmente bajo ciertas condiciones. Estudios revelan que la degradación puede observarse cuando la piperina se somete a hidrólisis básica, hidrólisis neutral, hidrólisis térmica y a la luz solar 4,5. En consecuencia, Tripathi et al. (3, investigaron el papel neuroprotector de la piperina irradiada y no irradiada con UV-B, con el fin de observar mejora o atenuación de la eficacia de la propiedad antioxidante de ésta. Se concluyó que la piperina no irradiada presentó una acción neuroprotectora a través de la reducción del volumen de infarto y escalas neurológicas. Mientras que, en la piperina irradiada, la eficacia neuroprotectora se atenuó a través de la disminución de la regulación de la enzima de defensa antioxidante, aumentando el nivel de especies reactivas de oxígeno (ROS) 4.
Las especies reactivas del oxígeno (ROS) y compuestos reactivos intermedios metabólicos generados a partir de diversos químicos carcinógenos juegan un papel importante en el daño celular, en la iniciación y progresión de la carcinogénesis. Muchos eliminadores de radicales, como antioxidantes naturales, se han encontrado para ser eficaces en la inhibición de la inducción de la carcinogénesis. Estudios también indican que diversos principios de especias son un grupo importante de antioxidantes 6 como es el caso del pipilongo debido a la piperina presente.
Entre los diferentes enfoques en el campo de la nanomedicina para superar la incapacidad de la mayoría de las terapias convencionales de entregar las concentraciones terapéuticas de medicamentos sin provocar efectos tóxicos graves en los órganos y tejidos normales, los sistemas vesiculares han recibido la máxima atención durante las últimas décadas 7,8. Las vesículas, especialmente liposomas (vesículas basadas en lípidos, generalmente fosfatidilcolina), son los sistemas de escala nanométrica, clínicamente establecidos, más utilizados para la administración de fármacos y para el desarrollo de nuevos nanomedicamentos 7.
Como sistemas de protección y entrega, los liposomas exhiben muchas ventajas como biocompatibilidad, no toxicidad, tamaño ajustable, mejora en la estabilidad química y física de moléculas, la capacidad de encapsular moléculas hidrofóbicas e hidrofílicas y entrega controlada 9,10. La incorporación de colesterol (Chol), tiene una contribución importante en la organización, la dinámica y función de la membrana. El colesterol reduce la libertad de rotación de las cadenas de hidrocarburos de fosfolípidos, que ayudan a disminuir la pérdida de materiales hidrófilos y también estabilizan la bicapa lipídica 11-13.
En particular, la encapsulación es una posible solución para preservar la actividad antioxidante de moléculas hasta su consumo, para asegurar una vida útil prolongada o para evitar el sabor desagradable de alta concentración de algunas moléculas (astringencia, amargura) 9,14.
Esta investigación exhibe la optimización de extracción asistida por ultrasonido, la preparación de vesículas liposomales sintetizadas a partir de fosfatidilcolina mediante la hidratación con buffer PBS pH 7.40, la encapsulación del extracto y piperina provenientes de la planta pipilongo (Piper tuberculatum) y la evaluación del poder antioxidante del extracto y piperina, libres y encapsulados, a través de la reacción de diferentes concentraciones de éstos frente al reactivo radical sintético DPPH.
2 Materiales y métodos
2.1 Materiales
El pipilongo se adquirió en cultivos orgánicos del corregimiento La Buitrera del municipio de Cali, Colombia. La Buitrera se extiende desde 1000 hasta 2000 metros sobre el nivel del mar con latitud (ϕ): N 3? 23´ 38,4770² y longitud (λ): W 76? 34´ 47,23608² La muestra de pipilongo se secó al horno a una temperatura no mayor a 60°C. El contenido de humedad de la materia prima aproximado fue de 7%. La piperina estándar Sigma Aldrich 97%, el etanol absoluto y hexano grado analítico fueron adquiridos de Scientific Products, Cali. Agua desionizada y Metanol grado HPLC (Scientific Products, Cali) se utilizaron como disolvente para cromatografía liquida de alta resolución (HPLC).
2.2 Equipos
La extracción asistida por ultrasonido se realizó en una sonda de ultrasonido (Sonic Dismembrator modelo 505 Fisher Scientific™ con una frecuencia de 20 KHz y potencia máxima de 500 W.
Para la medida del espectro UV-Vis se utilizó el espectrofotómetro UV-1700 marca SHIMADZU, que trabaja con un ancho de banda de 1 nm en la región de 190 a 1100 nm.
El Zetasizer S90 (Instrumentos Malvern), instrumento utilizado para la determinación del tamaño de partícula y tamaño molecular, posee un rango de medición de 0.3 nm-5 micras (diámetro). La principal forma de mediciones es a través de dispersión de luz dinámica (DLS) en un ángulo de dispersión dinámica de 90 grados.
2.3 Cromatografía líquida de alta resolución (HPLC)
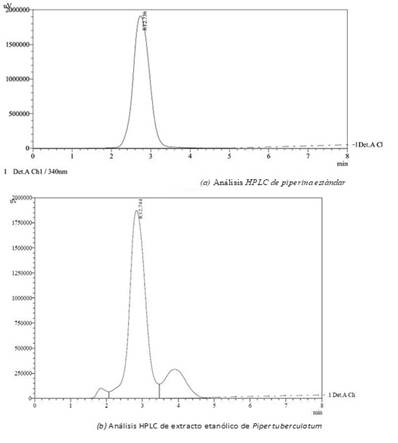
La piperina se analizó utilizando cromatografía líquida de alta resolución. Se utilizó el instrumento de HPLC marca SHIMADZU el cual posee un sistema LCSolutions 2010, que es un tipo de bomba del sistema en serie de doble émbolo y como detector de UV. La columna utilizada fue C18 (fase reversa), la columna vértice de la sección transversal de 150 x 3.9 mm empacada con sílica. La longitud de onda se fijó en 340 nm, la fase móvil utilizada fue MetOH:H2O (70:30), el volumen de inyección fue 20 μL y la tasa de flujo fue de 0.7 mL/min. El tiempo de retención estuvo en un rango de 2.7 - 2.8 min.
2.4 Extracción Soxhlet
La extracción fue llevada a cabo partiendo de 5 g de Piper tuberculatum seco y molido en un aparato convencional Soxhlet. Una vez finalizó el tiempo de extracción, se recuperó, por destilación, parte disolvente del balón. Se utilizaron 200 mL de disolvente en cada ensayo. 5 mL de los extractos resultantes se tomaron para ser analizados mediante HPLC. Los resultados obtenidos se presentan en la Tabla 1.
2.5 Extracción asistida por ultrasonido
La extracción se realizó en un recipiente de vidrio con fondo plano mantenido en un baño maría durante 10 minutos antes de ser sometidos a la sonda de ultrasonido. 5 g de Piper tuberculatum se mezclaron con 50 mL de disolvente en el recipiente de vidrio. El Piper tuberculatum se irradió por ultrasonido durante el tiempo establecido con un pulso de 10 segundos de sonicación y 5 segundos de espera. Se tomaron 5 mL de los extractos resultantes para ser analizados mediante HPLC. Los resultados se presentan en la Tabla 2.
Tabla 2 Diseño experimental - Método Ultrasonido (US)
| 125W (25%) | 175W (35%) | |
|---|---|---|
| 30 minutos | 1US | 3US |
| 40 minutos | 2US | 4US |
2.6 Aislamiento de la piperina
Se llevó a sequedad el extracto y se eliminaron residuos con éter etílico 15). Tras la adición de etanol y KOH 10% etanólico, se dejó en reposo la solución durante 2 horas. Se decantó el sobrenadante y éste se dejó en reposo un periodo de 48 horas. Posteriormente, se recogieron los cristales de piperina. Estos fueron purificados por recristalización de acetona:hexano (3:2).
2.7 Preparación de liposomas vesículas multilamelares tipo cebolla (MLV)
Inicialmente se preparó un buffer fosfato (PBS) 0.1 M a pH 7.4 con y en agua desionizada. Se prepararon soluciones del extracto de pipilongo y piperina a 20, 200 y 2000 ppm en cloroformo. Se tomó 0.3 g de lecitina y 0.1 g de colesterol 16, se adicionó individualmente cada solución preparada y mediante un baño maría a ~70º C, se eliminó por evaporación el disolvente agitando suavemente, promoviendo la formación de la bicapa lipídica. Se realizaron varios ciclos de secado en el baño, asegurando la evaporación total del cloroformo. 10 mL del buffer PBS fueron calentados en el mismo baño y se adicionaron a la bicapa lipídica. Para evitar la formación de sólidos y la hidratación completa de la bicapa, se sometió la emulsión a sonificación en un baño de ultrasonido y posteriormente a agitación magnética. La purificación de los liposomas se realizó, centrifugando a 3500 rpm.
2.8 Actividad antioxidante
Las actividades antioxidantes de las muestras fueron determinadas, usando el radical libre 2,2-difenil-1-picrilhirazil (DPPH). Clásicamente, el DPPH es disuelto en metanol y su ensayo se realiza en un rango entre 517y 520 nm. En este caso, una solución a 0.2 Mm de DPPH fue preparada en MetOH:H O (75:25) 9. Las muestras de extracto de pipilongo y piperina se disolvieron en metanol solamente, garantizando la completa dilución, ya que la piperina es insoluble en agua y la formación de partículas generaría interferencias en el espectrofotómetro UV. Concentraciones de 20, 200, 2000 ppm fueron preparadas tanto para el extracto aceitoso, la piperina y el estándar de referencia, quercetina. Para los estudios en el extracto, piperina y quercetina, 1.5 mL de DPPH (0.2 mM) se mezclaron con 1.5 mL de la muestra seleccionada. En las vesículas MLV se realizó una dilución de 50 µL en 10 mL con agua desionizada. La misma proporción muestra:DPPH (1:1) fue utilizada.
El extracto de la especie Piper tuberculatum utilizado para la preparación de vesículas y extracto libre para los análisis, fue aquel que contenía mayor cantidad de piperina.
La absorbancia a 520 nm se determinó después de 60 min de incubación a temperatura ambiente en la oscuridad. La actividad de inhibición fue calculada de la siguiente forma:
donde A0 es la absorbancia de control (DPPH sin adición de muestra), A1 es la absorbancia de la muestra. Los resultados se presentan como el promedio de análisis por triplicado.
3 Resultados y discusión
3.1 Validación de metodología de extracción
La preparación de las muestras se realizó tomando alícuotas de 500 μL de extracto llevados a aforo con etanol absoluto en un balón aforado de 5 mL. Las soluciones estándar fueron de igual forma preparadas en balones de 5 mL con etanol absoluto. Todas las muestras fueron filtradas en membranas 0.47 μm antes de ser inyectadas en el HPLC. La Figura 2a muestra el análisis HPLC de la piperina estándar y la Figura 2b, el extracto etanólico, en un tiempo de retención cercano a 2.7 min.
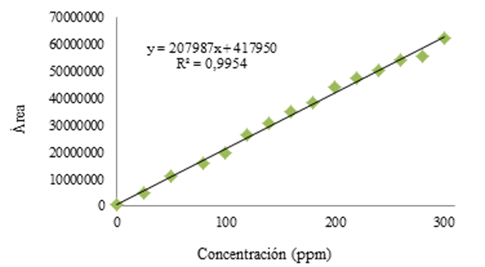
Inicialmente, se preparó una curva de calibración a 1, 170, 350, 500 y 1000 ppm de piperina estándar. Con concentraciones superiores a 350 ppm se saturó el detector. Por tal, la linealidad se estudió en un rango de concentración 1 ppm-300 ppm. Se prepararon tres curvas de calibración de 1-100 ppm, 120-200 ppm y 220-300 pm. Mediante una prueba t-student se determinó que las pendientes de las tres curvas no diferían significativamente. Por tal motivo, se trabajó como una sola curva de 1 a 300 ppm. El coeficiente de determinación R2 para esta curva fue 0.995 que responde a la ecuación de regresión lineal como lo muestra la Figura 3.
En la precisión del método, la reproducibilidad se obtuvo inyectando 7 extractos aleatorios de ambos diseños experimentales y para la repetitividad se inyectó uno de los extractos escogidos 7 veces, independientemente, en el equipo de HPLC, todas por triplicado. Se realizó la comparación de la desviación estándar de la precisión con el valor hallado en la ecuación de Horwitz () para verificar la precisión del método. Se encontró que éste es preciso. Los resultados están expresados como desviación estándar relativa (RSD).
La sensibilidad del método, límite de detección (LDD) y límite de cuantificación (LDC), fue determinada realizando una pequeña curva de calibración de tres puntos 0.01, 1 y 5 ppm con piperina estándar. Los valores de los parámetros se muestran en la Tabla 3.
Tabla 3 Parámetros de validación por cromatografía HPLC
| Parámetro | Resultados |
|---|---|
| Rango lineal/Linealidad | |
| R23 | 1-300 ppm. 0.9954 |
| Precisión | |
| Reproducibilidad | 3.2% |
| Repetitividad | 0.3% |
| Sensibilidad | |
| LDD | 1.1 ppm |
| LDC | 2.7 ppm |
La exactitud del método se determinó dopando uno de los extractos con una cantidad conocida de piperina estándar (50%, 100% y 150%). El porcentaje de recuperación se calcula dividiendo el valor medio entre el valor real. Se realizó la prueba de t-student para determinar si había diferencias significativas entre la recuperación media y el 100%. Se encontró que el método es exacto. Cada muestra dopada se inyectó por triplicado. Los resultados se muestran en la Tabla 4.
3.2 Efecto de dos diferentes disolventes
La selección del disolvente más adecuado para la extracción de los compuestos de interés de la muestra es un paso crucial para cualquier método de extracción, particularmente para extracción asistida por ultrasonido (UAE). Se evaluaron dos disolventes diferentes (etanol y hexano) para la extracción de piperina de la especie Piper tuberculatum por el método Soxhlet. La Tabla 5 muestra varias propiedades de los disolventes seleccionados (17).
Tabla 5 Propiedades fisicoquímicas de disolventes. (17)
| Disolvente | Tensión superficial (mN/m) | Índice de polaridad | Presión de vapor (kPa) | Viscosidad (cP) |
|---|---|---|---|---|
| Etanol | 23.3 | 5.2 | 5.2 | 1.2 |
| Hexano | 18.4 | 0.001 | 17.3 | 0.3 |
Los parámetros de la extracción por Soxhlet se mantuvieron constantes. Tales como: 5 g de la muestra seca molida, temperatura alrededor de 100° C y proporción de sólido a disolvente de 1:40. El tiempo de extracción depende del diseño experimental.
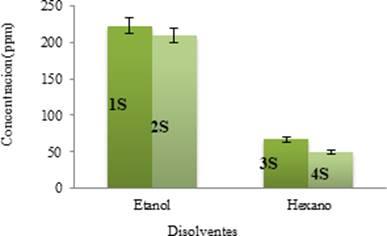
Los resultados obtenidos se muestran en la Figura 4. La máxima concentración de piperina se obtuvo en 1S (222.76 ppm - etanol) seguida por 2S (209.46 ppm - etanol) en comparación con 3S (66.62 ppm - hexano) y 4S (49.73 ppm - hexano). El rendimiento de la extracción se ve afectada por la polaridad y viscosidad del disolvente (17), como se observa en la Tabla 5. El índice de polaridad del etanol es mayor, por tal razón, reacciona con más afinidad con la piperina presente en la especie Piper tuberculatum en comparación con el hexano que es un disolvente apolar.
3.3 Efecto de potencia en ultrasonido
El efecto de dos diferentes potencias, i.e. 125 W y 175 W sobre la cantidad de piperina extraída de Piper tuberculatum asistida por ultrasonido a 20kHz están reportados en la Figura 5. Los resultados obtenidos a 175 W (3US - 216.59 ppm y 4US - 246.50 ppm) son mayores que a 125 W (1US - 210.11 ppm y 2US - 201.74 ppm). Con el aumento de la potencia de ultrasonido, existe mayor amplitud de las ondas que viajan a través del medio líquido y las burbujas colapsan de forma más violenta 18, lo cual conlleva a una mayor extracción. De igual forma, el aumento de tiempo en la zonificación también promueve mayor extracción en la muestra.
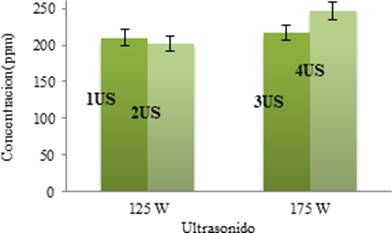
Figura. 5 Efecto de potencia de ultrasonido sobre la concentración de extracto etanólico de Piper tuberculatum (Método US proporción solido/disolvente 1:10, frecuencia 20kHz).
En presencia de ultrasonido, la variación en el rendimiento de la piperina también se atribuye a su diferente solubilidad y las propiedades físico-químicas, es decir, la tensión superficial, la viscosidad y presión de vapor. Generalmente, la presión de vapor de los disolventes juega un papel importante en la generación de la cavitación y se ha encontrado que el disolvente de presión de vapor más baja genera pocas burbujas que implosionan, pero con una fuerza superior. De esta manera, el disolvente que tiene menor presión de vapor ayuda a extraer más soluto 17.
La cuantificación de la piperina por el método HPLC, mostró que la mayor concentración de piperina en los extractos se obtuvo vía ultrasonido (246.50 ppm 4US) y corresponde a un rendimiento de 24.65 mg/g.
3.4 Caracterización de la piperina aislada
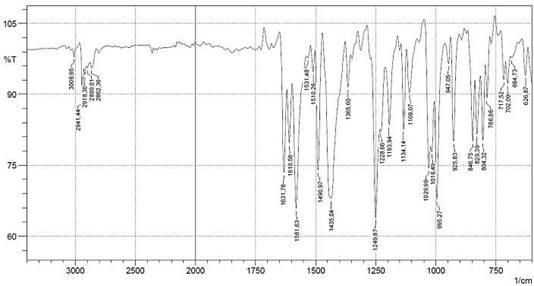
En la Figura 6 se muestra el espectro IR, identificando las bandas más importantes de la piperina aislada de la extracción de pipilongo y en la Figura 7, se muestra el espectro RMN protónico de la piperina.
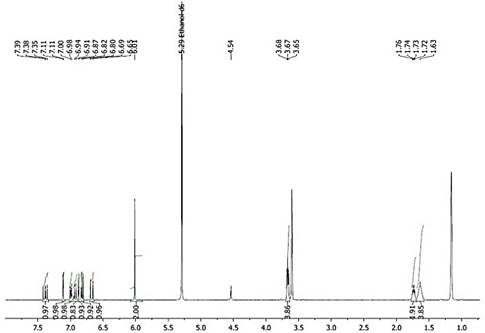
Sólido amarillo. P.f 131-133°C. IR ν(cm-1): 3009.0 (=C-H, tensión), 1610.6-1581.6- 1491.0 (-C=C- Ar, tensión), 1631.8 (-CO-N, tensión). Grupo metileniendoxi: 2918.8- 2862.4 (-CH2 as,sim, tensión), 1435.0 (-CH2 flexión), 1249.9-1193.9 (=C-O-C as, tensión), 1030.0 (=C-O-C sim, tensión), 925.8 (C-O, tensión), 1134.1 (C-H, flexión), 995.3 (-CH=CH- trans, flexión), 846.8-829.4-804.3 (C-H 1-2-4-trisust, flexión). RMN 1H (400 MHz, EtOD) δ 1.63 (s, 4H). 1.71-1.74 (m, 2H), 3.69-3.64 (m, 4H), 6.01 (s, 2H), 6.67 (d, J = 14.6 Hz, 1H), 6.81 (d, J = 8.0 Hz, 1H), 6.85 (d, J = 15.5 Hz, 1H), 6.92 (d, J = 10.5 Hz, 1H), 6.99 (d, J = 8.1 Hz, 1H), 7.11 (d, J = 1.4 Hz, 1H), 7.39 (dd, J = 14.6, 10.4 Hz, 1H).
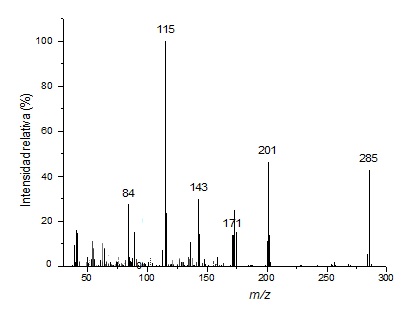
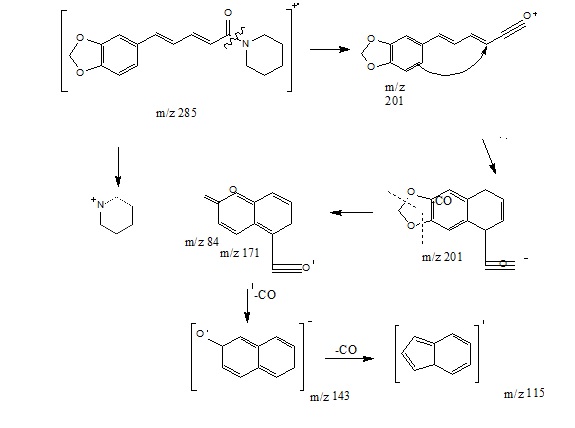
El espectro de Masas de la piperina se muestra en la Figura 8. La molécula de la piperina (Figura 1) tiene un peso molecular de 285 que corresponde al primer ion formado. La fragmentación molecular de los iones más representativos de la piperina se muestra en la Figura 9.
3.5 Caracterización de las vesículas
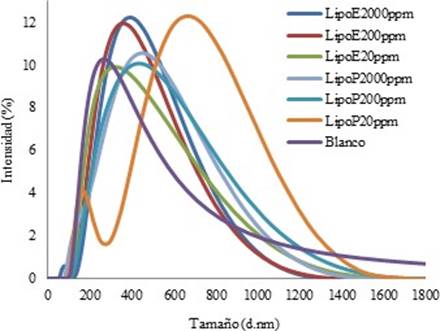
Los resultados del tamaño del diámetro hidrodinámico (nm) se muestran en la Figura 10. En la Tabla 6 se encuentran los valores del promedio Z, definido como la intensidad ponderada tamaño hidrodinámico medio de la colección de conjunto de partículas medido por difusión dinámica de luz (DLS) y los valores del índice de polidispersión (PDI), los cuales dan indicio sobre la diversidad de moléculas dentro de la emulsión. El PDI igual a 1 indica que las moléculas son del mismo tamaño (monodispersa) y éste se asocia a una distribución de tamaño de vesícula diferente 19.
Tabla 6 Tamaño promedio de vesículas MLV
| Muestra | Z-Average (d.nm) | PDI |
|---|---|---|
| LipoE2000ppm | 373 | 0.24 |
| LipoE200ppm | 338.9 | 0.21 |
| LipoE20ppm | 342.2 | 0.25 |
| LipoP2000ppm | 355.8 | 0.25 |
| LipoP200ppm | 409.4 | 0.27 |
| LipoP20ppm | 531.9 | 0.56 |
| Blanco | 299.7 | 0.22 |
El valor promedio Z del blanco es el menor, ya que son los liposomas preparados sin ninguna molécula dentro de su estructura coloidal. Por ello, el aumento de este promedio indica el encapsulamiento de material en su estructura.
El promedio de diámetro en los liposomas con extracto varía alrededor de 35 nm. Mientras mayor sea la concentración de piperina en los liposomas, menor es el promedio de diámetro hidrodinámico y menor PDI.
Se observó buen resultado en los liposomas preparados con 20 ppm de piperina. El valor promedio Z y el PDI son mayores, es decir que mostraron una mejor tendencia a encapsular todo el material de muestra y estar compuestos por liposomas de un solo tamaño 19, por lo cual, su curva en la Figura 10 es más ancha.
3.6 Actividad antioxidante: Ensayo con radical libre DPPH
El 2,2-difenil-1-picrilhidrazil (DPPH) es un radical libre estable con absorbancia característica entre 517-520 nm. Es uno de los sustratos comúnmente utilizados para evaluar la actividad antioxidante. Este ensayo se basa en la capacidad del DPPH de aceptar un radical de hidrógeno o de algún grupo R, resultando en la reducción de DPPH˙ (violeta) a DPPHH (amarillo). La disminución de la absorbancia, evidencia de la reducción del DPPH, se utiliza para evaluar el potencial de barrido del radical de las muestras 20.
La capacidad de reducir radicales DPPH de la piperina presente en el extracto (4US) fue determinado mediante la absorción UV a 520 nm. La Figura 11 muestra el porcentaje de actividad inhibido en las diferentes concentraciones preparadas de extracto, piperina y sus respectivas vesículas MLV cargadas.
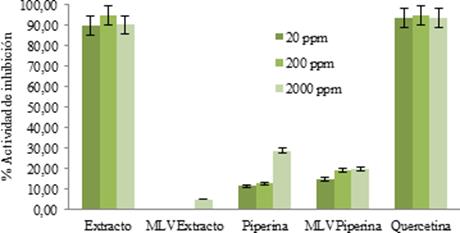
Figura 11 Determinación del porcentaje de actividad inhibitoria en el extracto, piperina, respectivas vesículas LV y quercetina frente al radical DPPH 0.2 mM
En el extracto se observó un alto porcentaje de inhibición, mientras que en la piperina libre solo la muestra más concentrada exhibe un porcentaje significativo. Se calculó el valor IC50 (half maximal inhibitory concentration por sus siglas en ingles) en las muestras libres, Tabla 7.
Tabla 7 Valores de IC50 del extracto, piperina y quercetina
| Extracto | Piperina | Quercetina | |
|---|---|---|---|
| Promedio IC50 | 2.8 | 2133 | 2.5 |
| Desviación | 0.2 | 1499 | 0.1 |
El valor de IC50 del extracto se comparó con la quercetina; un estándar de referencia preparado bajo las mismas condiciones. Este análisis mostró que el extracto de pipilongo posee una buena actividad antioxidante.
Experimentalmente, los resultados corroboran que la piperina no posee una actividad antioxidante significativa una vez es separada del extracto de la planta proveniente 1,6.
Las muestras de extracto y piperina encapsuladas difieren en sus resultados. Mientras que en el extracto las vesículas logran atenuar casi por completo el porcentaje de inhibición protegiendo la muestra y previniendo la medida de actividad antioxidante, en la piperina las vesículas MLV tienden a mantener constante el porcentaje de actividad inhibitoria en las tres distintas concentraciones. Cabe resaltar que, en la muestra preparada con piperina libre, se tomó una alícuota directa de las soluciones para reaccionar con DPPH, a diferencia de los MLV que fueron diluidos, obteniéndose valores de absorbancias cercanas a la absorbancia de control (A0). El valor de IC50 para las vesículas cargadas con extracto no fue calculado, su porcentaje de actividad inhibitoria fue muy baja. Al igual que en la piperina libre, en las vesículas cargadas con piperina se obtuvo un promedio de IC50 muy alto y desviación grande.
4 Conclusiones
Se optimizaron exitosamente las condiciones de extracción de piperina en la especie Piper tuberculatum asistida por Ultrasonido, disminuyendo tiempo de extracción y cantidad de disolvente empleado.
Mediante cromatografía líquida de alta resolución, se validó el método de extracción. Éste fue preciso, sensible y exacto para la determinación de piperina en el extracto de la especie Piperaceae.
Se logró aislar, caracterizar e identificar la piperina presente en Piper tuberculatum a través de técnicas espectroscópicas.
El extracto de pipilongo presentó una actividad antioxidante frente al DPPH de 2.8±0.2 ppm similar a la quercertina (2.5±0.1 ppm).
El encapsulado de extracto de pipilongo y de la piperina en vesículas multilamelares presentaron disminuciones de la actividad antioxidante con DPPH debido a la protección molecular.