1 Introducción
Los humedales son sistemas acuáticos que han sido considerados a nivel mundial entre los ecosistemas con mayor diversidad de hábitats 1,2. En estos ecosistemas, las macrófitas juegan un papel especial, ya que son de los principales elementos en delinear la estructura física del hábitat, confieren mayor heterogeneidad y modulan los diferentes procesos ecológicos que tienen lugar en los humedales. Además, tienen una fuerte influencia en la abundancia, diversidad y en los atributos de las comunidades de organismos acuáticos 3.
Este tipo de vegetación constituye un hábitat particular para varios grupos de insectos acuáticos, jugando un papel importante en la estructuración de sus comunidades, ya que proporcionan un lugar para la oviposición y emergencia de varios insectos acuáticos y refugio contra los depredadores, son además fuente indirecta de alimentos para raspadores que utilizan el biofilm que se adhiere a las paredes de las plantas, y directa para las especies minadoras y fragmentadoras, utilizando el tejido de la planta como fuente de alimento 4-8. Igualmente, la presencia de macrófitas en los ambientes acuáticos aumenta la complejidad del hábitat, aportando mayor riqueza y densidad de invertebrados asociados con estas plantas en relación con las asociadas con el sedimento 9.
El lirio acuático, Eichhornia crassipes (Mart), Solms es una macrófita flotante miembro de la familia de las Pontederiaceae, que ocupa un lugar sobresaliente entre las comunidades de hidrófitas de agua dulce 10. Entre las plantas flotantes es la que presenta el sistema radicular más desarrollado, cuyas raíces pueden extenderse hasta 1m debajo de la columna de agua 11, lo que genera un hábitat adecuado para el desarrollo de la fauna acuática 12. Esta especie posee características fisiológicas y estrategias reproductivas que permite su rápido crecimiento expansión en diversos tipos de ecosistemas acuáticos 13. Esta macrófita se encuentra presente sobre todo en la parte baja de la cuenca del río Atrato, donde llega a cubrir un alto porcentaje de la superficie de los sistemas lénticos.
El tema de los macroinvertebrados acuáticos y, entre ellos, los insectos asociados a macrófitas en sistema cenagosos, ha sido abordado extensamente en Colombia destacándose las investigaciones realizadas por Manjarrés-Hernández 14, Inger et al. 15, Ovalle 16, Deluque et al. 17, Venegas 18, Martínez 19, Quiroz et al. 20, Rivera-Usme 21, Rivera et al. (22, entre otras. En el departamento del Chocó, la única investigación publicada es la de Álvarez y Vivas 23 quienes estudiaron la variación espacial de la estructura de macroinvertebrados asociados a raíces de Pontederia rotundifolia en las ciénagas Plaza Seca y La Grande (Sanceno-Chocó); por lo que no existe una línea base importante sobre las comunidades de macroinvertebrados acuáticos asociadas a plantas acuáticas en sistemas cenagosos de la región.
Con el fin de contribuir al conocimiento de la entomofauna acuática en ciénagas tropicales, el presente estudio tuvo como objetivo caracterizar la comunidad de insectos acuáticos asociados a las raíces de E. crassipes en cinco ciénagas y su relación con las condiciones abióticas en ciénagas de la cuenca media y baja de la cuenca del Atrato, Chocó.
2 Materiales y métodos
2.1 Área de estudio
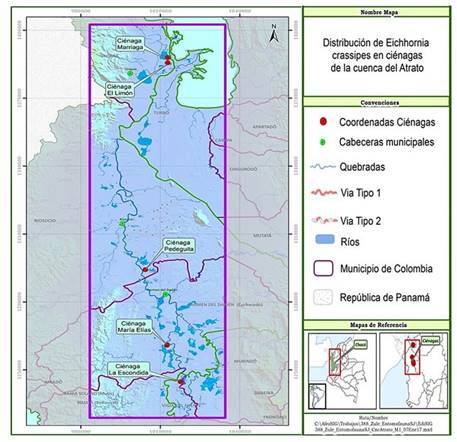
La presente investigación se desarrolló en cinco ciénagas de los municipios de Carmen del Darién, Bojayá, Río Sucio y Unguía, en la cuenca media y baja del río Atrato, Chocó (Figura 1), usando como criterio de selección la existencia de una cobertura significativa de E. crassipes. Esta zona presenta una precipitación promedio anual de 8000 mm, temperatura promedio de 26,8 °C y una humedad relativa del 85,7%, correspondiendo a una zona de vida de bosque muy húmedo tropical (bmh-T) 24. Según Duque 25, los sistemas cenagosos de esta región tienen un desarrollo genético de suelos muy incipientes, de la edad terciaria, arcillosos y permanecen inundados casi todo el año, localizados en las áreas más bajas (pendientes entre 1 y 8%) poseen baja fertilidad, son químicamente ácidos, orgánicos, de textura generalmente fina, afectados por un acentuado intemperismo, color pardo o grisáceo oscuro, superficiales, pobres en nitrógeno, fósforo y potasio, con niveles intermedios de aluminio intercambiable 26.
2.2 Métodos
La toma de datos se realizó entre los meses de agosto de 2014 y enero de 2015, abarcando los dos periodos climáticos de la zona (aguas altas y aguas bajas) y en cada ciénaga estudiada se ubicó una estación. Para el muestreo de los insectos acuáticos asociados a las raíces de E. crassipes se utilizó un cuadrante de un m2, dotado de una malla de 0,5 mm, con tres replicas por ciénaga. Este se introdujo lenta y cuidadosamente en posición vertical, hasta alcanzar la longitud máxima de las raíces de las plantas, las cuales fueron extraídas y lavadas para remover los organismos allí presentes y los insectos acuáticos colectados se preservaron en alcohol etílico al 90%. De forma simultánea, se hicieron mediciones de algunas variables abióticas (fisicoquímicas e hidrológicas): oxígeno disuelto, pH, temperatura del agua, Conductividad eléctrica, alcalinidad, sólidos totales disueltos, transparencia y profundidad. Los conteos e identificación se realizaron en el laboratorio de Limnología de la Universidad Tecnológica del Chocó, con un estereomicroscopio Nicon SMZ 745 y las claves taxonómicas de Domínguez et al. 27, Merrit et al. 28, Domínguez y Fernández 29 y cada taxón fue asignado a un grupo funcional de acuerdo a la clasificación propuesta por diversos autores 22,30.
2.3 Análisis de datos
La comunidad de insectos acuáticos se caracterizó de acuerdo con las siguientes variables: número total de individuos, abundancia relativa de cada taxón presente en E. crassipes y la clasificación de los grupos funcionales alimenticios. Los índices de diversidad de Shannon-Weaver y dominancia de Simpson se midieron en el programa Past 31. Se empleó una prueba de Kruskal-Wallis para evaluar las condiciones abióticas de las ciénagas entre periodos climáticos. Se utilizó el coeficiente de correlación de Pearson para relacionar la abundancia de familias de insectos acuáticos asociados a E. crassipes y las variables abióticas de los ecosistemas. Para estos análisis se emplearon los programas Minitab versión 17.1.0 32 y Statgraphics Centurion XV 33.
3 Resultados y discusión
3.1 Composición y estructura por grupos funciones de los insectos acuáticos asociados a E. crassipes
La entomofauna acuática asociada a E. crassipes estuvo compuesta por 24 géneros, distribuidos en 6 órdenes y 18 familias. Se reportan por primera vez géneros y familias para las ciénagas estudiadas en el departamento del Chocó (Tabla 1). Coleoptera fue el orden más abundante con 125 individuos, lo que representa el 39,81% de la fauna total y es el que presenta a la mayor riqueza de familias (5 familias), con Gyrinidae como la más representativa con el 32,17% de los individuos, sobresaliendo el género Hydrocanthus. Ephemeroptera fue el segundo orden más abundante con 114 individuos, que representan el 36,31% de todos los insectos, siendo la familia Baetidae la que contribuyo con la mayoría de los individuos de este orden (35,99%) (Figura 2). Sin embargo, los dípteros fueron los de mayor riqueza taxonómica con 7 géneros, entre los que destaca Ablabesmyia; seguido de Coleoptera con 6; los restantes órdenes mostraron un bajo número de taxones.
Tabla 1 Listado taxonómico de insectos acuáticos asociados a las raíces de Eichhornia crassipes.
| CLASE | ORDEN | FAMILIA | GENERO | Grupo Abundancia funcional* total | Densidad relativa | 0,96 |
|---|---|---|---|---|---|---|
| Mansonia | Cl | 5 | 1,59 | |||
| Culex | Cl | 7 | 2,23 | |||
| Chagasia | Cl | 2 | 0,64 | |||
| Chironomidae | Ablabesmyia | Cl | 18 | 5,73 | ||
| Pentaneura | Cl | 1 | 0,32 | |||
| Tabanidae | Tabanus | Pr | 1 | 0,32 | ||
| Ephemeroptera | Baetidae | Americabaetis | Cl | 7 | 2,23 | |
| Callibaetis | Cl | 106 | 33,76 | |||
| Caenidae | Caenis | Cl | 1 | 0,32 | ||
| Coleoptera | Hydrophilidae | Hydrochus | Pr | 11 | 3,50 | |
| Hydrophilus | Pr | 4 | 1,27 | |||
| Insecta | Dytiscidae | Rhantus | Pr | 4 | 1,27 | |
| Curculionidae | Tanysphyrus | Fr | 3 | 0,96 | ||
| Scirtidae | Scirtes | Cl | 2 | 0,64 | ||
| Gyrinidae | Hydrocanthus | Pr | 101 | 32,17 | ||
| Odonata | Coenagrionidae | Ischnura | Pr | 2 | 0,64 | |
| Protoneuridae | Protoneura | Pr | 1 | 0,32 | ||
| Libellulidae | Tramea | Pr | 15 | 4,78 | ||
| Aeshnidae | Boyeria | Pr | 2 | 0,64 | ||
| Trichoptera | Polycentropodidae | Cyrnellus | Pr | 4 | 1,27 | |
| Hemiptera | Naucoridae | Pelocoris | Pr | 5 | 1,59 | |
| Gerridae | Trepobates | Pr | 5 | 1,59 | ||
| Pleidae | Neoplea | Pr | 4 | 1,27 |
*Grupo funcional: (Pr) Predadores, (Cl) Colectores, (Fr). Fragmentadores.
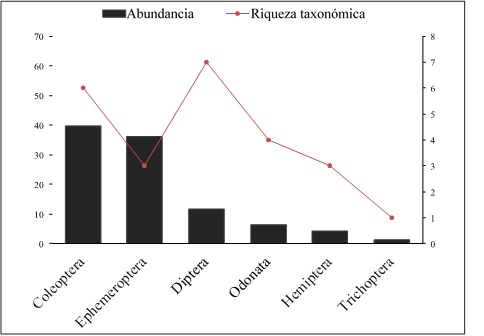
Figura 2 Abundancia relativa y riqueza taxonómica por órdenes de insectos acuáticos asociados a E. crassipes. Autor: Zuleyma Mosquera-Murillo.
La composición y abundancia de insectos acuáticos asociados a E. crassipes en las ciénagas estudiadas fue similar a la registrada en otros complejos cenagosos del país 17,20,22,34. Particularmente las masas de raíces de la planta flotante E. crassipes representan un complejo hábitat para una gran variedad de macroinvertebrados acuáticos. De acuerdo con Copatti et al.35, la abundancia y diversidad de artrópodos acuáticos generalmente aumentan en respuesta al incremento en la heterogeneidad del hábitat y la complejidad estructural proporcionada por el Jacinto de agua; estos pueden mejorar la abundancia de macroinvertebrados y riqueza a través de la provisión de adicionales y en algunos casos nuevos hábitats 12,36. Así mismo, de acuerdo con Quiroz et al. (20 y Thomaz y Cunha 37, estos proporcionan alimento, refugio, áreas para colonización y reproducción, y promueven un incremento en la biodiversidad y las relaciones inter e intra específicas.
La mayor abundancia de coleópteros, así como la riqueza de los dípteros puede ser explicada por la tolerancia a las altas temperaturas, bajas concentraciones de oxígeno y altas concentraciones de materia orgánica 34, todo esto unido a su capacidad de adaptarse a múltiples ambientes y desarrollar diferentes estrategias de alimentación, lo que los convierte en grupos importantes en las cadenas tróficas como fuente de alimento para peces y anfibios 38,39.
Particularmente, los dípteros son conocidos por presentar un alto número de especies en ambientes lénticos 40-43 al utilizar a las macrófitas acuáticos como sustrato, gracias a su capacidad de ocupar un amplio rango de microhábitats; a su vez, algunos tienen la capacidad de tolerar pH ácidos y bajos valores de oxígeno 44-45.
La composición de los grupos funcionales asociados a E. crassipes estuvo representada principalmente por los predadores (50,64%), con 12 familias abundantes correspondientes a los órdenes Odonata, Hemíptera, ciertas familias de coleópteros como Gyrinidae (Hydrocanthus), Hydrophilidae (Hydrochus) y Dytiscidae (Rhantus), así como dípteros de la familia Tabanidae (Tabanus); seguidos por los colectores (48,41%) representados por 5 familias de los órdenes Díptera (Ablabesmyia), Ephemeroptera (Callibaetis) y coleópteros de la familia Scirtidae (Scirtes); y finalmente se encuentran los fragmentadores (0,96%) con una familia (Curculionidae, Tanysphyrus) (Figura 3). Los resultados del análisis de las categorías tróficas concuerdan con los de otras investigaciones realizadas con E. crassipes20,46. Se ha sugerido que la mayor diversidad de nichos proporcionada por la biomasa de las plantas, el perifiton, los detritos y el limo recolectado por las esteras de las raíces, especialmente las esteras de raíz flotantes, soporta una estructura de red alimenticia más compleja y más rica que el substrato desnudo 47-49.

Figura 3 Abundancia relativa de familias y grupos funcionales de los insectos acuáticos asociados a las raíces de E. crassipes en la zona de estudio. Pr: predador, Cl: colector, Fr: fragmentador. Autor: Zuleyma Mosquera-Murillo.
En este estudio los predadores constituyeron el grupo predominante. Según Poi de Neiff y Neiff 50, la vegetación acuática constituye un área de refugio de los invertebrados para evitar la predación por peces, representando una oferta importante para los invertebrados depredadores, cuyo número puede incrementarse cuando hay más presas, lo cual puede explicar la abundancia de este grupo en la presente investigación. Igualmente, la diversidad de grupos predadores registrada, puede ser atribuida a la alta complejidad estructural de hábitat que genera este tipo de macrófita 51, siendo un indicio de una abundante oferta alimenticia.
Por otro lado, el alto porcentaje de colectores se favorece por las condiciones fisicoquímicas propias de la época de muestreo, correspondiente a la época de lluvias, así como por la presencia de altas concentraciones de materia orgánica que es retenida por las raíces de E. crassipes52, propiciando el medio adecuado para el desarrollo de estos organismos durante el periodo del estudio. De acuerdo con Poi de Neiff et al. 53, el alto porcentaje de materia orgánica que pueden retener las raíces de E. crassipes representa una importante oferta para los colectores, los cuales recogen los detritus proporcionados por las plantas 4,5.
3.2 Índices ecológicos
El índice de diversidad de Shannon-Weaver presentó un promedio de 1,17 bits/ind ± 0,47, lo que de acuerdo con Margalef 54, corresponden a baja diversidad (H < 2,70). Los ecosistemas lénticos tienen habitualmente baja diversidad y riqueza, lo cual está relacionado con la poca disponibilidad de hábitats en las ciénagas ya que las macrófitas y el sedimento del fondo constituyen los únicos sustratos disponibles. Thomaz & Cunha 37 señalan que el incremento en la diversidad, abundancia y la composición de comunidades de diferentes grupos de organismos adheridos a la vegetación flotante está fuertemente influenciada por la complejidad de macrófitas en diferentes escalas espaciales.
El índice de dominancia presentó un promedio de 0,54 ± 0,20; cuyos valores pueden estar relacionados con la alta abundancia que mostraron ciertos géneros como Hydrocanthus y Callibaetis (Tabla 1) los cuales representaron el 65,92% de los individuos registrados. Hydrocanthus (Noteridae) es muy común entre las raíces sumergidas de charcos, lagunas, ríos y quebradas de flujo lento y en raíces de plantas acuáticas 55. Los miembros de la familia Noteridae son capaces de tomar oxigeno atmosférico, que almacenan debajo de sus élitros, por lo tanto, la dependencia al oxígeno atmosférico es probablemente un factor primordial que restringe a estos escarabajos a aguas poco profundas 56,57 como las de la ciénaga estudiada. Callibaetis por su parte es común en charcos y lagos, sobre todo con abundante vegetación acuática 58; puede ser encontrado en todo tipo de aguas, tanto lénticas como lóticas, tolerando amplios rangos de temperatura, oxígeno disuelto y Ph 59.
3.3 Variables abióticas y comunidad de insectos acuáticos asociados a E. crassipes
La Tabla 2 resume los datos estadísticos básicos de las variables abióticas analizadas en las ciénagas estudiadas, con las variables transparencia, conductividad eléctrica, sólidos totales disueltos y profundidad como las de mayor variación a lo largo del estudio; sin embargo ninguna de las variables analizadas presentó variaciones significativas entre periodos climáticos (p>0,05). Según Lewis 60 los sistemas lénticos tropicales tienden a presentar valores relativamente bajos de oxígeno disuelto, lo que coincide con lo reportado en este estudio. En el caso del pH, los valores que pueden ser atribuidos a la naturaleza de los suelos de la zona, los cuales son ácidos al igual que los de la mayoría del departamento del Choco, sin embargo se encuentran dentro los límites para la supervivencia de los organismos acuáticos (4,5 a 8,5, 61). En el caso de la temperatura, su poca variación es una característica de los ecosistemas tropicales, donde las temperaturas no sufren grandes variaciones a lo largo del año, como las que ocurren en las zonas templadas debido a los cambios estacionales 62.
Tabla 2 Valores promedios, rangos, coeficientes de variación (CV) y diferencia significativa de las variables abióticas entre muestreos.
| Variables | Promedio | Rango | CV % | p-valor |
|---|---|---|---|---|
| Oxígeno disuelto (mg.l-1) | 5,20 | 3,78 - 7,96 | 26,73 | 0,121 |
| pH (unidades) | 7,10 | 6,6 - 7,43 | 4,46 | 0,699 |
| Temperatura del agua (°C) | 28,0 | 26,6 - 29,1 | 3,34 | 0,121 |
| Conductividad eléctrica (µS/cm) | 63,1 | 36,4 - 134,4 | 57,02 | 0,053 |
| Alcalinidad (mg.l-1 CaCO ) | 17,0 | 11 - 25 | 32,13 | 0,699 |
| STD (mg.l-1) | 46,6 | 23,4 - 81,9 | 46,33 | 0,121 |
| Transparencia (m) | 0,70 | 0,25 - 1,9 | 85,95 | 0,121 |
| Profundidad (m) | 1,90 | 0,97 - 3,6 | 45,31 | 0,439 |
La conductividad se encuentra dentro del rango normal para cuerpos de agua dulce colombianos (menores a 1500 μS/cm, 11, que permite catalogar a las zonas estudiadas como de clase I (conductividades < 600 μS/cm), según el sistema de caracterización del agua de Talling & Talling 63, que incluye muchos cuerpos de agua ecuatoriales situados en regiones selváticas y en los que muchos iones son absorbidos y acumulados por la vegetación circundante; o que son alimentados en buena parte por el agua lluvia, lo que reduce el contenido de solutos orgánicos por dilución. La alcalinidad estuvo dentro de los rangos reportados para ecosistemas neotropicales (menores a 100 mg.l-1, 11), con promedio por debajo de 20 mg.l-1. La alcalinidad del agua depende en gran parte de la naturaleza del terreno y de las rocas con las que está en contacto 61. La transparencia es en promedio de 0,70 m, con una alta variación (Tabla 2), lo que se haya asociado a la baja profundidad de las ciénagas estudiadas; encontrándose dentro del rango establecido para las ciénagas en Colombia por Arias 64 de entre 0,17 y 1,13 m.
La Tabla 3 muestra las correlaciones entre las variables abióticas y los insectos acuáticos (p< 0,05). A través de la correlación de Pearson se verificó que las variables que más influencian la comunidad de insectos acuáticos asociados a E. crassipes fueron pH, temperatura del agua, conductividad eléctrica, alcalinidad, solidos totales disueltos y profundidad; con 8 familias registradas correspondientes al 44,44 % con relación con alguna de las variables abióticas analizadas (Tabla 3). Esta asociación ha sido resaltada en investigaciones como las de Rocha-Ramírez 13 y Rúa-García 34, lo que corrobora con la estrecha correlación entre los organismos y los factores ambientales. Según algunos autores 65-68, la estructura y distribución espacial de los macroinvertebrados en las ciénagas está asociada con las características físicas, al estado trófico, a la heterogeneidad de hábitats, la profundidad, el oxígeno, el pH, la temperatura y la materia orgánica, entre otros factores. Así mismo, de acuerdo con Domínguez y Fernández 29 y Ocon y Rodríguez 69 los factores fisicoquímicos son considerados como los aspectos que más influencia ejercen sobre la distribución, abundancia y riqueza de insectos acuáticos. En el caso del pH, la mayoría de los organismos acuáticos tienen un límite dentro del cual su crecimiento se hace posible, habiendo muy pocas especies que puedan crecer en pH inferiores a 2 o superiores a 10 unidades; y en el caso particular de los macroinvertebrados, el pH óptimo se encuentra en el rango de 5,0 a 9,0 unidades 61. Por otro lado, variables como la alcalinidad y los sólidos afectan significativamente la distribución de los macroinvertebrados, ya que tienen efectos ecofisiológicos sobre sus procesos de osmoregulación y por ende sobre su supervivencia en los ambientes acuáticos 61,70,71. Los resultados de la presente investigación y los registros que se presentan contribuyen al conocimiento de la entomofauna del Chocó; así mismo, las correlaciones halladas, aunque preliminares, podrán utilizarse en futuros trabajos que intenten modelar los efectos de los factores ambientales sobre las abundancias de los macroinvertebrados en humedales similares de la región. Además, el estudio de los grupos funcionales permitió tener una visión del estado ecológico de las ciénagas, ya que estos gremios reflejan los atributos relacionados con los ensamblajes de la comunidad desde una perspectiva funcional.
Tabla 3 Correlación entre las variables abióticas y la abundancia de familias de insectos acuáticos asociados a E. crassipes. Se muestran solamente los resultados significativos. Taxón vs. Coeficiente de correlación de Pearson “r”, p < 0.05.
| Variable | Taxón | Correlación | Variable | Taxón | Correlación | |||
|---|---|---|---|---|---|---|---|---|
| Conductividad eléctrica | Baetidae | (0,910; 0,004) | Sólidos totales disueltos | Baetidae | (0,805; 0,028) | |||
| Gerridae | (0,982; 0,001) | Polycentropodidae | (0,874; 0,01) | |||||
| Coenagrionidae | (0,872; 0,010) | Alcalinidad | Polycentropodidae | (0,892; 0,006) | ||||
| Protoneuridae | (0,872; 0,010) | Profundidad | Dytiscidae | (0,756; 0,049) | ||||
| pH | Polycentropodidae | (0,785; 0,036) | Tabanidae | (0,861; 0,012) | ||||
| Temperatura del agua | Naucoridae | (-0,804; 0,029) | ||||||