1 Introducción
El uso masivo de combustibles fósiles como fuente principal de energía se ha asociado con el aumento en la emisión de gases invernadero y la contaminación ambiental 1; por tal motivo, se ha intensificado la búsqueda de fuentes energéticas más limpias y amigables con el ambiente. El biodiesel es considerado un combustible limpio y renovable, su producción a escala industrial se realiza mediante la transesterificación química de triacilglicéridos (TAG) con un alcohol de cadena corta, para obtener ésteres mono-alquílicos de cadena larga 2. Este proceso requiere de reactantes de alta pureza y condiciones de procesamiento a temperaturas y presiones altas, así como pasos complejos de purificación que permitan obtener un producto que cumpla con las especificaciones de las normas internacionales para el biodiesel (EN14214 y ASTM 6751-09) 3,4. Por lo anterior, actualmente un área de intensa investigación es la búsqueda y/o desarrollo de catalizadores novedosos que sean económicos y que no generen sub-productos.
Las lipasas EC. 3.1.1.3. se utilizan como catalizadores en reacciones de esterificación, alcoholisis, acidólisis e inter-esterificación en ambientes no acuosos y/o con muy baja actividad de agua 5,6; además, son quimio, regio y/o enantio-selectivas al sustrato 7, lo que las hace atractivas para la síntesis de biodiesel mediante transesterificación enzimática. Actualmente, la transesterificación enzimática se realiza principalmente con lipasas microbianas, provenientes de hongos como Mucor miehei (Lipozym IM 60® y Lipozyme TL IM®), Candida antarctica (Novozym 435®), Pseudomonas cepacia (PS 30) y Rhizopus oryzae, obteniendo porcentajes de conversión > 90%, usando metanol como aceptor de acilos 8,9. A pesar de sus ventajas, la mayoría de las lipasas microbianas son inestables en presencia de alcoholes de cadena corta como metanol y etanol 10, por lo que suelen usarse en forma inmovilizada, generando un incremento en los costos de producción del biodiesel, haciéndolas poco atractivas a nivel comercial. A la fecha, China es el primer país del mundo que incursiona en la producción industrial de biodiesel usando lipasas como catalizadores, con una capacidad de producción de 20.000 toneladas por año 11.
Por otra parte, diferentes estudios reportan que las lipasas vegetales pueden usarse en la transesterificación enzimática de aceites, reportándose resultados prometedores con lipasas provenientes del látex del fruto de C. papaya L. (familia: Caricaceae) 12,13,14. El látex del fruto de C. papaya presenta un complejo de enzimas lipóliticas (denominado CPL), que se encuentran naturalmente inmovilizadas en una matriz polimérica insoluble en agua, lo que las hace muy estables a la desnaturalización en un rango amplio de valores pH y temperatura y/o en presencia de solventes orgánicos, comparadas con las lipasas microbianas libres 15,16; además, pueden recuperarse y reutilizarse en futuros ciclos de reacción. CPL ha sido utilizado en la bioconversión de lípidos, principalmente en reacciones de lipólisis, alcoholisis e interesterificación. Sin embargo, para que CPL genere procesos económicamente viables, es necesario identificar las materias primas que permitan obtener buenos rendimientos en los procesos de bioconversión.
Previamente se demostró que en las reacciones de lipólisis 17 e interesterificación 18, las lipasas del látex de C. papaya exhiben estereoselectividad sn3 y selectividad por TAG de cadena corta. Estudios posteriores demostraron que fracciones del látex de C. papaya también presentan diferencias de especificidad por TAG, lo cual sugiere la existencia de por lo menos tres enzimas lipoliticas con propiedades cataliticas diferentes 19. Rivera y Sandoval 21) demostraron que la fracción cruda del látex exhibe preferencia por TAG de cadena corta, mientras que la fracción libre de proteasas (denominada CPL-p) y otra fracción libre de estereasas (denominada CPL-e) son más activas sobre TAG de cadena mediana y larga, respectivamente. Adicionalmente, estas fracciones exhiben condiciones en lo relacionado con la temperatura y pH óptimo de reacción, así: 40º C y pH 8,5 para la hidrólisis de TAG de cadena corta; 50º C y pH 9,0 para TAG de cadena larga 20. A la fecha, el mejor conocimiento de las lipasas parcialmente purificadas del látex de C. papaya se refiere a su actividad lipolítica.
Según la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO), Colombia es uno de los principales países productores del fruto de papaya en América 21, siendo la región Caribe colombiana una de las zonas con mayor cultivo 22. No obstante, su principal uso en el país es el consumo del fruto, siendo subestimada la utilización del látex como subproducto agroindustial. Por lo anterior, el presente estudio tuvo como propósito investigar el uso de las fracciones P3 y CPL-p del látex del fruto de C. papaya, cultivado en el departamento del Atlántico (Colombia), en la lipólisis y metanolisis del aceite de canola. La selección del aceite de canola se basó en el contenido mayoritario de TAG de cadena larga, mono y poliinsaturados 23. Para evaluar la eficiencia de la reacción de metanolisis, los porcentajes de conversión del aceite se compararon con los obtenidos con una enzima de referencia, la lipasa B de Candida antarctica inmovilizada en una resina acrílica, cuyo nombre comercial es Novozyme 435. Los resultados mostraron que CPL-p presenta mayor actividad lipolítica del aceite de canola comparado con P3; sin embargo, la actividad de esta fracción en la reacción de metanolisis fue significativamente menor al obtenido con Novozyme 435. En consecuencia, se hace necesario realizar estudios para incrementar el rendimiento de la reacción de transesterificación, así como explorar el uso de estas fracciones en otras áreas diferentes al sector energético.
2 Materiales y métodos
2.1 Reactivos
Metanol ≥ 99.9 % de pureza (CAS 67-56-1), n-hexano (CAS 110-53-3) y Triton® X-100 (CAS 9036-19-5) fueron adquiridos en Merck® (Darmstadt, Germany). Para la reacción de metanólisis se utilizó aceite de canola tipo comercial marca WESSON®. La lipasa B de Candida antarctica (Novozyme 435®) fue adquirida con Sigma-Aldrich.
2.2 Látex de C. papaya
El látex de C. papaya fue obtenido de un cultivo ubicado en el municipio de Ponedera, departamento del Atlántico (Colombia), previa confirmación botánica de la especie en el Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, sede Bogotá (Colección # 676924). El látex se recolectó en horas de la mañana, directamente desde frutos verdes, siguiendo el procedimiento descrito por Madrigal et al en 1980 24. El látex fresco se obtuvo realizando incisiones longitudinales de 2 mm de profundidad sobre la epidermis del fruto, usando una cuchilla de acero inoxidable (Figura 1). El látex exudado se recolectó en recipientes de plástico limpios que se transportaron rápidamente al laboratorio, en condiciones refrigeradas (4 - 8° C).
2.3 Obtención de las fracciones del látex de C. papaya
El látex fresco se secó durante 48 h a 42° C en un horno Thermolab TH240-Dies, luego se pulverizó hasta obtener un material fino de color blanco, que corresponde a la fracción cruda P3. La fracción CPL-p se obtuvo a partir de P3, siguiendo un protocolo descrito previamente 20,25). La mitad del material P3 obtenido se lavó cinco veces con agua destilada a una temperatura de 4° C, usando una relación peso/volumen del 0.15 %. El material insoluble en agua, que contiene la lipasa activa, se recuperó después de cada lavado mediante centrifugación a 5,000 rpm durante 20 min en un equipo Beckman modelo GPR, luego se liofilizó en un equipo LABCONCO® Freeze Dryer de 2.5 L, por 72 h, a -46° C y 0.098 mbar de presión. Las fracciones P3 y CPL-p se almacenaron a -20 °C en un congelador Panasonic (Biomedical Freezer Serie MDF-U5412).
2.4 Actividad lipolítica de las fracciones P3 y CPL-p
La actividad lipolítica de las fracciones P3 y CPL-p fue determinada mediante la reacción de hidrólisis de los TAG contenidos en el aceite de canola. Los ácidos grasos (AG) liberados se determinaron mediante titulación ácido-base, siguiendo el procedimiento descrito por Rivera y colaboradores en 2014 20, con pocas modificaciones. La reacción se inició en una incubadora con agitación orbital (Shel Lab SSI2-2 Mini Shaker®) a 50° C y 500 rpm, durante 60 min. La mezcla de reacción consistió en: 2.5 g de aceite de canola, 5 µL de Tritón X-100, 1 mL de Tris-HCl 50 mM (pH: 9) y 5% del catalizador (con relación al peso del aceite). Finalizado el tiempo de incubación, la reacción se detuvo con la adición de 5 mL de una mezcla neutra de acetona/etanol (1:1, v/v). Los ácidos grasos liberados del proceso anterior fueron titulados con una solución de NaOH (0.0969 M) previamente valorada. La mezcla de reacción en ausencia del catalizador fue usada como referencia. Los resultados fueron expresados en unidades de actividad lipolítica especifica (U. g-1), definida como la cantidad de enzima necesaria para liberar un µmol de AG por minuto por gramo (g) de enzima inmovilizada (Ec. 1).
2.5 Caracterización del aceite de canola
Se determinó la acidez del aceite de canola, usando el procedimiento descrito en la norma Icontec 5555-95: “Metodología estándar para la determinación de ácidos grasos libres contenidos en grasas animales, aceites marinos y vegetales” 26. El perfil de AG del aceite de canola se determinó por Cromatografía de Gases acoplada a Espectrometría de Masas (CG-EM), en un equipo CG-EMD HP-7890B/MSD-5977 Agilent, con un inyector automático ALS Agilent 7693 Autosampler. Un volumen de 1µL de muestra disuelta en éter de petróleo se inyectó en modo Split (relación 50:1) en el puerto de inyección del equipo a una temperatura de 140° C. La separación se llevó a cabo en una columna capilar (30 m x 250 µm, 0.25 µm de espesor, compuesta de difenilpolidimetilsiloxano AT-5). El gas de corrida fue helio, con flujo constante de 50 mL/min y presión de cabeza de 12,775 psi. La temperatura de la columna fue programada desde 140° C a 240° C a una tasa de 20° C/min, aumentando la temperatura a razón de 2° C/min hasta llegar a 260° C y 10° C/min hasta llegar a 300° C. El tiempo de corrida total fue de 32 min. El detector selectivo de masa MSD-5977 fue ajustado para escanear en el intervalo m/z 45,00 a 550,00. Los espectros de masas obtenidos fueron comparados con los reportados en la base de datos NIST (Mass spectral library NIST11).
2.6 Metanólisis del aceite de canola con KOH
La metanólisis del aceite de canola se llevó a cabo en un reactor tipo batch, siguiendo el procedimiento descrito por Fontalvo y colaboradores en 2013 27. Se calentó 10 g de aceite de canola a una temperatura máxima de 45 °C en un equipo Thermo Scientific Cimarec 25-540° C AG083. Se adicionó a la mezcla 1,5 % de KOH (con respecto al peso del aceite) y metanol del 99.9 % de pureza, en una relación molar 6:1 de metanol/aceite, seguido se mezcló en un agitador orbital vórtex 2,500 rpm durante 90 min. Finalizada la reacción, los EMAG se separaron del glicerol mediante decantación en un embudo; la fase superior, conteniendo los ésteres y otros contaminantes, se lavó varias veces con H2O destilada y luego con HCl 0.5 % v/v hasta obtener un pH 6-7 en las aguas de lavado. La mezcla de ésteres de metilo obtenida se secó con Na2SO4 sólido anhidro (CAS 7757-82-6), luego se filtró al vacío, se pesó y posterior se almacenó. El rendimiento de la producción de biodiesel se calculó con la Ec. 2.
2.7 Metanólisis del aceite de canola con Novozyme 435
Se realizó siguiendo las condiciones descritas por Winayanuwattikun y colaboradores en 2008 28, con algunas modificaciones. La reacción se llevó a cabo en un reactor tipo batch a una temperatura de 40° C y 55° C, agitación constante de 200 rpm y tiempo de reacción de 24 h. La mezcla de reacción consistió en: 6 g de aceite de canola, 30 % de n-hexano (con respecto al aceite), 13 % de Novozyme 435 (con respecto al aceite) y relación molar 3:1 metanol/aceite. El metanol se adicionó en tres etapas con el propósito de minimizar la inactivación de la enzima. Finalizado el tiempo de reacción, se adicionaron 3 mL de n-hexano a la mezcla, seguido de agitación suave por 5 min y filtración al vacío para separar la enzima Novozyme. El filtrado, conteniendo los EMAG, se dejó en campana de extracción durante 5 días para garantizar la evaporación completa del solvente. El producto se almacenó a 4° C en viales de vidrio color ámbar.
2.8 Metanólisis con las fracciones del látex de C. papaya
Con el propósito de evaluar cuál de las fracciones estudiadas del látex del fruto de la C. papaya presentaba mayor actividad enzimática en la reacción de metanólisis del aceite de canola, se realizó un diseño experimental 22, considerando los siguientes factores: tipo de enzima (P3 y CPL-p) y relación molar metanol: aceite (3:1 y 6:1). La reacción se llevó a cabo en un reactor tipo batch a una temperatura de 50º C, 200 rpm y un tiempo de reacción de 48 h. La mezcla de reacción consistió en: 6 g de aceite de canola, 20 % n-hexano (respecto al peso del aceite) y 15 % del catalizador (respecto al peso del aceite). Para detener la reacción se añadieron 3 mL de n-hexano, seguido de filtración al vacío para separar la enzima. El solvente se evaporó en campana y el producto se almacenó a 4 °C en viales de vidrio color ámbar.
2.9 Cromatografía en Capa Fina (CCF)
Los productos de las reacciones de metanólisis se analizaron por CCF siguiendo la metodología descrita por Fedosov y colaboradores, 2011 29) con algunas modificaciones. Brevemente, un volumen de 2µL de cada muestra se sembró en cromatoplacas de Silica gel (TLC Silica gel 60 F254, 25 Aluminum sheets 20 X 20 cm, Merck Millipore®). La fase móvil consistió en una mezcla de n-hexano/acetato de etilo/ácido acético (90:10:1). Las cromatoplacas se revelaron en una cámara saturada con vapores de yodo. Posteriormente, se realizó el análisis de las cromatoplacas con el software JustQuantifyFree (http://justquantify.eu/DefaultHD.aspx), para determinar el valor de Rf y la densidad óptica de la señal correspondiente a los EMAG en el biodiesel de referencia (biodiesel de canola obtenido con KOH) y en los productos de la metanólisis enzimática. Se realizó una aproximación al cálculo de la productividad de la metanólisis, usando la Ec. 3.
2.10 Análisis de los datos
Las reacciones de lipólisis y metanólisis se realizaron por duplicado. Los datos obtenidos se tabularon en una hoja de cálculo del programa Excel 2011 de Microsoft® para Mac, versión 14.4.0. Luego, fueron exportados al software de acceso libre “R studio” Versión 0.99.473-©2009-2015, para los análisis estadísticos. Los resultados se expresaron como la media aritmética ± 1 desviación estándar (DE). Para establecer una diferencia significativa entre los tratamientos, se realizaron análisis de varianza (ANOVA) con un nivel de confianza del 95 %, previa comprobación de los supuestos de independencia, normalidad y homocedasticidad de los datos.
3 Resultados y discusión
3.1 Fracciones del látex de C. papaya
Después del secado, el látex crudo de C. papaya adquirió un color amarillo pálido que luego se tornó blanco al pulverizarlo. El rendimiento de la obtención de la fracción P3 fue de 26.89 ± 0.26 %, mientras que el rendimiento de obtención de la fracción CPL-p fue de 4.85 ± 0.04 %, con respecto al peso de látex fresco inicial (Tabla 1).
Tabla 1 Rendimiento de obtención de las fracciones P3 y CPL-p del látex de C. papaya.
| Muestra | Látex (g) | P 3 | CPL-p | ||
|---|---|---|---|---|---|
| Peso (g) | Rendimiento (%) | Peso (g) | Rendimiento (%) | ||
| 1 | 29,569 | 8,036 | 27,178 | 1,423 | 4,813 |
| 2 | 35,254 | 9,395 | 26,649 | 1,705 | 4,837 |
| 3 | 42,467 | 11,398 | 26,839 | 2,078 | 4,893 |
| Media | 35,763 | 9,609 | 26,889 | 1,735 | 4,847 |
| DE | 6,464 | 1,691 | 0,268 | 0,328 | 0,041 |
3.2 Actividad lipolítica de las fracciones del látex de C. papaya
La actividad lipolítica de las fracciones P3 y CPL-p en la reacción de lipólisis del aceite de canola fue 77.09 ± 1.52 U.g-1 y 185.29 ± 2.59 U.g-1 respectivamente, a pH 9 y temperatura de 50º C. El análisis de ANOVA con un α = 5 %, demostró que existe una diferencia estadísticamente significativa entre las actividades de estas dos fracciones (F = 233; valor-p = 0.0004), siendo CPL-p la que presenta mayor actividad. Se plantea que la eliminación de las proteasas concentra las lipasas presentes en el látex crudo de C. papaya, causando un incremento significativo (58.4 %) en la capacidad de CPL-p para hidrolizar los TAG de cadena larga (C16 y C18) presentes en el aceite de canola. Previamente, Rivera y colaboradores (2014) habían comparado la actividad lipolítica de las fracciones P3 y CPL-p, usando como sustratos Tributirina (C4:0), Trioctanoina (C8:0) y aceite de oliva extra virgen con un contenido mayoritario de trioleína (C18:1), encontrando que CPL-p incrementa la hidrólisis de trioctanoina (AG de cadena mediana) pero no la del aceite de oliva 20. Adicionalmente, Campillo-Alvarado & Tovar-Miranda (2013) reportaron mayor actividad lipolítica de las lipasas del látex de C. papaya sobre TAG de cadenas corta y mediana 30. En nuestro estudio la fracción CPL-p fue más activa en la hidrólisis del aceite de canola, comparada con la fracción P3; en consecuencia, CPL-p sería más útil para la biotransformación de aceites ricos en AG de cadena larga; por ejemplo, para producir TAG estructurados nutricionalmente, bajos en calorías o enriquecidos con ácidos grasos esenciales poliinsaturados omega-3 y 6.
3.3 Caracterización del aceite de canola y metanólisis química con KOH
El porcentaje de acidez del aceite de canola fue 0.0491 ± 0.0037 %, valor que se encuentra en el rango adecuado para la síntesis de biodiesel, debido a que se requiere un porcentaje bajo de AG libres (< 0.05 %) para evitar la formación de sales que podrían interferir con la purificación de los ésteres metílicos 31. La Tabla 2 ilustra el resultado del perfil de AG en el aceite de canola y su abundancia relativa, determinada por CG-EM. Los AG mayoritarios fueron el ácido oleico (C18:1) y el ácido linoleico (C18:2), no se detectaron AG de cadenas corta o mediana y la relación de AG saturados/AG insaturados fue 10.06/89.85. Estas características corresponden a lo reportado en la literatura para este aceite 23.
Tabla 2 Perfil de ácidos grasos del aceite de canola.
| Ácido graso | t R a | Abundancia Relativa (%) b |
|---|---|---|
| C16:0 | 10,223 | 1.15 ± 0.15 |
| C16:1 [9] | 10,227 | 3.89 ± 0.17 |
| C18:0 | 11,885 | 8.91 ± 0.09 |
| C18:2 [9,12] | 11, 828 | 18.04 ± 0.43 |
| C18:1 [cis-9] | 11,880 | 68.01 ± 0.21 |
a. Tiempo de retención.
b. Media aritmética de 2 determinaciones ± desviación estándar.
El rendimiento de producción de EMAG obtenido a partir de la metanólisis básica del aceite de canola fue 93.594 ± 0.865 %. La Figura 2 ilustra los productos de la reacción de la metanólisis básica, separados por CCF. En esta figura se observa una señal cuyo valor de Rf corresponde al biodiesel de referencia B100 (Rf = 0.78). También se observaron otras señales minoritarias que corresponden a diferentes subproductos como diacilglicéridos (DAG) y monoacilglicéridos (MAG), con valores Rf = 0.28 y 0.2 respectivamente. Mediante este método analítico no se detectaron triacilglicéridos (TGA) sin convertir.
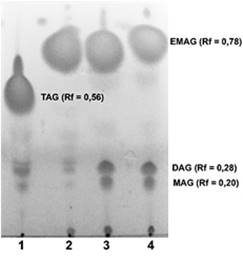
Figura 2 Cromatografía de capa fina de los productos de la metanólisis del aceite de canola con KOH. 1: Aceite de canola; 2: Biodiesel de referencia B100; 3 y 4: Biodiesel de canola. EMAG = Ésteres metílicos de ácidos grasos; TAG = Triacilglicéridos; DAG = Diacilglicéridos: MAG = Monoacilglicéridos.
3.4 Metanólisis enzimática del aceite de canola con Novozyme 435®
La Figura 3 ilustra el análisis por CCF de los productos de la metanólisis enzimática del aceite de canola a temperaturas de 40° C y 55° C y relación molar 3:1 de metanol/aceite. Todas las reacciones mostraron transformación del aceite de canola en EMAG, observándose una señal con Rf = 0.714 ± 0.007 que corresponde a la del biodiesel de canola usado como referencia en la misma placa cromatográfica (Rf = 0.717). Además, se detectaron TAG no convertidos (Rf = 0.564 ± 0.004), ácidos grasos libres (AGL) (Rf = 0.333 ± 0.010), DAG (Rf = 0.239 ± 0.006) y MAG (Rf = 0.192 ± 0.007). La Tabla 3 presenta las productividades de la metanólisis en las reacciones catalizadas por Novozyme 435 (expresada como % EMAG). A 55° C se produjo la mayor conversión de EMAG (62.967 ± 0.631). El análisis de ANOVA de una vía (α = 5%) demostró que la temperatura no influye significativamente en la actividad catalítica del Novozyme 435 (F = 14.79; valor-p = 0.0614), en el rango de temperaturas evaluado y bajo las condiciones experimentales desarrolladas.
Tabla 3 Productividades de la metanólisis del aceite de canola con la enzima inmovilizada de Candida antárctica (Novozyme 435).
| Catalizador | Vol. Señal a | % EMAG | Media ± 1DE |
|---|---|---|---|
| KOH | 2217.2 | - | - |
| Novozyme 435® (40 °C) | 1187.7 | 53.568 | 50.307 ± 4.611 |
| Novozyme 435® (40 °C) | 1043.1 | 47.046 | |
| Novozyme 435® (55 °C) | 1406.0 | 63.413 | 62.967 ± 0.631 |
| Novozyme 435® (55 °C) | 1386.2 | 62.520 |
a. Densidad óptica de la señal de EMAG calculados por el Sofware JustQuantifyFree.
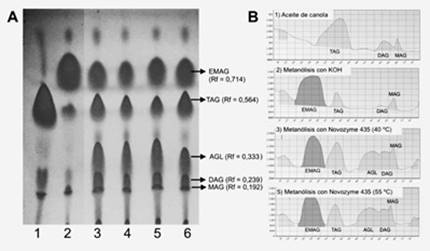
Figura 3 Cromatografía de capa fina (CCF) de la reacción de transesterificación con Novozyme 435. A) Separación de los productos de la metanólisis del aceite de canola en la placa de CCF. B) Gráficos de densidades ópticas de las manchas individuales detectadas en la misma placa, cada gráfico de densidad corresponde a una línea de corrida en la cromatoplaca. 1) Aceite de canola; 2) Metanólisis con KOH; 3 y 4) Metanólisis con Novozyme 435 a 40° C; 5 y 6) Metanólisis con Novozyme 435 a 55° C. EMAG = Ésteres metílicos de ácidos grasos; TAG = Triacilglicéridos; DAG = Diacilglicéridos: MAG = Monoacilglicéridos; AGL = ácidos grasos libres.
La transesterificación de aceites vegetales usando metanol como aceptor de acilo y Novozyme 435 como catalizador ha sido ampliamente investigada, reportándose porcentajes de conversión mayores a los logrados en este trabajo (> 90 %) 32. Varios factores pueden influir en la eficiencia de esta reacción, Chang y colaboradores publicaron en 2005 33 un estudio de optimización de la metanólisis del aceite de canola usando Novozyme 435, logrando identificar que la concentración de enzima, la temperatura de reacción y la relación molar metanol/aceite son los factores con mayor influencia en la conversión de este aceite, reportándose 97.9 % de conversión experimental al usar 42.3 % de enzima, temperatura de 38° C y relación molar metanol/aceite de 3.5. De acuerdo con este estudio, es posible que la cantidad de enzima utilizada en nuestros experimentos (13 % en peso con relación al aceite) sea la causa del menor porcentaje de conversión. Respecto al factor temperatura, se ha observado que en procesos batch, temperaturas entre 30° C - 50° C, son óptimas para la transesterificación enzimática usando aceites vegetales. Por otra parte, se ha descrito que cuando Novozyme 435 se trata previamente con los sustratos o reactivos análogos, se obtienen conversiones más altas de EMAG, al mejorar la tolerancia de la enzima al metanol y mantener la conformación de la enzima en su forma activa 34. En este estudio no se realizó tratamiento previo a la Novozyme 435, lo que podría haber afectado la eficiencia de la reacción.
3.4 Metanólisis enzimática del aceite de canola con las fracciones del látex de C. papaya
Los productos de reacción de la metanólisis enzimática del aceite de canola, usando las fracciones P3 y CPL-p como catalizadores, presentaron una apariencia turbia, la cual fue mayor a la observada en los productos de la metanólisis con Novozyme 435. Esto sugiere una posible conversión incompleta de los TAG en EMAG. El análisis por CCF (Figura 4), ilustra cualitativamente una mayor conversión a ésteres metílicos cuando se usa una relación molar metanol/aceite de 3:1, separándose un producto con Rf = 0.785 ± 0.045, que es comparable al biodiesel de canola usado como referencia en la misma cromatoplaca (Rf = 0.775 ± 0.062). También se observó la señal de los TAG que no se convirtieron (Rf = 0.592 ± 0.054) y los productos de su hidrólisis parcial: AGL (Rf = 0.390 ± 0.016), DAG (Rf = 0.294 ± 0.011) y MAG (Rf = 0.218 ± 0.009).
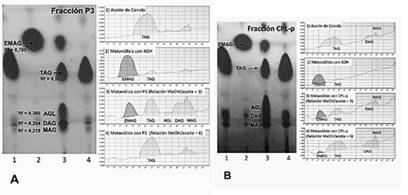
Figura 4 Cromatografía de capa fina (CCF) de la reacción de transesterificación del aceite de canola con las fracciones del látex de C. papaya. Se muestra la separación de los productos de las reacciones en la placa de la CCF y al lado los gráficos de densidades ópticas de las manchas detectadas en los carriles de cada cromatoplaca. A) CCF de la metanólisis con la fracción P3. B) CCF de la metanólisis con la fracción CPL-p. 1) aceite de canola; 2) metanólisis con KOH; 3) metanólisis con las fracciones de C. papaya usando una relación molar metanol/aceite de 3:1; 4) metanólisis con las fracciones de C. papaya, usando una relación molar metanol/aceite de 6:1. EMAG = Ésteres metílicos de ácidos grasos; TAG = Triacilglicéridos; DAG = Diacilglicéridos: MAG = Monoacilglicéridos; AGL = ácidos grasos libres.
La Tabla 4 muestra las productividades de la metanólisis del aceite de canola en las reacciones catalizadas por P3 y CPL-p (expresada como % EMAG). El análisis ANOVA de una vía demostró que existe diferencia estadísticamente significativa entre los tratamientos (F = 993.1; valor-p = 5.18e-05), bajo las condiciones experimentales realizadas, obteniéndose un mayor porcentaje de conversión al usar la fracción CPL-p como catalizador de la reacción de metanólisis. El análisis post. hoc de diferencias de medias pareadas de Tukey HDS indica que la producción de EMAG es influenciada por el tipo de fracción del látex de C. papaya, cuando se usa una relación molar metanol/aceite de 3:1 (Diferencia de Medias = 6.933; LCI = 3.051; LCS = 10.815 y valor p = 0.009).
Tabla 4 Productividades de la metanólisis del aceite de canola con las fracciones del látex de C. papaya.
| Catalizador | Relación Metanol/Aceite | Vol. Señal a | % EMAG | Media ± 1DE |
|---|---|---|---|---|
| KOH | 6:1 | 1109,300 | ||
| Fracción P3 | 3:1 | 342,050 | 30.835 | 31.550 ± 1.012 |
| Fracción P3 | 3:1 | 357,920 | 32.265 | |
| Fracción P3 | 6:1 | Sin señal | - | - |
| Fracción P3 | 6:1 | Sin señal | - | |
| KOH | 6:1 | 1028,400 | ||
| Fracción CPL-p | 3:1 | 390,210 | 37.943 | 38.484 ± 0.764 |
| Fracción CPL-p | 3:1 | 401,320 | 39.024 | |
| Fracción CPL-p | 6:1 | 64,010 | 6.224 | 6.131 ± 0.132 |
| Fracción CPL-p | 6:1 | 62,090 | 6.038 |
a. Densidad óptica de la señal de EMAG calculados por el Sofware JustQuantifyFree.
A pesar de que la fracción CPL-p produjo mayor conversión que P3 en la metanólisis del aceite de canola, la productividad de EMAG con cualquiera de las fracciones fue menor a la obtenida en la metanólisis con Novozyme 435 (valor-p < 0.0001). Caro et al.35, observaron que factores como el origen geográfico de la planta, el tiempo de reacción y la actividad termodinámica del agua (aw), influyeron significativamente sobre la actividad catalítica de lipasas de C. papaya; estos autores reportaron actividades específicas diferentes en la metanólisis del aceite de Copra, obteniendo conversiones máximas de 57.5 % y 36.0 % (a 50° C), al usar como catalizadores una preparación comercial de papaína cruda y CPL, respectivamente. En otro estudio, Rodrigues et al 36, informaron sobre porcentajes de conversión cercanos al 50 %, usando como sustrato el aceite de semillas de Jatropha curcas L., y como catalizador una lipasa recombinante de C. papaya inmovilizadas sobre la resina Lewatit® VP OC 1600, lo cual confirma que el tipo de lipasa influye el porcentaje de conversión.
Adicionalmente, se observó que al incrementar la cantidad de metanol en la reacción (relación metanol/aceite = 6) la conversión del aceite de canola se redujo significativamente (84 % más baja). Esto sugiere que, en las condiciones experimentales desarrolladas, el metanol afecta el proceso de transesterificación catalizado por CPL-p y P3. Este hallazgo es consistente con lo reportado previamente en estudios previos, en los cuales utilizan las lipasas del látex de C. papaya como catalizadoras y los alcoholes de cadena corta como aceptores de acilos 37,38. Igual como sucede con las lipasas microbianas, los alcoholes de cadena corta pueden desactivar la lipasa CPL al promover el cambio conformacional de la enzima a su forma inactiva 34. Previamente, Su & Wei 13 habían demostrado la susceptibilidad de las lipasas del látex de C. papaya al metanol, etanol e isopropanol en la alcoholisis del aceite de soja, obteniendo conversiones < 37 %, en preparaciones con una relación molar metanol/aceite de 4 y un tiempo de reacción de 24 h. Por otra parte, cuando se usaron alcoholes de 4 y 5 carbonos, las conversiones fueron mayores (entre 42.7 % - 58.4 %), bajo las mismas condiciones de reacción; conversiones > 90% fueron posibles con diferentes tipos de aceites de cadena larga, al usar n-butanol como aceptor de acilo, en un proceso batch bajo condiciones de reacción optimizadas (55° C, 150 rpm, 15 % de CPL-p, radio molar alcohol/aceite de 12 y aw = 0.225). A pesar de que el n-butanol puede obtenerse por fermentación, su costo es más elevado comparado con el metanol, lo que constituiría un limitante para la producción de biodiesel mediante este proceso a escala industrial, por lo que es necesario seguir explorando procesos de optimización de la metanólisis de aceites vegetales, usando la lipasa CPL-p como catalizador.
4 Conclusión
El presente estudio demostró que el látex obtenido de las plantas de C. papaya cultivada en la región Caribe colombiana presentan fracciones con actividad lipolítica, siendo la fracción libre de proteasas (CPL-p) la de mayor potencial para la bioconversión de aceites y grasas compuestas por TAG de cadena larga. Igualmente, se encontró que, bajo las condiciones del estudio, la eficiencia de los catalizadores P3 y CPL-p en la síntesis de EMAG, reflejaron una conversión incompleta del aceite de canola. Este resultado conduce a la necesidad de optimizar las condiciones de esta reacción para lograr mayores porcentajes de conversión o desarrollar estudios futuros con la fracción CPL-p para la producción de glicéridos parciales con potencial uso en las industrias de alimentos, farmacéutica o cosmética. Sin embargo, estos hallazgos preliminares, pueden contribuir a la caracterización de la materia prima (látex) con miras a la obtención de catalizadores “verdes” en la bioconversión de grasas y aceites.















