1 Introducción
En las últimas décadas, se ha encontrado en América Latina que la situación alimentaria y nutricional de las poblaciones ha presentado un mejoramiento, acompañado de una reducción progresiva de la mortalidad, sin embargo, otras carencias específicas como la anemia por deficiencia de hierro, el bocio endémico y la hipovitaminosis A, continúan altamente prevalentes 1 - 2. También están adquiriendo importancia otras formas de malnutrición por exceso de consumo de un determinado tipo de alimento y por el consumo de dietas inadecuadas, las cuales constituyen factores de riesgo en el aumento de enfermedades relacionadas con la nutrición, tales como la obesidad, la diabetes, las enfermedades cardiovasculares y algunos tipos de cáncer, que originan serios problemas de salud 3 , 4. Para el análisis del estado óptimo de nutrición de una persona, se establecen técnicas analíticas como la cromatografía líquida de alta eficiencia (HPLC), que también permiten plantear recomendaciones en cuanto al tipo de alimentación, según los niveles en sangre de sustancias nutritivas como aminoácidos, lípidos, proteínas y glucosa ( 5.
Desde que se introdujo la técnica de cromatografía de columna para análisis de aminoácidos 6 - 7 ha habido un dramático aumento en el desarrollo de estrategias y métodos para mejorar los resultados obtenidos en la detección de los diferentes aminoácidos. Este aumento se ha obtenido gracias al desarrollo rápido de la separación por HPLC y, que, desde hace algunos años, el procedimiento de análisis de aminoácidos basado en la derivatización pre-columna con fenilisotiocianato (PITC) ha ido ganando popularidad. Una revisión de la literatura muestra que antes de junio de 1981 se habían publicado un poco más de 100 artículos que utilizaban esta técnica. A pesar de no ser tan sensitivos como algunos de los reactivos fluorescentes, los derivados feniltiocarbamil (PTC) altamente absorbentes en la región UV 8, pueden ser detectados a niveles de 1 pmol 9, que representa un nivel práctico de sensibilidad para muestras reales con problemas de contaminación 10, de ahí la importancia de la preparación de la muestra, especialmente la hidrólisis de muestras como péptidos y proteínas en el análisis de aminoácidos y de implementar mejoras para el estudio.
Hariharan y colaboradores desarrollaron análisis de aminoácidos plasmáticos por HPLC con detector de UV y derivatización pre-columna utilizando fenilisotiocianato (PITC) 11. En este estudio ellos lograron la determinación de 25 aminoácidos y un porcentaje de recuperación de 99,9 %. El análisis fue lineal superior a 2 mmol, con un límite de detección de 1 pmol y un tiempo de análisis de 35 minutos. Por otro lado, Sánchez y Hubbard estudiaron la concentración de aminoácidos plasmáticos y la relación insulina/glucagón como una explicación para observar el efecto de proteína dietética en la arterosclerosis, encontrando que la composición aminoacídica de la dieta, tiene una influencia en los niveles postprandiales de los aminoácidos plasmáticos, lo mismo que a las hormonas insulina y glucagón, en humanos alimentados con un solo tipo de proteína idéntica en composición, excepto por su naturaleza (vegetal o animal) ( 12.
Tenemos que el método estándar para la estimación de la calidad de una proteína en humanos, involucra indicadores bioquímicos que permiten la evaluación de la calidad nutricional proteínica de una determinada dieta. Este método consiste en la determinación de los niveles de aminoácidos en plasma o suero, teniendo en cuenta que en varias dietas los factores fisiológicos y patológicos afectan los niveles de aminoácidos en plasma ( 13. En un intento por evaluar el valor nutricional de proteínas, se han usado cambios postprandiales (curvas de respuesta) en niveles plasmáticos de aminoácidos para calcular índices que permitan predecir los aminoácidos limitantes de varias proteínas ingeridas. Son muchos y variados los métodos de evaluación de la calidad proteica que han sido reportados y entre los más representativos, están los índices químicos 14, el índice de Oser 15, el índice de Mitchell 16, y el índice de aminoácidos o Score de aminoácidos ( 17, los cuales se basan en el hecho de fundamentar el valor nutritivo o la calidad de las proteínas alimentarias, en la identidad y cantidad de aminoácidos resultantes en su proceso hidrolítico enzimático.
Estos índices tienen como ventajas su sencillez y el hecho de identificar el aminoácido limitante en la proteína a investigar, pero entre sus desventajas está la de no considerar la digestibilidad de la proteína y la de los aminoácidos; también tenemos que la predicción de la calidad proteica es bastante buena para proteínas de muy alta o de muy baja calidad, pero se observa una baja exactitud en la predicción de proteínas de calidad intermedia 18.
En cuanto a la biodisponibilidad de las proteínas alimentarias, se sabe que es la mejor medida de calidad, debido a que tiene en cuenta la ingestión, digestión y utilización metabólica de los productos resultantes y entre los métodos de determinación más antiguos, encontramos el índice de eficiencia proteica o PER, desarrollado por Osborne 19, a partir del cual se han propuesto variaciones 20 - 21. A pesar de ser continuamente cuestionado, en 1975 fue adoptado por la AOAC y se fundamenta en ensayos experimentales con ratas macho recién destetadas a las cuales se les determinó el factor de ganancia de peso / gramo de proteína ingerida, utilizando un solo nivel de proteína. Algunos autores como Bressani 22 han demostrado una estrecha relación entre los análisis para determinar calidad proteica en humanos y animales, siendo ambas técnicas largas y costosas. Teniendo en cuenta esto y que la medida más exacta de la calidad de las proteínas es la que se realiza en el organismo vivo e inalterado, lo más conveniente es considerar el cuerpo humano como el mejor organismo test ( 23.
El presente estudio exploratorio tuvo como objetivo validar un método de determinación de aminoácidos plasmáticos por cromatografía líquida de alta eficiencia (HPLC) para evaluar las respuestas basales y postprandiales de aminoácidos en seres humanos con diversas dietas. Adicionalmente, se compararon las respuestas pre y post de glucosa, triglicéridos, colesterol, colesterol-HDL, proteína total y albúmina, en 9 adultos jóvenes sanos que ingirieron cantidades iso-proteicas de tres dietas típicas de Colombia: huevo cocido (HC), tortilla (arepa en Colombia) de maíz común simple (TMN) y tortillas (arepas) con queso mozzarella (TMQ). A partir de las comparaciones pre y post, se observaron respuestas diferenciales, estadísticamente significativas entre las diferentes dietas, lo que permitió demostrar que la biodisponibilidad de las proteínas y por ende de los aminoácidos debería ser el factor más importante para establecer recomendaciones nutricionales.
2 Materiales y métodos
2.1 Fase I. Validación del método de determinación de aminoácidos plasmáticos
Se validó y verificó el método de determinación de aminoácidos con base en el de Sarwar 24 - 25, cambiando el procedimiento estándar de secado al vacío por el de liofilización y empleando diferentes condiciones de gradientes de elución (ver Tabla 1).
Tabla 1 Programación del gradiente de elución.
| Tiempo (min) | Flujo (mL/min) | %A | %B |
|---|---|---|---|
| Inicial | 1,0 | 100 | 0 |
| 10,0 | 1,0 | 54 | 46 |
| 10,5 | 1,0 | 0 | 100 |
| 11,5 | 1,0 | 0 | 100 |
| 12,0 | 1,0 | 0 | 100 |
| 12,5 | 1,0 | 100 | 0 |
| 20,0 | 1,0 | 100 | 0 |
| 20,5 | 1,0 | 100 | 0 |
2.1.1 Reactivos y equipos
Reactivos. Acetonitrilo, metanol, etanol, ácido acético glacial y ácido fosfórico (JT Baker Chemical Co.). Acetato de sodio (anhidro), fosfato disódico y acetato de sodio (Mallinckrodt, Inc.). Trietilamina (TEA) de Aldrich Co. Fenilisotiocianato (PITC) y el estándar H de 17 aminoácidos (Pierce Co.). El estándar de aminoácidos contenía por cada mL: 1,25 μmoles de cisteína (Cys) y 2,5 μmoles de: arginina (Arg), histidina (His), isoleucina (Ileu), leucina (Leu), lisina (Lys), metionina (Met), fenilalanina (Phe), tirosina (Tyr), treonina (Thr), valina (Val), alanina (Ala), ácido aspártico (Asp), ácido glutámico (Glu), glicina (Gly), prolina (Pro), serina (Ser) y amoníaco, se adicionó también estándar de triptófano (Trp) en concentración de 2,5 µmol/mL. En la preparación de buffers y demás soluciones se utilizó agua de alta pureza generada por un sistema Milli-Q de Millipore Corp.
Equipos. La derivatización con fenilisotiocianato se llevó a cabo utilizando tubos de 10x75mm. Las muestras de estándares y de plasma fueron liofilizadas en un liofilizador Labconco. El sistema LC de gradiente consistía de 2 bombas Modelo 510, un auto-muestreador con loop de inyección de 1 a 250 µL, un módulo control de temperaturas (TCM) y un detector de U V Waters 486. Para la determinación de todos los aminoácidos se utilizó una columna PicoTag Waters de 300 x 3,9 mm. I.D., 3 µm. Se utilizó una pre-columna de seguridad C18 de 5 cm de longitud. La temperatura utilizada para obtener una óptima separación de los aminoácidos fue de 38 °C. El sistema analítico y de cálculos se controló utilizando el software Milleniun 2010 de Waters.
2.1.2 Preparación de las muestras
Se utilizaron muestras de plasma humano, las cuales fueron desproteinizadas, adicionando 50 mg de ácido sulfosalicílico a 1.0 mL de plasma, con posterior mezclado y centrifugación a 3000 r.p.m. durante 20 min con el propósito de separar los aminoácidos libres de la proteína precipitada. Posteriormente se tomaron 50 µL del sobrenadante para someterlos al proceso de resecado y derivatización.
2.1.3 Secado y derivatización de muestras
Las muestras de aminoácidos plasmáticos libres y del estándar H de aminoácidos en volumen de 50 µL se liofilizaron a sequedad a -40° C durante 30 min, previa congelación para evitar sublimación completa.
2.1.4 Preparación estándares de aminoácidos
Se prepararon estándares de aminoácidos a una concentración de 2,5 µmol/mL los cuales fueron sometidos al proceso de derivatización de acuerdo con las siguientes etapas:
Etapa 1. Proceso de resecado. Se preparó la solución de resecado compuesta de EtOH:H2O:TEA en una relación 2:2:1 respectivamente. Una vez obtenida la solución de resecado se adicionaron 10 μL de la misma a 10 μL de la solución estándar, procediéndose posteriormente a liofilizar durante 30 minutos hasta tener eliminación del solvente a sequedad completa.
Etapa 2. Preparación del reactivo derivatizante. EtOH:H2O-Q:TEA:PITC en la proporción 7:1:1:1 respectivamente.
Etapa 3. Reacción de derivatización. Se adicionaron 20 μL de reactivo derivatizante obtenido en la etapa 2 en cada muestra del estándar procesado en la etapa 1. Posteriormente se liofilizó durante 30 minutos con el propósito de secar completamente el fenilisotiocianato que no reaccionó. En esta etapa las muestras de estándar quedan perfectamente derivatizadas y listas para el proceso de cromatografía.
El proceso de cromatografía se inicia con la adición de 600 μL de solución diluente PicoTag, la cual se preparó previamente. Después de agitar vigorosamente en vórtex se transfirió a viales de 1 mL y se inyectaron 50 μL de la muestra derivatizada.
2.1.5 Preparación de las fases móviles y eluentes
Eluente A. Se preparó disolviendo 19,0 g de acetato de sodio trihidratado en 1,0 litro de agua Milli-Q. A esta solución se le adicionaron 0.5 mL de TEA y luego la solución se tituló hasta pH de 6,4 con ácido acético glacial. La solución se filtró empleando una membrana 0,45 μm. De la solución resultante se tomaron 940 mL y se le adicionaron 60 mL de acetonitrilo.
Eluente B. Se preparó mezclando 600 mL de acetonitrilo con 400 mL de agua Milli-Q, se filtró a través de una membrana de 0,45 μm y se desgasificó en un baño de ultrasonido durante 20 seg.
Diluente de la muestra. Se pesaron 710 mg de Na2HPO4 y se diluyeron en 1 litro de agua Milli-Q, se llevó a un pH de 7,4 con H2PO4 al 10% y se filtró con membrana de 0,45 μm. De la solución resultante se tomaron 95 mL para mezclarlos con 5 mL de acetonitrilo.
Gradiente de elución del método cromatográfico: el flujo de gradiente se programó de la manera indicada en la Tabla 1.
2.1.6 Curva de calibración y porcentaje de recuperación
Se preparó una curva de calibración en el rango de 4.2 µM a 20.8 µM y realizando inyecciones de 50 µL por duplicado para luego promediar las áreas. Para evaluar la repetitividad del sistema se inyectó cinco veces una solución estándar de concentración 12.5 µM y se determinó el coeficiente de variación, la desviación estándar y el promedio de los datos. Se efectuaron tres inyecciones de un mismo patrón estándar de concentración 12.5 µM en diferentes días y se calcularon el coeficiente de variación, la desviación estándar y el promedio para los datos obtenidos. Se determinó el porcentaje de recuperación tanto en plasma de hombre como de mujer. Para esto se adicionó al plasma humano una cantidad conocida del estándar de aminoácidos. El porcentaje de recuperación se calculó a partir de las áreas de los aminoácidos presentes en la muestra antes y después de la adición de los estándares.
2.2 Fase II. Análisis cuantitativo
Con ayuda de las curvas de calibración y teniendo en cuenta la respuesta lineal del método, se tomó la ecuación que representa la mejor recta para cada aminoácido y se calculó a partir de ella la concentración de los aminoácidos en el plasma humano.
2.2.1 Protocolo de selección de muestras
Las muestras de sangre requeridas para este análisis fueron donadas por nueve voluntarios, cuatro de ellos mujeres y cinco hombres con un rango de edades entre 20 y 24 años, considerados sanos después de ser seleccionados de una población que fue evaluada clínicamente, descartando aquellos que tenían enfermedades del corazón, diabetes y quienes estuvieran utilizando medicamentos. Previo al estudio, los participantes fueron desparasitados utilizando Pirantel tomada en 3 dosis de 500 mg/día. La edad promedio para las cuatro mujeres en estudio fue de 21,5 ± 1,3 años, el peso promedio fue de 54,0 ± 8,7 Kg y la estatura promedio de 1,60 ± 0,1 m; para los hombres la edad promedio fue de 22,2 ± 2,2 años, el peso promedio fue de 63,0 ± 7,6 Kg y la estatura promedio de 1,72 ± 0,01 m. El índice de masa corporal (IMC) calculada por el peso corporal / estatura2 (Kg/m2) fue de 21,09 para mujeres y de 21,29 para hombres. Todos los voluntarios fueron debidamente informados del estudio a realizar y firmaron el formato de consentimiento voluntario. Este protocolo fue revisado y aprobado por el Comité de Investigaciones de la Universidad del Valle, Cali-Colombia.
2.2.2. Procesamiento de los alimentos del ensayo
El huevo fue procesado de la manera convencional realizada en Colombia para obtener el denominado huevo cocido (HC): baño de agua en ebullición aproximadamente 15 min, posteriormente se eliminó la cáscara y se consumió la cantidad de huevo equivalente a 12 % de proteína.
La tortilla de maíz normal (TMN), denominada comúnmente en Colombia “arepa”, se elaboró a base de maíz blanco trillado (endospermo sin germen) cocción en suficiente agua durante tres horas y media, posterior molienda y adición de saborizantes (sal, panela y conservantes). Una vez moldeada fue sometida a pre-asado durante 7 minutos a 240 °C. Los voluntarios consumieron el peso equivalente a 12 % de proteína.
La tortilla de maíz con queso o arepa con queso (TMQ) se elaboró de manera análoga a la TMN, pero en este caso se introdujo en la parte media (a manera de sándwich) trozos de queso mozzarella equivalentes al 30 % del peso total. Los voluntarios consumieron la cantidad de TMQ equivalente a un 12 % de proteína.
2.2.3 Preparación para los ensayos
Cada uno de los 9 voluntarios consumió cada una de las tres dietas en tres días diferentes separados de entre 1 a 3 semanas por dieta. A los voluntarios se le tomó muestra sanguínea al cabo de 10 horas de ayuno con el propósito de determinar niveles séricos basales de glucosa, colesterol, colesterol-HDL, triglicéridos, proteínas totales y albúmina. Dos horas después de haber ingerido las dietas a investigar (TMN, TMQ o HC) se determinaron los niveles postprandiales séricos de los parámetros a investigar, así como también los niveles plasmáticos de aminoácidos.
2.2.4 Toma de muestras
Para la determinación de la respuesta basal y postprandial de los niveles plasmáticos de aminoácidos se utilizó un tubo Vacutainer con EDTA como anticoagulante, luego se centrifugó a 1200 x g a 4° C durante 20 minutos para separación del plasma. Las muestras de plasma obtenidas se almacenaron a -20° C hasta el momento del análisis. Una vez obtenidas las muestras de plasma se procesaron según técnica normalizada y validada en la Fase I. Para la determinación de la respuesta basal y postprandial de glucosa, perfil lipídico, proteínas totales y albúmina, la sangre fue colectada en jeringas desechables y entonces transferidas a tubos Vacutainer sin anticoagulante. Luego se centrifugó a 1200 x g a 4° C durante 20 minutos para separación de suero. Las muestras de suero obtenidas se almacenaron a -20° C hasta el momento del análisis.
2.2.5 Porcentaje de recambio y análisis estadístico
El porcentaje de recambio se determinó de la siguiente manera:
Donde (A.A)p: niveles de aminoácidos plasmáticos libres post ingesta
(A.A)o: niveles de aminoácidos plasmáticos libres basales pre ingesta
Para la comparación estadística de las diferentes dietas, se realizó análisis de varianza y comparación múltiple de Duncan con un nivel de confianza del 95 % (p<0.05). El programa estadístico utilizado fue el SPSS (Statistical Program of Social Sciences).
3 Análisis y Resultados
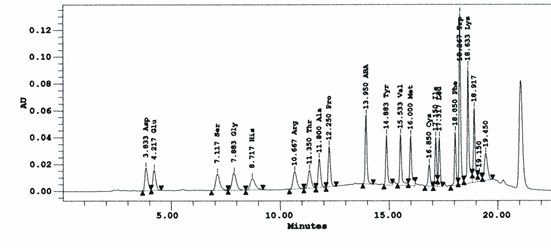
Para la identificación de cada aminoácido después de la cromatografía se tuvo en cuenta el siguiente cromatograma típico de una muestra de estándar (Figura 1):
Teniendo en cuenta el tiempo de retención para cada aminoácido, se hizo la identificación de éstos en las muestras de plasma. Los estándares de concentración 2,5 μmol/mL, que contienen los 18 aminoácidos presentan una buena separación como se observa en la Figura 1.
Con el propósito de estimar la linealidad del método, se tomaron por separado 1,0 μL, 2,0 μL, 3,0 μL, 4,0 μL y 5,0 μL, de la solución estándar de los aminoácidos de concentración 2,5 μmol/mL y se diluyeron a 600 μL con la solución diluente PicoTag obteniendo concentraciones de 4,2 μmol/L, 8,3 μmol/L, 12,5 μmol/L, 16,7 μmol/L y 20,8 μmol/L respectivamente, para todos los aminoácidos, excepto para la cisteína que se encontraba en una concentración de 1,25 μmol/mL.
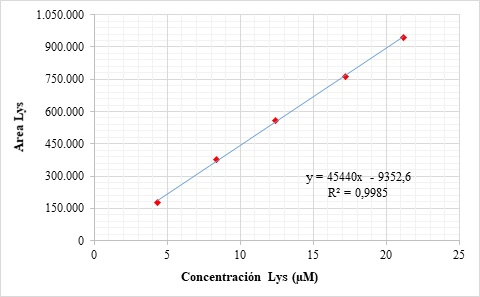
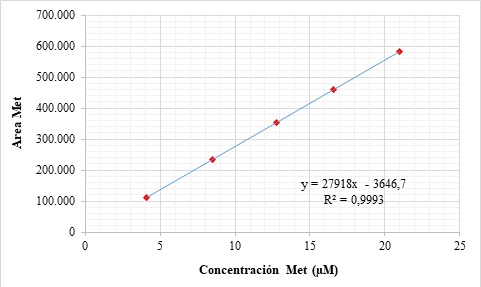
En las Figuras 2 y 3aparecen las curvas de calibración para dos de los aminoácidos más representativos: lisina y metionina.
En la Tabla 2 podemos apreciar los tiempos de retención promedio de los 18 aminoácidos estándar, así como también los respectivos coeficientes de correlación para la curva estándar a 5 concentraciones diferentes. Se observa cómo los coeficientes de correlación presentan valores que van desde 0.9983 para prolina y triptófano hasta 0.9996 para arginina, treonina y metionina. Teniendo en cuenta que para la cisteína el coeficiente de correlación fue de 0.9917, el más bajo de todos tal vez por la baja concentración en la que se encuentra en los estándares. Es destacable aquí la excelente respuesta en cuanto se refiere a la linealidad como sistema analítico para caracterizar el método de HPLC empleado.
Tabla 2 Tiempos de Retención y Coeficientes de Correlación (R) en estándares de aminoácido.
| Aminoácido | Tiempo de retención (min) | R |
|---|---|---|
| Asp | 3,633 ± 0,125 | 0,9994 |
| Glu | 3,967 ± 0,250 | 0,9991 |
| Ser | 6,888 ± 0,130 | 0,9988 |
| Gly | 7,250 ± 0,150 | 0,9987 |
| His | 7,600 ± 0,400 | 0,9993 |
| Arg/Thr | 10,733 ± 1,240 | 0,9996 |
| Ala | 11,450 ± 1,410 | 0,9992 |
| Pro | 11,967 ± 1,315 | 0,9983 |
| Tyr | 14,833 ± 1,150 | 0,9995 |
| Val | 15,417 ± 0,240 | 0,9990 |
| Met | 15,917 ± 0,320 | 0,9996 |
| Cys | 16,683 ± 1,400 | 0,9917 |
| Ile | 17,033 ± 0,120 | 0,9994 |
| Leu | 17,200 ± 6,150 | 0,9982 |
| Phe | 17,967 ± 0,180 | 0,9992 |
| Trp | 18,200 ± 0,200 | 0,9983 |
| Lys | 18,853 ± 0,300 | 0,9992 |
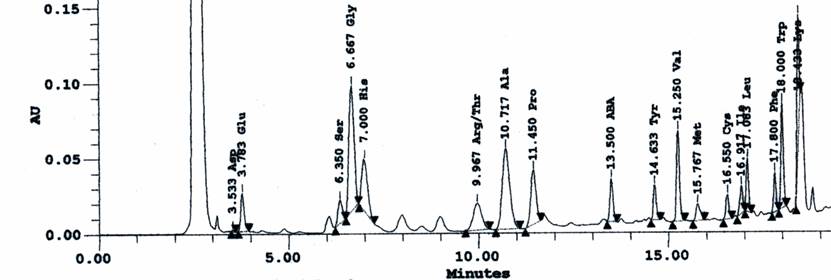
Con el propósito de establecer los tiempos de retención de cada aminoácido en la muestra de plasma, se trató 1,0 mL de ésta con 10,0 mg. de ácido sulfosalicílico (ASS), seguido de agitación con vórtex y posterior centrifugación a 3000 rpm durante 30 min. Se obtuvieron los aminoácidos libres en el sobrenadante, el cual se separó y filtró a través de una membrana de 0,45 μm. Las muestras así tratadas se procesaron en igual forma que los estándares tanto en el proceso de derivatización como en el análisis cromatográfico.
En el cromatograma correspondiente a los aminoácidos libres del plasma observado en la Figura 4, se puede apreciar la excelente resolución para la mayoría de los aminoácidos y la estrecha similitud en cuanto a los tiempos de retención los cuales aparecen comparados en la Tabla 3. Para la muestra de aminoácidos libres de plasma humano no hay buena resolución en los picos de arginina y treonina debido posiblemente a efectos de columna ya que esta tenía cierto tiempo de uso. Sin embargo, para propósitos de investigación podemos considerar como de excelente resolución. Estos resultados muestran una mejor resolución de picos de todos los aminoácidos en contraposición a los obtenidos por Lavi et al. 26 ) quienes reportaron alguna dificultad en la determinación de lisina, histidina, treonina, cisteína en fluidos biológicos por derivatización pre columna con PITC y separación de los aminoácidos derivatizados por cromatografía en fase reversa.
Tabla 3 Comparación entre los tiempos de retención de estándares de aminoácidos y los aminoácidos plasmáticos.
| Aminoácido | Muestras Estándares | Muestras Plasma Humano |
|---|---|---|
| Asp | 3,633 ± 0,125 | 3,533 ± 0,150 |
| Glu | 3,967 ± 0,250 | 3,783 ± 0,180 |
| Ser | 6,888 ± 0,130 | 6,350 ± 0,500 |
| Gly | 7,250 ± 0,150 | 6,667 ± 0,600 |
| His | 7,600 ± 0,400 | 7,000 ± 0,340 |
| Arg/Thr | 10,733 ± 1,240 | 9,967 ± 1,420 |
| Ala | 11,450 ± 1,410 | 10,717 ± 0,410 |
| Pro | 11,967 ± 1,315 | 11,450 ± 6,507 |
| Tyr | 14,833 ± 1,150 | 14,633 ± 0,200 |
| Val | 15,417 ± 0,240 | 15,250 ± 0,340 |
| Met | 15,917 ± 0,320 | 15,767 ± 0,608 |
| Cys | 16,683 ± 1,400 | 16,550 ± 0,890 |
| Ile | 17,033 ± 0,120 | 16,917 ± 0,208 |
| Leu | 17,200 ± 6,150 | 17,083 ± 0,160 |
| Phe | 17,967 ± 0,180 | 17,800 ± 0,310 |
| Trp | 18,200 ± 0,200 | 18,000 ± 0,600 |
| Lys | 18,853 ± 0,300 | 18,433 ± 0,290 |
Por otra parte, a pesar de que algunos autores 27 sostienen que el uso de metanol y ASS como agentes desproteinizantes causan considerables pérdidas y reducen el rendimiento de muchos PTC-aminoácidos, al realizar ensayos de porcentaje de recuperación en la Tabla 4 se puede observar que se obtuvieron muy buenos resultados, con porcentajes superiores al 90 % para la mayoría de los aminoácidos, excepto la glicina, demostrando de esta manera una buena exactitud del método de extracción de los aminoácidos libres del plasma humano utilizando como agente desproteinizante el ASS, esto puede deberse también al empleo del sistema de liofilización que por las condiciones de bajas temperaturas (-40 °C) y bajas presiones (5-10 mbar) evitan en gran parte la pérdida de PTC-aminoácidos por reacciones colaterales y simultáneamente mantienen la estructura molecular intacta lo cual no puede estar sucediendo cuando se utilizan los otros sistemas de secado en la pre-derivatización.
Tabla 4 Porcentajes de recuperación en las muestras.
| Aminoácido | Concentración determinada en la muestra (a.a. lib. 20µM) | Concentración Std 12.5µM agregada (std 12µM) | Concentración determinada en la muestra + std | %Recuperación |
|---|---|---|---|---|
| (a.a. lib + std 12,5) | ||||
| Asp | 0,292 | 13,432 | 12,464 | 90,82 |
| Glu | 2,094 | 13,487 | 14,802 | 95,00 |
| Ser | 4,881 | 13,004 | 15,797 | 88,33 |
| Gly | 12,099 | 13,282 | 10,194 | 40,16 |
| His | 9,031 | 13,536 | 22,186 | 98,31 |
| Arg/Thr | 5,355 | 13,534 | 18,454 | 97,70 |
| Ala | 32,079 | 14,245 | 45,590 | 98,42 |
| Pro | 16,069 | 15,622 | 31,917 | 99,72 |
| Tyr | 3,252 | 13,223 | 15,890 | 96,45 |
| Val | 10,469 | 14,554 | 23,756 | 94,94 |
| Met | 1,565 | 13,565 | 15,062 | 99,55 |
| Cys | 3,018 | 8,572 | 10,021 | 86,46 |
| Ile | 3,535 | 12,816 | 16,329 | 99,87 |
| Leu | 4,931 | 11,891 | 16,706 | 99,31 |
| Phe | 2,669 | 13,399 | 15,008 | 93,41 |
| Trp | 2,394 | 16,080 | 17,651 | 95,55 |
| Lys | 6,216 | 13,567 | 18,848 | 95,27 |
El procedimiento de hidrólisis, en particular, puede influenciar el perfil de aminoácidos. Algunos aminoácidos (Cys, Met, Trp, Thr., Ser y Tyr) se pueden destruir y otros (Val e Ileu) presentan problemas de velocidad. Los procedimientos analíticos también pueden afectar el perfil de aminoácidos. En conclusión, el método de cromatografía líquida reportado en esta primera fase del estudio puede ser usado para la determinación con una muy buena linealidad de los aminoácidos más importantes nutricionalmente especialmente los aminoácidos esenciales (Lys, Val, Phe, Leu, Met, Thr, Trp, Ile).
Respecto al triptófano, de acuerdo con cromatogramas publicados por Sherwood 28 y Hariharan 11 de aminoácidos plasmáticos utilizando las mismas técnicas de pre-derivatización con PITC y técnicas cromatográficas similares, se puede realizar su caracterización ubicándolo entre fenilalanina y lisina con un tiempo de retención promedio de 18.367 min. Esto es importante, debido a que el triptófano es un aminoácido esencial fácilmente degradable como se ha observado en los estudios in vitro de hidrolizados proteicos, por lo cual es necesario diseñar una técnica especial, en nuestro caso, por no haber realizado hidrólisis ácida.
Los niveles plasmáticos de triptófano pueden ser empleados como índice de su biodisponibilidad. Estudios similares en rumen animal han sido realizados por Or-Rashid et al. ( 29. El método de derivatización con fenilisotiocianato y el secado de la muestra en un liofilizador reportado en esta investigación puede ser usado como un método alternativo para una evaluación rápida de calidad proteínica ya sea desde el punto de vista de disponibilidad como de biodisponibilidad, metodología que según Hernández et al. 23 ) es costosa.
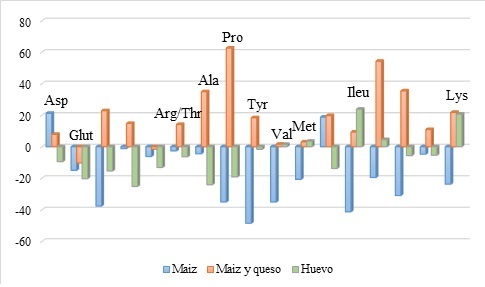
Una vez concluida la fase I, se procedió a aplicar los resultados obtenidos en la misma para la determinación de la biodisponibilidad de aminoácidos en las dietas bajo estudio. En la Tabla 5 se muestra el porcentaje de recambio total de aminoácidos. Los resultados que se obtuvieron indican que, para el análisis comparativo de las 3 dietas, la Ser, Ala, Pro, Tyr, Val, Ile, y Phe presentan diferencias estadísticamente significativas al 99 % de confianza (P<0.01), solo Leu presenta diferencias estadísticamente significativas al 95 % de confianza (P<0.05) y los demás aminoácidos en estudio no presentan diferencias estadísticamente significativas.
Tabla 5 Promedio de los porcentajes de cambio (∆%) observados como respuesta a la ingestión del equivalente a 12 % de proteína de huevo cocido (HC), maíz y queso (TMQ), maíz normal (TMN).
| Aminoácido | Maíz Normal | Maíz y Queso | Huevo Cocido | ANOVA |
|---|---|---|---|---|
| (TMN) | (TMQ) | (HC) | ||
| Asp | 21,21 ± 14,42 | 7,86 ± 28,27 | -9,43 ± 12,17 | N.S. |
| Glu | -14,96 ± 35,90 | -10,28 ± 47,62 | -20.28 ± 54.77 | N.S. |
| Ser | -37,63 ± 29,45 | 22,86 ± 53,27 | -15,38 ± 21,29 | ** |
| Gly | -1,20 ± 48,13 | 14,80 ± 17,71 | -25,22 ± 22,82 | N.S. |
| His | -6,20 ± 24,69 | -1,59 ± 21,18 | -13,17 ± 17,74 | N.S. |
| Arg/Thr | -2,62 ± 35,26 | 14,14 ± 21,90 | -6,38 ± 29,94 | N.S. |
| Ala | -4,48 ± 30,57 | 34,91 ± 31,25 | -24,09 ± 13,05 | ** |
| Pro | -35,06 ± 40,73 | 62,57 ± 101,34 | -19,12 ± 10,59 | ** |
| Tyr | -48,56 ± 26,50 | 18,41 ± 51,12 | -1,66 ± 25,07 | ** |
| Val | -35.05 ± 24.77 | 1,58 ± 21,94 | 1,49 ± 30,05 | ** |
| Met | -20,69 ± 32,09 | 3,06 ± 22,39 | 3,54 ± 28,74 | N.S. |
| Cys | 18,78 ± 31,85 | 19,78 ± 40,09 | -13,78 ± 31,28 | N.S. |
| Ile | -41,31 ± 22,11 | 9,27 ± 34,55 | 23,85 ± 58,00 | ** |
| Leu | -19,50 ± 30,26 | 54,24 ± 72,19 | 4,54 ± 35,47 | * |
| Phe | -30,94 ± 29,43 | 35,43 ± 61,75 | -5,60 ± 27,06 | * |
| Trp | -4,70 ± 24,84 | 10,89 ± 31,52 | -5,39 ± 11,07 | N.S. |
| Lys | -23,74 ± 50,37 | 21,82 ± 34,61 | 20,69 ± 39,75 | N.S |
| X ± S.D. | -16,86 ± 20,23 | 18,81 ± 19,12 | -6,20 ± 14,06 | ** |
| N.S.: No existen diferencias estadísticamente significativas | ||||
| * *: Diferencias altamente significativas (p<0.01) | ||||
La Figura 5 se observa comparativamente el porcentaje de recambio de aminoácidos individuales para cada una de las dietas. Los aminoácidos que presentan un aporte significativo al “pool” por parte de la dieta de tortilla de maíz con queso son: Lys, Trp, Phe, Leu, Ileu, Cys, Tyr, Pro, Ala, Arg/Thr, Gly, Ser. La mencionada dieta tiene una acción positiva de enriquecimiento del “pool” mucho mejor que la dieta de tortilla de maíz normal. En cuanto al efecto del sexo, se detectó la existencia de un nivel de cambio dentro de las dietas, ya que para la dieta de tortilla de maíz con queso (TMQ) las mujeres dieron 17,4 % de recambio, los hombres 20,2 %; en el caso de la dieta de huevo cocido (HC), las mujeres dieron un 8,1 % y los hombres -17,7 %; la dieta de tortilla de maíz normal (TMN) dio, en el caso de las mujeres, -27,5 % y, para los hombres, el valor del recambio fue -10,2 %.
Una vez realizadas las pruebas de ANOVA en donde se demostró que existían diferencias altamente significativas en porcentaje de recambio de aminoácidos entre las tres dietas, se procedió a efectuar las pruebas de comparación de medias de Duncan, dicha prueba dio como resultado que la dieta que marca la diferencia, cuando se analizan resultados en hombres, es la dieta de maíz con queso (TMQ), es decir, que no hay diferencias significativas entre las dietas de tortilla de maíz normal (TMN) y huevo cocido (HC), en tanto que, para el caso de los resultados en mujeres, la prueba de comparación de Duncan señala que la dieta que marca la diferencia es la de tortilla de maíz normal (TMN), con un aporte negativo de 27,52 % al pool, sin observarse diferencias significativas entre las otras dos dietas bajo estudio. No sucede igual comportamiento en el análisis global (promedio de hombres y mujeres), ya que la dieta que marca la diferencia es la dieta de tortilla de maíz con queso (TMQ) con un aporte positivo de 18,80 % y se observa que no hay diferencias significativas entre las dietas de tortilla de maíz normal y huevo cocido (HC).
Cuando analizamos las diferencias entre los resultados obtenidos con proteína de huevo y las proteínas de maíz, encontramos que el huevo a pesar de ser la proteína patrón de la FAO presenta una disminución notable en cuanto a la biodisponibilidad de los aminoácidos, esto puede deberse al efecto de tratamiento térmico toda vez que el calentamiento del huevo puede producir una reacción de pardeamiento de Maillard ya que la clara de huevo contiene cierta cantidad de glucosa (0,4 %) la cual al reaccionar con la proteína disminuye el valor biológico de la misma haciendo que el aporte de aminoácidos al “pool” se reduzca ostensiblemente. Esto concuerda con la característica tan peculiar de las proteínas de la clara de huevo de ser bastante sensibles a los diversos factores que promueven su desnaturalización 30 - 31. En el caso de la tortilla de maíz normal, ha quedado bien establecido que la proteína del maíz normal es de poca calidad debido a que es deficiente en dos aminoácidos, lisina y triptófano 32 - 33 lo cual disminuye la biodisponibilidad de los demás aminoácidos y es, por esta razón, que el aporte de aminoácidos al “pool” genera valores negativos con la consecuente disminución en el valor biológico. Un comportamiento diferente se observa cuando la tortilla de maíz es “enriquecida” con queso, ya que la suplementación hace que la proteína proveniente del queso mejore de manera significativa el valor biológico puesto que el aporte de aminoácidos esenciales mejora la biodisponibilidad de la mayor parte de los aminoácidos.
El proceso de suplementar una proteína vegetal (maíz) con otra de origen animal (queso) se conoce bastante bien, solo que en nuestro caso estamos comprobando el efecto que tiene desde el punto de vista de biodisponibilidad como un aporte positivo al “pool” de aminoácidos de los voluntarios en estudio. Es importante anotar que el queso por encontrarse en medio de la tortilla de maíz no recibía un aporte importante de tratamiento térmico directo conservando de esta manera las características nutricionales casi intactas.
Los resultados hasta aquí obtenidos nos permiten plantear una concordancia respecto al concepto de que las proteínas poseen diferente calidad nutritiva o biodisponibilidad, es decir, ellas difieren en su capacidad para cubrir los requerimientos proteicos en humanos, según las necesidades del organismo. Es por tal motivo que la biodisponibilidad de las proteínas y, por ende, de los aminoácidos debería ser el factor más importante para establecer recomendaciones nutricionales. De igual manera, en cuanto al aspecto tecnológico se refiere, la biodisponibilidad nos permite clasificar las proteínas según su verdadero potencial nutritivo pudiendo detectar cambios que puedan ocurrir durante el procesado y almacenado de los alimentos. Observemos entonces, cómo la proteína del huevo a pesar de tener un alto puntaje químico, cuando se trata bajo las condiciones normales de consumo en Colombia la biodisponibilidad de los aminoácidos se reduce de manera importante.
Esto nos lleva a la conclusión final de que la presencia de un nutriente en un alimento no indica su digestibilidad. Además, la digestión adecuada del mismo no asegura su absorción y la absorción del mencionado nutriente no nos asegura que sea posible su utilización en una determinada función fisiológica. Por tanto, la biodisponibilidad es el concepto más importante que nos refleja globalmente los diferentes procesos metabólicos implicados en la utilización de un nutriente por parte del organismo puesto que considera todos los factores intrínsecos y extrínsecos que afectan a dicha utilización. Desde luego que se requiere más ajuste y control a los parámetros que intervienen en la determinación de la biodisponibilidad de los aminoácidos para entrar a aprobar totalmente el modelo aquí planteado. De todas maneras, es claro de nuestro estudio y en concordancia con los estudios clásicos de Vaughan y colaboradores 34, que es posible tener una buena idea del verdadero valor nutricional de las proteínas en una determinada dieta cuando utilizamos el nivel de respuesta de aminoácidos libres en plasma humano.
La siguiente fase se llevó a cabo, con el propósito de establecer el comportamiento de los niveles séricos de la glucosa, lípidos y proteínas en los individuos bajo estudio con las dietas investigadas. Los sujetos bajo estudio se mantuvieron en el peso corporal normal y antes de la toma de muestras post ingesta, realizaron sus labores de rutina diaria. Ellos consumieron el peso de dieta equivalente a 12 % de proteína y en el caso del huevo cocido (HC) la ingesta de calorías fue de 1,680 cal/g, siendo para la ingesta de tortilla de maíz común (TMN) y tortilla de maíz con queso (TMQ) de 3,840 cal/g. Es conveniente aclarar aquí, que la ingesta de calorías es diferente para el caso de la dieta de huevo y las dietas de tortilla de maíz. El propósito del diseño era el de considerar factores extrínsecos e intrínsecos en la biodisponibilidad de los nutrientes a evaluar, de tal manera que las dietas fueran consumidas bajo las condiciones normales de ingesta. La concentración inicial obtenida en el tiempo cero horas, en ayunas, para cada una de las variables demostró que no existían diferencias estadísticamente significativas en las concentraciones totales para los tres días diferentes del estudio.
Finalmente, la Tabla 6 muestra el comportamiento global de hombres y mujeres en la cual es posible destacar que de los análisis realizados los únicos que marcan la diferencia son los obtenidos con la dieta de TMQ para proteínas totales con 21,742 % ± 12,122 y albúmina con valores de 21,166 % ± 14.75.
Tabla 6 Promedio de los porcentajes de cambio (∆%) observados como respuesta a la ingestión de 12 gramos de proteína de Maíz Común (TMN), Maíz y Queso (TMQ), Huevo Cocido (HC).
| Química Sanguínea | Maíz Normal | Maíz y Queso | Huevo Cocido | ANOVA |
|---|---|---|---|---|
| (TMN) | (TMQ) | (HC) | ||
| Glucosa | 5,871 ± 8,888 | 1,876 ± 9,741 | 3,455 ± 7,796 | N.S. |
| Colesterol | 0,5407 ± 8,466 | 1,204 ± 9,282 | 0,0808 ± 7,440 | N.S. |
| Colesterol-HDL | -1,747 ± 14,292 | -6,108 ± 16,087 | 1,942 ± 11,841 | N.S. |
| Triglicéridos | 11,949 ± 13,785 | 27,877 ± 37,328 | 16,267 ± 16,499 | N.S. |
| Proteína Total | 3,617 ± 4,859 | 21,742 ± 12,122 | 5,523 ± 8,402 | ** |
| Albumina | 4,736 ± 4,171 | 21,166 ± 14.754 | 6,268 ± 5,082 | ** |
| N.S.: No existen diferencias estadísticamente significativas | ||||
| * *: Diferencias altamente significativas (p<0.01) | ||||
4 Conclusiones
Con base a los anteriores resultados podemos sugerir que algunos de estos aminoácidos, especialmente el triptófano (Tyr), podrían servir como fuente de diagnóstico para establecer mejoramiento en la calidad en una dieta nutricional desde el punto de vista proteico. Por otro lado, el método reportado de derivatización con fenilisotiocianato y el secado de la muestra en un liofilizador permite obtener información de calidad acerca del valor nutritivo de ciertos alimentos y tiene una buena perspectiva para su utilización en el análisis de biodisponibilidad de proteínas y aminoácidos directamente en humanos, considerando los factores específicos en torno a los procesos metabólicos de nuestra especie. El modelo aquí propuesto, con los correctivos y mejoras que se puedan ejecutar, podrán servir de información de primera mano para un conocimiento más próximo a la realidad de las dietas de una región o de una nación.