1 Introducción
La trazabilidad es una propiedad de un resultado de medida que no se ha socializado lo suficiente en los laboratorios médicos, a diferencia de otros campos de medición; además, actualmente no es un requisito para otorgar la autorización para los materiales que se utilizan para calibrar o para los controles de veracidad. Este concepto adquiere importancia a partir de la introducción de la norma ISO 15189 en 2003, para la acreditación de los laboratorios clínicos. Existen alternativas que permiten alcanzar la comparabilidad de las mediciones en la medicina de laboratorio, buscando la equivalencia a través de la armonización o de la estandarización, lo que se encuentra documentado en el estándar internacional ISO 17511, “Productos sanitarios para diagnóstico in vitro-Requisitos para establecer la trazabilidad metrológica de los valores asignados a calibradores, materiales de control de veracidad y muestras humanas”, normativa que establece seis diferentes jerarquías de calibración en modelos de trazabilidad metrológica.
2 La equivalencia a través de la estandarización o la armonización
El propósito de una prueba de laboratorio médico es proporcionar información sobre la condición fisiopatológica de un paciente que ayuda el diagnóstico, la terapia o la evaluación del riesgo de una enfermedad1, esto es problemático cuando las mediciones de una prueba son diferentes según el laboratorio donde se realizan los análisis, lo que puede dar lugar a una evaluación inexacta o inconsistente o, en el peor de los casos, a una intervención o un procedimiento inadecuado o la falta del mismo, además de una sobreutilización del recurso de repeticiones debido a información discrepante2. Para un servicio de laboratorio óptimo, los resultados de diferentes procedimientos de medición (PM) para el mismo mensurando deben ser equivalentes (armonizados) entre métodos dentro de las especificaciones establecidas lo que, permita que los resultados se utilicen de manera confiable para decisiones médicas y para reducir el riesgo de una interpretación errónea de los resultados de las pruebas1,3.
El término armonización se refiere a cualquier proceso que permita establecer la equivalencia de los valores reportados entre diferentes PM en usuarios finales2. Generar resultados armonizados permite el uso de intervalos de referencia comunes para diferentes PM.
La estandarización, en un nivel más avanzado, consigue que los resultados de las magnitudes sean trazables a unidades del sistema internacional mediante un método o un material de referencia. Los resultados obtenidos en diferentes laboratorios deberían ser intercambiables, es decir estandarizados (en el caso de magnitudes biológicas con patrones de calibración y métodos de referencia disponibles) o armonizados (para magnitudes biológicas sin las condiciones anteriores)4. Lograr la estandarización en la medicina de laboratorio no parece ser una meta sencilla, cuando vemos que existen problemas desde la uniformidad en el menú de pruebas que se ofrecen en los laboratorios clínicos (LC) y, en los intervalos biológicos de referencia. Bajo este contexto, tal vez la armonización sea una alternativa más viable.
3 La trazabilidad en la medicina de laboratorio
Para garantizar el uso de procedimientos cercanos a mediciones del más alto nivel metrológico en los laboratorios médicos, se requiere la estandarización de los procedimientos de medición apoyados en la trazabilidad metrológica de las mediciones, enlazando las mediciones realizadas en el laboratorio médico con materiales y procedimientos de referencia de mayor jerarquía metrológica; sin embargo, esta posibilidad está limitada para una gran parte de los mensurandos del LC, estando disponibles las alternativas que presenta ISO 17511, que en su versión más reciente del 2020, incluye de manera formal la alternativa de la armonización5.
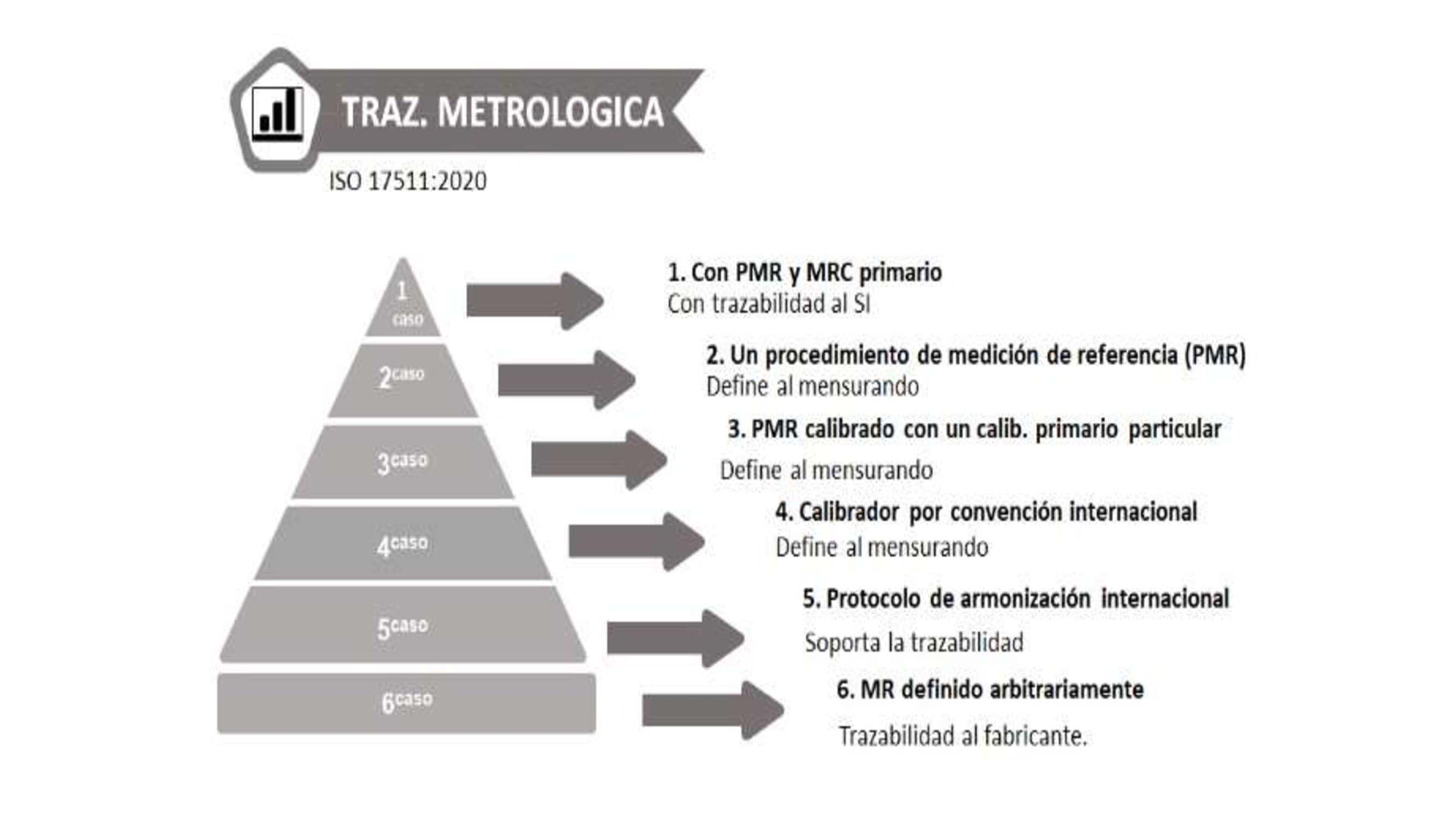
La norma ISO 17511, muestra diferentes alternativas para demostrar la trazabilidad, al documentar seis cadenas para seis diferentes modelos de jerarquías de calibración (Figura 1). El primer modelo cuenta con trazabilidad al sistema internacional de medidas (Figura 2). En el cuarto modelo, la trazabilidad está soportada por protocolos de armonización internacional (Figura 3).
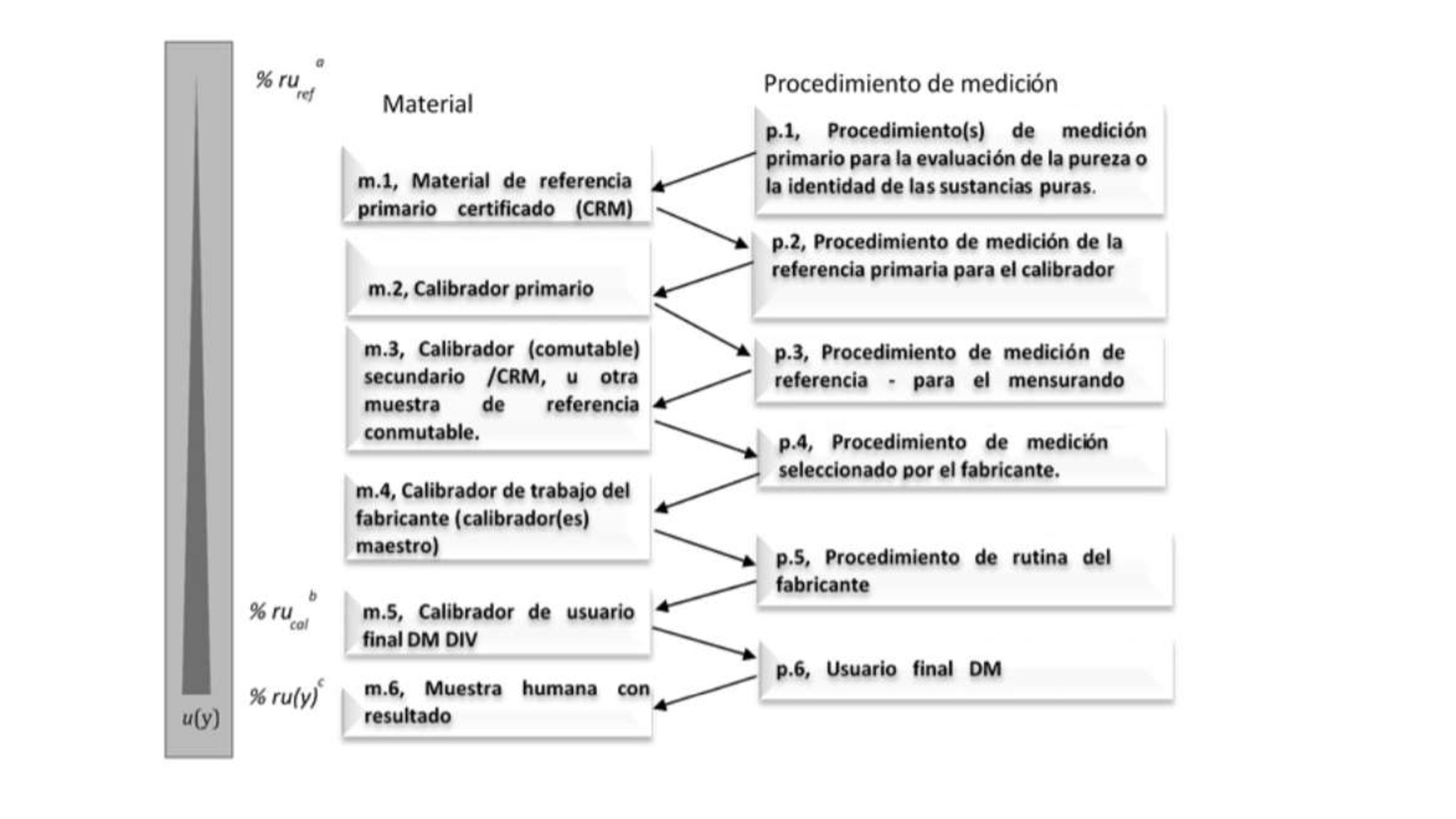
Fuente: ISO 17511:2020
Figura 2 Se cuenta con Procedimientos de medición de referencia (PMR) y con materiales de referencia (MRC) con trazabilidad al SI5.
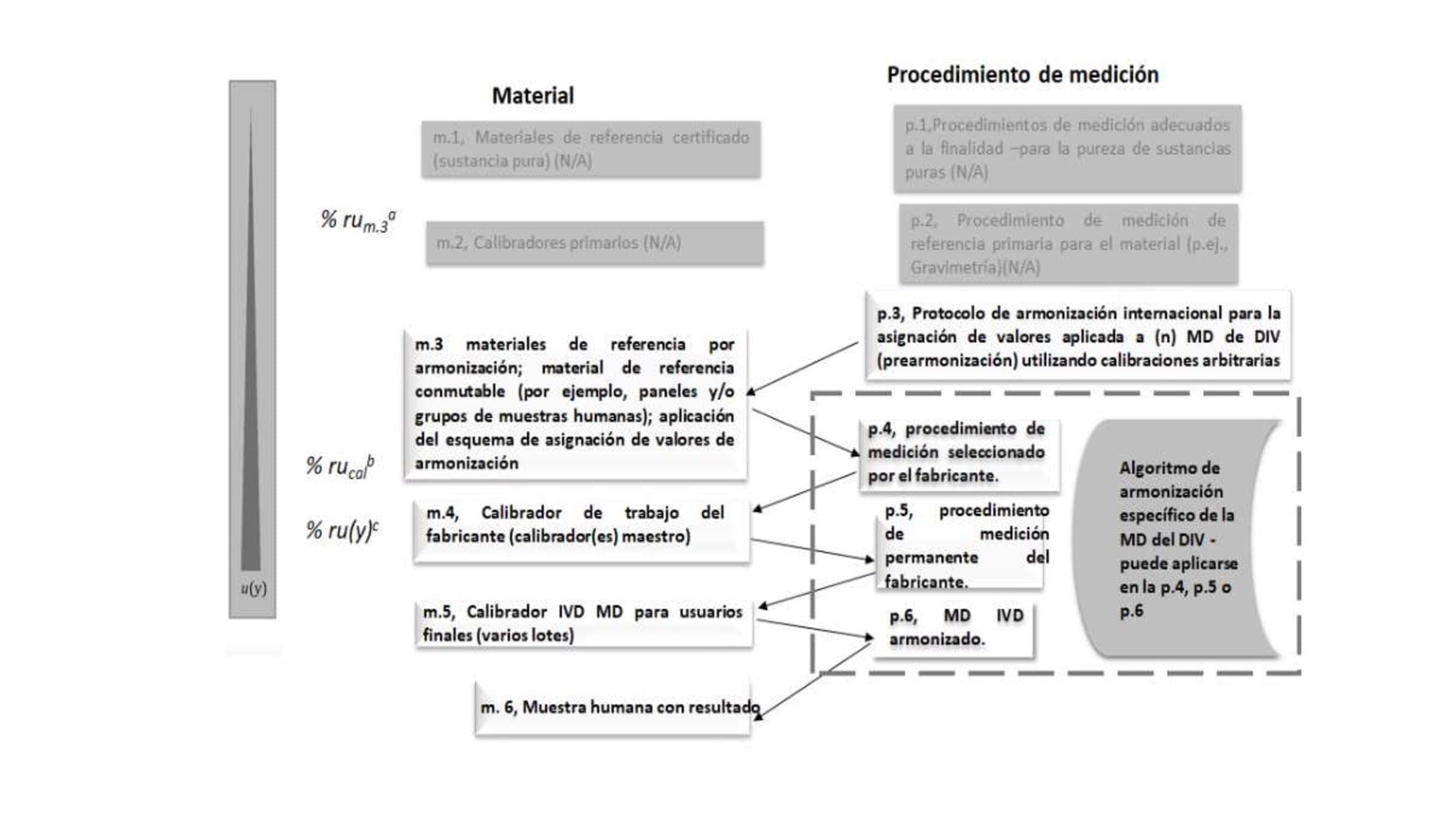
Fuente: ISO 17511:2020
Figura 3 Caso con trazabilidad metrológica suportada por un protocolo de armonización internacional (sin MRC; no trazable al SI)5.
La estandarización no solo tiene que abordar la trazabilidad metrológica, sino que también debe considerar la eficacia de su implementación. Por lo que los MR para ser utilizados de acuerdo con su uso previsto, deberían ser conmutables. El uso de MR no conmutables puede introducir un sesgo significativo en los procedimientos de calibración y producir resultados incorrectos en las muestras clínicas6.
La conmutabilidad es una propiedad de una MR que significa que la respuesta analítica observada para el mensurando es la misma para el MR y para muestras clínicas que contienen la misma cantidad del mensurando. Algunos de los MR listados por el Comité Conjunto de Trazabilidad en Medicina de Laboratorio (JCTLM) no han sido aún validados para la conmutabilidad y, cuando se utilizan en jerarquías de calibración, pueden contribuir a sesgos entre diferentes PM de usuarios finales. De manera similar, la Organización Mundial de la Salud proporciona MR que, históricamente, no han sido validados para conmutabilidad y por tanto pueden contribuir a sesgos entre diferentes PM de usuarios finales1.
El JCTLM, creó recientemente el Grupo de Trabajo sobre Implementación de Sistemas de Medición de Referencia con el objetivo de proporcionar orientación sobre la implementación de la trazabilidad a la comunidad de DIV, el cual busca que los materiales de referencia seleccionados por los fabricantes para dar valor a sus calibradores comerciales sean conmutables. Además de que cumplan el presupuesto de incertidumbre y que lo declaren, mencionando las especificaciones de rendimiento analítico que están utilizando7.
4 Partes interesadas en la trazabilidad en la medicina de laboratorio
Lograr la trazabilidad es un objetivo común que involucra a partes interesadas como organizaciones internacionales de normalización, expertos científicos y clínicos, organismos reguladores y la industria del diagnóstico in vitro (DIV). Con frecuencia, los fabricantes proporcionan una descripción breve de la trazabilidad metrológica de los calibradores comerciales, limitada al nombre del material de referencia de orden superior y/o procedimiento de medición de referencia al que se puede trazar la calibración del ensayo, no proporcionándose información adicional, que describa los pasos de la cadena8, hasta el usuario final. Por lo que es recomendable que la oferta de nuevas tecnologías y pruebas de laboratorio no solo ofrezca soluciones para las necesidades clínicas no satisfechas en las disciplinas existentes, sino también la información que enlace los procedimientos de laboratorio a materiales y métodos de referencia del más alto orden jerárquico existente, de manera robusta, sistemática y sostenible9 para alcanzar la equivalencia en las mediciones.
Una de las primeras regulaciones alusivas al tema, fue la Directiva Europea de 1998 (efectiva en 2003) que indicaba que todos los dispositivos médicos de diagnóstico in vitro (DM DIV) vendidos en la Unión Europea tuvieran una calibración rastreable a un sistema de referencia de orden superior, cuando existiera. Esta fue reemplazada por un nuevo reglamento en 2017 (que entra en vigor en 2022), agregando un proceso formal de revisión y aprobación independiente aplicable a una gama más amplia de mensurados1.
Para abordar esta problemática en 2003, se formó el JCTLM, integrado por el Buró Internacional de Pesas y Medidas, la Cooperación Internacional de Acreditación de Laboratorios y la Federación Internacional de Química Clínica y Medicina de Laboratorio, con la finalidad de coordinar las actividades y brindar apoyo educativo para la trazabilidad. Esta organización, mantiene una base de datos de materiales de referencia, procedimientos de medición de referencia y laboratorios de referencia, que requieren criterios estrictos para su inclusión que incluye la evidencia de la conmutabilidad de los MR y la incertidumbre de la medición3.
5 La trazabilidad metrológica en los laboratorios clínicos acreditados en México
En México, los laboratorios acreditados cumplen este requisito y se apoyan en una guía emitida por el Centro Nacional de Metrología, la Entidad Mexicana de Acreditación (EMA) y un grupo de trabajo de expertos técnicos, denominada “Guía de Trazabilidad Metrológica de los Valores Asignados a los Calibradores y Material de Control Empleados por el Laboratorio Clínico”10. Esta guía gratuita, está basada en ISO 17511, versión 2003. En su contenido muestra ejemplos de las cinco diferentes cadenas de trazabilidad que, facilitan la comprensión de los conceptos y la búsqueda de la información. Cabe mencionar que la EMA ha promovido el acercamiento a la información de la trazabilidad a los profesionales del laboratorio clínico, involucrando a los distribuidores y productores de materiales de calibración y a otras partes interesadas.
6 Conclusiones
Para alcanzar la equivalencia de las mediciones en el laboratorio clínico se requieren estrategias, en las que participen los usuarios finales de las cadenas de trazabilidad, quienes representan la base de la pirámide de las partes interesadas. También, es recomendable mayor educación en metrología a las nuevas generaciones, que les permita considerar a la trazabilidad como un requisito adicional para seleccionar un método de medición previo a su implementación en el laboratorio clínico.
El diagnóstico y el tratamiento consistente, efectivo y sostenible solo se puede lograr si las pruebas de laboratorio miden mensurados bien definidos con una veracidad e incertidumbre dentro de los límites permitidos acorde con el uso previsto8,9, lo que se puede alcanzar a medida que se vaya escalando en las jerarquías de las cadenas de trazabilidad descritas en ISO 17511.
Se han logrado avances en el ámbito de la armonización en la etapa analítica en la medicina de laboratorio, sin embargo, deberían extenderse hacia las otras etapas del proceso como la pre y la post analítica. Además de ampliarse el alcance de la estandarización, considerando que un número elevado de resultados de las pruebas de laboratorio aún generan resultados variables11) y, en algunos casos no equivalentes.
Es deseable unir esfuerzos entre todas las partes interesadas para lograr la equivalencia de las mediciones entregadas a los usuarios finales que, son la razón de ser de la medicina de laboratorio.