Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Odontología Universidad de Antioquia
Print version ISSN 0121-246X
Rev Fac Odontol Univ Antioq vol.20 no.1 Medellín July/Dec. 2008
ARTÍCULOS ORIGINALES DERIVADOS DE INVESTIGACIÓN
Evaluación de los enfoques terapéuticos para las varias formas de enfermedad periodontal. Parte III: Prevalencia de Bacilos entéricos y levaduras1
Evaluation of the therapeutic approach of various types of periodontal disease. Part III: enterobacteriaceae enteric rods, and yeast species
Alejandro Botero B.2; Fanny Stella Alvear E.3; María Eugenia Vélez L.3; Leticia Botero Z.4; Hernando Velásquez E.4
1 Artículo derivado de investigación clínica Facultad de Odontología Universidad de Antioquia
2 Odontólogo, máster y doctor en Ciencias Odontológicas, profesor titular y emérito, Facultad de Odontología, Universidad de Antioquia, Medellín, Colombia. Dirección electrónica: boteroboteroalejandro@hotmail.com
3 Odontóloga especialista en Odontología Integral del Adulto, profesora titular, Facultad de Odontología Universidad de Antioquia, Medellín, Colombia
4 Odontólogos especialistas en Odontología Integral del Adulto, profesores asociados, Facultad de Odontología Universidad de Antioquia, Medellín, Colombia
RESUMEN
INTRODUCCIÓN: (véanse partes I y II) esta publicación se enfoca en la prevalencia de bacilos entéricos y levaduras en muestras de placa subgingival de los 69 pacientes de la investigación. Estudios preliminares sugieren una asociación entre bacilos entéricos y algunos tipos de patógenos periodontales. Se realizó análisis microbiológico y se determinó la susceptibilidad a los siguientes antibióticos: Ciprofloxacina, Metronidazol, Amoxicilina, Tetraciclina y Clindamicina.
MÉTODOS: las características socio-demográficas (edad, género, tabaquismo y agrupación familiar) y los parámetros clínicos (profundidad sondeable, nivel de inserción, sangrado superficial y sangrado al sondaje) se evaluaron al comienzo, a los 3,6, 12 y 24 meses, se tomaron muestras microbiológicas de 6 sitios por paciente al inicio del estudio, a los 12 y 18 meses. Los resultados de este estudio con relación a la presencia de bacilos entéricos y de Candida albicans sólo obedecen al primer cultivo, que es cuando se mide la prevalencia, aunque a todos los pacientes se les hizo seguimiento durante dos años, después de realizarles la terapia periodontal no quirúrgica convencional. Se realizó un análisis descriptivo en el cual se obtuvieron las frecuencias, proporciones y prevalencias de aparición de los bacilos entéricos y levaduras para el grupo total de pacientes, de buenos y malos respondedores mediante tablas de distribución de frecuencias y gráficos de barras compuestas.
RESULTADOS: se presentó una prevalencia de bacilos entéricos, entre ellos Escherichia coli, Klebsiella spp, Enterobacter spp y también de levaduras en la microflora subgingival de los pacientes con periodontitis n=69 (36.2%), tanto de buenos n=57 (33.3%) como de malos respondedores n=12 (49.9%).
CONCLUSIÓN: del estudio se puede concluir que E.coli fue el microorganismo que se presentó en mayor porcentaje en ambos grupos de pacientes. De acuerdo al test de susceptibilidad antibiótica, la ciprofloxacina mostró ser el antibiótico de elección en pacientes que presentaban periodontitis con bacilos entéricos.
Palabras clave: enfermedad periodontal, bacilos entéricos, levaduras y agentes antimicrobianos.
ABSTRACT
INTRODUCTION: (see parts I and II): this publication is focused on the prevalence of enteric rods and yeasts species in samples taken from subgingival plaque of 69 patients included in the investigation. Preliminary studies suggest an association between enteric rods and some types of periodontal pathogens. Microbiological analysis was realized by means of culture, and susceptibility was determined for the following antibiotics: Ciprofloxacin, Metronidazole, Amoxicillin, Tetracycline and Clindamycin.
METHODS: evaluations of the socio-demographic criteria (age, gender, tobacco use, and family grouping), and clinical parameters (probing depth, clinical attachment, superficial bleeding, and probing bleeding) were made at the beginning, 3, 6, 12, and 24 months. Microbiological samples of each patient were taken from 6 different sites at the beginning of the study, 12, and 18 months. The results corresponding to the presence of enteric rods, and Candida albicans are only part of the first sample, which measured the prevalence, although all the patients had a follow up of two years after conventional non surgical periodontal therapy. A descriptive analysis was made, which determined the frequency, proportion, and prevalence of enteric rods and yeasts in both groups, good and poor responders, shown in frequency distribution tables and compound bar charts.
RESULTS: the most prevalent species, found in subgingival microflora in patients with periodontitis n=69(36.2%) including both, good n=57 (33.3%) and poor responders n=12 (49.9%) were enteric rods, mainly Escherichia coli, Klebsiella spp and Enterobacter spp, and yeasts.
CONCLUSION: Escherichia coli had the highest prevalence percentage in both, good and poor responders. According to antimicrobial susceptibility test, Ciprofloxacin would be the antibiotic of choice in subjects with periodontitis and with enteric rods.
Key words: periodontal diseases, enteric rods, yeasts antimicrobial agents.
INTRODUCCIÓN
La investigación microbiológica con relación a la etiología de la enfermedad periodontal indica que las bacterias son el principal factor etiológico de la enfermedad.1-6 Solamente unas pocas especies, entre ellas Porphyromonas gingivalis, Prevotella intermedia, Fusobacterium nucleatum, Aggregatibacter actinomycetemcomitans y Tannerella forsythia son considerados como patógenos periodontales y asociados con el progreso de las periodontitis en adultos.7-13 El análisis de estos microorganismos podría ayudar a identificar los individuos o sitios en riesgo, a seleccionar los agentes terapéuticos y a evaluar los efectos de los tratamientos suministrados.14-16
Estudios de investigación preliminares sugieren asociación entre los patógenos periodontales y bacilos entéricos en algunas poblaciones y tipos de periodontitis.17-22 Los bacilos entéricos, las levaduras y las pseudomonas han sido encontradas previamente en varios sitios de la cavidad oral y relacionados con lesiones de la mucosa oral y con halitosis.18, 23-25
Microorganismos tales como los bacilos entéricos, pseudomonas, staphylococcus y levaduras normalmente no se encuentran en la cavidad oral, cuando están presentes ocurren en pequeño número y son considerados como parte de la flora transitoria; sin embargo, puede desarrollarse aumento en la flora oral por varias razones. En pacientes inmunosuprimidos puede presentarse en alto número y causar infecciones referidas como infecciones oportunistas. Los antibióticos pueden suprimir la flora normal, permitiendo el incremento de microorganismos no susceptibles, causando así una sobreinfección.2, 26 Las personas de mayor edad parecen tener mayor susceptibilidad a los patógenos oportunistas y esto se puede explicar por la edad en sí o por las medicaciones.2, 18, 27, 28 Para otras condiciones también se han reconocido alteraciones locales ocasionadas por el uso de prótesis dentales o por implantes, que favorecen el crecimiento de levaduras y de microorganismos no encontrados normalmente en la cavidad oral.18, 24
La alta prevalencia de bacilos entéricos en ciertas poblaciones puede también estar relacionada con diferencias culturales, ambientales, etc. entre las poblaciones,29 a la ingesta de agua o alimentos contaminados, a la higiene personal inadecuada y al uso indiscriminado de antibióticos, ocasionando sobrecrecimiento o colonización por organismos sobreinfectantes en el área subgingival.29-36 Otros factores que pueden resultar en la variación de la ocurrencia de bacilos entéricos en muestras de placa subgingival están relacionados con los procedimientos microbiológicos tales como: diferencias en las técnicas de laboratorio, diferencias en la toma de la muestra, el medio de transporte utilizado y por el tiempo prolongado para procesar las muestras; estos microorganismos pueden ser sobreestimados en estudios donde las muestras bacterianas están sometidas a tiempo de transporte mayor de 24 horas.30
Existe una considerable variación en la prevalencia de periodontitis en varias partes del mundo.22, 29, 31 Las diferencias en la severidad de la enfermedad periodontal, en parte, pueden deberse a variaciones en las prácticas de higiene oral y también puede ser que ciertas poblaciones presentan altos niveles de microorganismos particularmente más virulentos.29, 31
La prevalencia de periodontitis en Santo Domingo (República Dominicana)32 es probablemente la más alta reportada.
En Colombia, según el Estudio Nacional de Salud Oral (ENSAB III)33 realizado en 1998, se encontró que la enfermedad periodontal generalizada afectaba al 12% de la población con edad menor de 35 años y al 42% de la población con edad mayor de 60 años. Con relación a la severidad, el 14% de la población con edad aproximada a los 35 años tiene pérdida de inserción moderada y el 40% de la población con edad alrededor de los 60 años tiene pérdida de inserción moderada a severa.
La microbiota de las enfermedades periodontales en países en desarrollo ha recibido sorpresivamente poca atención. Patógenos periodontales han sido identificados en pacientes con periodontitis del adulto en: Colombia, Guatemala, Barbados, Kenya, Suráfrica, China, India, Panamá, Korea, Nueva Guinea.10, 20-22, 29, 32, 34-41 Estos microorganismos también han sido implicados en la enfermedad periodontal en EE. UU. y Europa.36
Estudios epidemiológicos de varias partes del mundo reportan diferentes prevalencias de microorganismos entéricos en la cavidad oral de poblaciones sanas y también en pacientes con periodontitis.17-22 La prevalencia de bacilos entéricos en bolsas periodontales puede variar ampliamente de acuerdo con diferentes poblaciones, así: 14% en pacientes con periodontitis en Estados Unidos,36 61,1% en pacientes con periodontitis en Rumania,38 67% en pacientes con periodontitis en Santo Domingo32 y 92% en pacientes con periodontitis en Sudán.39
Evidencia suficiente en la literatura por más de 30 años ha establecido el concepto que las enfermedades periodontales son infecciones bacterianas.1-6, 42 Los microorganismos de la placa dental son capaces de iniciar los mecanismos de destrucción del tejido periodontal1, 2, 6, 7, 42 y por consiguiente, para el manejo de algunos tipos de periodontitis, se requiere el uso de agentes antimicrobianos sistémicos.33, 35, 43-48 Ellos, en bajas concentraciones, pueden inhibir el crecimiento in vitro de la mayoría de los patógenos periodontales; esto hace que se utilicen en el tratamiento de las periodontitis del adulto, particularmente para los pacientes malos respondedores a la terapia mecánica convencional.49, 50
Sin embargo, algunos pacientes con periodontitis continúan con enfermedad destructiva a pesar del uso adjunto de la terapia antibiótica sistémica; esta falta de respuesta puede ser debida a la inadecuada absorción de la droga, al pobre compromiso por parte del paciente o a especies bacterianas resistentes a los antibióticos. También puede deberse a otros patógenos sin identificar no afectados por los agentes antimicrobianos que habitan sitios periodontales que no responden.45-50
Los bacilos entéricos presentan resistencia a muchos antibióticos, incluyendo los comúnmente utilizados para el manejo de las enfermedades periodontales refractarias al tratamiento mecánico convencional, tales como la amoxicilina, tetraciclina y el metronidazol.47-50
El objetivo de la presente investigación (parte III) fue estudiar la prevalencia de los bacilos entéricos y las levaduras en muestras de placas subgingivales y su sensibilidad al agente antimicrobiano sistémico in vitro en el grupo de pacientes que participaron en el estudio.
MATERIALES Y MÉTODOS
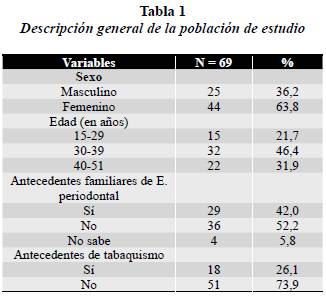
En este estudio participaron 69 pacientes (25 hombres y 44 mujeres) con rango de edad entre los 15 y 51 años, con enfermedad periodontal localizada o generalizada; incipiente, moderada o avanzada; con evidencia radiográfica de destrucción periodontal.51 Se logró culminar el tratamiento por dos años a 55 pacientes.
Los criterios de exclusión fueron: enfermedad sistémica (diabetes, cáncer, valvulopatía congénita, enfermedad del colágeno tratada con inmunosupresores entre otras), ingestión de antibióticos en los tres meses anteriores al inicio del tratamiento, terapia con AINES o corticoides por más de dos semanas consecutivas en los seis meses anteriores, embarazo, consumo de anticonceptivos orales, enfermedad periodontal asociada a lesiones endoperiodontales o a factores anatómicos (surcos cérvico-radiculares, perlas de esmalte). Para ser incluidos en el estudio, debían tener mínimo 20 dientes presentes.
Una vez obtenido el consentimiento informado y aprobado por el Comité de Etica52 de la Universidad de Antioquia, los pacientes fueron sometidos a limpieza supragingival sónica, eliminación de excesos de restauraciones, control de caries, eliminación de desarmonías oclusales mayores, exodoncias mandatorias, endodoncias, control de higiene oral, profilaxis y aplicación de flúor. Terminada esta fase, se tomaron las muestras para los cultivos microbiológicos y se realizaron las primeras mediciones de las variables clínicas: índice de placa53 (IP, 0 a 3), índice del sangrado superficial54 (IG, expresado en porcentaje), índice de sangrado al sondaje55 (ISS expresado en porcentaje), profundidad sondeable (PS, mm) y nivel de inserción (NI, mm)56, 57
Las mediciones clínicas fueron tomadas utilizando la sonda periodontal WHO58 en quince sitios interproximales de diez dientes índices previamente definidos59 17(M), 16(M y D), 11(M), 23(M y D), 25(M y D), 36(M), 35(M y D), 34(D), 41(M), 43(M y D). Para estandarizar el punto de referencia a partir del cual se hicieron las mediciones del nivel de inserción, se adaptó en cada sujeto, una placa acrílica oclusal a la que se le hizo un surco localizado en cada sitio donde se registrarían las mediciones, con el fin de colocar la sonda siempre en el mismo sitio, obteniéndose como resultado mediciones relativas del nivel de inserción (NRI),60 el cual se define como la distancia entre la base del surco o bolsa y el punto de referencia proximal de una placa. Este parámetro es a partir del cual se clasificó la buena o mala respuesta.
Con base en los valores obtenidos en la profundidad sondeable proximal (PSP), se clasificó la extensión y la severidad de la enfermedad periodontal; así, la enfermedad es localizada, si el 30% o menos de las superficies proximales evaluadas presentaban profundidades sondeables iguales o mayores a 4 mm, generalizada, si más del 30% de las superficies presentaban profundidades sondeables iguales o mayores a 4 mm y la severidad se considero como leve si el promedio de PSP es menor a 4 mm, moderada, si es de 4 a 6 mm y avanzada si es mayor de 6 mm.
Las mediciones de los parámetros clínicos fueron realizadas por un mismo examinador en todas las oportunidades y para todos los pacientes, quien presentó un Kappa de 0,95.
Algunos factores de riesgo de la enfermedad periodontal como el tabaquismo y la agrupación familiar fueron identificados durante el interrogatorio.61
Tratamiento
Todos los sujetos recibieron detartraje, alisado radicular supra- y subgingival, profilaxis y flúor, por cuadrantes, con anestesia local e instrumentación manual, en un tiempo promedio de 40 min por cita y en período máximo de un mes. Este tratamiento es conocido en la literatura periodontal como terapia periodontal no quirúrgica convencional, la cual fue ejecutada por cuatro operadores experimentados.
Tres meses después de realizada la terapia periodontal no quirúrgica tradicional62 se evaluó la respuesta a la misma, mediante la comparación del NRI de la primera (datos de base) y segunda medición y dependiendo del cambio en los resultados, se clasificaron los pacientes del estudio en las categorías de buen o mal respondedor.
Buen respondedor. Aquel sujeto que ganó nivel de inserción (NI), no sufrió cambio o perdió NI solo en un sitio, cuando se compararon los valores de la primera (datos de base) y la segunda medición (a los 3 meses).
Mal respondedor: Aquel sujeto con pérdida en el NI en dos o más sitios en el mismo intervalo de tiempo. Se consideró pérdida en el NI a una diferencia negativa de 2 o más mm, entre la primera y la segunda medición (1 mm atribuible al margen de error y 1 mm de variación efectiva en la posición de la sonda periodontal).
Los sujetos buenos respondedores (BR) recibieron mantenimiento cada tres meses durante 24 meses.63
Durante este período se realizaron las mediciones de las variables clínicas a los 3, 6, 12 y 24 meses y los cultivos para el análisis microbiológico al inicio, a los 12 y 18 meses.
Los sujetos malos respondedores (MR) fueron sometidos a evaluación médica con exámenes complementarios para descartar enfermedades sistémicas. Al grupo MR se le realizó la terapia periodontal no quirúrgica alternativa que consistió en el tratamiento de "boca completa" con instrumental sónico, realizado en una o dos sesiones separadas por unos pocos días y se complementó con terapia sistémica antimicrobiana,43-48 basada en los resultados del antibiograma. Una vez terminado este tratamiento, los malos respondedores continuaron con el mismo protocolo de mantenimiento que el grupo BR.
Evaluación microbiológica-cultivo de bolsas periodontales
Se tomaron muestras de los seis sitios representativos con el mayor daño periodontal y se agruparon en una muestra que permitiera identificar las bacterias periodontopáticas más prevalentes de la cavidad bucal.64-66 Las muestras se tomaron con una cureta de Gracey 7/8 (Hu Friedy) de los sitios con sondaje más profundo o de aquellos dientes que estaban programados para extracción por el daño periodontal severo, eliminando previamente la placa supragingival si estaba presente. Se depositaron en un vial estéril con 10 perlas de vidrio (4 mm de diámetro) y 2 ml de medio de transporte. Se homogeinizaron en agitador eléctrico (IKA Vibrofix) durante 10 segundos.
Estas muestras fueron analizadas en el Laboratorio de la Facultad de Odontología de la Universidad de Antioquia.
Los cultivos se hicieron con diluciones hasta 10-4.
-
Se sembró 0,1 ml de las diluciones 10-3 y 10-4 en agar Brucella suplementado con 5% de sangre de carnero, vitamina K (0,1µg/ml), Hemina (5µg/ml) y L-Cysteina (400 mg/ml), para aislamiento de anaerobios estrictos y se incubó con Anaerogen a 37° C (marca Oxoid), por una semana, para determinar la sensibilidad al oxígeno, se determinó el género microbiano después de realizada la prueba de fluorescencia (MUG CAAM), con luz UV y movilidad.
-
Se sembró 0,1 ml del poll de la muestra directamente y de la dilución 10-1 en TSVB (agar de tripticasa de soya suplementado con vancomicina (7,5 mg/l) y bacitracina (7,5mg/l) para determinar la presencia de Aggregatibacter actinomycetemcomitans. Se incubo a 35 °C, en estufa de CO2 por 96 horas.
-
Se sembró 0,1 ml de la dilución 10-1 (eosina azul de metileno) o en agar Mac Conkey para determinar la presencia de bacilos entéricos. Se incubó a 37 °C en aerobiosis durante 48 horas.
Test de sensibilidad
La evaluación de la sensibilidad antibiótica fue realizada utilizando los discos de sensibilidad correspondientes para los microorganismos, particularmente aquellos reconocidos como patógenos potenciales: Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Tannerella forshytia, Campylobacter sp., Micromonas micros, Fusobacterium sp., Eikenella corrodens, Dialister pneumosintes, bacilos entéricos gram negativos, estreptococos beta-hemolíticos y levaduras. Utilizando los antibióticos de uso clínico en el tratamiento de la enfermedad periodontal:43-48 metronidazol, amoxicilina, tetraciclina, ciprofloxacina y clindamicina.
Monitoreo microbiológico
Con relación a la presencia de patógenos periodontales, se analizaron en cada cultivo las tres especies más prevalentes y las que se presentaron en cantidad abundante (> 1 x 106 UFC): al inicio del estudio (cultivo N.° 1), a los doce meses (cultivo N.° 2) y a los 18 meses (cultivo N.° 3) (tabla 3). La prevalencia de los bacilos entéricos se basó en los resultados del primer cultivo(cultivo n° 1) que es cuando se mide la prevalencia y se tuvo en cuenta la presencia en cantidades altas (> 1 x 106 UFC), medianas (entre 5 x 105 y 1 x 106) y bajas (< 5 x 105).
Análisis de los datos
Se hizo un análisis descriptivo en el cual se obtuvieron las frecuencias, proporciones y prevalencias de aparición de los bacilos entéricos y de las levaduras para el grupo total de pacientes, de buenos y malos respondedores mediante tablas de distribución de frecuencias y gráficos de barras compuestas. De la gran variedad de microorganismos entéricos que existen, en este estudio solo se aislaron tres microorganismos: Escherichia coli, Enterobacter spp., Klebsiella spp. y también se aisló Candida albicans.
Adicionalmente, se determinó la susceptibilidad de los microorganismos a los antimicrobianos como ciprofloxacina, tetraciclina, metronidazol, amoxicilina y clindamicina en el grupo de buenos y malos respondedores; la susceptibilidad se midió mediante proporciones de pacientes que presentaron respuesta sensible o resistente al medicamento.
RESULTADOS
Características de la población estudiada
Se incluyeron en el estudio en total 69 pacientes (63,8% mujeres), con un rango de edad entre 15 y 51 años y predominio de adultos entre los 30 y 39 años (46,4%). El 42% de los pacientes manifestaron durante la entrevista, que tenían antecedentes familiares de enfermedad periodontal y el 5,8% desconocía si en su familia otras personas tenían este antecedente. La mayoría de los pacientes (73.9%) respondieron que no eran, ni habían sido fumadores (tabla 1).
Características clínicas iniciales de la población de estudio (datos de base)
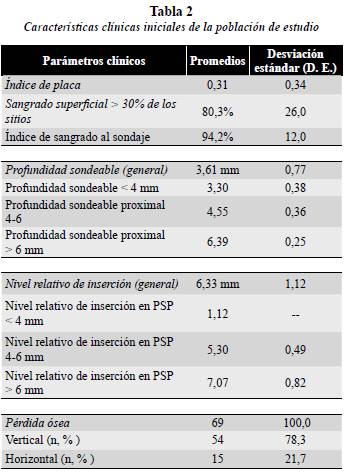
Todos los pacientes incluidos en el estudio tenían signos asociados a la enfermedad periodontal; la pérdida ósea de tipo vertical se presentó en el 78,3% de los pacientes (tabla 2).
El promedio del índice de placa fue de 0,31 ± 0,34 (D. E.), el 94,2 ± 12% (D. E.) de los sitios examinados sangraron al sondaje; en aquellos pacientes en los que la profundidad sondeable proximal (PSP) estaba entre 4 y 6 mm, el valor promedio fue de 4,55 mm ± 0,36 y en pacientes con PSP mayor de 6 mm, el promedio fue 6,39 mm ± 0,25. (D. E.). El valor promedio de pérdida de NRI del grupo general fue de 6,33 mm ± 1,12. (D. E). En los pacientes que tenían una PSP entre 4 y 6 mm el promedio fue de 5,30 mm ± 0,49 (D. E.) y en los pacientes con PSP mayor de 6 mm, el promedio fue 7,07 mm ± 0,82 (D. E.). En cuanto a la extensión de la enfermedad, en el 66,7% de los pacientes fue localizada (< 30% de los sitios comprometidos) y en cuanto a la severidad, en el 63.8% moderada y en el 33,3% severa (tabla 2).
Microorganismos prevalentes encontrados en las bolsas periodontales
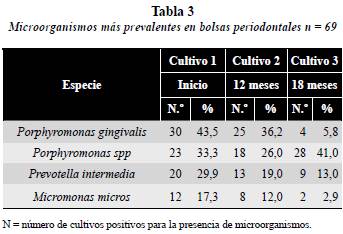
Se analizaron las especies más prevalentes y las que se presentaron en cantidad abundante ( >1 x 106) UFC, al inicio, a los 12 y a los 18 meses en los 69 pacientes del estudio. Se encontró que las especies más prevalentes correspondían en su orden a Porphyromonas gingivalis, Porphyromonas subespecies y Prevotella intermedia (tabla 3).
Porphyromonas gingivalis se encontró aumentada en 30 muestras de pacientes (43,5%) al inicio del estudio, disminuyó a los doce meses a 25 muestras (36,2%), y a los 18 meses sólo se detectó en cuatro (5,8%). En cambio Porphyromonas spp se encontró o aisló en 23 muestras de pacientes (33,3%) en el primer cultivo, disminuyó a 18 muestras (26,0%) en el segundo cultivo y a los 18 meses se aisló en 28 (41,0%). Por su parte, Prevotella intermedia se aisló inicialmente en 20 muestras (29,9%), a los 12 meses disminuyó a 13 (19,0%) y a los 18 meses se halló solo en nueve (13,0%) (tabla 3).
PREVALENCIA DE BACILOS ENTÉRICOS Y LEVADURAS
Los resultados de este estudio con relación a la presencia de bacilos entéricos y de Candida albicans sólo obedecen al primer cultivo, que es cuando se mide la prevalencia aunque a todos los pacientes se les hizo seguimiento durante dos años. Con relación a la prevalencia de bacilos entéricos se reportaron cantidades altas (> 1 x 106 UFC), medias (entre 5 x 105 y 1 x 106) y bajas (< 5 x 105).
Se encontró en el grupo de estudio contaminación por entéricos en 36.2%, en el grupo MR en 49,9% y en el BR 33,3.
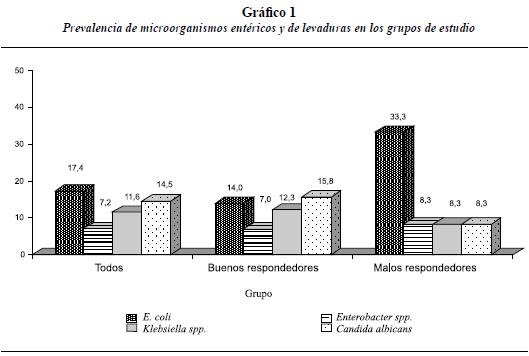
Prevalencia de microorganismos entéricos y de levaduras en los grupos de estudio
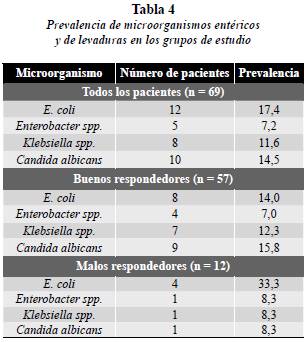
Se observa la prevalencia y proporción de pacientes que presentaron bacilos entéricos y levaduras en el grupo de estudio (tanto buenos como malos respondedores). En todos los pacientes se encontró prevalencia de microorganismos entéricos entre 7,2 y 17,4% siendo E. coli la más frecuente y Enterobacter spp el que menos aparecía (tabla 4, gráfico 1).
En el grupo de los buenos respondedores (BR) el microorganismo más frecuentemente encontrado fue Candida albicans, la cual se presentó en el 15,8% (9) seguida de E. coli que se presentó en el 14% (8) y Klebsiella spp. con el 12,3% (7); el microorganismo que menos se presentó fue Enterobacter spp. el cual se halló en el 7% (4) (tabla 4, gráfico 1).
En el grupo de los malos respondedores (MR) que correspondía solo a 12 pacientes se halló con mayor frecuencia E. coli presente en la tercera parte de los pacientes y otros microorganismos como Enterobacter spp., Klebsiella spp. y Candida albicans se presentaron sólo en 1 paciente cada una (tabla 4, gráfico 1).
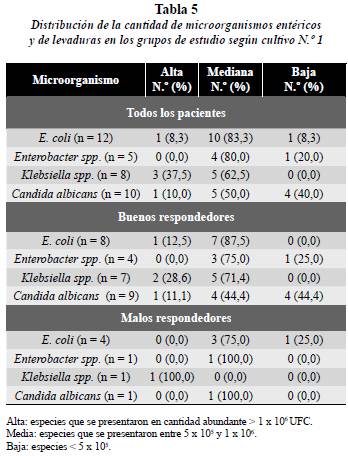
Distribución de la cantidad de microorganismos entéricos y de las levaduras en los grupos de estudio
Se observa la distribución de la cantidad de microorganismos entéricos y levaduras en el grupo de estudio según el cultivo N.° 1. Lo más frecuente fue encontrar cantidades medianas de los microorganismos cuyos porcentajes variaron entre el 50 y el 83% en el total de los pacientes (n = 69). Llama la atención que Klebsiella spp. fue el microorganismo que más cantidad presentó, aislada en 3 pacientes (37,5%). En cantidad baja se halló en mayor proporción Candida albicans, aislada en 4 pacientes (40%) (tabla 5).
En el grupo BR se observa en cantidades altas la presencia de E. coli 1 paciente (12,5%), 7 de ellos presentaron cantidades medianas (87,5%). Enterobacter spp. se aisló en cantidad media en 3 pacientes que corresponden al 75%. Klebsiella spp. en cantidad mediana en 5 pacientes que corresponden al 71,4% y Candida albicans, se presentó en cantidad abundante en 1 paciente (11,1%) en cantidad media en 4 pacientes (44,4%) y en cantidad baja en 4 pacientes (44,4%) (tabla 5).
En el grupo MR E. coli se presentó en 3 pacientes (75%) en mediana cantidad y en otro paciente se presentó en baja cantidad. El paciente en que se halló Enterobacter spp. el microorganismo fue encontrado en mediana cantidad en 100%, al igual que al paciente que se le aisló Candida albicans (100%). Al paciente que se le aisló Klebsiella spp. este microorganismo fue hallado en alta cantidad (100%) (tabla 5).
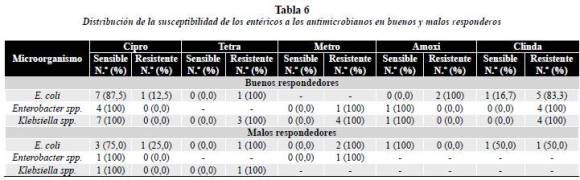
Distribución de la susceptibilidad de los entéricos a los antimicrobianos en buenos y malos respondedores
Se probó la susceptibilidad de los microorganismos aislados en BR y MR frente a 5 medicamentos: ciprofloxacina (Cipro), tetraciclina (Tetra), metronidazol (Metro), amoxicilina (Amoxi) y clindamicina (Clinda). Sólo se prescribieron antibióticos al grupo MR.
El grupo de buenos respondedores (tabla 6), con relación a E. coli fue sensible en 87,5% a Ciprofloxacina y resistente en 100% a tetraciclina y amoxicilina. El metronidazol no presentó resultados concluyentes, por los cuales se pueda hablar o concluir de sensibilidad o resistencia.
Enterobacter spp. fue sensible en 100% a ciprofloxacina y amoxicilina y resistente a clindamicina y a metronidazol en otro 100%; no mostró resultados concluyentes para Tetraciclina.
Klebsiella spp. sensible en 100% a ciprofloxacina y amoxicilina y resistente a Tetraciclina y a clindamicina (100%).
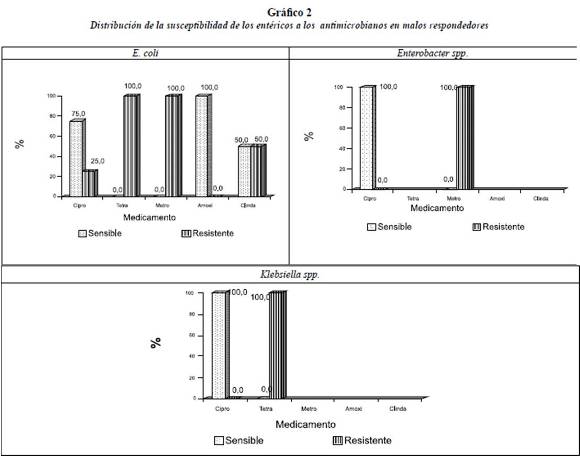
En el grupo de los malos respondedores (tabla 6, gráfico 2) E. coli presentó sensibilidad en el 75% a ciprofloxacina y en 100% para amoxicilina y resistencia en 100% a tetraciclina y metronidazol.
Enterobacter spp. sensible en 100% a ciprofloxacina y resistente en 100% a metronidazol. Para tetraciclina, amoxicilina y clindamicina no se presentaron resultados concluyentes.
Klebsiella spp. fue sensible en 100% a ciprofloxacina y resistente en 100% a tetraciclina. Para metronidazol, amoxicilina y clindamicina no se presentaron resultados concluyentes.
DISCUSIÓN
Las enfermedades del periodonto en los humanos son consideradas globalmente como enfermedades infecciosas. Existen variaciones en los diferentes países del mundo, desarrollados y en vía de desarrollo, en la prevalencia y en la severidad. Tales variaciones pueden ser explicadas por las diferencias en los niveles de higiene oral y pueden reflejar cambios en las condiciones raciales, geográficas y nutricionales.22, 29, 31, 38 En esencia las bacterias son consideradas el principal factor etiológico de la enfermedad periodontal.5
Aunque más de 500 especies bacterianas diferentes han sido encontradas en el área subgingival, solamente unas pocas están implicadas en la patogénesis de la enfermedad periodontal; estas especies patógenas son probablemente Porphyromonas gingivalis, Prevotella intermedia, Fusobacterium nucleatum, Aggregatibacter actinomycetemcomitans y Tannerella forsythia.9, 38, 39
Los bacilos entéricos han sido aislados de las bolsas periodontales en altos porcentajes en pacientes con periodontitis en la República Dominicana,32 en Sudán39 y en países en vía de desarrollo.32, 34, 35, 37, 38 En contraste, los bacilos entéricos han sido aislados en pequeños porcentajes en pacientes con periodontitis en Estados Unidos35 y en Suecia.
Se especulan como posibles causas de estas altas proporciones de entéricos en estas poblaciones la ingesta de alimentos y agua contaminada, la higiene personal inadecuada, el uso indiscriminado de antibióticos y la multiplicación en el medio de transporte; esto está de acuerdo con el hecho de que los bacilos entéricos pueden multiplicarse en el medio de transporte a temperatura ambiente, si las muestras no son procesadas rápidamente en el laboratorio.30, 39
En este estudio, con el propósito de minimizar este factor, los especímenes fueron procesados en menos de 24 horas después de tomadas las muestras en el Laboratorio de la Facultad de Odontología de la Universidad de Antioquia.
La frecuencia de bacilos entéricos en este estudio fue de 36,2%, muy similar al obtenido en una población de Bogotá (39,2%),20 en Cali (36%)21 y también en datos muy globales de Colombia (29.8%).29 En contraste, la prevalencia de bacilos entéricos en Brasil (31,2%)22 fue relativamente inferior y esto puede estar relacionado con el nivel de desarrollo del país.34, 35, 37-41.
Si los bacilos entéricos actúan como patógenos periodontales en pacientes susceptibles de Santo Domingo32 y países en vía de desarrollo,10, 20-22, 29, 34, 35, 37-41 entonces, la periodontitis asociada con bacilos entéricos puede representar una infección exógena debida a condiciones sanitarias inadecuadas. Esta posibilidad puede ayudar a explicar la alta prevalencia de la periodontitis en ciertos países en desarrollo. En Estados Unidos y Europa36 las infecciones por bacilos entéricos parecen estar relacionadas con pacientes que sufren de desórdenes inmunológicos,67 con la quimioterapia extensa para el tratamiento del cáncer46, 68 y con la edad en individuos sistémicamente sanos.28
Los estudios de investigación no reportan diferencias significativas con relación al género y a la edad,28 pero como las mujeres consultan con mayor frecuencia que los hombres se reporta mayor presencia de bacilos entéricos en ellas. El aumento con la edad puede reflejar exposición a largo plazo por la acumulación de estos microorganismos en el tiempo, puesto que pueden no ser efectivamente controlados con la terapia periodontal convencional.36
Los bacilos entéricos poseen factores de virulencia de posible relevancia para la enfermedad periodontal.34 E. coli posee amplia variedad de factores de virulencia, tanto generales (endotoxinas, cápsula, resistencia antimicrobiana, etc.), como especializados (adhesinas, exotoxinas). Las adhesinas favorecen la adherencia, la agregación y la coagregación a las células. Entre las exotoxinas está la hemolisina HlyA que lisa los eritrocitos y otras células, llevando a la liberación de citocinas y a la estimulación de una respuesta inflamatoria.69
La presencia de microorganismos no residentes en la cavidad bucal (transeúntes) en altas proporciones en muestras de placa subgingival puede ser reconocida en enfermedades periodontales.18, 36 Sin embargo su prevalencia en varias poblaciones y su papel en la periodontitis no ha sido completamente elucidado; falta por aclarar si estos microorganismos no residentes que crecen preferiblemente en ambientes aeróbicos, pueden crecer y competir con los residentes anaeróbicos en la bolsa periodontal profunda y causar daño periodontal. Estos microorganismos han sido asociados principalmente con infecciones sistémicas (pulmonares, sepsis, etc.) en pacientes médicamente comprometidos, en pacientes con prótesis parciales o totales y en personas con edad avanzada, pero también en pacientes en condiciones aparentemente normales.18, 27
Tomando como base los resultados que se observan en la tabla 4 de nuestro estudio se observó prevalencia de microorganismos entéricos del 36,2%, distribuidos proporcionalmente en 49.9% para MR y 33,3% para BR.
En este reporte con relación a la prevalencia de bacilos entéricos y levaduras al comparar los datos de los BR con los MR, en estos últimos se encontró mayor predominio de E. coli (33,3%) y de Enterobacter spp. (8,3%). Los niveles de Klebsiella spp. y Candida albicans aparecieron en mayor proporción para los BR (tabla 4).
Las diferencias observadas en forma cualitativa reportan mayor presencia de estos microorganismos en los MR con respecto a los BR, pero estas diferencias no pueden ser inferidas a toda la población dado los pequeños tamaños de muestra en cada uno de los grupos de estudio.
Con respecto a la distribución, tanto en BR como en MR predominó la cantidad mediana de microorganismos (entre 5 x 105 y 1 x 106), exceptuando la distribución de Klebsiella spp. en MR (tabla 5).
Poca importancia se le ha dado a la presencia a nivel subgingival y al potencial periodontopático de las levaduras. Candida albicans y otros hongos han sido detectados en alto número en la flora subgingival o en los tejidos gingivales de abscesos periodontales agudos, en la periodontitis avanzada de pacientes con sida17 y en lesiones periodontales agresivas en pacientes jóvenes. Se ha reportado una correlación significativa entre las levaduras subgingivales y la pérdida del nivel de inserción en pacientes con leucemia a los que se les trata con quimioterapia supresiva.
Las levaduras son patógenos en varias infecciones médicas y poseen factores de virulencia relevantes para las enfermedades del periodonto. Así, C. albicans puede invadir el epitelio del surco y el tejido conectivo gingival, inhibe las funciones del polimorfo nuclear neutrófilo, matan los monocitos, degradan la alfa-2- macro-globulina; procesa colagenasa, fosfolipasa aminopeptidasa, fosfatasa ácida y alcalina, proteasa de queratina y las proteasas de inmunoglobulinas IgG1, IgA1 e IgA2.17
Finalmente, puesto que las especies de C. albicans están asociadas con infecciones sistémicas serias en pacientes afectados médicamente debe prestarse atención a la flora subgingival de pacientes con periodontitis del adulto como potencial reservorio para estos patógenos oportunistas.17
Dada la etiología microbiana de las enfermedades periodontales,1-6, 42 el abordaje terapéutico con el uso adjunto de antimicrobianos sistémicos puede ser beneficioso, en especial para el grupo de pacientes que no responden a la terapia periodontal no quirúrgica convencional. Es evidente que los agentes antimicrobianos son de gran interés y de gran valor como terapia adjunta al desbridamiento mecánico convencional. La vía sistémica para el uso de varios agentes antimicrobianos ha sido estudiada en varias formas de periodontitis, a pesar de que algunos de ellos muestran efectos adversos tales como hipersensibilidad, intolerancia gastrointestinal y desarrollo de resistencia.34, 36, 43-48
La administración de antibióticos sistémicos en el tratamiento de las infecciones periodontales mejoran el nivel de inserción y disminuyen: el porcentaje de sitios que sangran al sondaje, los microorganismos orales, la inflamación gingival y la profundidad sondeable. En este estudio se presenta la lista de los antibióticos utilizados en la tabla 6.
Los patrones de susceptibilidad a los agentes antimicrobianos sistémicos sugieren que la terapia con ciprofloxacina puede tener potencial para erradicar los bacilos entéricos de las bolsas periodontales. Por otra parte la ciprofloxacina es un antibiótico de amplio espectro, capaz de suprimir parte de la flora normal compuesta por Streptococcus y actinomyces.36, 47
La ciprofloxacina mostró ser altamente efectiva para el control de los bacilos entéricos sensibles en este estudio. Se encontró alta resistencia a la tetraciclina y al metronidazol, por consiguiente no serían estos los medicamentos de elección; estos resultados están en concordancia con lo reportado en la literatura.34, 36, 47
El uso de clorhexidina como agente antibacteriano y antimicótico en odontología está bien documentado; su mayor aplicación es para el control de la placa dentobacteriana. Sin embargo algunos estudios han indicado que la clorhexidina es también efectiva en el tratamiento adjunto de la periodontitis.48
La posición de la Academia Americana de Periodontología70 indica que la terapia antibiótica sistémica no es aceptada de manera general para usarla en periodontitis crónica, estos casos pueden ser manejados exitosamente con terapia periodontal no quirúrgica tradicional. La terapia antibiótica sistémica debe ser considerada en pacientes con los diferentes tipos de periodontitis agresiva.
No existen elementos clínicos, ni microbiológicos que con certeza nos permitan anticipar la respuesta al tratamiento periodontal para poder seleccionar terapias más efectivas y así de una vez obtener buenos resultados. Tampoco se debe desconocer el componente inmunologico71 y las diferencias de la microflora en distintos grupos poblacionales para así brindar mejores opciones de tratamiento.
Cualquiera que sea la terapia seleccionada o sus resultados, exige la existencia de un plan de mantenimiento y el acatamiento por parte del paciente, reconocidos éstos como pilares fundamentales en el éxito del tratamiento a largo plazo.
CONCLUSIÓN Y RECOMENDACIÓN
Del estudio se puede concluir que E. coli fue el microorganismo que se presentó en mayor porcentaje en ambos grupos de pacientes, siendo mayor en el grupo MR. Se recomienda hacer seguimiento más detallado para ver el comportamiento de estos microorganismos después de la terapia periodontal no quirúrgica convencional en el grupo de los buenos respondedores y con el uso adjunto del antibiótico sistémico para los malos respondedores.
AGRADECIMIENTOS
A la microbióloga Beatriz Restrepo por su colaboración en la toma y procesamiento de las muestras. (Laboratorio de Microbiología de la Facultad de Odontología de la Universidad de Antioquia).
A la doctora Ángela María Segura por su colaboración en la interpretación estadística de los resultados obtenidos.
A la doctora Maria Cecilia Martínez y el doctor Adolfo Contreras por sus aportes y asesoría en el campo de la microbiología.
REFERENCIAS BIBLIOGRÁFICAS
1. Kinane DF, Attstrom R. Advances in the pathogenesis of periodontitis. Group B consensus report of the Fifth European Workshop in Periodontology. J Clin Peridontol 2005; 32: 130-131. [ Links ]
2. Van Winkelhoff AJ, Boutaga K. Transmission of periodontal bacteria and models of infection. J Clin Periodontol 2005; 32: 16-27. [ Links ]
3. Sánz M, Quirynen M. Advances in the aetiology of periodontitis. Group a consensus report of the 5th European Workshop in Periodontology. J Clin Periodontol 2005; 32: 54-56. [ Links ]
4. Socransky SS, Haffajee AD. Periodontal microbial ecology. Periodontol 2000 2005; 38: 135-187. [ Links ]
5. Haffajee AD, Socransky SS. Microbial etiological agents of destructive periodontal disease. Periodontol 2000 1994; 5: 78-111. [ Links ]
6. Elter JR, Beck JD, Slade GD, Offenbacher S. Etiologic models for incident periodontal attachment loss in older adults. J Clin Periodontol 1999; 26: 113-123. [ Links ]
7. Curtis MA, Slaney JM, Duse-Opoku J. Critical pathways in microbial virulence. J Clin Periodontol 2005; 32: 28-38. [ Links ]
8. Wolff LF, Aeppli DM, Phihlstronm B, Anderson L. Natural distribution of 5 bacteria associate with periodotal disease. J Clin Periodontol 1993; 20: 699-706. [ Links ]
9. Ashimoto A, Chen C, Bakker I, Slots J. Polymerase chain reaction detection of 8 putative periodontal pathogens in subgingival plaque of gingivitis and advanced periodontitis lesions. Oral Microbiol Immunol 2001; 16: 306-310. [ Links ]
10. Jaramillo A, Contreras A, Lafaurie G. Microbiota subgingival en pacientes con enfermedad periodontal agresiva y crónica en Colombia. Memorias Revista ACFO 2002; (Abstract) p.22-30. [ Links ]
11. Contreras A, Doan N, Chen C, Rusitanonta T, Flynn MJ, Slots J. Importance of Dialister pneumosintes in human periodontitis. Oral Microbiol Immunol 2000; 15: 269-272. [ Links ]
12. Contreras A, Slots J. Herpes virus in human periodontal disease. J Periodontal Res 2000; 35: 3-16. [ Links ]
13. Contreras A, Slots J. Active cytomegalovirus infection in human periodontitis. Oral Microbiol Inmunol 1998; 13:225-230. [ Links ]
14. Umeda M, Chen C, Bakker I, Contreras A, Morrison JL, Slots J. Risk indicators for harboring periodontal pathogens. J Periodontol 1998; 69: 1111-1118. [ Links ]
15. Wolff L, Dahlen G, Aeppli D. Bacteria as risk markers for periodontitis. J Periodontol 1994; 64: 498-510. [ Links ]
16. Quirynen M, De Soete M, Dierickx K, Van Steenberghe D. The intra-oral translocation of periodontopathogens jeopardises the outcome of periodontal therapy. A review of the literature. J Clin Periodontol 2001; 28: 499-507. [ Links ]
17. Slots J, Rams TE, Listgarrten NA. Yeasts, enteric rods and pseudomonads in the subgingival flora of severe adult periodontitis. Oral Microbiol Inmunol 1988; 3: 47-52. [ Links ]
18. Dahlen G, Wikstrom M. Ocurrence of enteric rods, staphylococci and Candida in subgingival samples. Oral Microbiol Immunol 1995; 10: 42-46. [ Links ]
19. Reynaud AH, Nygaard-Ostby B, Boygard GK, Eribe ER, Olsen I, Gjermo P. Yeasts in periodontal pockets. J Clin Periodontol 2001; 28: 860-864. [ Links ]
20. Mayorga de Fayad I, Lafaurie G, Hurtado P, Galindo R, Cadena A. Detección de Porphyromonas gingivalis y bacilos entéricos en pacientes con periodontitis crónica severa en una muestra de población de Bogotá, D. C. Rev Cient 2002; 8(1): 28-37. [ Links ]
21. Betancourth M, Arce R, Botero J, Jaramillo A, Cruz C, Contreras A. Microorganismos inusuales en surcos y bolsas periodontales. Colombia Medica 2006; 37(1): 6-14. [ Links ]
22. Botero JE, Contreras A, Lafaurie G, Jaramillo A, Betancourt M, Arce RM. Occurrence of periodontopathic and Superinfecting Bacteria in Chronic and Aggressive periodontitis subjects in a Colombian population. J Periodontol 2007; 78: 696-704. [ Links ]
23. Sedgley CM, Samaranayake LP. Oral and oropharybgeal prevalence of Enterobacteriaceae in humans: a review. J Oral Pathol Med 1994; 23: 104-113. [ Links ]
24. Marsh PD, Percival RS, Challacombe SJ. The influence of denture-wearing and age on the oral microflora. J Dent Res 1992; 71: 1374-1381. [ Links ]
25. Goldberg S, Cardash H, Browning H, IIII Sahly, Rosenberg M. Isolation of Enterobacteriaceae from the mouth and potencial association with malodor. J Dent Res 1997; 76: 1770-1775. [ Links ]
26. Rams TE, Listgarten MA, Slots J. Utility of 5 major putative periodontal pathogens and selected clinical parameters to predict periodontal breakdown in patients on maintenance care. J Clin Periodontol 1996; 23: 346-354. [ Links ]
27. Pereival RS, Challacombe SJ, Marsh PD. Age-related microbiological changes in the salivary and plaque microflora of healthy adults. J Med Microbiol 1991; 35: 5-11. [ Links ]
28. Slots J; Feik D, Rams TE. Age and sex relationships of superinfecting microorganisms in periodontitis patients. Oral Microbiol Immunol 1990; 5: 305-308. [ Links ]
29. Lafaurie GL, Contreras A, Barón A, Botero J, Mayorga-Fayad I, Jaramillo A et al. Demographic, Clinical and Aspects of Chronic and Aggressive Periodontitis in Colombia: a Multicenter study. J Periodontol 2007; 78: 629-639. [ Links ]
30. Ali RW, Bancescu G, Nielsen O, Skaug N. Viability of four putative periodontal pathogens and enteric rods in the anaerobic transport medium VMGA III. Oral Microbiol Immunol 1995; 10: 365-371. [ Links ]
31. Haffajee AD, Bogren A, Hasturk H, Feres M, Lopez NJ, Socransky SS. Subgingival microbiota of chronic periodontitis subjects from different geographic location. J Clin Periodontol 2004; 31: 996-1002. [ Links ]
32. Slots J, Rams TE, Feik D, Tavares HD & Gillespie GM. Subgingival microflora of advanced periodontitis in the Dominican Republic. J Periodontal 1991; 62: 543-547. [ Links ]
33. Ministry of Health. National Study of Oral Health (ENSAB III). National study of risk factors for chronic disease VII (in Spanish). Bogotá, Colombia: Ministry of Health; 1999: 104-113. [ Links ]
34. Barbosa FCB, Mayer MPA, Saba-Chujfi E, Cai S. subgingival occurrence and antimicrobiana susceptibility of enteric rods and pseudomonas from Brazilian periodontitis. Oral Microbiol Immunol 2001; 16: 306-310. [ Links ]
35. Choi BK, Park SII, Yoo YJ, Choi SH, Chai JK, Cho KS, Kim CK. Detection of major putative periodontopathogens in Korea advanced adult periodotitis patients using a nucleic acid-based approach. J Periodontol 2000; 71(9): 1387-94. [ Links ]
36. Slots J, Feik D, Rams TE. Prevalence and antimicrobial susceptibility of Enterobacteriaceae, Pseuseudomonadaceae and Acinetobacter in human periodontitis. Oral Microbiol Immunol 1990; 5: 149-154. [ Links ]
37. Colombo APV, Teles RP, Torres MC, Souto R, Rosalém W, Jr, Méndes MCS, Uzeda M. Subgingival microbiota of Brazilian subjects with untreated chronic periodontitis. J Periodontol 2002; 73: 360-369. [ Links ]
38. Ali RW, Velcescu C, Jivanescu M-C, Lofthus B, Skaug N. Prevalence of six putative periodontal pathogens in subgingival plaque samples from Romanian adult periodontitis patients. J Clin Periodontol 1996; 23: 133-139. [ Links ]
39. Ali RW; Bakken V, Nilsen R, Skaug N. Comparative detection frequency of 6 putative periodontal pathogens in Sudanese and Norwegian adult periodontitis patiens. J Periodontol 1994; 65: 1046-1052. [ Links ]
40. Sedgley CM, Samaranayake LP, Chan JCY, Wie SHY. A 4-year longiyudinal study of oral prevalence of enteric gram-negative rods and yeasts in Chinese children. Oral Microbiol Immunol 1997; 12: 183-188. [ Links ]
41. Herrera D, Contreras A, Gamonal J, Oteo A, Jaramillo A, Silva N et al. Subgingival microbial profiles in chronic periodontitis patients from Chile, Colombia and Spain. J Clin Periodontol 2008; 35: 106-113. [ Links ]
42. Socransky SS, Haffajee AD. Dental biofilms: difficult therapeutic targets. Periodontology 2000 2002; 28: 12-55. [ Links ]
43. Mombelli A. Antimicrobial profiles of periodontal pathogens and systemic antimicrobial therapy. J Clin Periodontol 2005; 32: 891-892. [ Links ]
44. López NJ, Socransky SS, Da Silva I, Japlit MR, Haffajee AD. Effects of metronidazole plus amoxicillin as the only therapy on the microbiological and clinical parameters of untreated chronic periodontitis. J Clin Periodontol 2006; 33: 648-660. [ Links ]
45. Slots J, Ting M. Systemic antibiotics in the treatment of periodontal disease. Periodontol 2000 2002; 28: 106-176. [ Links ]
46. Rams TE, Babalola OO, Slots J, Subgingival occurrence of enteric rods, yeasts and staphylococci after systemic doxycycline therapy. Oral Microbiol Immunol 1990; 5: 166-168. [ Links ]
47. Slots J, Feik D, Rams TE. In vitro antimicrobial sensitivity of enteric rods and pseudomonas from advanced adult periodotitis. Oral Microbiol Immunol 1990; 5: 298-301. [ Links ]
48. Slots J, Rams TE, Schonfeld SE. In vitro activity of clorhexidine against enteric rods, pseudomonad and Acinetobacter from human periodontitis. Oral Microbiol Immunol 1991; 6: 62-64. [ Links ]
49. Haffajee AD, Uzel NG, Arguello EI, Torresyap G, Guerrero DM, Socransky SS. Clinical and microbiological changes associated with the use of combined antimicrobial therapies to treat "refractory"periodontitis. J Clin Periodontol 2004; 31: 869-877. [ Links ]
50. Mejía GI, Botero A, Rojas W, Robledo JA. Refractory Periodontitis in a Colombian Population: Predominant anaerobic bacterial flora and antibiotic susceptibility. Clin Infect Dis 1995; 20 (suppl. 2): 311-313. [ Links ]
51. The American Academy of Periodontology. Parameter on comprehensive periodontal examination. J Periodontol 2000; 71(Suppl): 847-883. [ Links ]
52. Ministerio de Salud. Declaración de Helsinki de la Asociación Médica Mundial 1964 y de la Norma científico-técnica y administrativas para la investigación en salud, Resolución N.° 008430 de 1993 [en línea] 1993. [Consultado 23 de enero de 2006]; URL disponible en: http://www.unal.edu.co/dib/normas/etica_res_8430_1993.pdf. [ Links ]
53. Silness J, Loe H. Periodontal disease in pregnancy. II correlation between oral hygiene and periodontal condition. Acta Odont Scand 1964; 22: 121-135. [ Links ]
54. Ainamo J, Bay I. Problems and proposals for recording gingivitis and plaque. Int Dent J 1975; 25: 229-235. [ Links ]
55. Mühlemann HR. Son. S. Gingival Sulcus bleeding a leading symptom in initial gingivitis. Helv Odontol Acta 1971; 15: 107-113. [ Links ]
56. Van der Velden U, Abbas F, Winkel EG. Probing considerations in relation to susceptibility to periodontal breakdown. J Clin Periodontol 1986; 13: 894-899. [ Links ]
57. Page RC, Krall EA, Martin J, Mancl Ll, Garcia RI. Validity and accuracy of a risk calculator in predicting periodontal disease. J Am Dent Assoc 2002; 133: 569-576. [ Links ]
58. Ainamo J, Barmes D, Beagrie G, Crutess T, Martin J, Sardo-Infiri J. Development of the word Health Organization (WHO) Community Periodontal Index of Treatment Needs (CPITN). Int Dent J 1982; 32: 281-291. [ Links ]
59. Papapanou PN, Wennstrom JL, Johnson T. Extent and severity of periodontal destruction based on partial clinical assessments. Community Dent Oral Epidemiol 1993; 21: 181-184. [ Links ]
60. Cugini MA, Haffajee AD, Smith C, Kent Jr. RL, Socransky SS. The effect of scaling and root planing on the clinical and microbiological parameters of periodontal diseases: 12 month results. J Clin Periodontol 2000; 27: 30-36. [ Links ]
61. Bergström J, Eliasson S, Dock J. Exposure to tabacco smoking and periodontal health. J Clin Periodontol 2000; 27: 61-68. [ Links ]
62. Cobb CM. Clinical significance of non-surgical periodontal therapy: an evidence-based perspective of scaling and root planning. J Clin Periodontol 2002; 29(Suppl 2): 6-16. [ Links ]
63. Gunsolley JC, Zambon JJ, Mellot CA, Brooks CN, Kaugars CC. Maintenance therapy in young adults with severe generalized periodontitis. J Periodontol 1994; 65:274-279. [ Links ]
64. Savitt ED, Darack AP, Killoj WJ, Lieberman MG. Site selection criteria for microbiological testing of periodontal microorganisms. J Periodontol 1991; 62:558-561. [ Links ]
65. Van Steenberghe TJM, Petit MDA, Tijhof CJ, Van Winkelhoff AJ, Van der Velden U, de Graaff J. Survival in transport media of Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis and Prevotella intermedia in human subgingival samples. Oral Microbiol Immunol 1993; 8:370-374. [ Links ]
66. Gunsolley JC, Chinchilli VN, Savitt ED, Killoy W, Darack AP, Christersson LA et al. Analysis of site specific periodontal bacteria sampling schemers. J Periodontol 1992;63:507-514. [ Links ]
67. Rams TE, Andriolo M, Feik D, Abel SN, McGivern TM, Slots J. microbiological study of HIV-related periodontitis. J Periodontol 1991;62:74-81. [ Links ]
68. Slots J, Ras TE. New views on periodontal microbiota in special patient categories. J Clin Periodontol 1991;18:411-420. [ Links ]
69. Enterobacteriaceae. En: Murray, Patrick, Rosenthal, Ken, Kobayashi, Georges, Pfaller, Michael. Microbiología Médica 4.a ed. Madrid: ELSEVIER;2003.p 262-276. [ Links ]
70. American Academy of Periodontology. Academy Report. Modulation of the host response in periodontal therapy. J Periodontol 2002; 73: 460-470. [ Links ]
71. Berglundh T, Donati M. Aspects of Adaptive host response in periodontitis. J Clin Periodontol 2005; 932: 87-107. [ Links ]
RECIBIDO: AGOSTO 4/2008 - ACEPTADO: SEPTIEMBRE 30/2008
CORRESPONDENCIA
Alejandro Botero Botero
Facultad de Odontología Universidad de Antioquia.
Teléfono 250 36 36.
Correo electrónico:boteroboteroalejandro@hotmail.com
Cómo citar este artículo:
Botero A, Alvear FS, Vélez ME, Botero L. Velásquez H. Evaluación de los enfoques terapéuticos para las varias formas de enfermedad periodontal. Parte III: Prevalencia de Bacilos entéricos y levaduras Rev Fac Odontol Univ Antioq 2008; 20 (1): 72-86.
Botero A, Alvear FS, Vélez ME, Botero L. Velásquez H. Evaluation of the therapeutic approach of various types of periodontal disease. Part III: enterobacteriaceae enteric rods, and yeast species. Rev Fac Odontol Univ Antioq 2008; 20 (1): 72-86.