Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Odontología Universidad de Antioquia
Print version ISSN 0121-246X
Rev Fac Odontol Univ Antioq vol.24 no.1 Medellín July/Dec. 2012
ARTÍCULOS ORIGINALES DERIVADOS DE INVESTIGACIÓN
EFECTO DE LA PEROXIDASA SOBRE LA ADHESIÓN DE UNA RESINA COMPUESTA AL ESMALTE DENTAL POSBLANQUEAMIENTO1
Paula Alejandra Baldión Elorza2, Laura Nathalia Viteri Lucero3, Edilberto Lozano Torres3
1 Artículo derivado de una investigación para optar al título de Odontólogo, como proyecto del grupo de Investigación en Materiales Dentales (Grimad). Apoyo financiero de la Facultad de Odontología de la Universidad Nacional de Colombia dentro de la convocatoria interna para apoyo de la investigación, año 2009
2 Odontóloga, especialista en Rehabilitación Oral, Facultad de Odontología, Universidad Nacional de Colombia. Docente, Facultad de Odontología, Universidad Nacional de Colombia
3 Odontólogos, Facultad de Odontología, Universidad Nacional de Colombia
RECIBIDO: ENERO 17/2012-ACEPTADO: JUNIO 5/2012
Baldión PA, Viteri LN, Lozano E. Efecto de la peroxidasa sobre la resistencia de unión de una resina compuesta al esmalte dental posblanqueamiento. Rev Fac Odontol Univ Antioq 2012; 24(1): 8-21.
RESUMEN
INTRODUCCIÓN: se ha reportado que el oxígeno residual liberado por los agentes blanqueadores interfieren en la adhesión de las resinas compuestas a la estructura dental, razón por la cual se tiene como objetivo comparar la resistencia de unión al corte (RUC) de una resina compuesta al esmalte dental posblanqueamiento con peróxido de hidrógeno al 38%, antes y después de tratar la superficie con la enzima peroxidasa previo a la adhesión.
MÉTODOS: se seleccionaron 45 premolares humanos sanos, divididos en tres grupos de 15 dientes cada uno. Grupo 1: control (solo adhesión); grupo 2: blanqueamiento y adhesión; grupo 3: blanqueamiento, aplicación de peroxidasa y adhesión. Posterior al tratamiento se midió la RUC en la máquina de ensayos Shimadzu, para determinar diferencia estadísticamente significativa entre los tres grupos con nivel de confianza de 95% y con valor de p < 0,05.
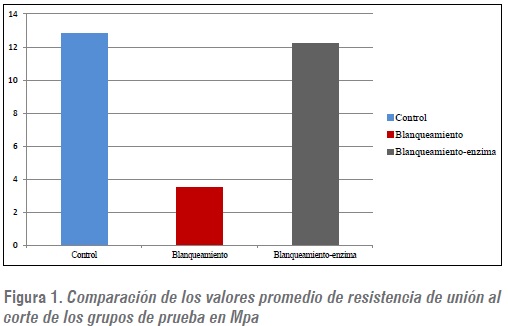
RESULTADOS:el grupo control obtuvo la RUC de 12,8 Mpa (± 3,2), el grupo con blanqueamiento tuvo el promedio de 3,5 Mpa (± 1,43) y el grupo con blanqueamiento y aplicación de peroxidasa presentó promedio de 12,2 Mpa (± 3,12).
CONCLUSIONES: los valores de RUC disminuyeron significativamente con la aplicación de peróxido de hidrógeno al 38%, sin embargo, se logró el aumento significativo al aplicar la peroxidasa previa a la adhesión.
Palabras clave: peroxidasa de rábano silvestre, adhesión dental, blanqueamiento dental, resinas compuestas, peróxido de hidrógeno.
INTRODUCCIÓN
Existe controversia en cuanto a los efectos de los agentes de blanqueamiento sobre los tejidos orales duros y blandos. Se ha intentado promulgar el uso racional y responsable de los mismos, así como la elección de productos que hayan sido sometidos a investigación, parámetros que darán seguridad y éxito en el tratamiento, minimizando los posibles efectos adversos. Las alteraciones del esmalte reportadas en algunos estudios incluyen incremento de la porosidad, formación de fisuras, erosión de la superficie y zonas de desmineralización de las áreas interprismáticas,1-6 como también, cambios en su composición química y alteraciones de sus propiedades mecánicas.1, 7-13 Autores como Dishman y colaboradores14 y Villarreal y colaboradores,15 aseguran que los agentes blanqueadores interfieren en la adhesión de las resinas compuestas a la estructura dental, a través de la interacción con el oxígeno residual en forma de radicales libres que permanecen en los tejidos de dos a cuatro semanas después de concluido el tratamiento de blanqueamiento dental,7, 8, 10 inhibiendo la capacidad adhesiva de las mismas. Sin embargo, se ha intentado probar algunos métodos que ayuden a inactivar los radicales libres de oxígeno residual para tratar de reversar las consecuencias fisicoquímicas indeseables sobre la estructura dental y la adhesión al sustrato adamantino.15, 16 Esperar un lapso de tiempo prudente posterior al tratamiento de blanqueamiento dental17 o el uso de sustancias antioxidantes, 15, 18, 19 se han propuesto como estrategias para eliminar el peróxido residual de la estructura dental para poder efectuar restauraciones adhesivas inmediatamente después de terminado el proceso de blanqueamiento, y a la vez, proteger la estructura del esmalte de los posibles efectos adversos del peróxido residual de los agentes de blanqueamiento, como cambios microestructurales, 2, 4, 5 disminución de la dureza superficial20 y alteración en su composición química.7, 9
Estudios como el de Türkün y colaboradores19, 21 y de Gökçe y colaboradores22 han sugerido el uso de ascorbato de sodio como método eficaz para revertir el efecto oxidante de sustancias blanqueadoras, mientras que Rotstein y colaboradores18 encontraron que, la catalasa aplicada tópicamente por tres minutos fue efectiva en eliminar totalmente el peróxido de hidrógeno residual contenido en las estructuras dentarias después de la aplicación del peróxido de hidrógeno a nivel intracoronal.
Este estudio pretendió evaluar comparativamente el efecto de un tratamiento antioxidante con la enzima peroxidasa sobre la resistencia de unión inmediata de una resina compuesta al esmalte dental expuesto a un agente de blanqueamiento con base en peróxido de hidrógeno de alta concentración (38%).
MATERIALES Y MÉTODOS
Se hizo un estudio de tipo experimental cuantitativo in vitro, para el cual se seleccionaron 45 dientes premolares humanos sanos, con formación radicular completa recién extraídos por razones ortodónticas, se verificó ausencia de caries, fracturas, desgastes, defectos del esmalte y restauraciones previas, las muestras fueron mantenidas en el medio de almacenamiento durante un periodo no mayor a tres meses. Se tuvieron en cuenta las consideraciones éticas para la recolección, manejo y desecho de las muestras, según la resolución N.° 008430 de 1993 del Ministerio de Salud,23 en la cual este estudio se clasifica como una investigación de riesgo mínimo, para la que fue necesario diligenciar un formato firmado por cada paciente, quien dio su consentimiento para la donación de sus dientes específicamente para este estudio, el cual fue aprobado por el Comité de ética de la Facultad de Odontología de la Universidad Nacional de Colombia.
Las muestras se fijaron en cloramina al 0,5% por 24 h y luego fueron almacenadas en agua destilada hasta el momento de las pruebas. Los dientes fueron embebidos en moldes de resina acrílica para conformar sostenedores en forma de cubo para facilitar la colocación de las muestras en la máquina de ensayos Shimadzu AG-SI Series. El área adhesiva se delimitó previamente mediante el empleo de un círculo de papel Contact® con un agujero en el centro del mismo de 2 mm de diámetro. Después se aplicó ácido fosfórico al 37% para hacer el acondicionamiento superficial al esmalte, se secó con papel absorbente y luego se aplicaron dos capas de adhesivo Tetric N-Bond® (Ivoclar/Vivadent, Alemania, Liechtenstein) con un aplicador hasta obtener una superficie brillante, se aireó suavemente y se fotopolimerizó durante 20 s en cada superficie (M-D-V) con la lámpara Bluephase C8 G2® (Ivoclar/Vivadent, Alemania, Liechtenstein) en el programa Low o de baja potencia, según las instrucciones del fabricante.
Las muestras fueron separadas en tres grupos; grupo 1: adhesión, limpieza de la superficie con bicarbonato de sodio y agua, aplicación de ácido fosfórico al 37%, lavado, secado, adhesivo y resina; grupo 2: blanqueamiento -adhesión, aplicación de peróxido de hidrógeno al 38% (Opalescence X-tra Boost®/Ultradent Products, South Jordan, USA); siguiendo las indicaciones del fabricante, se mezcló la jeringa activadora con el agente blanqueador para hacer dos aplicaciones consecutivas de 15 min cada una, formando una capa no mayor a 1 mm de espesor; limpieza de la superficie con bicarbonato de sodio y agua, aplicación de ácido fosfórico al 37%, lavado, secado, adhesivo, resina; grupo 3: blanqueamiento-enzima; el antioxidante enzimático utilizado fue peroxidasa de rábano picante (Peroxidase from horseradish type I/ SIGMA-ALDRICH, St. Louis, USA), que contiene 50-150 unidades/mg sólido, la cual fue disuelta en un buffer de fosfato, dando una concentración final de peso volumen de 472 mg/ml a pH de 6,9 a 7, la solución fue almacenada a -20 °C hasta el momento de su utilización, momento en el cual se aplicó una capa delgada en la superficie dental con un aplicador y se dejó actuar durante 15 min. Luego, se hizo el lavado de las muestras con agua destilada, se secó la superficie con papel absorbente y se hizo el proceso de adhesión convencional.
Posterior a los tratamientos de superficie y adhesión de la resina compuesta, cada muestra fue probada en la máquina de ensayos universales Shimadzu AG-IS Series, ubicando la lámina de corte a 0,5 mm de la interfase adhesiva para aplicar la carga de 50 N, a velocidad constante de 1 mm/min, hasta producir la fractura de espécimen y así, registrar los valores en los que se produjo la falla. Teniendo en cuenta el área de adhesión (A = p r2) en mm2 y la magnitud de la carga registrada en Newtons, se calculó el correspondiente esfuerzo en Mpa (N/mm2), consignando los datos en una tabla que relacionaba las dos variables del estudio: tratamiento de la superficie por grupo y la fuerza de adhesión al esmalte dental (resistencia de unión al corte en Mpa).
Los datos fueron analizados mediante la prueba no paramétrica basada en rangos de ANOVA Kruskal-Wallis de una vía para contrastar la hipótesis de igualdad de las medianas de los tratamientos y posteriormente la prueba no paramétrica de Mann-Whitney para contrastar la hipótesis de igualdad de los grupos de interés,con el empleo del paquete estadístico Social Sciences Statistical Package SPSS, 15.0 (SPSS Inc., Chicago, IL, USA). Se aplicaron medidas de tendencia central (media y desviación estándar) para resumir la presentación de los datos por grupo. Considerándose valores de p < 0,05 como diferencias estadísticamente significativas, entre el grupo control y los grupos tratados con blanqueador y la enzima peroxidasa.
RESULTADOS
Con un nivel de significancia de 5% (nivel de confianza de 95%) se rechaza la hipótesis nula de igualdad de medianas entre tratamientos. Se encontró evidencia estadísticamente significativa de disminución de la RUC de la resina compuesta al esmalte luego de aplicar peróxido de hidrógeno al 38% en comparación con el grupo control (p = 0,003). Además, aumento en la RUC hallada en el grupo del blanqueamiento con posterior aplicación de la peroxidasa al compararla con la RUC del grupo con blanqueamiento y adhesión inmediata (p = 0,0025); y se observó recuperación del valor de RUC inicial al no encontrar diferencia estadística entre el grupo control de solo adhesión y el grupo en que se aplicó la peroxidasa (p = 0,069) (tabla 1).
Los resultados encontrados demuestran que en el grupo 1 (adhesión), se obtuvo mayor promedio de resistencia de unión al corte con valor de 12,8 Mpa (± 3,2), con respecto al grupo 2 (blanqueamiento-adhesión) en el que se observó disminución en los valores de resistencia de unión del 72,65% en comparación con el grupo 1 con promedio de 3,5 Mpa (± 1,43).
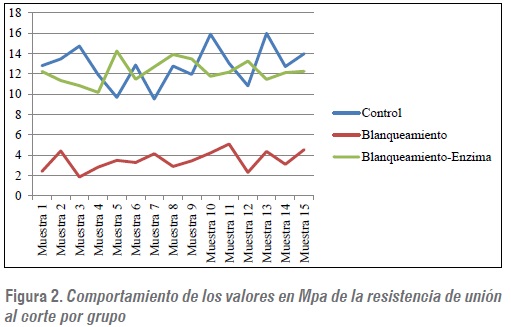
Al aplicar la peroxidasa posblanqueamiento en el grupo 3 se obtuvo recuperación del 95,3% con respecto al grupo 1 con promedio de 12,2 Mpa (± 3,12) (figuras 1 y 2).
DISCUSIÓN
Se ha reportado que los agentes blanqueadores con base en peróxido pueden inducir cambios morfológicos y estructurales en la interfase resina-esmalte, interfiriendo con la adhesión de las resinas compuestas a la estructura dental.8, 10, 14, 15
El propósito del estudio fue determinar el efecto de la enzima peroxidasa sobre la adhesión de una resina compuesta al esmalte dental previamente expuesto a peróxido de hidrógeno al 38%; con este fin se hicieron pruebas de adhesión aplicando una carga tangencial a tres grupos; grupo 1: grupo control en el cual se hizo únicamente adhesión, grupo 2: adhesión posterior al blanqueamiento y grupo 3: blanqueamiento, tratamiento con peroxidasa y adhesión inmediata.
Se logró demostrar la disminución de 8,93 Mpa en la resistencia de unión al corte de la resina adherida inmediatamente al esmalte blanqueado, en comparación con el grupo control en donde solo se hizo adhesión, esto confirma que el uso de agentes blanqueadores con base en peróxido de hidrógeno de alta concentración durante los tiempos establecidos por el fabricante genera una reducción de la resistencia de unión de las resinas compuestas al esmalte dental. La fundamentación del análisis de dicho efecto ha sido sustentada por autores como Bulut y colaboradores,24 Miles y colaboradores25 y McGuckin y colaboradores26 por la presencia de peróxido residual u oxígeno liberado por los agentes de blanqueamiento que inhiben el proceso de polimerización de los sistemas adhesivos y las resinas compuestas, y por una alteración de la estructura superficial del esmalte asociada a una erosión de la capa aprismática, y a una pérdida del contenido de calcio y fósforo.15, 27 Esta disminución de la fuerza adhesiva ha llevado a sugerir, por parte de autores como Miranda y colaboradores28 y Shinohara y colaboradores,29 que los procedimientos restaurativos deben postergarse de dos a cuatro semanas después del blanqueamiento dental, ya que la reducción en la resistencia de unión de la resina compuesta al esmalte recién blanqueado ha demostrado ser transitoria.30 Esto se atribuye a que el esmalte pasa por un proceso de remineralización,31 que permite el remplazo de iones de fosfato, calcio y otros minerales perdidos, por los mismos elementos u otros iones provenientes de la saliva; incluyendo los de fluoruro, que van a fomentar la formación de cristales aportando una matriz más consolidada para la adhesión. La sobresaturación en la saliva de iones calcio y fosfato, tiene un papel importante en el proceso de remineralización, sin embargo, autores como Larsen y colaboradores32 reportan que este proceso requiere tiempo, porque a pesar de que la saliva y las soluciones remineralizantes se encuentran sobresaturadas con respecto a la apatita del esmalte, la cantidad total de calcio y fosfato disuelto es pequeñ;o, así que después de la precipitación de los minerales disueltos solo 1/20.000-1/30.000 del volumen de la solución de mineralización está ocupado por mineral. Además, que los gradientes de concentración de la solución de mineralización en el esmalte son bajos, lo que indica la lenta difusión dentro de la estructura,32 razón por la cual es prudente esperar el tiempo recomendado por autores como Shinohara y colaboradores,29 Basting y colaboradores33 y Cavalli y colaboradores34 para recuperar una superficie de esmalte con menores cambios aparentes.
Situaciones clínicas tales como, restauraciones antiguas en el sector anterior que afectan la apariencia estética, necesidad de inicio de un tratamiento de ortodoncia o simplemente la disponibilidad de tiempo del paciente para un tratamiento cosmético que requiera procedimientos adhesivos posblanqueamiento,25, 35 ponen al clínico en una postura difícil en el momento de decidir si acceder a hacer el tratamiento restaurador, antes de esperar el tiempo prudente para hacer la adhesión posblanqueamiento dental. Por esta razón, ha surgido la necesidad de buscar la forma de permitir al clínico hacer restauraciones adhesivas inmediatamente después de un blanqueamiento dental sin el riesgo al fracaso de las mismas.
Villarreal y colaboradores15 reportan que el uso complementario de sustancias antioxidantes reducen el efecto adverso sobre la resistencia de unión de las resinas al esmalte acondicionado y sobre los cambios en su morfología y composición química. Antioxidantes enzimáticos como la catalasa y la superóxido dismutasa,15, 18, 36 y no enzimáticos37 como el ascorbato de sodio al 10% han sido probados como agentes inactivadores del oxígeno residual, capaces de reversar el efecto negativo de los agentes blanqueadores sobre la resistencia de unión al esmalte dental, obteniendo hasta el momento buenos resultados.19, 21, 24, 38 Rotstein y colaboradores12 demostraron que la aplicación de catalasa por tres minutos tiene la capacidad de eliminar totalmente el peróxido de hidrógeno residual y lo recomiendan como protocolo posblanqueamiento intracameral en dientes no vitales para eliminar el oxígeno de la cámara pulpar y de los tejidos periodontales circundantes para disminuir su daño potencial.
Lai y colaboradores39 Türkün y colaboradores19 y Feiz y colaboradores38 comprobaron que con la inmersión de las muestras en agua por 24 horas39 y el uso de un agente antioxidante como el ascorbato de sodio se inhibe la disminución en la resistencia de unión de las resinas compuestas posblanqueamiento.
La peroxidasa también ha sido probada en estudios por Bowles y colaboradores40 y Gimeno y colaboradores,41 quienes demostraron que durante o inmediatamente después del tratamiento blanqueador con peróxido de hidrógeno, su uso puede prevenir efectos nocivos sobre los tejidos blandos de la cavidad oral y la pulpa dentaria. Masaki y colaboradores,42 Spector y colaboradores43y Björkman y colaboradores44 hicieron investigaciones sobre cultivos celulares de fibroblastos, células epiteliales y tiroideas demostrando un efecto protector de tejidos mediante la utilización de catalasa y peroxidasa frente a los radicales libres de oxígeno.
Al evaluar la acción antioxidante de la enzima peroxidasa, bajo las condiciones de este estudio, se observó el aumento en la resistencia de unión al corte al aplicarla sobre la superficie dental inmediatamente posterior al blanqueamiento con peróxido de hidrógeno al 38%, demostrando la recuperación significativa de la fuerza adhesiva de la resina compuesta al esmalte dental por medio de la eliminación de los radicales liberados por el agente blanqueador gracias a su acción enzimática en procesos de oxidorreducción,15, 16, 18 lo que indica que la actividad enzimática de la peroxidasa permite la eliminación del peróxido residual. Por tratarse de una molécula de tamaño del orden de 40.000 Da, tiene la capacidad de penetrar a través de la matriz adamantina entre las varillas del esmalte y quizá, hasta los túbulos dentinales, permitiendo la interacción con las moléculas de oxígeno, causando su oxidación y degradándose a subproductos como el agua, evitando así, la inhibición en el proceso de polimerización de las resinas compuestas y sistemas adhesivos al conformarse una red tridimensional estable de enlaces carbono-carbono de los grupos metacrilato.38, 39
Rocha y colaboradores45 reportaron que la aplicación de catalasa y glutatión peroxidasa mejoraron la resistencia de unión al esmalte en comparación con el grupo control positivo con aplicación de peróxido de hidrógeno, sin embargo, la catalasa demostró mejor actividad que la peroxidasa. Este resultado lo atribuyen al mecanismo de acción de la catalasa, el cual requiere un número reducido de moléculas para generar su acción enzimática. A pesar de esto, los autores afirman que ambas enzimas no tuvieron la capacidad de neutralización completa pues la resistencia de unión fue significativamente más baja que la del grupo control negativo, infiriendo que el uso de una solución más concentrada probablemente podría presentar mejores resultados. Concepto que aclararía el porqué de la diferencia en los resultados con respecto a este estudio. Rocha y colaboradores45 utilizaron una peroxidasa de eritrocitos de bovino de 680 unidades/mg de proteínas con una concentración de 10 mg/ml, mientras que en este estudio se hizo la aplicación de peroxidas de rábano picante de 150 unidades/mg de proteínas con una concentración de 472 mg/ml, aumentando la cantidad final de peso volumen de la enzima,arrojando mejores resultados en la recuperación de la resistencia de unión al esmalte dental posblanqueamiento.
Para que se cumplan las condiciones inherentes en las reacciones enzimáticas, las enzimas deben manipularse bajo condiciones que no favorezcan su desnaturalización, puesto que esta conduce a su inactivación. El uso de agentes antioxidantes enzimáticos, como la catalasa, peroxidasa y superóxido dismutasa, presentan mayor sensibilidad de la técnica para su aplicación clínica comparado a los antioxidantes no enzimáticos. La actividad enzimática está condicionada a los siguientes factores: el efecto de la concentración enzimática, la temperatura, el pH del medio y su agitación. El efecto de la concentración de la enzima determina la velocidad de la reacción por la proporcionalidad entre la cantidad de enzima versus el sustrato, la velocidad de la reacción disminuye, a medida que aumenta la concentración del sustrato. Con respecto al control de la temperatura, la mayoría de reacciones enzimáticas ocurren a temperaturas entre 0 y 60 °C, la temperatura óptima está usualmente relacionada con la temperatura del medio ambiente celular de la cual es derivada la enzima, para la activación de la peroxidasa esta temperatura es de 37 °C. Su estructura proteica terciaria se mantiene gracias a enlaces de naturaleza física no covalentes, los cuales son altamente sensibles a cambios de temperatura. Otro factor importante es el efecto del pH, la enzima peroxidasa tiene pH óptimo característico de 6,9 a 7,0; los cambios en las concentraciones de los iones H+ y OH- modifican el pH de la solución alterando las interacciones entre las moléculas de proteínas y, por tanto, su estructura tridimensional y su actividad. Y por último, el efecto de la agitación, condición en la que cuando se agitan violentamente, forman espuma por la baja tensión superficial que presentan las soluciones de proteínas, lo que hace que se favorezca su desnaturalización.15, 46-48
Es necesario considerar que el protocolo planteado para el procesamiento del preparado enzimático y conservación de la peroxidasa, que permitió que la actividad catalítica se llevara a cabo sobre el sustrato de peróxido de hidrógeno residual y los radicales libres en la superficie dental, contiene parámetros de preparación, conservación y aplicación de la enzima específicos, que aumentan la sensibilidad y dificultad de la técnica clínica, ya que podría alterarse fácilmente su actividad catalítica debido a su naturaleza biológica, razón por la cual es importante evaluar la aplicabilidad del protocolo de manejo clínico de la peroxidasa de rábano picante (Horseradish Tipo I/SIGMA-ALDRICH, St. Louis, USA)en nuestro medio, pues fue evidente su elevado costo y dificultad de consecución, al igual que ocurre con cualquier tipo de enzima antioxidante de características similares como la catalasa u otros tipos de peroxidasa derivadas de sangre, levadura o habichuela. La presentación de la peroxidasa de polvo liofilizado requirió una preparación en una solución amortiguadora de fosfato, a pH de 7 como medio estable para que hiciera su acción catalítica sin desnaturalizarse, y poder conseguir una preparación líquida o gel de fácil aplicación, además fue necesario el riguroso almacenamiento a -20°C, transporte cuidadoso de la enzima, y el tiempo de espera prolongado para el envío del producto a nuestro país; estas limitaciones hacen sugerir la posibilidad de búsqueda de nuevas alternativas para la producción de la enzima a menor costo, con facilidades de adquisición y distribución, aislando la enzima directamente de productos que se puedan obtener de forma práctica o con un proceso sencillo de separación de la misma en el laboratorio.
Los hallazgos se consideran importantes en cuanto a su alcance, ya que aportan evidencia significativa para ahondar en procedimientos clínicos que disminuyan los efectos nocivos de los agentes blanqueadores, pues pese a las múltiples investigaciones que demuestran las alteraciones a niveles fisiológico,49-53 químico,7, 9, 54 mecánico1,8-11, 13, 20, 55 y estructural1-3, 6, 12 por acción de peróxidos, sigue siendo uno de los tratamientos estéticos más solicitados por los pacientes y más ejecutados por los odontólogos en la actualidad.
RECOMENDACIONES
Se recomiendan estudios para encontrar una alternativa de aplicación de la peroxidasa evaluando la actividad catalítica cuantitativamente, en cuanto a la velocidad de reacción y tiempo, al igual que la evidencia microscópica de su acción sobre los cambios microestructurales del esmalte dental.
Se necesita determinar las constantes catalíticas y el tiempo de vida media de la peroxidasa con respecto al peróxido de hidrógeno al 38% de uso odontológico sobre la superficie del esmalte dental, para tener un parámetro o determinar la cantidad de unidades catalíticas más cercanas que aseguren la eliminación total del peróxido de hidrógeno residual y sus radicales libres.
CONCLUSIONES
Entre de las limitaciones de este estudio se puede concluir que:
Existe una significativa reducción estadística en la resistencia de unión al corte de la resina compuesta adherida al esmalte dental sometido a blanqueamiento con peróxido de hidrógeno al 38%.
Hay recuperación en los valores de resistencia de unión al corte de la resinas compuestas al aplicar la enzima peroxidasa sobre la superficie dental inmediatamente posterior a la aplicación del peróxido de hidrógeno al 38%.
AGRADECIMIENTOS
A la Facultad de Odontología de la Universidad Nacional de Colombia por su apoyo financiero para la elaboración de este estudio dentro de la convocatoria interna de la Facultad, año 2009.
REFERENCIAS
1. Akal N, Over H, Olmez A, Bodur, H. Effects of carbamide peroxide containing bleaching agents on the morphology and subsurface hardness of enamel. J Clin Pediatric Dent 2001; 25: 293-296. [ Links ]
2. Cavalli V, Arrais CAG, Giannini M. Scanning electron microscopy observations of human bleached enamel surface. Acta Microsc 2001; 1 (supl A): 41-42. [ Links ]
3. Flaitz CM, Hicks MJ. Effects of carbamide peroxide whitening agents on enamel surfaces and caries-like lesion formation: An SEM and polarized light microscopic in vitro study. J Dent Child 1996; 63: 249-256. [ Links ]
4. Hegedüs C, Bistey T, Flóra-Nagy E, Keszthelyi G, Jenei A. An atomic force microscopy study on the effect of bleaching agents on enamel surface. J Dent 1999; 27: 509-515. [ Links ]
5. Perdigão J, Francci C, Swift Jr EJ, Ambrose WW, Lopes M. Ultramorphological study of the interaction of dental adhesives with carbamide peroxide-bleached enamel. Am J Dent 1998; 11: 291-301. [ Links ]
6. Shannon H, Spencer P, Gross K, Tira D. Characterization of enamel exposed to 10% carbamide peroxide bleaching agents. Quintessence Inter 1993; 24: 39-44. [ Links ]
7. Attin T, Kielbassa AM, Schwanenberg M, Hellwig E. Effect of fluoride treatment on remineralization of bleached enamel. J Oral Rehabil 1997; 24: 282-286. [ Links ]
8. Cavalli V, Giannini M, Carvalho R. Effect of carbamide peroxide bleaching agents on tensile strength of human enamel. Dent Mater 2004; 20: 733-739. [ Links ]
9. Cimilli H, Pameijer CH. Effect of carbamide peroxide bleaching agents on the physical properties and chemical composition of enamel. Am J Dent 2001; 14: 63-66. [ Links ]
10. Murchison DR, Charlton DG, Moore BK. Carbamide peroxide bleaching: effects on enamel surface hardness and bonding. Oper Dent 1992; 17: 181-185. [ Links ]
11. Potocnik I, Kosec L, Gaspersic D. Effect of 10% carbamide peroxide bleaching gel on enamel microhardness, microstructure and mineral content. J Endod 2000; 26: 203-206. [ Links ]
12. Rotstein I, Dankner E, Goldman A, Heling I, Stabholz A, Zalkind M. Histochemical analysis of dental hard tissues following bleaching. J Endod 1996; 22: 23-26. [ Links ]
13. Seghi RR, Denry I. Effects of external bleaching on indentation and abrasion characteristics of human enamel. J Oral Rehabil 1992; 71: 1340-1344. [ Links ]
14. Dishman MV, Covey DA, Baughan LW. The effects of peroxide bleaching on resin composite to enamel bond strength. Dent Mater 1994; 10(1): 33-36. [ Links ]
15. Villarreal B, Einer N. Función de las sustancias antioxidantes sobre esmalte blanqueado con peróxido de hidrógeno ante la adhesión inmediata de resina compuesta y sus cambios estructurales y morfológicos superficiales. Rev Paul Odontol 2004; 26(3): 27-31. [ Links ]
16. Hakan B, Murat T, Aysegul D. Effect of an antioxidizing agent on the shear bond strength of brackets bonded to bleached human enamel. Am J Orthod Dentofacial Orthop 2006; 29(2): 266-272. [ Links ]
17. Van der Vyver PJ, Lewis SB, Marais JT. The effect of bleaching agent on composite/enamel bonding. J Dent Assoc S Afr 1997; 52(10): 601-603. [ Links ]
18. Rotstein I. Role of catalase in the elimination of residual hydrogen peroxide following tooth bleaching. J Endod 1993; 19(11): 567-569. [ Links ]
19. Türkün M, Kaya AD. Effect of 10% sodium ascorbate on the shear bond strength of composite resin to bleached bovine enamel. J Oral Rehabil 2004; 31(12): 1184-1191. [ Links ]
20. Attin T, Muller T, Patyk A, Lennon AM. Influence of different bleaching systems on fracture toughness and hardness of enamel. Oper Dent 2004; 29(2): 188-195. [ Links ]
21. Türkün M, Celik EU, Kaya AD, Arici M. Can the hydrogel form of sodium ascorbate be used to reverse compromised bond strength after bleaching? J Adhes Dent 2009; 11(1): 35-40. [ Links ]
22. Gökçe B, Cömlekoglu ME, Ozpinar B, Türkün M, Kaya AD. Effect of antioxidant treatment on bond strength of a luting resin to bleached enamel. J Dent 2008; 36(10): 780-785. [ Links ]
23. Colombia. Ministerio de Salud. Resolución N.° 8430 de 1993 (4 de octubre). Por la cual se establecen las normas científicas, técnicas y administrativas para la investigación en salud. Título II. De la investigación en seres humanos. Capítulo 1. De los aspectos éticos de la investigación en seres humanos: artículos 5.° al 16. [en línea] [fecha deacceso 15 de octubre de 2011] Disponible en: http://www.dib.unal.edu.co/promocion/etica_res_8430_1993.pdf [ Links ]
24. Bulut H, Turkun M, Demirbas AK. Effect of an antioxidizing agent on the shear bond strength of brackets bonded to bleached human enamel. Am J Orthod Dentofacial Orthop 2006; 129(2): 266-272. [ Links ]
25. Miles PG, Pontier J, Bahiraei D, Close J. The effect of carbamide peroxide bleach on the tensile bond strength of ceramic brackets: an in vitro study. Am J Orthod Dentofacial Orthop 1994; 106(4): 371-375. [ Links ]
26. McGuckin RS, Thurmond BA, Osovitz S. Enamel shear bond strengths after vital bleaching. Am J Dent 1992; 5(4): 216-222. [ Links ]
27. Torneck CD, Titley KC, Smith DO, Adibfar A. Effect of water leaching on the adhesion of composite resin to bleached and unbleached bovine enamel. J Endod 1991; 17(4): 156-160. [ Links ]
28. Miranda AM, Bermejo GN, Bazán JE, Saravia MA. Efectos de un blanqueamiento dental con ozono y otro con peróxido de carbamida al 22% sobre la fuerza de adhesión al esmalte en diferentes intervalos de tiempo. Acta Odontol Venez 47(4): 69-77.
29. Shinohara MS, Peris AR, Pimenta LA, Ambrosano GM. Shear bond strength evaluation of composite resin on enamel and dentin after non vital bleaching. J Esthet Restor Dent 2005; 17(1): 22-29. [ Links ]
30. Sung EC, Chan SM, Mito R, Caputo AA. Effect of carbamide peroxide bleaching on the shear bond strength of composite to dental bonding agent enhanced enamel. J Prosthet Dent 1999; 82(5): 595-599. [ Links ]
31. Chen HP, Chang CH, Liu JK, Chuang SF, Yang JY. Effect of fluoride containing agents on enamel surface properties. J Dent 2008; 36(9): 718-725. [ Links ]
32. Larsen MJ, Fejerkov O. Chemical and structural challenges in remineralization of dental enamel lesions. Eur J Oral Sci 1989; 97(4): 285-296. [ Links ]
33. Basting RT, Rodrigues JA, Serra MC, Pimenta LA. Shear bond strength of enamel treated with seven carbamide peroxide bleaching agents. J Esthet Restor Dent 2004; 16(4): 250-259. [ Links ]
34. Cavalli V, Reis AF, Giannini M, Ambrosano GM. The effect of elapsed time following bleaching on enamel bond strength of resin composite. Oper Dent 2001; 26: 597-602. [ Links ]
35. Nour El-din AK, Miller BH, Griggs JA, Wakefield C. Immediate bonding to bleached enamel. Oper Dent 2006; 31(1): 106-114. [ Links ]
36. Marklund SL. Regulation by citokynes of extracellular superoxide dismutase and other superoxide dismutase isoenzimes in fibroblastes. J Biol Chem 1992; 267(6): 696-701. [ Links ]
37. Sies H, Stahl W, Sundquist AR. Antioxidant functions of vitamins. Vitamin E and C, beta-carotene, and other carotenoids. Ann NY Acad Sci 1992; 669: 7-20. [ Links ]
38. Feiz A, Khoroushi M, Gheisarifar M. Bond strength of composite resin to bleached dentin: effect of using antioxidant versus buffering agent. J Dent 2011; 8(2): 60-66. [ Links ]
39. Lai S, Tay F, Cheung G, Mak Y, Carvalho R, Wei S et al. Reversal of compromised bonding enamel. J Dent Res 2002; 81(7): 477-481. [ Links ]
40. Bowles WH, Burns H Jr. Catalase/peroxidase activity in dental pulp. J Endod 1992; 18(11): 527-534. [ Links ]
41. Gimeno I, Riutord P, Tauler P, Tur JA, Pons A. The whitening effect of enzymatic bleaching on tetracycline. J Dent 2008; 36: 795-800. [ Links ]
42. Masaki H, Okano Y, Sakurai H. Differential role of catalase and glutathione peroxidase in cultured human fibroblasts under exposure of H2O2 or ultraviolet B light. Arch Dermatol Res. 1998; 290(3): 113-118. [ Links ]
43. Spector A, Yang Y, Ho YS, Magnenat JL, Wang RR, Ma W et al. Variation in cellular glutathione peroxidase activity in lens epithelial cells, transgenics and knockouts doesnot significantly change the response to H2O2 stress. Exp Eye Res 1996; 62(5): 521-540. [ Links ]
44. Björkman U, Ekholm R. Hydrogen peroxide degradation and glutathione peroxidase activity in cultures of thyroid cells. Mol Cell Endocrinol 1995; 111(1): 99-107. [ Links ]
45. Rocha C, Fuzuko A, Buhler A. The effects of anti-oxidants agents as neutralizers of bleaching agents on enamel bond strength. Braz J Oral Sci 2006; 5(16): 971-976. [ Links ]
46. Fleschin S, Fleschin M, Nita S, Pavel E, Magearu V. Free radical mediated protein oxidation in Biochemistry. Roun Biotechnol Lett 2000; 5: 479-495. [ Links ]
47. Southorn PA, Powis G. Free radicals in medicine. II. Involvement in human disease. Mayo Clin Proc 1988; 63: 390-408. [ Links ]
48. Southorn PA, Powis G. Free radicals in medicine. I. Chemical nature and biologic reactions. Mayo Clin Proc 1988; 63: 381-389. [ Links ]
49. Tredwin CJ, Naik S, Lewis NJ, Scully C. Hydrogen peroxide tooth-whitening (bleaching) products: review of adverse effects and safety issues. Br Dent J 2006; 200: 371-376. [ Links ]
50. Haywood VB, Leonard RH, Nelson CF, Brunson WD. Effectiveness, side effects and long-term status of night guard vital bleaching. J Am Dent Assoc 1994; 125(9): 1219-1226. [ Links ]
51. Dias AP, Sacono NS, Campos FR, Rosetti FL, Nogueira I, Coldebella CR et al. Cytotoxic effect of a 35% hydrogen peroxide bleaching gel on odontoblast-like MDPC-23 cells. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009; 108: 458-464. [ Links ]
52. Dalh JE, Pallesen U. Tooth bleaching —A critical review of the biological aspects. Crit Rev Oral Biol Med 2003; 14: 292-304. [ Links ]
53. Weitzman SA, Weitberg AB, Stossel TP, Schwartz J, Shklar G. Effects of hydrogen peroxide on oral carcinogenesis in hamsters. J Periodontol 1986; 57: 685-688. [ Links ]
54. Attin T, Kocabiyik M, Buchalla W, Hannig C, Becker K. Susceptibility of enamel surfaces to demineralization after application of fluoridated carbamide peroxide gels. Caries Res 2003; 37: 93-99. [ Links ]
55. Lewinstein I, Hirschfeld Z, Stabholz A, Rotstein I. Effect of hydrogen peroxide and sodium perborate on the micro hardness of human enamel and dentin. J Endod 1994; 20: 61-63. [ Links ]
CORRESPONDENCIA
Paula Alejandra Baldión Elorza
Cra. 30 N.° 45-03
Universidad Nacional de Colombia
Facultad de Odontología
Ciudad Universitaria
Teléfono: 316 50 00, Ext. 16015
Fax: 623 08 59
Bogotá, Colombia
Correo electrónico: pabaldione@unal.edu.co











 text in
text in