Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Odontología Universidad de Antioquia
Print version ISSN 0121-246X
Rev Fac Odontol Univ Antioq vol.25 no.1 Medellín July/Dec. 2013
ARTÍCULOS ORIGINALES DERIVADOS DE INVESTIGACIÓN
INFLUENCIA DEL TIEMPO POSBLANQUEAMIENTO SOBRE LA ADHESIÓN DE UNA RESINA COMPUESTA AL ESMALTE DENTAL1
Paula Alejandra Baldión Elorza2
1 Artículo derivado de trabajo para optar por la categoría de Profesor asociado. Grupo de Investigación en Materiales dentales (GRIMAD). Apoyo institucional de la Facultad de Odontología, Universidad Nacional de Colombia
2Odontóloga, especialista en Rehabilitación Oral, Facultad de Odontología, Universidad Nacional de Colombia. Docente, Departamento de Salud Oral, Facultad de Odontología, Universidad Nacional de Colombia, Sede Bogotá. Correo electrónico: pabaldione@unal.edu.co
RECIBIDO: OCTUBRE 23/2012-ACEPTADO: FEBRERO 5/2013
Baldión PA. Influencia del tiempo posblanqueamiento sobre la adhesión de una resina compuesta al esmalte dental. Rev Fac Odontol Univ Antioq 2013; 25(1): 92-116.
RESUMEN
INTRODUCCIÓN: a pesar de las ventajas estéticas del blanqueamiento dental, se ha demostrado que puede producir alteraciones en la adhesión de las resinas compuestas al esmalte dental, proceso dependiente de la concentración residual de radicales libres de oxígeno en la superficie y subsuperficie del esmalte por la degradación del peróxido de hidrógeno del agente blanqueador. El objetivo del estudio fue evaluar el efecto del peróxido de hidrógeno sobre la resistencia de unión de una resina compuesta al esmalte dental en diferentes intervalos de tiempo posterior al blanqueamiento dental. MÉTODOS: se seleccionaron 90 premolares humanos divididos en 6 grupos: el grupo control al que solo se le hizo técnica adhesiva y 5 grupos de estudio, a los cuales se les aplicó el agente blanqueador para luego hacer la técnica adhesiva a cada grupo en diferentes intervalos de tiempo posterior al blanqueamiento dental (0, 1, 7, 14 y 28 días) para luego determinar la resistencia de unión al corte de la resina adherida al esmalte dental. Los datos fueron analizados mediante la prueba ANOVA con la prueba estadística F y las comparaciones múltiples de Fisher y Duncan, con valores de p < 0,05 como diferencias estadísticamente significativas. RESULTADOS: los valores de adhesión en los grupos con blanqueamiento de los 0 a los 28 días fueron estadísticamente menores al grupo control. CONCLUSIONES: el peróxido de hidrógeno reduce los valores de adhesión al esmalte dental. El tiempo posblanqueamiento es determinante para recuperar la resistencia de unión de la resina compuesta a la estructura dental.
Palabras clave: canales radiculares, transportación, instrumentación rotatoria, CBCT.
INTRODUCCIÓN
En múltiples investigaciones como las de Dishman y colaboradores,1 van der Vyver y colaboradores,2 Homewood y colaboradores3 y Cappeletto y colaboradores4 se han descrito los efectos de los agentes blanqueadores sobre los tejidos dentales y la adhesión de las resinas compuestas posteriores al tratamiento de blanqueamiento dental. Sin embargo, lo que se sabe sobre cómo minimizar o revertir los efectos indeseables aún está en estudio, y en la actualidad es una preocupación importante determinar la mejor manera de hacer un procedimiento clínico estéticamente exitoso y que además, brinde seguridad biológica, disminuyendo los efectos adversos durante y después del tratamiento sobre los tejidos orales y los materiales dentales.5, 6 Por esta razón, se requieren estudios que sustenten alternativas de protocolos clínicos que mejoren el pronóstico de las restauraciones adhesivas posblanqueamiento.
Cobankara y colaboradores,7 y Pinto y colaboradores,8 han reportado alteraciones producidas por la aplicación de agentes blanqueadores sobre la estructura dental como cambios microestructurales y rugosidades del esmalte dental valoradas por microscopía electrónica. Gotz y colaboradores9 demostraron cambios en la composición química del esmalte por pérdida del contenido mineral y alteración en la fluorescencia y deshidratación dental.
Claus10 y Moreira de Freitas y colaboradores11 reportan disminución de la dureza superficial y de la resistencia al desgaste de la estructura del esmalte y la dentina. Estos inconvenientes han sido atribuidos al mecanismo de acción de los agentes blanqueadores, el cual se fundamenta en la degradación del peróxido de hidrógeno; que es una sustancia altamente reactiva e inestable con capacidad de descomponerse lentamente en oxígeno y agua con liberación de calor. La velocidad de descomposición puede aumentar en presencia de catalizadores, desencadenando una reacción redox o de óxido-reducción que consiste en una trasferencia de electrones entre las sustancias reactivas dando lugar a un cambio en los estados de oxidación de estas con respecto a los productos.12
El peróxido de hidrógeno actúa como un agente oxidante que tiende a captar los electrones del medio quedando reducido; mientras que las moléculas de pigmentos de cadenas moleculares largas que se encuentran inmersas en la estructura funcionan como un agente reductor que suministra electrones de su estructura química al medio siendo oxidado, generándose un rompimiento de enlaces simples y dobles de las cadenas conjugadas extensas. Este proceso químico resulta en la conversión de pigmentos oscuros o cromóforos que frecuentemente incluyen heteroátomos, carbonilos y anillos fenílicos,13 a estructuras de cadenas moleculares lineales no saturadas débilmente pigmentadas hasta convertirse en estructuras hidrofílicas no pigmentadas que facilitan el paso de la luz a través de la estructura del esmalte dental hasta llegar al denominado ''punto de saturación'',14 que se define como el fraccionamiento completo de las cadenas lineales de pigmentos.
Las moléculas de oxígeno gaseoso liberadas tienen la capacidad de penetrar a través de la estructura por vías naturales de permeabilidad del esmalte dental como son las vainas de los prismas, la matriz intercristalina, las estrías de Retzius, las lamelas del esmalte y los cuerpos fusiformes o husos adamantinos15 o por zonas porosas creadas por desmineralización asociadas al bajo pH de algunos agentes blanqueadores.16
Los radicales de oxígeno son moléculas muy pequeñas que penetran fácilmente y son altamente reactivas debido a la presencia de una capa de electrones de valencia no apareada, su reactividad depende de las condiciones de la reacción, incluyendo la temperatura, el pH, la luz y la presencia de metales de transición.13 El peróxido de hidrógeno es capaz de producir diferentes tipos de especies reactivas de oxígeno (ROS); bajo condiciones alcalinas, el peróxido de hidrógeno procede vía el anión perhidroxil (HO2-) y bajo condiciones diferentes de pH se forman radicales libres tipo: anión superóxido (O2-) y el anión hidroxilo (OH-),13, 17 que se pueden presentar a partir de la reacción de Fenton, que involucra la presencia de iones y subespecies metálicas o por la reacción de Haber-Weiss a partir de peróxido de hidrógeno y superóxido, generando radicales (OH-).18
El estrés oxidativo se ha definido como el fenómeno por el cual se desencadenan alteraciones significativas en las estructuras, esto es debido a la exposición de tejidos vitales a diversas fuentes que producen una ruptura del equilibrio que debe existir entre la cantidad de especies reactivas de oxígeno y las sustancias o factores prooxidantes y los mecanismos antioxidantes (como la peroxidasa) encargados de eliminar dichas especies químicas. 19 Este mecanismo, en el caso del blanqueamiento dental, no se regula adecuadamente por el incremento exagerado en la producción de especies reactivas del oxígeno a partir de la utilización de peróxidos de carbamida e hidrógeno o de perborato de sodio.20
Mc Guckin y colaboradores20 y Titley y colaboradores21 han reportado que la presencia de peróxido residual u oxígeno liberado por los agentes de blanqueamiento, además de tener un potencial nocivo sobre los tejidos bucales, pueden inhibir el proceso de polimerización de los sistemas adhesivos y las resinas compuestas, por interrupción en la conformación de la red tridimensional de la cadena larga de polímero de las resinas a base de metacrilato, disminuyendo el grado de conversión. Como consecuencia de este fenómeno, se reporta una disminución de la fuerza adhesiva que ha llevado a sugerir por parte de varios autores como van der Vyver y colaboradores,2 Cappeletto y colaboradores,4 Carvalli y colaboradores,22 Rotstein y colaboradores,23 Shinora y colaboradores24 y Sung y colaboradores25 que los procedimientos restaurativos deben postergarse de dos a cuatro semanas después del blanqueamiento dental, ya que la reducción de la resistencia de unión ha demostrado ser transitoria.24
Dishman y colaboradores,1 reportan una disminución en la adhesión al esmalte dental luego de la aplicación de peróxido de hidrógeno al 25%, resultado que atribuyen a una formación inadecuada de las interdigitaciones del adhesivo en la interfase resina-esmalte.
Shinohara y colaboradores24 demostraron que los valores de resistencia de unión al corte posblanqueamiento son dependientes del tiempo, por lo que recomiendan esperar dos semanas después del blanqueamiento dental para poder hacer restauraciones adhesivas satisfactorias en esmalte y dentina; hallazgos similares a los reportados por van der Vyver y colaboradores2 quienes describen el mismo fenómeno de disminución en los valores de fuerza adhesiva cuando se aplicaba peróxido de carbamida y este era activado por luz.
Sung y colaboradores25 concluyeron que la resistencia de unión adhesiva al esmalte dental se disminuía con la aplicación previa de un agente blanqueador a base de peróxido de carbamida al 10%, encontrando una correlación con el tipo de solvente utilizado en la composición de los sistemas adhesivos, reportando mayor afectación de la unión para adhesivos a base de acetona comparado con los adhesivos a base de alcohol.
Adicionalmente, Cadenaro y colaboradores26 afirman que el grado de conversión de los sistemas adhesivos aplicados posblanqueamiento sobre la superficie de dentina es bajo, debido a la inhibición de la polimerización por el oxígeno residual impregnado en la estructura dental y que un tiempo de catorce días o una polimerización prolongada pueden mejorar el grado de conversión de los adhesivos dentinales.
Por otro lado, autores como Ben-Amar y colaboradores, 27 y Josey y colaboradores,28 atribuyen este efecto al cambio en la composición química de la estructura del esmalte posterior al blanqueamiento dental.29
El propósito de este estudio fue evaluar el efecto del blanqueamiento con peróxido de hidrógeno de alta concentración (38%) sobre la resistencia de unión al corte de un sistema adhesivo a base de etanol y de una resina compuesta nanohíbrida al esmalte dental, en diferentes intervalos de tiempo (0, 1, 7, 14 y 28 días) posterior al tratamiento de blanqueamiento dental.
MÉTODOS
Se hizo un estudio de tipo experimental cuantitativo in vitro, para el cual se seleccionaron 90 dientes premolares humanos recientemente extraídos por razones ortodóncicas con un tiempo de almacenamiento máximo posterior a la extracción de tres meses.
Todos los dientes fueron seleccionados según los criterios de inclusión, verificando que tuvieran formación radicular completa y ausencia de: caries o defectos del desarrollo del esmalte, restauraciones previas, líneas de fracturas o fracturas completas del esmalte, dentina expuesta por desgaste o lesiones superficiales. Se tuvieron en cuenta las consideraciones éticas para el estudio según la Declaración de Helsinki30 y la resolución N.° 8430 de 1993 del Ministerio de Salud,31 en donde se clasifica como una investigación con riesgo mínimo, para la cual se diligenció un formato firmado por cada paciente quien dio su consentimiento para la donación de sus dientes para el presente estudio específicamente, que fue aprobado por el Comité de Ética de la Facultad de Odontología de Universidad Nacional de Colombia.
Se hizo una limpieza mecánica de los restos de tejido blando a nivel radicular de cada diente y se fijaron en cloramina al 0,5% por 24 h.32
Posteriormente, se aplicó formaldehído al 2% en el foramen apical con una lima de endodoncia de calibre delgado recubierta con algodón. Se selló el foramen apical con acrílico de autopolimerización y se cubrió la raíz con espaciador de troqueles hasta la línea amelocementaria para disminuir la permeabilidad dentinal.
Las muestras se mantuvieron en agua destilada desionizada en un refrigerador a una temperatura nominal de 4° C, en recipiente con selle hermético que fue reemplazada periódicamente a fin de minimizar el deterioro, hasta 24 h antes de hacer las pruebas, momento en el cual se procedió a colocarlas en agua destilada a 37° C, según las recomendaciones de la Norma Técnica Colombiana 4882.32
Para la aplicación de la prueba de resistencia de unión al corte, y facilitar la colocación de las muestras en la máquina de ensayos universales Shimadzu AG-SI Series (Corporación Shimadzu, Tokio, Japón), se conformaron moldes sostenedores en forma de cubo para embeber en resina acrílica cada diente dejando expuesta la superficie vestibular del esmalte, previa amputación radicular con disco de diamante 2 mm por debajo de la unión amelocementaria.
La superficie del esmalte vestibular expuesta fue desgastada con lija de SiC n.° 1000 para retirar la capa aprismática y mejorar el tipo de acondicionamiento superficial del esmalte y crear una superficie plana para garantizar la aplicación de una fuerza de cizalla pura.32
Los 90 dientes se dividieron aleatoriamente en seis grupos de quince dientes cada uno, a los que se les hizo la técnica adhesiva dependiendo del intervalo de tiempo estimado para cada grupo de la siguiente manera: grupo control adhesión sin blanqueamiento previo; grupo I blanqueamiento y adhesión inmediata; grupo II blanqueamiento y adhesión 1 día después; grupo III blanqueamiento y adhesión siete días después; grupo IV blanqueamiento y adhesión 14 días después; grupo V blanqueamiento y adhesión 28 días después. La aplicación del peróxido de hidrógeno al 38% (Opalescence Xtra Boost®/Ultradent Products, South Jordan, USA) se hizo según las instrucciones del fabricante, haciendo tres aplicaciones consecutivas con un espesor máximo de 0,5 mm, dejándose actuar cada una durante un periodo de 8 min, sin lavar entre aplicación y aplicación.
Luego de terminado el proceso de blanqueamiento se procedió a retirar el agente blanqueador con agua corriente, cepillo manual extra suave33, 34 y crema dental sin flúor (FitoKids®, PF Farmacéutica SA/Tecser Laboratorios Ltda, Bogotá, Colombia).
Los dientes se mantuvieron inmersos en saliva artificial (Salivar®, Laboratorios Farpag, Bogotá, Colombia) a 37° C desde que se inició el procedimiento de blanqueamiento dental hasta el momento del ensayo de resistencia de unión según el intervalo de tiempo asignado a cada grupo de prueba, se hizo recambio de la saliva artificial cada 2 días.35
Para comenzar la técnica adhesiva los dientes fueron limpiados con bicarbonato de sodio y agua. El área en donde se aplicó el adhesivo se delimitó previamente mediante el empleo de un círculo de papel Contact® de 6 mm de diámetro con un agujero en el centro del mismo de 2 mm de diámetro, esto para estandarizar el área de adhesión.
Se aplicó ácido fosfórico al 35% en gel Scotchbond® (3M ESPE, St Paul, Minnesota, USA) como agente grabador durante 15 s, se lavó y se secó con papel absorbente y se aplicaron dos capas consecutivas de sistema adhesivo Single Bond Plus® (3M ESPE, St Paul, Minnesota, USA) con un aplicador tipo cepillo (brush) para facilitar la impregnación, hasta que la superficie quedara brillante, manteniéndolo en posición antes de airear durante 20 s; posteriormente se aireó entre 2 a 5 s y se fotopolimerizó con una lámpara de luz halógena Elipar® 2500 (3M ESPE, St Paul, Minnesota, USA) con una intensidad de 600 mW/cm2 durante 10s a una distancia de 2 mm, siguiendo las instrucciones del fabricante.36
Se introdujo el material restaurador de resina compuesta Filtek Z350 XT® Color A2E (3M ESPE, St Paul, Minnesota, USA) dentro de un tubo de polipropileno de 2,08 mm de diámetro externo y una luz interna de 2 mm de diámetro que correspondía al área adhesiva. Los agregados se hicieron en dos incrementos de 1 mm cada uno, utilizando una espátula de acero inoxidable con recubrimiento de teflón y se asentó sobre la superficie del esmalte preparada evitando burbujas y excesos laterales. Por último, se fotopolimerizó por 40 s por la superficie mesial, distal y vestibular.
Después de hecha la adhesión de la resina, los especímenes fueron inmersos en agua destilada a 37° C por 24 h.
Posteriormente, las muestras fueron llevadas a la máquina universal de ensayos Shimadzu AG-SI Series (Corporación Shimadzu, Tokio, Japón), la cual consta de una lámina de corte, que fue colocada a 0,5 mm de la interfase de unión para aplicar la carga de 50 N a una velocidad de 1 mm/min, y registrar los valores en los que se produjo la falla. Teniendo en cuenta el área de adhesión () en mm2 y la magnitud de la carga registrada en Newtons se calculó el correspondiente esfuerzo en Mpa (N/mm2).
Los datos fueron procesados en el software de operación para la prueba de materiales TRAPEZIUM X (Microsoft Windows®, USA) para ser consignados en una tabla que relacionaba las dos variables del estudio: intervalos de tiempo posblanqueamiento (0, 1, 7, 14 y 28 días) y la fuerza de adhesión al esmalte dental en cada momento de prueba (resistencia de unión al corte en Mpa).
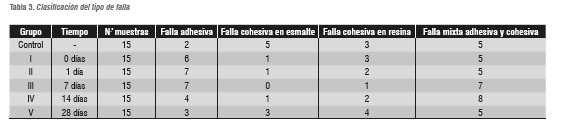
Una vez hecha la fractura de los especímenes, se procedió a determinar el tipo de falla que se presentó en cada una de las muestras, mediante la utilización del estéreomicroscopio Leica Zoom® 2000 (Leica Microsystems, Buffalo NY, USA) a un aumento de 15X.
La evaluación de las fracturas, consistió en clasificar el tipo de falla en: adhesiva (> 75% de falla entre el esmalte y la resina compuesta), cohesiva en esmalte (> 75% de falla en el espesor del esmalte), cohesiva en resina (> 75% de falla en el espesor de la resina compuesta), y mixta (combinación de las anteriores).
Para la prueba de resistencia de unión al corte los datos fueron analizados mediante el test de varianza unidireccional (ANOVA) con la prueba estadística F con el empleo del paquete estadístico Social Sciences Statistical Package SPSS, 15,0 (SPSS Inc., Chicago, IL, USA). Por medio de las comparaciones múltiples de Fisher y Duncan, estas últimas avaladas por la homogeneidad de varianzas con la prueba de Levene, se aplicaron medidas de tendencia central (media y desviación estándar) para resumir la presentación de los datos por grupo. Considerándose valores de p < 0,05 como diferencias estadísticamente significativas entre el grupo control y los grupos tratados con blanqueador en diferentes intervalos de tiempo.
RESULTADOS
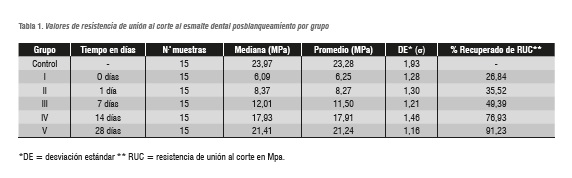
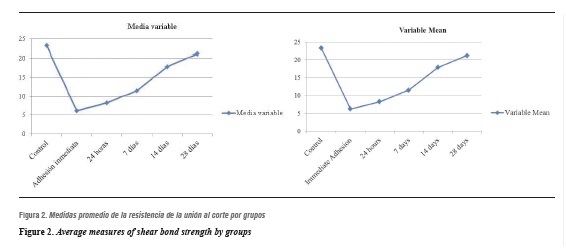
Los valores de resistencia de unión al corte de cada muestra por grupo en los diferentes intervalos de tiempo se observan en la figura 1. La media y el promedio de los valores de resistencia de unión al corte obtenidos en cada grupo se presentan en la tabla 1, y se observa el porcentaje de recuperación de la resistencia de unión a medida que trascurre el tiempo posblanqueamiento.
En la figura 2 se presentan las medias en cada uno de los intervalos de tiempo. Se observa que a medida que pasa el tiempo, la resistencia de unión al corte se recupera. Se establece que en el día 28 el promedio de la resistencia se acerca a la obtenida en el grupo control.
Con respecto a la variabilidad en cada uno de los grupos, el comportamiento de la varianza es homogéneo. Este resultado hace que los grupos sean comparables y que se puedan hacer las pruebas necesarias para saber si existen diferencias estadísticas entre los grupos. La descripción de los datos da como hipótesis que el día 28 se obtiene el mejor promedio entre los grupos de tratamiento y se acerca al promedio del grupo control.
Con un nivel de confianza de 95% con el cual el valor de Α (nivel de significancia) es de 0,05, en la primera prueba se establece si hay diferencia entre el grupo control y los diferentes tiempos de exposición, el resultado es que al menos uno de los grupos es estadísticamente diferente al grupo control (p < 0,001), determinando que hay evidencia estadística para asegurar que existe al menos un tratamiento que es diferente.
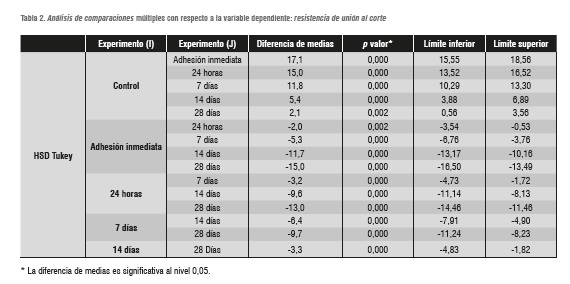
Los valores de resistencia de unión con las diferencias entre cada uno de los grupos con sus respectivos valores p se presentan en la tabla 2. Se rechaza la hipótesis nula de igualdad entre medias de tratamientos. Se encontró una disminución estadísticamente significativa en los valores de resistencia de unión al corte al esmalte dental posblanqueamiento con respecto al grupo control en los grupos I (0 días p = 0,000), II (1 día p = 0,000), y III (7 días p = 0,000), IV (14 días p = 0,000) y V (28 días p = 0,002).
La prueba de Duncan es más fuerte en su composición, por lo cual los resultados confirman que estadísticamente existen diferencias entre todas las medias de los tratamientos. La media del grupo I es estadísticamente menor que la del grupo II, esta es menor que la del grupo III, la del grupo III menor que la media del grupo IV y al igual que la del grupo V y finalmente este último grupo es estadísticamente menor que el control.
El tipo de falla más frecuente fue la mixta adhesiva y cohesiva. En algunas muestras la falla cohesiva se presentó en el esmalte y en otras en la resina o en el espesor de la capa adhesiva. Más específicamente, se observó que las muestras del grupo control la mayoría tuvieron fallas cohesivas en esmalte; entre los 0 y 14 días posblanqueamiento se presentaron la mayoría de fallas adhesivas y aumentó la frecuencia de fallas cohesivas en la resina, a los 28 días se presentaron menor cantidad de fallas cohesivas en la resina y aumentaron las fallas cohesivas en el esmalte asemejándose al comportamiento del grupo control (tabla 3).
DISCUSIÓN
Varias investigaciones como las de Dishman y colaboradores, 1 van der Vyver y colaboradores,2 Homewood y colaboradores3 y Cappeletto y colaboradores4 reportan disminución transitoria de la resistencia de unión de resinas compuestas al esmalte posblanqueamiento,37, 38 es relevante clínicamente tener conocimiento del comportamiento de la adhesión con respecto al tiempo por la necesidad de intervenciones estéticas adhesivas como remplazo de restauraciones preexistentes, modificaciones de contorno y forma, y cementación de carillas indirectas, entre otras.37
Por este motivo, en el presente estudio se pretendió evaluar el efecto de la aplicación de peróxido de hidrógeno al 38% sobre la resistencia de unión al corte de una resina compuesta, haciendo el procedimiento adhesivo en diferentes intervalos de tiempo (0, 1, 7, 14 y 28 días) después de haber culminado el tratamiento de blanqueamiento dental, para poder determinar el lapso de tiempo en el que este procedimiento afecta significativamente la adhesión al esmalte dental y así, poder contrastar los resultados con lo reportado por otros autores. En este estudio se determinó que hay una reducción significativa de la adhesión después de haber aplicado peróxido de hidrógeno al 38%, efecto que es inmediato y puede prolongarse durante los días posteriores al blanqueamiento dental, resultado que concuerda con los hallazgos de Kimyai y colaboradores39 y Shinohara y colaboradores, 24 quienes afirman que la aplicación de agentes blanqueadores en diferentes concentraciones afectan adversamente la unión inmediata de las resinas compuestas.
Sin embargo, autores como Dishman y colaboradores1 y Homewood y colaboradores3 concluyeron que al cabo de 24 horas no se presentaron diferencias estadísticamente significativas en la adhesión posblanqueamiento, pero reportan haber encontrado una disminución en la formación de las interdigitaciones de resina e inhibición de la polimerización de la misma, por contacto con el oxígeno residual; teoría que podría explicar una de las posibles razones por las cuales se puede observar en el presente estudio, alta frecuencia de fallas adhesivas y cohesivas en la resina entre los 0 y 14 días; mientras que en el grupo control se presentaron fallas cohesivas en el esmalte, resultado que demuestra que la resistencia de unión en la interfase adhesiva es mayor que la misma resistencia cohesiva del tejido; comportamiento similar a lo obtenido a los 28 días en el que se presentaron menor cantidad de fallas cohesivas en la resina y aumentaron las fallas cohesivas en el esmalte.
Van der Vyver y colaboradores2 reportan que hay disminución importante de los valores de resistencia de unión, pero solo durante las dos primeras semanas, mientras que bajo las condiciones del presente estudio se determinó que las alteraciones en la resistencia de unión adhesiva pueden prolongarse hasta cuatro semanas después de culminado el blanqueamiento, a las dos semanas solo se logró una recuperación del 76,93% de la resistencia de unión, resultado que puede explicarse por los hallazgos de un estudio anterior29 en el que se determinaron los cambios en la composición química del esmalte luego de la aplicación de peróxido de hidrógeno al 38%, encontrando disminución de calcio del 9,25%; un aumento de peso del oxígeno en 9,43% con respecto al grupo control, y luego de esperar durante dos semanas, solamente se alcanzó a disminuir el porcentaje de oxígeno 2,5%, lo que indica que este tiempo no fue suficiente para que se liberara la totalidad del oxígeno residual de la superficie del esmalte dental.
Según Suelieman y colaboradores40 los radicales libres de oxígeno y el peróxido residual penetran en el esmalte, hasta alcanzar el tejido dentinal e incluso la pulpa dental, lo que dificulta la liberación de oxígeno residual del blanqueador a través del tiempo, a lo que se puede atribuir la disminución en la adhesión por alteración del grado de conversión del sistema adhesivo y de la resina compuesta restauradora.
Titley y colaboradores,41 reportan una formación de zonas porosas de aspecto granular y apariencia de burbuja en la interfase adhesiva atribuidas a la retención de peróxido que reacciona oxidándose en la superficie del esmalte.
Miranda y colaboradores,42 argumentan que la reducción en la resistencia de unión microtensil al utilizar peróxido de carbamida al 22% se puede dar hasta tres semanas después de la aplicación del agente blanqueador por dos razones: la primera, una alteración estructural, asociada a una pérdida y erosión de la capa aprismática del esmalte, además de una reducción en el porcentaje de calcio y fósforo; y la segunda, una de carácter residual, debido a la penetración de radicales de oxígeno en el esmalte, que pueden inhibir la polimerización.43
En este estudio, fue necesario retirar la capa aprismática del esmalte, para obtener una superficie plana, estándar y reproducible para aplicar adecuadamente la fuerza de corte en la prueba de resistencia de unión siguiendo los recomendaciones de la Norma técnica Colombiana 4882.32 Se ha reportado que esta capa está presente en un 70% de los dientes permanentes44 y su espesor varía entre los diferentes tipos de dientes.45 Shi y colaboradores46 la describen como una capa superficial altamente mineralizada comparada con la subsuperficie del esmalte, siendo a su vez más resistente a la desmineralización. De esta manera, la función protectora que puede existir a partir de esta estructura se pierde, por lo tanto, el efecto del agente blanqueador a nivel estructural y químico, se presenta en la zona prismática del esmalte afectando la superficie que va a ser acondicionada, disminuyendo así, la resistencia de unión.28
Josey y colaboradores,28 sugieren que el grabado ácido posblanqueamiento produce una pérdida estructural en los límites de los prismas del esmalte, y que dichos cambios podrían afectar las cualidades de retención de los sistemas adhesivos, por la formación inadecuada de las interdigitaciones de resina. Basados en estas afirmaciones, la disminución en la resistencia de unión en dientes con blanqueamiento previo, se puede atribuir en general a dos posibles factores: la modificación microestructural de la superficie y la difusión de peróxido de hidrógeno residual y de los radicales libres de oxígeno en la estructura dental.
La diferencia en los datos reportados por varios autores incluyendo el presente estudio, con respecto al tiempo en el cual se recupera la resistencia de unión de las resinas compuestas puede deberse a varios factores, entre ellos al tipo de agente blanqueador empleado (peróxido de carbamida, peróxido de hidrógeno, perborato de sodio u ozono), pues cada uno difiere en la cantidad de peróxido que tiene la capacidad de degradarse a oxígeno. El peróxido de carbamida al 10% se descompone en 3% de peróxido de hidrógeno y urea, por lo que la cantidad de moléculas de oxígeno gaseoso liberadas se reduce, a comparación de los peróxidos de alta concentración, a los que se les atribuye en estudios como el de Hegedüs y colaboradores,47 que se incrementa la posibilidad de daño estructural de la superficie y subsuperficie del esmalte dental.
Adicionalmente, Pérez y colaboradores48 afirman que los cambios en la morfología superficial del esmalte están relacionados con el tiempo de exposición y la concentración del agente blanqueador y que un tiempo de exposición mayor a 20 horas produce cambios histológicos en los prismas del esmalte, efecto que puede interferir en el patrón de grabado del esmalte dental.21 También se reportan cambios en el comportamiento de los agentes blanqueadores con respecto a la estructura dental por la adición de otras sustancias como carbopol,49 flúor50, 51 o fosfato de calcio amorfo,52, 53 sustancias que incluidas en el producto o utilizadas previamente o posterior al procedimiento de blanqueamiento dental influyen en los cambios microestructurales y en las propiedades mecánicas del esmalte como la dureza superficial.50, 54
Es importante resaltar que las muestras fueron mantenidas inmersas en saliva artificial hasta el momento de la prueba para simular mejor las condiciones intraorales, aunque autores como Cappeletto y colaboradores4 mencionan que, a pesar de la exposición prolongada in vitro a saliva artificial para revertir los efectos deletéreos del oxígeno residual, no se logra una rápida neutralización del peróxido de hidrógeno. Es posible que los niveles adecuados de adhesión en el esmalte in vivo se alcancen en un menor tiempo que el obtenido en este estudio por la acción remineralizante y antioxidante de los componentes salivares.
Se han sugerido diferentes técnicas a fin de reducir el tiempo de espera para hacer técnicas adhesivas posblanqueamiento, como la remoción de la capa externa superficial del esmalte,55 el uso de agentes antioxidantes enzimáticos como la catalasa56 y la peroxidasa57 y no enzimáticos como el ascorbato de sodio,57, 58 la aplicación de etanol,59 de bicarbonato de sodio y vitamina E,60 procedimientos que se plantean como una alternativa para eliminar las moléculas residuales de la superficie del esmalte y así, recuperar la resistencia de unión de las resinas compuestas adheridas al esmalte dental y prevenir los efectos biológicos adversos.61
En la búsqueda de componentes que actúen disminuyendo los problemas que producen los agentes blanqueadores en el esmalte dental, se ha estudiado el uso de los fluoruros para la estabilización del proceso cíclico de intercambio iónico al cual es sometido el diente. Los átomos de flúor remplazan al ion hidroxilo (OH), formando la flúorapatita, compuesto que ha demostrado tener mayor resistencia a los cambios del pH y por ende a la desmineralización. Türkün y colaboradores59 y Da Costa y colaboradores62 reportan que la aplicación tópica de flúor tiene la capacidad de revertir los efectos adversos de la desmineralización causada por la aplicación de agentes de blanqueamiento como la disminución de la dureza superficial del esmalte dental.
El uso de la crema dental libre de flúor tuvo como objetivo en la metodología aplicar una sustancia que permitiera retirar completamente el peróxido por un efecto mecánico por medio del cepillado, y no el de hacer modificación de la estructura por medio de aplicación de sustancias remineralizantes.
La crema dental utilizada adicionalmente, contiene Lauril sulfato de sodio que es una sustancia limpiadora que ejerce un efecto detergente que tiene la capacidad de penetrar y favorecer la eliminación de las impurezas depositadas a nivel superficial. Sin embargo, autores como Barkvoll63 han descrito que esta sustancia puede reducir el efecto cariostático del fluoruro cuando está presente conjuntamente con monofluorofosfato de sodio durante la aplicación tópica y que puede interactuar en la deposición del fluoruro en el esmalte dental, situación que no es la que se presenta en la composición de la crema dental utilizada en el presente estudio, pero es importante analizar que a pesar de no encontrar reportes en la literatura específicos donde se determine si el Lauril sulfato afecta la deposición de iones calcio y fosfato en la capa superficial de esmalte, puede ser probable que se produzca alguna interacción similar a la ocurrida en la formación de la fluorapatita, inhibiendo la acción protectora remineralizante que se deseaba obtener a partir del uso de saliva artificial como medio de conservación durante la fase experimental, asemejando las condiciones normales de cavidad oral in vivo.
Adicionalmente, la crema dental FitoKids® (PF Farmacéutica SA/Tecser Laboratorios Ltda, Bogotá, Colombia) tiene en su composición extractos de Caléndula officinalis, Salvia officinalis y Cardamomo, plantas a las que se les atribuyen propiedades antioxidantes, estrogénicas y antiinflamatorias.64-67 Su composición se fundamenta en principios activos relacionados con su actividad biológica como los alcaloides, saponinas, flavonoides, taninos, terpenos, cumarinas, entre otros.68
Este amplio espectro de tipos de compuestos químicos, está en concordancia con la diversidad de acciones farmacológicas que presentan estas plantas. Su función antioxidante se fundamenta en el contenido de polifenoles que son fitoquímicos de bajo peso molecular, que conforman moléculas simples como el ácido fenólico y los flavonoides, hasta compuestos altamente estructurados como los taninos. Su actividad antioxidante, proviene de su gran reactividad como donador de electrones y de la capacidad del radical formado para estabilizar el electrón desapareado para interrumpir la reacción en cadena. Los flavonoides tienen una poderosa acción antioxidante in vitro, siendo capaces de actuar sobre un amplio rango de especies reactivas del oxígeno, nitrógeno y cloro, tales como el superóxido, el radical hidroxilo, el radical perhidroxilo, el ácido hipocloroso, actuando como agentes reductores.69, 70
Es importante analizar que según los resultados de resistencia de unión logrados posterior a la limpieza de la superficie posblanqueamiento, se estima que no hubo una influencia positiva de la sustancia como agente antioxidante, lo que puede deberse a la relación entre la concentración del peróxido y la del antioxidante, lo cual está sustentado por Freire y colaboradores,71 quienes reportan que los antioxidantes son útiles en la eliminación de radicales libres de oxígeno de la superficie, pero que debe existir una relación directa entre la concentración del peróxido de hidrógeno y la concentración del antioxidante. Reportan que para eliminar completamente 2 g de peróxido de hidrógeno al 35% se requieren 20 ml de ascorbato de sodio al 25%, como mínimo. Por lo que se considera que una solución de menor concentración no alcanza a ser efectiva para neutralizar los radicales producidos por peróxido de hidrógeno al 38%.
Con relación al tiempo de aplicación de la crema como posible agente antioxidante, Lai y colaboradores72 afirman que el tiempo que se debe dejar actuar el agente antioxidante en la superficie dental es de al menos una tercera parte del tiempo empleado en el procedimiento de blanqueamiento dental, así por ejemplo, si el blanqueamiento dental duró 8 horas el agente antioxidante debe estar en contacto mínimo durante 3 horas.
En el presente estudio no se cumple este parámetro, ya que el agente blanqueador se aplicó según las instrucciones del fabricante durante 24 minutos (3 aplicaciones de 8 minutos cada una y la crema estuvo en contacto con la superficie dental aproximadamente durante 30 segundos. Este tiempo no fue efectivo para lograr recuperación de los valores adhesivos desde los 0 hasta los 28 días posblanqueamiento, demostrándose poca influencia de la sustancia limpiadora.
Como la disminución en la resistencia de unión se ha atribuido a la alteración de la relación de calcio y fosfato de la estructura cristalina,9, 73 a los cambios microestructurales de los cristales de hidroxiapatita, y por ende, al inadecuado patrón de grabado que se pueda producir en el esmalte durante la técnica adhesiva,74, 75 se han utilizado diferentes productos para lograr un efecto de remineralización en la estructura dental que ha sido alterada, mecanismo que ha sido definido por Cochrane NJ,76 como el proceso por el cual los iones se suministran desde una fuente externa al diente para promover la deposición de iones en los cristales en esmalte desmineralizado para producir ganancia de la red mineral, y de esta manera procurar obtener una mejor calidad del tejido frente a la técnica adhesiva.
Para lograr este efecto se han probado diferentes sustancias, entre ellas: el fluoruro de sodio74, 77 y calcio,78 que actúa como un agente remineralizante que inhibe la pérdida mineral y evita la disminución de la microdureza superficial; el fosfato de calcio amorfo en su forma cristalina, el cual ha demostrado tener dificultad para lograr una remineralización del esmalte adecuada por la poca solubilidad de las fases de fosfato de calcio, de tal manera que los iones de calcio y de fosfato no están disponibles para la remineralización;76 de la misma manera ha sido reportado por Da Costa62 y Tschoppe y colaboradores,79 que tanto el nitrato de potasio como el fosfato de calcio amorfo no tienen la capacidad de evitar la disminución de la dureza superficial del esmalte.
También, se ha intentado agregar fosfato tricálcico (TCP) a los productos dentales, del cual se reporta que mejora la microdureza de la superficie del esmalte desmineralizado en comparación con productos con solo fluoruro, posiblemente a través de un efecto abrasivo. Sin embargo, ningún estudio de este material ha sido publicado demostrando su capacidad para remineralizar las lesiones subsuperficiales de esmalte.76
Con respecto al fosfato de calcio amorfo estabilizado con fosfopéptidos de caseína (CPP-ACP), se ha encontrado un aumento de la microdureza pos blanqueamiento para muestras blanqueadas con peróxido de hidrógeno utilizando pasta de CPP-ACP antes y después del blanqueamiento, sugiriendo una deposición de minerales en el esmalte. El sistema CPP-ACP proporciona un depósito superior de calcio biodisponible y iones fosfato en comparación con ACP solo, conduciendo a mayor potencial de remineralización.76
Dado que siguen siendo controversiales los resultados sobre los efectos adversos de los agentes de blanqueamiento sobre la estructura dental y la adhesión posblanqueamiento, se evidencia la necesidad de replantear protocolos clínicos para procurar un mejor manejo de los agentes de blanqueamiento, de las sustancias remineralizantes y del tiempo necesario para lograr neutralización y remineralización de la estructura dental posblanqueamiento.
CONCLUSIONES
- Bajo las condiciones que se desarrollaron en este estudio se concluye que:
- Hay una reducción significativa de la resistencia de unión al corte de una resina compuesta al esmalte dental, luego de la aplicación de peróxido de hidrógeno al 38% hasta los 28 días posblanqueamiento.
- La resistencia de unión obtenida en los diferentes intervalos de tiempo es estadísticamente inferior a la del grupo control, el grupo V de 28 días descriptivamente se parece al grupo control pero sigue siendo estadísticamente inferior por lo cual el tiempo de espera debería ser mayor a los 28 días si se desea recuperar al 100% el valor de resistencia de unión al corte de la resina adherida al esmalte dental posblanqueamiento.
RECOMENDACIONES
Se espera el desarrollo de nuevas investigaciones que incluyan el uso de sustancias antioxidantes de fácil manejo clínico y de bajo costo, para disminuir el tiempo posblanqueamiento necesario para neutralizar el oxígeno residual y poder efectuar restauraciones adheridas al esmalte dental sin esperar un periodo de tiempo prolongado.
CONFLICTO DE INTERÉS
Se declara que no existe ningún conflicto de interés en el presente estudio.
REFERENCIAS
1. Dishman MV, Covey DA, Baughan LW. The effects of peroxide bleaching on composite to enamel bond strength. Dent Mater 1994; 10(1): 33-36. [ Links ]
2. Van der Vyver PJ, Lewis SB, Marais JT. The effect of bleaching agent on composite/enamel bonding. J Dent Assoc S Afr 1997; 52(10): 601-603. [ Links ]
3. Homewood C, Tyas M, Woods. Bonding to previously bleached teeth. Aust Orthod J 2001; 17(1): 27-34. [ Links ]
4. Cappeletto E, Pedroso C, Takeo A, Campos M. Influence of post-bleaching time intervals on dentin bond strength. Braz Oral Res 2004; 18(1): 75-79. [ Links ]
5. Haywood VB, Leonard RH, Nelson CF, Brunson WD. Effectiveness, side effects and long-term status of nightguard vital bleaching. J Am Dent Assoc 1994; 125(9): 1219-1226. [ Links ]
6. Dahl J, Pallesen U. Tooth bleaching a critical review of the biological aspects. Crit Rev Oral Biol Med 2003; 14(4): 292-304. [ Links ]
7. Cobankara FK, Unlun N, Altinoz HC, Fusun O. Effect of home bleaching agents on the roughness and surface morphology of human enamel and dentine. Int Dent J 2004; 54(4): 211-218. [ Links ]
8. Pinto CF, Oliveira R, Cavalli V, Giannini M. Peroxide bleaching agent effects on enamel surface microhardness, roughness and morphology. Braz Oral Res 2004; 18(4): 306-311. [ Links ]
9. Gotz H, Duschner H, White DJ, Klukowska A, Malgorzata A. Effects of elevated hydrogen peroxide 'strip' bleaching on surface and subsurface enamel including subsurface histomorphology, micro-chemical composition and fluorescence changes. J Dent 2007; 35: 457-466. [ Links ]
10. Claus PE. Effects of hydrogen peroxide-containing bleaching agents on the morphology of human enamel. Quintessence Int 1996; 27(1): 53-56. [ Links ]
11. Moreira de Freitas PM, Turssi CP, Hara AT, Serra MC. Dentin microhardness during and after whitening treatments. Quintessence Int 2004; 35(5): 411-417. [ Links ]
12. Romero AD, Bueno GJ. Radicales libres del oxígeno y antioxidantes en medicina. Rev Clin Española 1998; 184(7): 345-346. [ Links ]
13. Joiner E. The bleaching of teeth: A review of the literature. J Dent 2006; 34(7): 412-419. [ Links ]
14. Goldstein RE, Garber DA. Complete dental bleaching. Chicago: Quintessence Publishing; 1995. [ Links ]
15. Domínguez MN, González LS, Menéndez NM. Study of the diffusion ways in the white spot enamel lesion. RCOE 2002; 7(5): 469-476. [ Links ]
16. Price RBT, Sedarous M, Hiltz GS. The pH of tooth-whitening products. J Can Dent Assoc 2000; 66: 421-426. [ Links ]
17. Cheesman KH, Slater TF. Free radicals in medicine. Br Med Bull 1998; 49: 118-121. [ Links ]
18. Floyd RA. The effect of peroxides and free radicals on body tissues. J Am Dent Assoc 1997; 128: 37-44. [ Links ]
19. Venereo JR. Daño oxidativo, radicales libres y antioxidantes. Rev Cub Med Mil 2002; 31(2): 126-133. [ Links ]
20. Mc Guckin RS, Thurmond BA, Osovitz S. Enamel shear bond strengths after vital bleaching. Am J Dent 1992; 5: 216-222. [ Links ]
21. Titley KC, Torneck CD, Smith DC, Chernecky R, Adibfar A. Scanning electron microscopy observation on the penetration and structure of resin ''tags'' in bleached and unbleached bovine enamel. J Endod 1991; 17: 72-75. [ Links ]
22. Carvalli V, Giannini M, Carvalho R. Effect of carbamide peroxide bleaching agents on tensile strength of human enamel. Dent Mater 2004; 20: 733-739. [ Links ]
23. Rotstein I. Role of catalase in the elimination of residual hydrogen peroxide following tooth bleaching. J Endod 1993; 19: 567-569. [ Links ]
24. Shinohara MS, Peris AR, Pimenta LA, Ambrosano GM. Shear bond strength evaluation of composite resin on enamel and dentin after nonvital bleaching. J Esthet Restor Dent 2005; 17(1): 22-29. [ Links ]
25. Sung EC, Chan SM, Mito R, Caputo AA. Effect of carbamide peroxide bleaching on the shear bond strength of composite to dental bonding agent enhanced enamel. J Prosthet Dent 1999; 82(5): 595-599. [ Links ]
26. Cadenaro M, Breschi L, Antoniolli F, Mazzoni A, Di Lenarda R. Influence of whitening on the degree of conversion of dental adhesives on dentin. Eur J Oral Sci. 2006; 114(3): 257-262. [ Links ]
27. Ben-Amar A, Liberman R, Gorfil C, Bernstein Y. Effect of night guard bleaching on enamel surface. Am J Dent 1995; 8: 29-32. [ Links ]
28. Josey AL, Meyers IA, Romaniuk K, Symons AL. The effect of vital bleaching technique on enamel surface morphology and the bonding of composite resin to enamel. J Oral Rehabil 1996; 23: 244-250. [ Links ]
29. Baldión PA, Arcos LC, Mora MA. Efecto de los fluoruros en la composición química del esmalte dental posblanqueamiento. Univ Odontol 2011; 30(65): 41-49. [ Links ]
30. Manzini JL. Declaración de Helsinki: Principios éticos para la investigación médica sobre sujetos humanos. Acta Bioethica 2000; 6(2): 321-334. [ Links ]
31. Colombia Ministerio de Salud. Resolución N.° 8430 de 1993, octubre 4, por la cual se establecen las normas científicas, técnicas y administrativas para la investigación en salud. Título II. De la investigación en seres humanos. Capítulo 1. De los aspectos éticos de la investigación en seres humanos: Artículos 4 al 16. Bogotá: El Ministerio; 1993. [ Links ]
32. Comité Materiales Odontológicos. NTC 4882. Métodos de ensayo para la evaluación de la unión adhesiva entre los materiales odontológicos y la estructura dental. Instituto Colombiano de Normas Técnicas y Certificación, ICONTEC. Sector: 11-Tecnología del cuidado de la salud. Fecha de ratificación: 25/10/2000. Actualización: Ninguna. [ Links ]
33. Tschoppe P, Zandim DL, Martus P, Kielbassa AM. Enamel and dentine remineralization by nano-hydroxyapatite toothpastes. J Den 2011; 39(6): 430-437. [ Links ]
34. Tschoppe P, Meyer-Lueckel H. Effects of regular and highly fluoridated toothpastes in combination with saliva substitutes on artificial enamel caries lesions differing in mineral content. Arch Oral Biol 2012; 57(7): 931-939. [ Links ]
35. Tschoppe P, Kielbassa AM, Meyer-Lueckel H. Evaluation of the remineralising capacities of modified saliva substitutes in vitro. Arch Oral Biol 2009; 54(9): 810-816. [ Links ]
36. 3M ESPE Casa comercial. Perfil técnico del producto: Adpter® Single Bond. Sistema adhesivo dental. [en línea] [fecha de acceso 15 de octubre de 2012 ]; URL disponible en: http://multimedia.3m.com/mws/mediawebserver? UUUUUUC04ehUnx7UGx7UUUPJtEtttttS- [ Links ]
37. Torneck CD, Titley KC, Smith DO, Adibfar A. Effect of water leaching on the adhesion of composite resin to bleached and unbleached enamel. J Endodon 1991; 17: 156-160. [ Links ]
38. Gokce B, Comlekoglu ME, Ozpinar B, Turkun M, Demirbas AK. Effect of antioxidant treatment on bond strength of a luting resin to bleached enamel. J Dent 2008; 36: 780- 785. [ Links ]
39. Kimyai S, Oskoee SS, Rafighi A, Valizadeh H, Ajami AA, Helali ZZ. Comparison of the effect of hydrogel and solution forms of sodium ascorbate on orthodontic bracket- enamel shear bond strength immediately after bleaching: An in vitro study. Indian J Dent Res 2010; 21: 54-58. [ Links ]
40. Suelieman M, Addy M, Macdonald E, Ress J. The leaching depth of a 35% hydrogen peroxide based in-office product: a study in vitro. J Dent 2005; 33: 33-40. [ Links ]
41. Titley KC, Torneck CD, Ruse ND. The effect of carbamide- peroxide gel on the shear bond strength of a microfilm resin to bovine enamel. J Dent Res 1992; 71: 20-24. [ Links ]
42. Miranda AM, Bermejo GN, Bazan JE, Saravia MA. Efectos de un blanqueamiento dental con ozono y otro con peróxido de carbamida al 22% sobre la fuerza de adhesión al esmalte en diferentes intervalos de tiempo. Acta Odontol Venez 2009; 47(4): 69-77. [ Links ]
43. Cavalli V, Reis AF, Giannini M, Ambrosano GM. The effect of elapsed time following bleaching on enamel bond strength of resin composite. Oper Dent 2001; 26: 597-602. [ Links ]
44. Gómez ME, Campos A. Esmalte. En: Histología y embriología bucodental. 2ed. Madrid: Médica Panamericana; 2003. p. 273-316. [ Links ]
45. Whittaker DK. Structural variations in the surface zone of human tooth enamel observed by scanning electron microscopy. Archs Oral Biol 1982; 27(5): 383-392. [ Links ]
46. Shi XC, Ma H, Zhou JL, Li W. The effect of cold-light-activated bleaching treatment on enamel surfaces in vitro. Int J Oral Sci 2012; 4: 208-213. [ Links ]
47. Hegedüs C, Bistey T, Flóra-Nagy E, Keszthelyi G, Jenei A. An atomic force microscopy study on the effect of bleaching agents on enamel surface. J Dent 1999; 27: 509-515. [ Links ]
48. Pérez LF, Díaz AM, Aguirre M, Alcántara CM, Aguilar RE, Acedo JE et al. Efecto del peróxido de carbamida sobre el esmalte dentario a diferentes concentraciones y tiempos de exposición (estudio in vitro). Odontol Sanmarquina 2004; 8(1): 25-29. [ Links ]
49. Rodrígues JA, Oliveira GP, Amaral CM. Effect of thickener agents on dental enamel microhardness submitted to at-home bleaching. Braz Oral Res 2007; 21(2): 170-175. [ Links ]
50. Chen HP, Chang CH, Liu JK, Chuang SF, Yang JY. Effect of fluoride containing bleaching agents on enamel surface properties. J Dent 2008; 36(9): 718-725. [ Links ]
51. Dominguez JA, Bittencourt B, Michel M, Sabino N, Gomes JC, Gomes OM. Ultrastructural evaluation of enamel after dental bleaching associated with fluoride. Microsc Res Tech 2012; 75(8): 1093-1098. [ Links ]
52. Adebayo OA, Burrow MF, Tyas MJ. Effects of conditioners on microshear bond strength to enamel after carbamide peroxide bleaching and/or casein phosphopeptide-amorphous calcium phosphate (CPP-ACP) treatment. J Dent 2007; 35(11): 862-870. [ Links ]
53. Zhao J, Liu Y, Sun WB, Zhang H. Amorphous calcium phosphate and its application in dentistry. Chem Cent J 2011; 5: 40. [ Links ]
54. Goswami M, Saha S, Chaitra TR. Latest developments in non-fluoridated remineralizing technologies. J Indian Soc Pedod Prev Dent 2012, 30(1): 2-6. [ Links ]
55. Cvitko E, Deheny GE, Swift Jr EJ, Pires JA. Bond strength of composite resin to enamel bleached with carbamide peroxide. J Esthet Dent 1991; 3: 100-102. [ Links ]
56. Rotstein I, Dankner E, Goldman A, Heling I, Stabholz A, ZalkindM. Histochemical analysis of dental hard tissues following bleaching. J Endod 1996; 22: 23-26. [ Links ]
57. Baldión PA, Viteri LN, Lozano E. Efecto de la peroxidasa sobre la resistencia de unión de una resina compuesta al esmalte dental posblanqueamiento. Rev Fac Odontol Univ Antioq 2012; 24(1): 8-21. [ Links ]
58. Kaya AD, Türkün M. Reversal of dentin bonding to bleached teeth. Oper Dent 2003; 28(6): 825-829. [ Links ]
59. Türkün M, Kaya AD. Effect of 10% sodium ascorbate on the shear bond strength of composite resin to bleached bovine enamel. J Oral Rehab 2004; 31: 1184-1191. [ Links ]
60. Barghi N, Godwin JM. Reducing the adverse effect of bleaching on composite–enamel bond. J Esthet Dent 1994; 6: 157-161. [ Links ]
61. García EJ, Oldoni TL, Alencar SM, Reis A, Loguercio AD, Grande RH. Antioxidant activity by DPPH assay of potential solutions to be applied on bleached teeth. Braz Dent J 2012; 23: 22-27. [ Links ]
62. Da Costa DB, Mazur RF. Effects of the new formulas of bleaching gel and fluoride application on enamel microhardness: An in vitro study. Oper Dent 2007; 32: 589-594. [ Links ]
63. Barkvoll P. Effect of sodium lauryl sulfate on the uptake of fluoride from NaF and MFP by etched enamel in vitro. J Biol Buccale 1991; 19(3): 235-239. [ Links ]
64. Kennedy DO, Scholey AB. The psychopharmacology of European herbs with cognition-enhancing properties. Curr Pharm Des 2006; 12(35): 4613-4623. [ Links ]
65. Dedio I. Value of Calendula officinalis as a tannin source. Herba Pol 1983; 29(3-4): 211-216. [ Links ]
66. Brasseur T, Abgenot L, Pricemail J, Debev C. Free radical formation inhibiting and antioxidant properties of flavonoids. J Exptl Biol Med 1986; 37: 533-548. [ Links ]
67. Groppo FC, de Cássia BC, Cogo K, Franz-Montan M, Lopes RH, Dias AE. Use of phytotherapy in dentistry. Phytother Res 2008; 22(8): 993-1133. [ Links ]
68. Lu Y, Foo LY. Flavonoid and phenolic glycosides from Salvia officinalis. Phytochemistry 2000; 55(3): 263-267. [ Links ]
69. Halliwell B. Rafter J, Jenner A. Health promotion by flavonoids, tocopherols, tocotrienols, and other phenols: direct or indirect effects? Antioxidant or not? Am J Clin Nutr 2005. 81(suppl): 268-276. [ Links ]
70. Roginsky V. Chain-breaking antioxidant activity of natural polyphenols as determined during the chain oxidation of methyl linoleate in Triton X-100 micelles. Arch Biochem Biophys 2003; 414: 261-270. [ Links ]
71. Freire A, Souza E, Biazzetto D, Ribeiro E, Cynthia C, Marins R et al. Reaction kinetics of sodium ascorbate and dental bleaching gel. J Dent 2009; 37: 932-936. [ Links ]
72. Lai S, Mak Y, Cheung G, Osorio R, Toledano M. Reversal of compromised bonding to oxidized etched dentin. J Dent Res 2001; 80: 1919-1924. [ Links ]
73. Tezel H, Ertas OS, Ozata F, Dalgar H, Korkut ZO. Effect of bleaching agents on calcium loss from the enamel surface. Quintessence Int 2007; 38(4): 339-347. [ Links ]
74. Attin T, Kielbassa AM, Schwanenberg M, Hellwig E. Effect of fluoride treatment on remineralization of bleached enamel. J Oral Rehabil 1997; 24: 282-286. [ Links ]
75. Attin T, Hanning G, Wiegand A, Attin R. Effect of bleaching on restorative materials and restorations. A systematic review. Dent Mater 2004; 20: 852-861. [ Links ]
76. Cochrane NJ, Cai F, Huq NL, Burrow MF, Reynolds EC. New approaches to enhanced remineralization of tooth enamel. J Dent Res 2010; 89: 1187-1197. [ Links ]
77. Lewinstein I. Effect of different peroxide bleaching regimens and subsequent fluoridation on the hardness of human enamel and dentin. J Prosthet Dent 2004; 92: 337-342. [ Links ]
78. Cavalli V, Rodrigues LK, Paes-Leme AF, Brancalion ML, Arruda MA, Berger SB, et al. Effects of bleaching agents containing fluoride and calcium on human enamel. Quintessence Int 2010; 41: 157-165. [ Links ]
79. Tschoppe P, Neumann K, Mueller J, Kielbassa AM. Effect of fluoridate bleaching gels on the remineralization of predemineralized bovine enamel in vitro. J Dent 2009: 37(2): 156-162. [ Links ]











 text in
text in