Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Odontología Universidad de Antioquia
Print version ISSN 0121-246X
Rev Fac Odontol Univ Antioq vol.26 no.2 Medellín Jan./June 2015
ARTÍCULOS ORIGINALES DERIVADOS DE INVESTIGACIÓN
ADHESIÓN CONVENCIONAL EN DENTINA, DIFICULTADES Y AVANCES EN LA TÉCNICA1
Gisela Ramos Sánchez2; Norberto Calvo Ramírez3; Ricardo Fierro Medina4
1 Este trabajo es requisito para optar por un título profesional, por tanto no obedece a ninguna relación comercial. Universidad Nacional de Colombia. Investigación financiada por el Grupo de Investigación en Materiales Dentales (GRIMAD), de la Universidad Nacional de Colombia
2 MSc en Odontología, Universidad Nacional de Colombia. Correo electrónico: gisers@hotmail.com
3 Especialista Rehabilitador Oral, Docente Universidad Nacional de Colombia
4 PhD. Docente Departamento de Química. Laboratorio de Compuestos Organometálicos. Universidad Nacional de Colombia
RECIBIDO: OCTUBRE 22/2013-ACEPTADO: JULIO 22/2014
Ramos G, Calvo N, Fierro R. Adhesión convencional en dentina, dificultades y avances en la técnica. Rev Fac Odontol Univ Antioq 2015; 26(2): 468-486.
RESUMEN.
INTRODUCCIÓN:estudios respecto a la adhesión en dentina han reportado que, contrario a la estabilidad lograda sobre esmalte dental, en dentina los mecanismos adhesivos todavía son sensibles, impredecibles e inestables. El objetivo de este trabajo es revisar la literatura actual sobre la adhesión en dentina, con el fin de caracterizar la adhesión convencional describiendo las modificaciones actuales del protocolo convencional, encaminadas a mejorar el desempeño adhesivo de los materiales dentales.MÉTODOS: se hizo una revisión de la literatura evaluando 3 bases de datos: ScienceDirect, Springer y Medline, de las cuales se escogieron los 52 artículos más relevantes, publicados entre los años 2004 y 2013. Se usaron, como criterios de búsqueda, las palabras clave: dentin, dentin bonding, bond strength y acid etching.
RESULTADOS: al revisar los artículos seleccionados, se logró una descripción del protocolo de adhesión convencional que muestra la formación del barrillo dentinario (smear layer), la acción del ácido fosfórico y la formación de la interfase adhesiva pzropiamente dicha, junto con las dificultades propias de la técnica y las posibles soluciones planteadas hasta la fecha.
CONCLUSIONES: la adhesión convencional sobre dentina es un procedimiento estricto y delicado, que evidencia inconvenientes como la degradación hidrolítica y proteolítica de la matriz de colágeno por parte de enzimas liberadas en el momento de la desmineralización, lo que deteriora la interfase adhesiva. Por tanto, se han sugerido sustancias que pueden ser utilizadas como agentes de protección del colágeno, sin alterar e incluso mejorando la resistencia adhesiva.
Palabras clave: adhesivos, resinas compuestas, recubrimientos dentinarios, cementos dentales, ácido fosfórico.
INTRODUCCIÓN
La odontología restauradora moderna ha evidenciado un rápido progreso en la tecnología de los adhesivos dentales en los últimos 50 años,1 logrando devolver forma y color de los dientes naturales, conservando la estructura dental a través del concepto de la odontología mínimamente invasiva. Sin embargo, la duración clínica de las resinas compuestas sigue siendo hoy en día muy corta, debido a una incompleta hibridización en la interfase adhesiva que origina una zona de colágeno expuesto y desprotegido.2 Por tanto, la técnica de adhesión convencional en dentina se considera inestable, ya que la composición heterogénea del tejido no permite que la unión adhesiva sea ideal y, por el contrario, puede afectarse con la degradación hidrolítica de los monómeros hidrofílicos3 presentes en los sistemas adhesivos, y por la acción de las metaloproteinasas que degradan las fibras colágenas expuestas. Como consecuencia, hay pérdida en la retención de las restauraciones adhesivas, aumento de la microfiltración bacteriana, caries secundaria y alteraciones pulpares irreversibles.4 Por lo anterior, es necesario caracterizar y evaluar la dentina, el protocolo de adhesión convencional y los avances actuales de la técnica, de manera que este conocimiento sea usado como base de futuras investigaciones que busquen mejorar el desempeño de los materiales adhesivos.
CARACTERÍSTICAS DEL TEJIDO DENTINAL
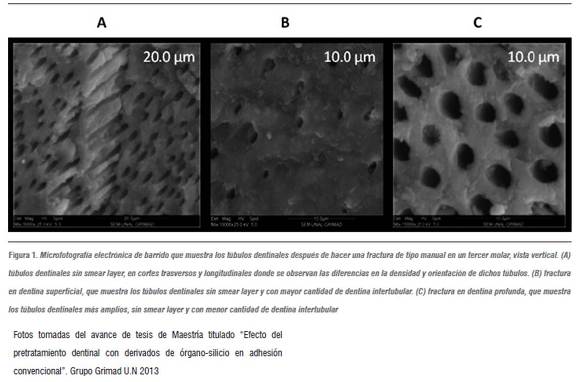
La dentina se compone de un mineral de fosfato de calcio identificado como dahllita,5 que se dispone en pequeños cristales de hidroxiapatita carbonatada con dimensiones de 36 nm x 25 nm x 4 nm, y por una fase orgánica cuyo principal componente es el colágeno tipo l en un 90%, que se orienta en forma de malla. Igualmente, en su estructura tiene pequeñas cantidades de otros tipos de colágeno (IV, V y VI) y otros componentes como proteínas no colágenas fosforiladas y no fosforiladas, además de proteoglicanos, mucopolisacáridos y lípidos.2 Ivancik y colaboradores6 y Shrivastava y colaboradores7 describen cómo las características estructurales de la dentina, como lo son los túbulos dentinales, dependen geométricamente de la ubicación dentro del diente y de la distancia desde el tejido pulpar hasta el esmalte dental. En general, los túbulos presentan un diámetro que va desde 1 a 2,5 µm y una densidad de 10.000 a 60.000 por mm-2 y cada túbulo está rodeado por dentina peritubular, con un espesor de 0,5 a 1 µm y la región entre los túbulos es considerada como dentina intertubular (figura 1) , cuya constitución principal es una malla de colágeno fibrilar que se apoya en los cristales de apatita.6, 8 Por tanto, la dentina es un tejido altamente permeable, con túbulos que además se acompañan de microporos y microgrietas que pueden nacer desde la superficie del esmalte.
La respuesta a los estímulos mecánicos y químicos del ambiente es dada por la dentina según sus características sensoriales y mecánicas como el módulo elástico fundamentalmente. Estas características anatómicas son las que determinan las condiciones de permeabilidad, humedad y propiedades físicas como la fuerza y la elasticidad.9, 10
IMPLICACIÓN DEL BARRILLO DENTINARIO EN EL PROCESO ADHESIVO
Siempre que el tejido dentinal es manipulado de manera manual o con instrumentos rotatorios, se crea sobre la superficie una capa de detritus o desechos llamada capa de barrillo dentinario (smear layer).11 Esta capa es considerada como un impedimento en odontología adhesiva, ya que en un adecuado protocolo de adhesión convencional se logra, con el ácido fosfórico, retirar de la superficie este barrillo dentinario.
Como lo indican los estudios de Eldarrata y colaboradores, 12 el espesor aproximado de dicha capa de barrillo dentinario es de 0,5 µm, que además se forma con componentes orgánicos en el diente, como hidroxiapatita, saliva, sangre y bacterias. El barrillo se compone de dos capas de carácter amorfo, una superficial y otra profunda, esta última puede extenderse hasta 110 µm dentro de los túbulos dentinales y se denomina (smear plug).12 Esta capa de barrillo sella la interfase adhesiva y no contribuye al acoplamiento entre el adhesivo y la dentina.
Dos grupos de autores reportan que la manipulación del tejido dentinal11, 13 puede realizarse con lijas, fresas y discos de corte, lo que hace que varíe el espesor, la rugosidad, la densidad y el grado de adhesión a la estructura dentinal de la capa de barrillo de acuerdo al tipo de instrumentación.14 Por lo tanto, el espesor de dicha capa oscila entre 0,5 y 2 µm.15 De este modo, el barrillo dentinario formado por el papel de lija deja túbulos dentinarios más abiertos que los dejados por las fresas dentales, sin olvidar que los diferentes tipos de fresas, de acuerdo con el tamaño del grano, brindan características
cualitativas y cuantitativas diferentes (figura 2). El barrillo dentinal en la literatura ha sido motivo de controversia, ya que se presentan autores como Phasley y colaboradores,2 quienes promueven la eliminación de dicha capa para facilitar la impregnación de los adhesivos en los túbulos dentinales y en el colágeno desmineralizado, principio básico de la adhesión convencional.2 Y autores como Van Meerbeeky y colaboradores,16 que, por el contrario, presentan la conservación de la capa de barrillo dentinario con ánimo de disminuir el número de pasos clínicos y la incidencia de la sensibilidad posoperatoria.
ACCIÓN DEL ÁCIDO FOSFÓRICO SOBRE EL TEJIDO DENTINAL
A pesar de la complejidad en la estructura orgánica e inorgánica de la dentina, esta puede ser modificada con el uso de agentes ácidos pre-acondicionadores,17 capaces de generar porosidades variables que pueden alterar las características físicas y morfológicas de los túbulos dentinales. El pretratamiento dentinal con ácido fosfórico, está diseñado para retirar la capa de barrillo dentinario y generar una rugosidad en la superficie a través de la desmineralización, que permite mejorar la adhesión de las resinas poliméricas al sustrato dental.17, 18
Así, pues, el ácido fosfórico tiene la capacidad de incrementar la permeabilidad dentina lintertubular e intratubular, como lo describen autores como Brajdiey colaboradores18 y Shellis y colaboradores,19 disolviendo la fase inorgánica de la dentina en un rango de 3-7 µm. Esta permeabilidad, contrario al efecto deseado, se asocia con los procesos de hipersensibilidad posoperatoria generada cuando la dentina recibe estímulos mecánicos o térmicos, como consecuencia de dicho ensanchamiento de los túbulos después del grabado ácido. Es decir, la técnica de grabado ácido, además de buscar generar rugosidad en la superficie dentinal para disminuir el ángulo de contacto de los materiales adhesivos con la superficie dentinal obteniendo mayor humectación y adherencia, 20 puede generar efectos secundarios no deseados.
Del mismo modo, el ácido fosfórico, al aumentar el tamaño de los túbulos dentinales, hace que se presente una fuga del fluido dentinal gracias a la presión hidrostática, que además puede debilitar la interacción del enlace químico entre los monómeros y la dentina.21 Actualmente, se ha reportado que antes de desmineralizar la dentina con ácido fosfórico, esta se compone de 50% de elementos minerales, 30% de colágeno y 20% de agua.2 Al desmineralizar, el 50% de la interfase mineralizada se solubiliza y pasa a componerse de 70% de nuevo contenido de agua y 30% de fibras colágenas ancladas en la base mineralizada de la dentina.2 Lo ideal sería que ese 70% fuera ocupado por monómeros que polimericen in situ, para producir un biocompuesto reforzado con fibras colágenas. Sin embargo, de manera contradictoria, la presencia de solventes residuales y el movimiento del fluido dentro de los túbulos dentinales hacen que la sustitución del 70% del porcentaje de agua por monómeros no ocurra de manera ideal.2
ESTABILIDAD ADHESIVA EN LA CAPA HÍBRIDA
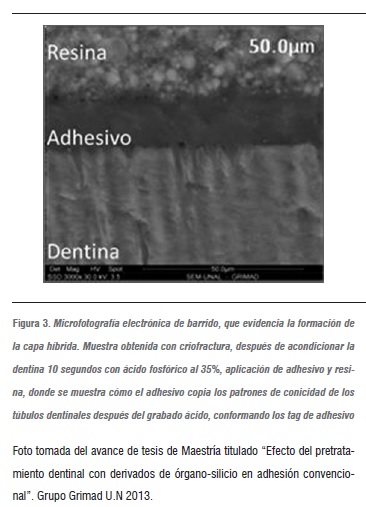
Actualmente, se acepta que la base de la adhesión a la dentina está constituida por una estructura llamada capa híbrida (figura 3), que tiene un espesor entre 3 a 6 µm, una zona intermedia entre la dentina y la restauración constituida por fibras colágenas y adhesivo, que se forma como resultado de la infiltración de este último en estado fluido entre las fibras colágenas, ya que la fase mineral ha sido disuelta por el ácido fosfórico.2, 15 Con base en numerosas investigaciones morfológicas, los estudios manifiestan que la unión adhesiva depende de varios factores, dentro de los cuales tenemos: la humedad y profundidad del sustrato dentinal, la penetración del adhesivo a través de los túbulos y el entrecruzamiento de los mismos con las fibras colágenas expuestas en la dentina intertubular desmineralizada y los componentes del adhesivo.22
Del mismo modo, gracias a las características anatómicas del tejido dentinal, la capa híbrida es diferente en dentina superficial y en dentina profunda. La primera se compone, en su mayor parte, por dentina intertubular desmineralizada, y en menor grado por los tag de resina que penetran con mayor dificultad en forma de embudo dentro de los túbulos dentinales más estrechos.23 Por el contrario, en la dentina profunda hay menor cantidad de dentina intertubular desmineralizada, pero los túbulos son más grandes y más numerosos, por esta razón los tag de resina representan una fracción importante de unión de las superficies cercanas a la pulpa. Por tanto, algunos autores aseveran que la penetración e imprimación del adhesivo en la dentina acondicionada, crea un enlace con el colágeno, generando una retención química y una retención micromecánica con la formación de los tag24 que contribuyen, en un 30%, a la fuerza total de la unión adhesiva.
Entre los adhesivos convencionales, se encuentran los sistemas adhesivos de tres pasos, que incluyen 3 recipientes que contienen el desmineralizante, el primer y el bonding. Y los adhesivos de dos pasos, que incluyen dos recipientes, uno con el desmineralizante y uno que contiene el primer con el bonding en una sola mezcla.25 Actualmente, los adhesivos convencionales de 2 pasos son los más usados, porque simplifican el número de pasos clínicos, pero la evidencia nos muestra que con el tiempo, estos muestran alteraciones en la fuerza adhesiva, probablemente debido a que en un solo frasco están presentes los componentes hidrófilos de la imprimación y los hidrófobos del adhesivo, es decir, que pueden contener hasta 50% de disolventes en su composición, aumentando el potencial para absorber agua de la dentina subyacente y de la cavidad oral, haciendo que la capa de adhesivo sea menos estable.26 Conjuntamente, cuanto mayor es el contenido de disolvente dentro de la solución de adhesivo antes de la fotopolimerización, menor es el grado de conversión y, por ende, desfavorecen las propiedades mecánicas de dicho adhesivo.23
En esta misma línea, los autores describen que, contrario a la uniformidad esperada, los constituyentes del adhesivo se distribuyen en el colágeno expuesto de manera diferente. Los monómeros hidrofílicos como el 2-hidroxietil metacrilato (HEMA), se limitan a la mitad inferior, cerca de la dentina, siendo el más sometido a tensión durante la función masticatoria que puede producir fallas por fatiga de las fibras de colágeno y los monómeros hidrófobos como el bisfenol glicidilmetacrilato (BIS-GMA), se restringen a quedar en la mitad superior de la capa híbrida cerca a la resina. De este modo, la problemática más significativa de la interfase adhesiva se presenta en que, aún después de la polimerización,el grupo éster del HEMA es el más vulnerable a la disociación hidrolítica formando ácido metacrílico y etilen-glicol, en presencia de agua a pH básico y a pH ácido.2 Adicionalmente, una vez desmineralizada la dentina, la difusión de los monómeros adhesivos no se presenta en la totalidad del colágeno expuesto,27 resultando en una zona en la parte inferior de la capa híbrida en donde las fibras colágenas están en riesgo de degradación e hidrólisis enzimática.28
Autores como Hashimoto y colaboradores29 y Carrilho y colaboradores,30 reportaron, en sus estudios, que en esta zona se encuentran libres las enzimas de la matriz dentinal llamadas metaloproteinasas, proteasas endógenas presentes en la dentina desde el desarrollo, que quedan expuestas al desmineralizar la dentina, por lo que se puede pensar que la prevención de la degradación enzimática del colágeno es una estrategia potencial para mejorar la unión adhesiva.29, 30 Existen varios tipos de metaloproteinasas (MMP), colagenasas (MMP-8), gelatinasas (MMP-2) y enamelinas (MMP-20), que son las responsables de la pérdida del colágeno y, por ende, de la continuidad de la capa híbrida, lo cual genera una disminución de la retención del material polimérico a la dentina.31 De esta forma, las fibrillas de colágeno se degradan en la capa híbrida y, como consecuencia directa, se pierde la interfase adhesiva con la dentina, lo que lleva a pensar que por la estabilidad de la adhesión sobre esmalte, el sellado de la resina en la periferia de las restauraciones sería el que más contribuye a la durabilidad de la adhesión, lo cual no es suficiente para soportar las fuerzas de flexión y compresión que generan una tensión cíclica durante la función masticatoria.
Por lo anterior, estudios recientes en el área de adhesión dentinal tienen como objetivo evidenciar la manera de inhibir el efecto de dichas metaloproteinas. De esta manera se han probado diferentes sustancias, una de ellas es la clorhexidina, de la cual los autores reportan que es un potente inhibidor de las metaloproteinasas a concentraciones muy bajas.32, 33 Una concentración de 0,2% de digluconato de clorhexidina es capaz de inhibir 99% de la actividad colagenolítica de las metaloproteinasas in vitro. Este proceso está en investigación, ya que todavía no se conoce el mecanismo de dicha inhibición.34
De esta forma, no solo la clorhexidina ha sido una sustancia usada como pretratamiento dentinal para mejorar el desempeño de la interfase adhesiva, sino que también se ha usado el hipoclorito de sodio (NaOCl) como un agente de desnaturalización y desproteinización, capaz de eliminar el colágeno, obedeciendo a la idea planteada en la cual la eliminación de la malla de colágeno puede aumentar la estabilidad de los sistemas adhesivos.35 De esta manera, se plantea crear una capa de dentina con características similares a las del esmalte grabado, es decir, una mayor presencia de cristales de hidroxiapatita con alta energía superficial.36 Los resultados obedecen a que una dentina desproteinizada tiene mayor dureza, mayor capacidad de humectación y mayor permeabilidad que la dentina desmineralizada; sin embargo, a pesar de las aparentes ventajas, falta información de cómo podría afectar el hipoclorito a las fibras colágenas residuales, los efectos de biocompatibilidad pulpar y los efectos de interacción con las resinas adhesivas.
De manera contradictoria, el hipoclorito, según lo manifiestan Zhang y colaboradores37 y Pascon y colaboradores, 38 crea porosidades submicrométricas dentro de la fase mineral, y aumenta el tamaño de los túbulos, debido a una pérdida de dentina peritubular e intertubular, generando una ampliación y coalescencia de los túbulos dentinarios, al ser utilizado como irrigante en los canales radiculares. El hipoclorito elimina tanto materia orgánica como iones de magnesio y carbonato, que afectan las propiedades mecánicas de la dentina y la capacidad de sellado de los materiales dentales. De igual manera, Kaya y colaboradores39 y Prasansuttiporn y colaboradores, 40 reportaron que la alteración que genera el hipoclorito en la dentina es proporcional a la concentración. La erosión causada a una concentración del 1,3% de NaOCl es menor a la causada a una concentración de 5,25% de NaOCl.39 Incluso si el hipoclorito es mezclado con soluciones como el ácido etilen diaminotetraacético (EDTA), dicha erosión en dentina se potencializa de manera proporcional a la concentración y al tiempo de exposición, disminuyendo progresivamente la fuerza de adhesión y las propiedades mecánicas.
Recientemente se ha evidenciado que el hipoclorito de sodio (NaOCl) reduce la resistencia de unión entre los compuestos de resina y la dentina, debido a que restos y subproductos generados del hipoclorito tienen un efecto negativo sobre la polimerización de los sistemas adhesivos.40 Por tanto, la investigación ha intentado usar agentes antioxidantes como el ácido ascórbico, soluciones con capacidad antioxidante e inhibidora de las MMP, que mejorarían la capacidad adhesiva de la dentina tratada.
Entre dichas sustancias usadas como pre-tratamientos dentinales, el ácido etilendiaminotetraacético (EDTA) es un ligando polivalente, que actúa como agente quelante atrapando el ión Zn+2, que las metaloproteinasas necesitan para mantener su actividad de hidrolasa catalítica, y de igual manera el ión Ca+2, le permite a dichas enzimas mantener su estructura terciaria.2, 40 El acondicionamiento dentinal con el EDTA 0,5 M por 1 o 2 minutos en etanol, crea una capa híbrida más delgada, donde los monómeros hidrófobos se infiltrarían completamente sin dejar espacios libres de adhesivo, como ocurre al usar el ácido fosfórico, lo cual mejoraría la adherencia y la fuerza microtensil.41 Además, puede inactivar las metaloproteinasas igual que otros quelantes, como la 1,10-Fenantrolina y el ácido etilendiaminotetrafosfórico, los cuales podrían resultar en una mejor conservación a largo plazo de la capa híbrida en dentina sana y dentina afectada por caries.
Entre las sustancias propuestas para la inhibición de las metaloproteinasas, encontramos los llamados agentes de entrecruzamiento de proteínas, de modo que las metaloproteinasas endógenas se ligan a sus cadenas de péptidos inmediatamente después del grabado ácido, perdiendo movilidad molecular esencial para la actividad enzimática.2 Guentsch y colaboradores42 e Ishihata y colaboradores,43 destacan el glutaraldehído como un agente de entrecruzamiento muy eficaz, cuyo efecto negativo es la citotoxicidad para la pulpa dental y el potencial cancerígeno.42 El glutaraldheído en solución acuosa de 5 y 35% de 2-hidroxietil metacrilato (HEMA), ha sido utilizado en el manejo de la hipersensibilidad dentinaria,43 mostrando la coagulación de las proteínas plasmáticas y, por lo tanto, el bloqueo tubular después de la aplicación tópica en dentina hipersensible.
Los autores describen nuevos agentes de entrecruzamiento menos tóxicos con el tejido, las llamadas proantocianidinas y las carbodiimidas.44 Las proantocianidinas (PA) son compuestos vegetales flavonoides antioxidantes que se encuentran en una amplia variedad de frutas, verduras, flores, nueces, semillas y cortezas. Su gran ventaja es que promueven la salud de los tejidos y se ha demostrado que aumentan la fuerza de unión entre la resina y la dentina.45 La desventaja que presentan es que su tiempo de acción está entre 10 y 30 min y, por tanto, no sería relevante a nivel clínico.
Hasta el momento, se está probando la acción de estas sustancias en función del tiempo, logrando intervalos más cortos con el uso de la carbodiimida. Las proantocianidinas pueden extraerse de la semilla de la uva. Este extracto puede promover la formación de hueso en los cóndilos mandibulares de las ratas, aumenta la rigidez de la dentina desmineralizada, inhibe la progresión de la caries en raíces artificiales e inhibe la producción de metaloproteinasas.46 Sus efectos son similares a los extractos de arándano y de la corteza del árbol del olmo. Las investigaciones con las proantocianidinas son muy recientes, pero se ha logrado una inhibición de la degradación del colágeno en la interfase adhesiva y una mejora en la resistencia a la tracción y la rigidez.
Recientes estudios reportan un tratamiento previo en dentina desmineralizada con proantocianidinas durante 1 hora, antes de aplicar el protocolo adhesivo, con excelentes resultados, incluso en dentina afectada por caries. 47 Debido a los tiempos tan prolongados para su uso, se ha propuesto manejar las proantocianidinas directamente en los sistemas adhesivos, donde han mostrado buenos resultados en la disminución de la nanofiltración sin afectar la fuerza de adhesión.48, 49 De esta manera se plantea un concepto nuevo para las investigaciones, la biomodificación de la dentina que busca mejorar las propiedades biomecánicas y bioquímicas de la matriz orgánica, a través de enlaces covalentes y no covalentes dentro del colágeno, capaces de formar enlaces cruzados intra- e inter moleculares, gracias a la hidroxilación de la lisina y al índice de rotación molecular, que brindarán finalmente mayor estabilidad al colágeno.45
Tezvergily y colaboradores50 y Kimay y colaboradores,51 destacaron el uso del ácido polivinilfosfórico (PVPA), una sustancia con actividad anticolagenolítica que se une electrostáticamente al colágeno de la dentina, y puede ser atrapado en matrices por agentes de enlace cruzado a través de la 1-etil-3-(3-dimetilaminopropil) carbodiimida y en un tiempo de 1-5 minutos, lo cual minimiza la pérdida del colágeno por competencia iónica. El PVPA también se ha utilizado en modelos de mineralización biomimética, de manera que, unido a las fibras de colágeno, puede guiar la distribución de los cristales de apatita, gracias a que imita las cargas negativas de las fosfoproteínas como la sialoproteína ósea y la fosfoserina.
Recientemente se presenta la riboflavina como un agente de entrecruzamiento de colágeno tipo I, capaz de aumentar la estabilidad de las fibras colágenas, e incrementar las propiedades mecánicas y disminuir la degradación enzimática, proporcionando mayor eficiencia a la dentina desmineralizada.52 La riboflavina ha demostrado el aumento en la resistencia biomecánica de la córnea humana en el tratamiento del queratocono, es por esto que se evidencia la acción de la riboflavina como agente de entrecruzamiento en la dentina humana desmineralizada. La riboflavina produce radicales libres al ser foto activada con longitudes de onda de 270, 366 y 445 nm,53 de manera que se liberan especies reactivas de oxígeno y la luz es absorbida, formando enlaces cruzados covalentes entre moléculas adyacentes de colágeno. De esta forma, el efecto de la activación por rayos UVA (Radiación ultravioleta de onda larga) de la riboflavina aumenta la resistencia de la unión inmediata a la dentina, estabilizando la interface adhesiva e inhibiendo las metaloproteinasas.47
De esta manera, las investigaciones actuales buscan unir los monómeros constituyentes de las resinas adhesivas con sustancias capaces de formar enlaces cruzados anti- metaloproteinasas, que se unan directamente con el colágeno de la dentina y formen una capa híbrida con mayor potencial de duración.50
DISCUSIÓN
Esta revisión de la literatura coloca de manifiesto que el protocolo convencional actual empleado en el proceso de adhesión sobre el tejido dentinal, presenta fallas relacionadas con la duración y la estabilidad de dicha unión, que hasta el momento sigue siendo sensible e impredecible adhesiva según lo publicado por Pashley en 2011.2, 50 A través dela experiencia, se ha evidenciado que las restauraciones en resina necesitan ser reemplazadas, en promedio, cada 5,7 años, debido a la pérdida de la interfase adhesiva, lo que lleva a que se presenten fracturas y caries secundaria por microfiltración bacteriana.4 Es decir, existe una necesidad de buscar métodos que permitan aumentar la longevidad de las restauraciones resinosas.
Además, los autores muestran las dificultades relacionadas con las características propias del sustrato dentinal, debido a su constitución de tipo heterogénea y a su comportamiento fisiológicamente dinámico, que puede tener variaciones bajo distintas situaciones clínicas normales y patológicas.2
El fluido dentinal y la formación de la capa de barrillo (smearlayers) en la superficie del sustrato dentinal, que además puede proyectarse a nivel intratubular al ser instrumentado, son variables determinantes en el momento de realizar un protocolo adhesivo. En la adhesión convencional dicho sustrato es acondicionado con el uso de ácido fosfórico al 37%, generando una desmineralización que hace una ampliación de los túbulos dentinales y expone la matriz colágena de la dentina, creando una superficie dispuesta y disponible para la humectación del adhesivo.17, 18 El uso del acondicionador ácido y la subsecuente exposición de la trama de colágeno al eliminar el calcio, son considerados como el punto más álgido de la adhesión al sustrato dentinal, ya que a partir de este proceso se presentan la mayor parte de los errores clínicos y problemas de la técnica propiamente dicha.
Por tanto, la literatura describe que la desmineralización que genera el ácido fosfórico es capaz de alterar los minerales de fósforo y calcio de la dentina, más profundamente de lo que es capaz de penetrar el sistema adhesivo, formando una zona de colágeno expuesto susceptible al daño mecánico y a la degradación hidrolítica. 29, 30 De esta forma, una de las bases de la investigación actual se enfoca en inhibir la actividad de las endopeptidasas dependientes de zinc, también llamadas metaloproteinasas, con ayuda de sustancias usadas como pretratamientos dentinales, antes de aplicar el adhesivo en el protocolo convencional.
Hasta el momento, han sido probadas sustancias como el hipoclorito de sodio, el EDTA y el glutaraldehído, sustancias que no han mostrado avances como pretratamiento dentinal por sus efectos bioquímicos secundarios o colaterales, que finalmente disminuyen la biocompatibilidad. 37, 41, 43 Por el contrario, algunos autores refieren que actualmente sustancias como la clorhexidina y sustancias antioxidantes más compatibles con el tejido pulpar como las proantocianidinas y las carbodiimidas, tejidos vegetales flavonoides de origen natural derivados de verduras y frutas, son capaces de inhibir la degradación del colágeno y mejorar la resistencia a la tracción y la rigidez.44, 47
Igualmente, se exalta el efecto del ácido polivinilfosfórico usado en modelos de mineralización biomimética, y de la riboflavina, capaz de aumentar la resistencia de la unión inmediata a la dentina.50 Los resultados del uso de estas últimas sustancias, hasta el momento, han sido positivos y satisfactorios, pero aún faltan estudios a nivel de biocompatibilidad que aclaren el mecanismo de acción de estos tipos de pretratamiento dentinal sobre el tejido pulpar, y estudios mecánicos de termociclado o envejecimiento de la interfase adhesiva que permitan ver el comportamiento de dichas sustancias a largo plazo.
Del mismo modo, los esfuerzos a los que la dentina es sometida durante la masticación, la deglución y demás hábitos parafuncionales, también desafían la durabilidad de la interfase adhesiva, ya que un colágeno dañado mecánicamente es más susceptible a la proteólisis. Es por esto que la durabilidad de esta debe ser evaluada también a través de una carga mecánica, de manera que sea posible hacer un paralelo entre los cambios bioquímicos y biomecánicos.
CONCLUSIONES
La dentina es un compuesto biológico poroso, formado por apatita sostenida sobre una matriz de colágeno, que por sus características estructurales tiene propiedades que dependen de la situación anatómica de los túbulos dentinales, el fluido pulpar y la profundidad del tejido. Por tanto, el protocolo de adhesión convencional sobre dentina es un procedimiento estricto y delicado, que ha evidenciado inconvenientes relacionados con la degradación hidrolítica y proteolítica del colágeno por parte de enzimas presentes en la dentina, que son liberadas en el momento de la desmineralización y que deterioran la interfase adhesiva. De esta manera, las investigaciones actuales buscan sustancias que puedan ser utilizadas como agentes de protección del colágeno, logrando mayor durabilidad de las restauraciones adhesivas en dentina, sin alterar e incluso mejorando las propiedades mecánicas, objetivo que ha tenido hasta el momento resultados prometedores.
AGRADECIMIENTOS
Este estudio fue apoyado por la Universidad Nacional de Colombia, Facultad de Odontología, Sede Bogotá; hecho durante el periodo de estudios para optar por el título de Magister en Odontología línea de Materiales Dentales. Dirigido por el doctor Ricardo Fierro Medina y el doctor Norberto Calvo Ramírez, apoyado por la doctora Clementina Infante Contreras, Coordinadora del programa de Maestría.
CONFLICTO DE INTERESES
Ninguno de los autores ha declarado conflicto de interés alguno.
REFERENCIAS
1. Van Meerbeek B, Peumans M, Poitevin A, Mine A, Van Ende A, Neves A et al. Review relationship between bondstrength tests and clinical outcomes. Dent Mater 2010; 26: e100-121. [ Links ]
2. Pashley DH, Tayb FR, Breschic L, Tjäderhanee L, Carvalhof RM, Carrilhog M et al. State of the art etch-andrinse adhesives. Dent Mater 2011; 27: 1-16. [ Links ]
3. Van Landuyt KL, Snauwaert J, De Munck J, Peumans M, Yoshida Y, Poitevin A et al. Systematic review of the chemical composition of contemporary dental adhesives. Biomaterials 2007; 28: 3757-3785. [ Links ]
4. Sulkala M, Tervahartiala T, Sorsa T, Larmas M, Salo T, Tjäderhane L. Matrix metalloproteinase-8 (MMP-8) is the major collagenase in human dentin. Arch Oral Biol 2007; 52: 121-127. [ Links ]
5. Zaslansky P, Zabler S, Fratzl P. 3D variations in human crown dentin tubule orientation: A phase-contrast microtomography study. Dent Mater 2010; 26: e1-10. [ Links ]
6. Ivancik J, Majd H, Bajaj D, Romberg E, Arola D. Contributions of aging to the fatigue crack growth resistance of human dentin. Acta Biomater 2012; 8: 2737- 2746. [ Links ]
7. Shrivastava S, Aifantis Katerina E. Effects of cola drinks on the morphology and elastic modulus of dentin. Mater Lett 2011; 65: 2254-2256. [ Links ]
8. Elbaum R, Tal E, Perets AI, Oron D, Ziskind D, Silberberg Y et al. Dentin micro-architecture using harmonic generation microscopy. J Dent 2007; 35: 150-155. [ Links ]
9. Arola D, Reprogel RK. Tubule orientation and the fatigue strength of human dentin. Biomaterials 2006; 27: 2131- 2140. [ Links ]
10. Zaslansky P. Dentin. En: Fratzl P. Collagen: structure and mechanics. New York: Springer; 2008. [ Links ]
11. Sattabanasuk V, Vachiramon V, Qian F, Armstrong SR. Resin-dentin bond strength as related to different surface preparation methods. J Dent 2007; 35: 467-475. [ Links ]
12. Eldarrata AH, High AS, Kale GM. In vitro analysis of 'smear layer' on human dentine using ac-impedance spectroscopy. J Dent 2004; 32: 547-554. [ Links ]
13. Nakajima M, Kunawarote S, Prasansuttiporn T, Tagami J. Bonding to caries-affected dentin. Jpn Dent Sci Rev 2011; 47: 102-114. [ Links ]
14. Oliveiraa SS, Pugach MK, Hiltonb JF, Watanabe LG, Marshall SJ, Marshall GW Jr. The in?uence of the dentin smear layer on adhesion: a self-etching primer vs. a totaletch system. Dent Mater 2003; 19: 758-767. [ Links ]
15. Spencer P, Ye Q, Park J, Topp EM, Misra A, Marangos O et al. Adhesive/Dentin Interface: The Weak Link in the composite restoration. Ann Biomed Eng 2010; 38: 1989- 2003. [ Links ]
16. Van Meerbeek B, Yoshihara K, Yoshida Y, Mine A, De Munck J, Van Landuyt KL. State of the art of self-etch adhesives. Dent Mater 2011; 27: 17-28. [ Links ]
17. Farge P, Alderete L, Ramos SM. Dentin wetting by three adhesive systems: Influence of etching time, temperature and relative humidity. J Dent 2010; 38: 698-706. [ Links ]
18. Brajdic D, Krznaric O M, Azinovic Z, Macan D, Baranovic M. Influence of different etching times on dentin surface morphology. Coll Antropol 2008; 32: 893-900. [ Links ]
19. Shellis RP, Curtis AR. A minimally destructive technique for removing the smear layer from dentine surfaces. J Dent 2010; 38: 941-944. [ Links ]
20. Ramos SM, Alderete L, Farge P. Dentinal tubules driven wetting of dentin: Cassie-Baxter modelling. Eur Phys J E 2009; 30: 187-195. [ Links ]
21. Miyazaki M, Tsubota K, Takamizawa T, Kurokawa H, Rikuta A, Ando S. Factors affecting the in vitro performance of dentin-bonding systems. Jpn Dent Sci Rev 2012; 48: 53-60. [ Links ]
22. Wang Y, Yao X. Morphological/chemical imaging of demineralized dentin layer in its natural, wet state. Dent Mater 2010; 26: 433-442. [ Links ]
23. Fawzy AS. Variations in collagen fibrils network structure and surface dehydration of acid demineralized intertubular dentin: effect of dentin depth and air-exposure time. Dent Mater 2010; 26: 35-43. [ Links ]
24. Langer A, Llie N. Dentin infiltration ability of different classes of adhesive systems. Clin Oral Invest 2012; 17: 205-216. [ Links ]
25. Reis A, de Carvalho Cardoso P, Vieira LC, Baratieri LN, Grand RH, Loguercio AD. Effect of prolonged application times on the durability of resin-dentin bonds. Dent Mater 2008; 24: 639-644. [ Links ]
26. Proença JP, Polido M, Osorio E, Erhardt MC, Aguilera FS, García-Godoy F et al. Dentin regional bond strength of self-etch and total-etch adhesive systems. Dent Mater 2007; 23: 1542-1548. [ Links ]
27. Erhardt MC, Osorio R, Toledano M. Dentin treatment with MMPs inhibitors does not alter bond strengths to cariesaffected dentin. J Dent 2008; 36: 1068-1073. [ Links ]
28. Fang M, Liu R, Xiao Y, Li F, Wang D, Hou R et al. Biomodification to dentin by a natural crosslinker improved the resin-dentin bonds. J Dent 2012; 40: 458- 466. [ Links ]
29. Hashimoto M, Nagano F, Endo K, Ohno H. A review: biodegradation of resin-dentin bonds. Jpn Dent Sci Rev 2011; 47: 5-12. [ Links ]
30. Carrilho MR, Carvalho RM, Sousae EN, Nicolau J, Breschi L, Mazzoni A et al. Substantivity of chlorhexidine to human dentin. Dent Mater 2010; 26: 779-785. [ Links ]
31. Wang DY, Zhang L, Fan J, Li F, Ma KQ, Wang P et al. Matrix metalloproteinases in human sclerotic dentine of attrited molars. Arch Oral Biol 2012; 57: 1307-1312. [ Links ]
32. Kim J, Uchiyama T, Carrilho M, Agee KA, Mazzoni A, Breschi L et al. Chlorhexidine binding to mineralized versus demineralized dentin powder. Dent Mater 2010; 26: 771-778. [ Links ]
33. Perdigão J. Dentin bonding -variables related to the clinical situation and the substrate treatment. Dent Mater 2010; 26: e24-37. [ Links ]
34. Zhou J, Tan J, Chen L, Li D, Tan Y. The incorporation of chlorhexidine in a two-step self-etching adhesive preserves dentin bond in vitro. J Dent 2009; 37: 807-812. [ Links ]
35. Hegde M, Bhide S. Nanoleakage phenomenon on deproteinized human dentin -an in vitro study. Indian J Dent 2012; 3(1): 5-9. [ Links ]
36. Correr GM, Alonso RC, Grando MF, Borges AF, Puppin- Rontani RM. Effect of sodium hypochlorite on primary dentin -A scanning electron microscopy (SEM) evaluation. J Dent 2006; 34: 454-459. [ Links ]
37. Zhang K, Tay FR, Kim YK, Mitchell JK, Kim JR, Carrilho M et al. The effect of initial irrigation with two different sodium hypochlorite concentrations on the erosion of instrumented radicular dentin. Dent Mater 2010; 26: 514-523. [ Links ]
38. Pascon FM, Kantovitz KR, Sacramento PA, Nobre-dos-Santos M, Puppin-Rontani RM. Effect of sodium hypochlorite on dentine mechanical properties. A review. J Dent 2009; 37: 903-908. [ Links ]
39. Kaya S, Yigit-Özer S, Adigüzel Ö. Evaluation of radicular dentin erosion and smear layer removal capacity of selfadjusting file using different concentrations of sodium hypochlorite as an initial irrigant. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2011; 112(4): 524-530. [ Links ]
40. Prasansuttiporn T, Nakajima M, Kunawarote S, Foxton RM, Tagami J. Effect of reducing agents on bond strength to NaOCl-treated dentin. Dent Mater 2011; 27: 229-234. [ Links ]
41. Sauro S, Toledano M, Aguilera FS, Mannocci F, Pashley DH, Tay FR et al. Resin-dentin bonds to EDTAtreated vs. acid-etched dentin using ethanol wet-bonding. Dent Mater 2010; 26: 368-379. [ Links ]
42. Guentsch A, Seidler K, Nietzsche S, Hefti AF, Preshaw PM, Watts DC et al. Biomimetic mineralization: Long-term observations in patients with dentin sensitivity. Dent Mater 2012; 28: 457-464. [ Links ]
43. Ishihata H, Kanehira M, Finger Werner J, Shimauchi H, Komatsu M. Effects of applying glutaraldehyde-containing desensitizer formulations on reducing dentin permeability. J Dent Sci 2012; 7: 105-110. [ Links ]
44. Green B, Yao X, Ganguly A, Xu C, Dusevich V, Walker MP et al. Grape seed proanthocyanidins increase collagen biodegradation resistance in the dentin/adhesive interface when included in an adhesive. J Dent 2010; 38: 908-915. [ Links ]
45. Xie Q, Bedran-Russo AK, Wu CD. In vitro remineralization effects of grape seed extract on artificial root caries. J Dent 2008; 36: 900-906. [ Links ]
46. Bedran-Russo AK, Castellan CS, Shinohara MS, Hassan L, Antunes A. Characterization of biomodi?ed dentin matrices for potential preventive and reparative therapies. ActaBiomater 2011; 7: 1735-1741. [ Links ]
47. Epasinghe DJ, Yiu CK, Burrow MF, Tay FR, King NM. Effect of proanthocyanidin incorporation into dental adhesive resin on resin-dentine bond strength. J Dent 2012; 40: 173-180. [ Links ]
48. Liu Y, Wang Y. Effect of proanthocyanidins and photoinitiators on photo-polymerization of a dental adhesive. J Dent 2013; 41: 71-79. [ Links ]
49. Castellan CS, Pereira PN, Grande RH, Bedran-Russo AK. Mechanical characterization of proanthocyanidin-dentin matrix interaction. Dent Mater 2010; 26: 968-973. [ Links ]
50. Tezvergil-Mutluay A, Agee KA, Hoshika T, Tay FR, Pashley DH. The inhibitory effect of polyvinylphosphonic acid on functional matrix metalloproteinase activities in human demineralized dentin. Acta Biomater 2010; 6: 4136-4142. [ Links ]
51. Kim YK, Gu LS, Bryan TE, Kim JR, Chen L, Liu Y et al. Mineralisation of reconstituted collagen using polyvinylphosphonic acid/polyacrylic acid templating matrix protein analogues in the presence of calcium, phosphate and hydroxyl ions. Biomaterials 2010; 31: 6618-6627. [ Links ]
52. Fawzy AS, Nitisusanta LI, Iqbal K, Daood U, Beng LT, Neo J. Chitosan/Riboflavin-modified demineralized dentin as a potential substrate for bonding. J Mech Behav Biomed Mater 2013; 17: 278-289. [ Links ]
53. Fawzya AS, Nitisusanta LI, Iqbal K, Daood U, Neo J. Riboflavin as a dentin crosslinking agent: Ultraviolet A versus blue light. Dent Mater 2012; 28: 1284-1291. [ Links ]











 text in
text in