Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Odontología Universidad de Antioquia
Print version ISSN 0121-246X
Rev Fac Odontol Univ Antioq vol.28 no.2 Medellín Jan./June 2017
https://doi.org/10.17533/udea.rfo.v28n2a1
Articles
ELEVACIÓN DEL PISO DEL SENO MAXILAR USANDO HUESO HOMÓLOGO LIOFILIZADO Y HUESO AUTÓLOGO DE TIBIA: REPORTE DE RESULTADOS RADIOGRÁFICOS E HISTOLÓGICOS1
2 DMD, Oral and Maxillofacial Surgeon, Specialist in Basic Biomedical Sciences, Professor at the School of Dentistry, Universidad de Antioquia, Medellín, Colombia
3 DMD, Oral and Maxillofacial Surgeon, School of Dentistry, Universidad de Antioquia, Medellín, Colombia.
4 DMD, Specialist in Comprehensive Dentistry of the Adult with emphasis in Prosthodontics, School of Dentistry, Universidad de Antioquia, Medellín, Colombia.
Introducción:
los injertos de hueso autólogo para elevación del piso del seno maxilar son ampliamente aceptados para la reconstrucción de defectos en el reborde alveolar; sin embargo, existen sitios donantes que no han sido debidamente explorados y que pueden representar opciones válidas para este tipo de procedimientos. El objetivo de este estudio consistió en evaluar el comportamiento de los injertos autólogos de tibia, comparados con injertos homólogos de hueso liofilizado en la elevación de seno maxilar.
Métodos:
estudio prospectivo, controlado, aleatorio, que incluyó a 11 pacientes que requerían elevación del seno maxilar. Se tomaron radiografías panorámicas en tres momentos (prequirúrgico, posquirúrgico inmediato y posquirúrgico a 6 meses) en los dos grupos (tibia y liofilizado). En estas se midió la altura del reborde alveolar en el maxilar posterior. Se tomaron biopsias de hueso en la zona injertada 6 meses después del procedimiento.
Resultados:
Se encontró una disminución significativa de la altura ósea en el grupo injertado con hueso liofilizado. El grupo injertado con hueso autólogo de tibia presentó mayor estabilidad entre el periodo de la cirugía y 6 meses después. En los cortes histológicos se evidenció igualdad de condiciones entre ambos grupos.
Conclusión:
el hueso de tibia muestra mayor estabilidad en el periodo investigado, en términos de altura obtenida en procedimientos de elevación de piso del seno maxilar, con características clínicas e histológicas adecuadas para la colocación de implantes. Este estudio debe complementarse con una muestra mayor para aportar resultados más representativos aplicables a la población.
Palabras clave: elevación de seno maxilar; biomateriales; hueso autólogo; hueso liofilizado; injerto de tibia
Introduction:
autologous bone grafts for maxillary sinus floor lifting are widely accepted to reconstruct alveolar ridge defects; however, there are donor sites that have not been fully explored and can be valid alternatives for this type of procedures. The objective of this study was to evaluate the behavior of tibia autologous grafts compared with freeze-dried homologous bone in maxillary sinus floor lifting.
Methods:
prospective, controlled, randomized study in 11 patients requiring maxillary sinus elevation. Panoramic radiographs were taken in three different moments (pre-surgery, immediately after surgery, and 6 months post-surgery) in the two groups (tibia and freeze-dried), measuring the alveolar ridge height in the posterior maxilla. Bone biopsies were taken in the grafted area 6 months after the procedure.
Results:
A significant reduction in bone height was found in the group grafted with freeze-dried bone. The group grafted with tibia autologous bone showed greater stability between baseline and 6 months after surgery. The histological sections showed equal conditions between the two groups.
Conclusion:
tibia bone shows greater stability in the evaluated period in terms of the height obtained in maxillary sinus floor lifting procedures, with clinical and histological characteristics suitable for the placement of implants. This study should be complemented with a larger sample to provide more representative results that can be applied to the general population.
Key words: maxillary sinus lifting; biomaterials; autologous bone; freeze-dried bone; tibia graft
INTRODUCCIÓN
Los implantes son parte imprescindible en el campo de la odontología rehabilitadora actual, puesto que, gracias a su demostrada tasa de éxito,1,2,3,4,5 han reemplazado en gran medida a los tratamientos tradicionales; sin embargo, para que sean exitosos, necesitan cumplir unas condiciones mínimas, dentro de las cuales la más importante es la presencia de un hueso alveolar residual con altura y espesor adecuado. Por tal razón, al tiempo que se ha expandido la práctica de la oseointegración, se han desarrollado nuevos tratamientos complementarios para facilitar el cumplimiento de dicha condición.6,7,8,9,10,11
En el sector posterior del maxilar deben superarse dos problemas claves: la neumatización del seno maxilar y la reabsorción del hueso alveolar después de la extracción.7,12 Estos dos fenómenos combinados hacen que el hueso disponible disminuya en forma rápida e irreversible.
La técnica de elevación de seno maxilar fue diseñada para mejorar esta condición por medio del ascenso del piso, aumentando la altura y la cantidad de hueso disponible, posibilitando así el uso de implantes para la restauración implanto-soportada de esta región,11,13 lo cual ha demostrado resultados satisfactorios desde su publicación hace casi dos décadas.13,14,15 No obstante, la literatura no es concluyente sobre el tipo de material ideal para utilizar como injerto. Los estudios han reportado el uso de diversos materiales, dentro de los cuales podemos citar el hueso autólogo,11,15,16,17,18,19 el hueso homólogo,20,21,22,23,24 los xenoinjertos14,15,19,25 y los materiales aloplásticos.1,14,25,26 Dentro de estas opciones, el hueso autólogo es el que presenta las condiciones más cercanas a las ideales,2,27,28,29 pero debido a la desventaja de un segundo sitio quirúrgico donante y a la morbilidad que esto acarrea, se hizo necesaria la exploración de las otras opciones.
A pesar de los avances logrados en la búsqueda de nuevos materiales, los estudios con huesos diferentes al autólogo, no han logrado superar las ventajas de este último, por lo que se hace necesario estudiar todos los posibles sitios donantes, buscando la obtención de un hueso autólogo con las mejores características biomecánicas posibles y con el mínimo de riesgos o secuelas posquirúrgicas.30,31,32
Con respecto a los sitios extraorales para la obtención de hueso, el injerto de tibia presenta varias ventajas frente al de cresta ilíaca, que es actualmente el más estudiado; dentro de dichas ventajas podemos destacar un menor tiempo de recuperación y un postoperatorio menos traumático y manejable para el paciente. Además, ofrece la posibilidad de realizarse bajo anestesia local, sin disminuir la cantidad o la calidad de hueso disponible.32,33,34
En nuestro medio, el uso del hueso de tibia no ha sido documentado. Se requieren estudios que demuestren que su utilización puede brindar condiciones de regeneración ósea óptima, con un postoperatorio manejable para el paciente en términos de dolor e incapacidad.
El objetivo de esta investigación es comparar el comportamiento radiográfico e histológico de hueso autólogo extraído de tibia y de hueso homólogo liofilizado desmineralizado en la elevación de seno maxilar, evaluándolo de dos formas: a) radiográficamente, midiendo la altura ósea obtenida con ambas técnicas antes de la cirugía, inmediatamente después, y a los seis meses posteriores a la cirugía, y b) histológicamente, con muestras de hueso obtenidas al momento de la inserción del implante seis meses después del acto quirúrgico.
MATERIALES Y MÉTODOS
Para el desarrollo del proyecto se contó con la aprobación del Centro de Investigaciones y el Comité de Ética de la Facultad de Odontología de la Universidad de Antioquia. El estudio cumple con las recomendaciones para investigación biomédica de la Declaración de Helsinki, de la Asociación Médica Mundial de 1964 y de las Normas Científico-Técnicas y Administrativas para la Investigación en Salud, Resolución N.° 008430 de 1993, emanada del Ministerio de Salud, en su título, II, capítulo 1, sobre los aspectos éticos de la investigación en humanos, artículos 5, 8 y 11.
Entre junio de 2007 y diciembre de 2009 fueron intervenidos quirúrgicamente, en forma aleatoria, 16 pacientes para realizar elevación del seno maxilar antes de la colocación de implantes en la zona maxilar posterior. En 13 pacientes se hizo el procedimiento en uno de los lados del maxilar y en 3 se hizo en ambos lados, para un total de 19 senos maxilares intervenidos. Todos los pacientes tenían diagnóstico de pérdida dental con atrofia de reborde alveolar asociada a neumatización del seno maxilar. Se incluyeron casos con altura del reborde alveolar remanente en sectores posterosuperiores por debajo de 6 mm, sin un criterio excluyente de altura alveolar mínima. Fueron excluidos de la muestra los pacientes fumadores, con antecedentes de patología sinusal, con enfermedades sistémicas que pudiesen comprometer el proceso de cicatrización o con ruptura severa no tratable de la membrana sinusal durante el procedimiento quirúrgico inicial. De los 16 pacientes, 11 eran mujeres y 5 hombres. El promedio de edad fue 53 años, con un rango entre los 23 y los 66 años (Tabla 1). En 10 senos maxilares se hizo el procedimiento usando hueso homólogo liofilizado como material de injerto (Banco de huesos y tejidos, Fundación Cosme y Damián. Bogotá, Colombia) (Grupo 1), en los 9 casos restantes se utilizó hueso autólogo extraído de tibia proximal como injerto (Grupo 2). Todos los pacientes fueron operados por el mismo cirujano (JDM) utilizando la técnica descrita por Boyne y James (citado por Mish et al).8 Se realizaron controles radiográficos en tres momentos, por medio de radiografía panorámica, utilizando el equipo de la Facultad de Odontología de la Universidad de Antioquia (Orthopantomograf OP100 de la casa Instrumentarium Imaging). El primer control se llevó a cabo antes de la cirugía (R1), el segundo se hizo en la primera semana después de la cirugía de elevación del piso del seno (R2) y el tercero se realizó entre 6 y 8 meses después (R3). Todos los pacientes se evaluaron en los primeros dos momentos, pero al final, en el tercer momento, 8 de ellos (4 de cada grupo, todos ellos casos de elevación unilateral) no continuaron con la investigación (a 6 no fue posible contactarlos y 2 se retiraron en forma voluntaria), de modo que, al final de la investigación, el número de senos evaluados se redujo a 11 (5 pacientes con elevación unilateral y 3 en forma bilateral).
Tabla 1 Evaluación histológica. Las muestras de 1 a 6 pertenecen al grupo 1, y de 7 a 11 pertenecen al grupo 2. Los signos + y - significan presencia y ausencia de cada uno de los ítems seleccionados
| Muestra | A | B | C | D | E | F | G | H |
|---|---|---|---|---|---|---|---|---|
| 1 | + | - | + | + | + | + | - | - |
| 2 | + | + | + | + | + | + | + | - |
| 3 | + | + | + | + | - | - | - | - |
| 4 | - | - | - | - | + | - | - | + |
| 5 | + | + | + | - | + | + | - | + |
| 6 | + | - | + | + | + | - | - | - |
| 7 | + | - | + | + | + | - | - | - |
| 8 | + | - | + | - | + | - | - | - |
| 9 | + | - | + | + | + | + | + | + |
| 10 | + | - | - | + | - | + | - | - |
| 11 | - | - | + | - | + | - | - | - |
| Grupo 1 | 83.3% | 50% | 83.3% | 66.6% | 83.3% | 50% | 16.6% | 33.3% |
| Grupo 2 | 80% | 0 | 80% | 60% | 80% | 40% | 20% | 20% |
A: Material eosinófilo amorfo. B: Hueso injertado remanente unido al hueso. C: Hueso propio maduro vital. D: Tejido de granulación. E: Tejido conectivo. F: Vasos sanguíneos. G: Osteoblastos. H: Tejido osteoide. Se calculó el porcentaje de muestras en las que se presentó cada tipo de tejido y se reporta en la parte inferior de la tabla
Evaluación radiográfica
Se utilizó radiografía panorámica por su amplia disponibilidad y bajo costo; además, en una investigación previa de uno de los autores,35 se demuestra que esta es lo suficientemente sensible y específica para ser utilizada como herramienta diagnóstica en la valoración de patología sinusal, con un nivel de confianza del 95%, en comparación con una tomografía computarizada.
El análisis radiográfico fue realizado por dos evaluadores en dos momentos distintos, logrando resultados iguales dada la simplicidad de la medición.
Para realizar el análisis cuantitativo de la zona de interés se digitalizaron todas las imágenes utilizando el programa AxioVision versión 3.1. La altura de hueso e injerto fue medida y ajustada de acuerdo a la magnificación, usando un factor de conversión de 25%. Las medidas iniciales se expresaron en pixeles y posteriormente fueron convertidas a milímetros, usando como referencia una regla milimetrada que fue digitalizada con cada radiografía. Se tomaron las medidas desde el punto de mayor altura de reborde alveolar en la región donde se planeaba colocar los implantes en la siguiente fase, hasta el punto donde se evidencia el cambio en radioopacidad en sentido apical dentro del seno maxilar (Figuras 1, 2 y 3).
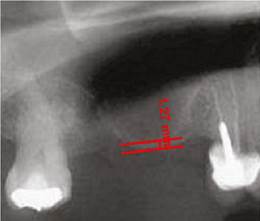
Figura 1 Altura residual del reborde alveolar en zona maxilar posterior antes del procedimiento de elevación de piso del seno maxilar
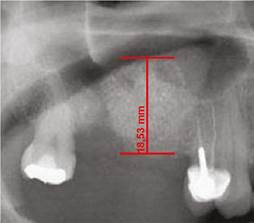
Figura 2 Altura del reborde alveolar inmediatamente después del procedimiento quirúrgico del mismo paciente de la (Figura 1). Se aumentó la altura del reborde en 17,2 mm
Extracción del injerto de tibia
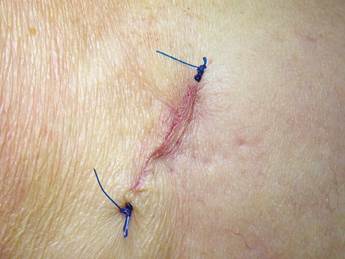
Los pacientes fueron ubicados en posición supina con flexión parcial de la rodilla para una mejor exposición de la tibia. Después de la preparación de toda el área quirúrgica con jabón yodado, se ubicaron los campos estériles. Se identificaron las referencias anatómicas en la superficie anterior de la porción proximal de la tibia. Entre los cóndilos se puede palpar una protuberancia oval llamada el tubérculo de Gerdy. Tener esta referencia ayuda a evitar complicaciones que involucran la superficie articular de la rodilla o la cabeza del peroné, que también se encuentra en esta zona. Bajo anestesia local, con dos carpules de lidocaína al 2% con epinefrina 1:80.000 (Roxicaína, Ropsohn Therapeutics. Colombia), se hizo una incisión oblicua de 2-3 cm con una hoja de bisturí #15 (Figura 4). La incisión se profundizó para comprometer piel, tejido subcutáneo, la fascia del tracto iliotibial y el periostio. El hueso en la porción proximal de la tibia fue obtenido en su superficie cortical por medio de trepanadores de 5 mm de diámetro interno por 14 mm de longitud (Trepano Meisinger T229L, Germany) y de curetas óseas en la zona profunda (Figuras 5 y 6). Se extrajo una cantidad variable de hueso medular, en un rango entre 2-3 gr (5 cc). En el caso de elevación bilateral de seno, la cantidad nunca excedió los 7 gr. Se cerró la herida por planos con vicryl 3-0 en la parte profunda y nylon 6-0 (Ethicon, Johnson & Johnson, USA) en la piel, en forma subdérmica, para lograr un aspecto más estético de la cicatriz final (Figura 7). No se utilizaron drenes, ni se intentó llenar el espacio muerto en la epífisis ósea con material alguno.
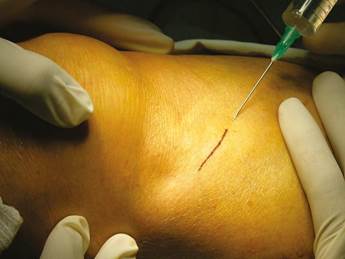
Figura 4 Diseño de la incisión para el abordaje de la porción proximal lateral de la tibia previo a la infiltración del anestésico local para la extracción de injerto autólogo.
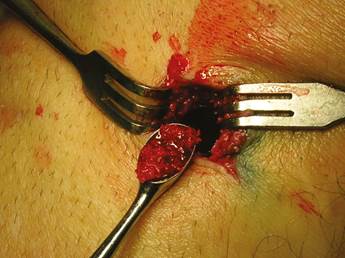
Figura 6 La porción medular de la epífisis tibial también puede ser recolectada por medio de curetas, cuando se requiere mayor volumen de hueso.
Elevación de seno
En todos los pacientes se hizo una evaluación clínica y radiográfica por medio de radiografía panorámica para establecer la cantidad de atrofia ósea y descartar aquellos casos con patología sinusal evidente. Todos los procedimientos se realizaron bajo anestesia local en medios de esterilidad estricta.
Se aplicó anestesia local con vasoconstrictor, lidocaína al 2% con epinefrina 1:80.000, en la zona vestibular y palatina. Se hizo una incisión crestal, llevada ligeramente hacia palatino en todo el reborde edéntulo maxilar en el lado correspondiente. Se complementó dicho abordaje con una incisión relajante vestibular en el límite anterior de la zona edéntula y una pequeña incisión liberadora distal. Se disecó un colgajo de espesor total hasta exponer suficiente altura de la superficie lateral del seno maxilar para realizar el procedimiento en forma cómoda y segura. Teniendo en cuenta las medidas tomadas a partir de la radiografía panorámica, se establecieron los límites del seno maxilar. Se procedió a realizar una ventana ósea de forma rectangular o elíptica con ángulos redondeados, usando fresas redondas de carburo de baja velocidad bajo irrigación continua. Una vez expuesta la membrana sinusal, se movilizó dicha ventana ósea hacia al interior del seno, teniendo un eje de rotación en la osteotomía horizontal superior, tomando las precauciones para evitar lacerar la membrana sinusal.
Usando curetas romas de diferentes angulaciones (External sinus lift control. Meisinger, Germany), se separó la membrana de las paredes óseas del seno maxilar. En caso de ruptura de esta menor a 3 mm, se procedió inmediatamente a obturarla con una membrana de colágeno reabsorbible de 30 por 30 mm (Genius, Baumer, Brazil), con el fin de sellar la comunicación y evitar complicaciones posoperatorias graves, y se continuó con el procedimiento en forma convencional según el protocolo de Testori et al.36
Después de elevar la membrana sinusal, se ubicaron los diferentes tipos de injerto óseo utilizados: hueso humano liofilizado desmineralizado en un grupo de pacientes y hueso cortico-medular autólogo de tibia en el segundo grupo de pacientes. El material de injerto se empacó primero en la zona posterior, después medialmente, y finalmente en la zona central (Figura 8). Se hizo el cierre de la herida quirúrgica usando vicryl Plus 4-0 (Ethicon, Johnson & Johnson, USA) por medio de puntos simples tanto en las incisiones verticales como en la zona crestal. Se permitió la cicatrización del injerto por un periodo de mínimo 6 meses, después del cual se procedió a la ubicación de implantes en la zona. Durante la cirugía de colocación de implantes, se remplazaron las primeras fresas de preparación ósea por un trépano de 2 mm de diámetro interno y 3 mm de diámetro externo por 10 mm de longitud (trepano Meisinger T229, Germany), para así extraer una muestra de tejido óseo en forma cilíndrica que posteriormente sería analizada histológicamente. La preparación del alvéolo para el implante continuó con las fresas convencionales del sistema en particular seleccionado en cada paciente, de acuerdo con el protesista tratante, hasta finalmente posicionar implantes con un diámetro nunca inferior a 3.5 mm y una longitud no menor de 10 mm, dado el tamaño del defecto óseo creado con el trépano.

Figura 8 Aspecto de la ventana quirúrgica en la pared anterior del seno maxilar después de haber hecho la elevación del piso del seno maxilar y de colocar el injerto.
En ambos grupos, se manejó terapia analgésica según el paciente y antibiótica con Amoxidal duo cap 875 mg cada 12 horas por 6 días (Roemmers, Uruguay). Los puntos de sutura intraorales y de piel de tibia fueron retirados a los quince días posquirúrgicos.
Procesamiento de muestras para histología
El procesamiento de las muestras se hizo en el Laboratorio de Patología de la Facultad de Odontología de la Universidad de Antioquia por personal especializado y bajo la supervisión de un patólogo oral.
Las muestras obtenidas en el acto quirúrgico fueron introducidas en frascos individuales debidamente rotulados y fijadas con formol al 10% (pH 7.0) en cantidad que cubriera todo el espécimen.
En el laboratorio, cada uno de los fragmentos fue sumergido en ácido clorhídrico con polivinilpirrolidona (Shandon, TBD - 1, Rapid Decalcifier, Thermo Fisher Scientific. Kalamazoo, MI), según instrucciones del fabricante, durante períodos que oscilaron entre 2 y 16 horas. Posteriormente fueron introducidos durante 10 min en agua bicarbonatada para neutralizar el pH. Después se incluyeron en casetes para procesamiento de tejidos (Histossetes, Simport. Canada), con el fin de iniciar el proceso de fijación, deshidratación y aclaramiento en el procesador de tejidos durante 12 horas. A continuación se hizo el proceso de inclusión en parafina líquida (Histoplast PE., Thermo Fisher Scientific) a temperaturas que oscilaron entre 58 y 60 oC. Luego se hicieron cortes seriados a 5 µm utilizando micrótomo (Micrótomo M3500, Bright Instrument Co Ltd. Huntingdon, Cambridgeshire, England).
De cada uno de los casos se obtuvieron tres láminas que fueron procesadas con las siguientes coloraciones: a) hematoxilina y eosina, b) coloración tricrómico de Masson, c) tinción de von Kossa. Cabe destacar que todas las láminas fueron obtenidas de la parte más profunda del cilindro óseo, verificando previamente la altura inicial de hueso del paciente en la radiografía inicial, y tomando las muestras siempre a una profundidad mayor para así garantizar que en todas las biopsias las láminas obtenidas correspondieran siempre a hueso injertado y no a hueso autólogo previo a la elevación.
Posteriormente, un patólogo oral hizo el análisis morfométrico detallado, utilizando un microscopio de luz, de acuerdo con los criterios dados por los investigadores, que consistían en verificar lo siguiente en cada uno de los cortes y tinciones:
Tinción H&E: presencia o ausencia de material eosinófilo amorfo, hueso propio maduro vital, tejido de granulación, tejido conectivo, vasos sanguíneos, osteoblastos y osteoide.
Tinción tricrómico de Masson (modificación de Goldner): porcentaje de osteoide (teñido de color rojo) y de hueso mineralizado (teñido de color azul).
Tinción von Kossa: Porcentaje de osteoide (teñido de color rosa) y de hueso mineralizado (teñido de color oscuro negro o café).
RESULTADOS
En los 16 pacientes originales se hicieron 19 procedimientos de elevación de seno maxilar utilizando dos tipos diferentes de injerto. En el grupo 1 se realizó la elevación de seno maxilar, complementada con hueso homólogo liofilizado; cuatro casos fueron realizados en hombres y seis en mujeres. En el grupo 2, los pacientes fueron injertados con hueso autólogo de tibia, dos casos fueron en hombres y siete en mujeres. El promedio de edad en el grupo 1 fue de 50 años (rango 23-57) y en el grupo 2 de 58 años (rango 43-67).
En todos los pacientes del segundo grupo, la extracción del injerto de tibia proximal y su colocación en el seno maxilar se hizo en un solo tiempo quirúrgico, bajo anestesia local estricta en un tiempo no mayor a 20 min.
Al finalizar, cuatro pacientes de cada uno de los grupos no continuaron en la investigación (todos ellos con elevación unilateral), de modo que la muestra se redujo a 11 casos, seis del grupo 1 y cinco del grupo 2.
Como complicaciones, se presentó ruptura menor a 3 mm de la membrana sinusal en cuatro pacientes, uno del grupo de hueso liofilizado y tres del grupo de tibia, pero a pesar de esta ruptura, la colocación inmediata de membrana bioabsorbible evitó complicaciones mayores, como sinusitis o reabsorción del injerto. Además, un paciente presentó una infección de la herida quirúrgica en la piel de la zona de extracción del injerto de tibia, la cual fue manejada con terapia antibiótica con dicloxacilina cap 500 mg, cuatro veces al día, por quince días (Diclocil, Bristol Myers Squibb, Colombia), y se resolvió sin complicaciones posteriores. Complicaciones menores en 5 pacientes de 16 nos muestra una tasa de 31,2%. Sin embargo, debe tenerse en cuenta que 4 de 5 de estas complicaciones fueron rupturas menores de la membrana sinusal, que están relacionadas con la técnica quirúrgica y no tuvieron un efecto negativo en el pronóstico del injerto.
Al aplicar las pruebas estadísticas a aquellos pacientes que completaron los tres tiempos, se encontró que la prueba de Shapiro Wilk demostró, con una significancia del 5%, que las variables se distribuían de forma normal. Una prueba t evidenció que existían diferencias, con una significancia del 5%, entre las medias en los tres momentos de evaluación (R1, R2 y R3) en ambos grupos. Se aplicó una prueba Anova para comparar los resultados en los tres tiempos de evaluación en ambos grupos y se encontró que en el grupo 1 existían diferencias significativas (5%, p > 0,05) tanto entre el momento inicial y la evaluación radiográfica inmediatamente después del procedimiento, como entre este segundo momento y la evaluación a los 6 meses. En el grupo 2, se encontraron diferencias significativas entre la evaluación radiográfica prequirúrgica y la posquirúrgica inmediata, pero no se encontró diferencia significativa entre el segundo momento y la evaluación a los 6 meses; es decir, existieron diferencias significativas en la altura alveolar inicial y la obtenida con el procedimiento quirúrgico en ambos grupos, así como 6 meses después de haberse iniciado el proceso de cicatrización solo en el grupo 1, pero no hubo mayor cambio en la altura ósea en los momentos R2 y R3 del grupo 2, lo que indica una reabsorción posquirúrgica mínimamente significativa específicamente en los pacientes intervenidos con injerto autólogo de tibia.
La altura inicial del reborde alveolar en los pacientes del grupo 1 fue en promedio 2,9 mm (rango 0,9-4,3 mm) y en el grupo 2 fue de 3,9 mm (rango 1,4-5,4 mm). En el grupo 1 se obtuvo una ganancia en altura inicial promedio de 13,9 mm (rango 9,9-17,7 mm) y en el grupo 2 una ganancia promedio de 10,3 mm (rango 4,9-15,2mm). Seis meses después, los casos del grupo 1 presentaron una pérdida promedio de 2,9 mm (rango 0,4-3,6mm) y en el grupo 2 de solo 1,9 mm (rango 0,3-3,9mm).
Resultados histológicos: Se procesaron un total de 11 muestras, todas las cuales fueron procesadas y coloreadas con hematoxilina y eosina, tricrómico de Masson y von Kossa para diferenciar el osteoide del hueso mineralizado
Para cada muestra se utilizaron los parámetros descritos por Becker et al (1996) y se obtuvieron los resultados registrados en la (Tabla 1).
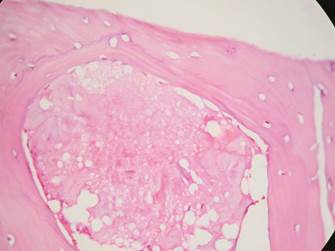
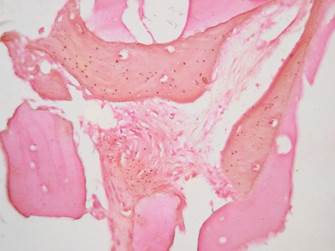
Tanto en las muestras del grupo 1 como del grupo 2 se encontraron cantidades moderadas de material amorfo eosinófilo (Grupo 1: 83,3%, Grupo 2: 80%), hueso propio maduro vital (Grupo 1: 83,3%, Grupo 2: 80%), tejido de granulación (Grupo 1: 66,6%, Grupo 2: 60%), vasos sanguíneos (Grupo 1: 50%, Grupo 2: 40%), osteoblastos (Grupo 1: 16,6%, Grupo 2: 20%) y osteoide (Grupo 1: 33,3%, Grupo 2: 20%). (Figuras 9, 10 y 11)
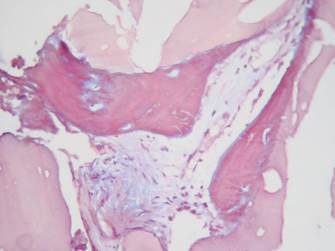
Figura 10 Tinción de tricrómico de Masson (Modificación de Goldner) 40X. Grupo 2. Se aprecia osteoide de color rojo con pequeñas islas centrales de hueso mineralizado de color azul.
DISCUSIÓN
Este estudio comparó la estabilidad de injertos de tibia y de hueso liofilizado (DFDB por sus iniciales en inglés decalcified freeze-dried bone) en procedimientos de elevación de seno maxilar previo a la colocación de implantes. Los resultados obtenidos muestran que los pacientes del grupo en el que se injertó hueso liofilizado presentaron diferencias significativas entre la altura obtenida inicialmente y la altura encontrada 6 meses después de haber realizado el procedimiento. Mientras que en el grupo en el que se utilizó el hueso autólogo de tibia como injerto, la altura inicial no disminuyó de manera significativa durante los 6 meses posteriores a la cirugía de elevación del piso del seno maxilar (Figuras 1 a 3).
Los anteriores resultados son similares a los mostrados en el reporte del consenso sobre elevación del seno maxilar de 1996,13 en el cual los injertos de hueso liofilizado mostraron una pérdida en altura promedio de 2,09 mm, en comparación con 2,9 mm en nuestro estudio. Los injertos de tibia de nuestro estudio presentaron una disminución en altura de 1,9 mm, comparable con la reducción mostrada por injertos de cresta iliaca en el reporte mencionado.
Con relación a los resultados histológicos de nuestro estudio, estos son similares a los reportados en investigaciones previas con injertos autólogos. Algunos autores reportan la generación de hueso laminar y trabecular en cantidades moderadas, con poca cantidad de vasos sanguíneos y cantidades variables de tejido de granulación (Figura 9).11,29,37,38 En las muestras procesadas con el tricrómico de Masson y von Kossa se encontraron resultados similares en ambos grupos, lo cual indica que tanto en el grupo 1 como en el 2 hay neoformación ósea (Figuras 10 y 11).
Respecto al hueso liofilizado, se encontraron resultados similares al hueso autólogo, con formación moderada de hueso nuevo. Otro estudio reporta hallazgos similares,29 pero en este se especifica que el hueso neoformado se localiza en las zonas adyacentes al hueso preexistente. Esta afirmación no se pudo confirmar ni descartar en nuestra muestra.
En nuestro estudio se realizaron los procedimientos de elevación del piso del seno maxilar e implante en dos fases. A pesar de un segundo tiempo quirúrgico, no se presentaron complicaciones importantes. Desde el punto de vista clínico, la resistencia ofrecida por el hueso injertado tanto de tibia como de DFDB al momento de la colocación de implantes y toma de biopsia fue similar al hueso tipo 3-4 en la clasificación de Lekholm y Zarb.39
El hueso autólogo se considera el estándar ideal entre los diferentes tipos de injerto, y dentro de las opciones disponibles actualmente es la más predecible y de mayor éxito.40,41 Su principal problema es la disponibilidad. La necesidad de un segundo sitio quirúrgico ha motivado la búsqueda de diferentes materiales sustitutos.42 El DFDB es una de las opciones alternativas al hueso autólogo; se ha usado con frecuencia y ha mostrado biocompatibilidad, osteoconductividad y una tasa lenta de reabsorción.23
A pesar de su limitada disponibilidad, el hueso autólogo es el material de injerto que más se acerca a las condiciones ideales para realizar tratamientos de reconstrucción.43 Satisface exigencias tan importantes como la biocompatibilidad y la integridad estructural.44 Además, estimula la formación de nuevo hueso por medio de procesos de osteogénesis, osteoinducción y osteoconducción,20 posee una estructura anatómica que permite la invasión celular al mismo tiempo que da soporte estructural al sitio receptor, y es una fuente importante de colágeno tipo I, que facilita los procesos de vascularidad y resiliencia, promoviendo así la activación osteoblástica.44
El hueso autólogo puede extraerse de sitios donantes intraorales y extraorales. Entre los sitios donantes intraorales están la sínfisis,8 la rama mandibular,2 la tuberosidad,45 la apófisis coronoides y el hueso cigomático,46 y entre los sitios extraorales se reportan la calota,47 las costillas, la cara anterior o posterior de cresta iliaca48,49 y la tibia.6,16,18 La selección de uno u otro sitio depende principalmente de la cantidad de hueso a extraer y de la preferencia del cirujano tratante.
La elección del sitio donante determina el origen embriológico del hueso extraído. Los injertos de hueso endocondral (cresta iliaca o tibia) sufren una mayor reabsorción que los huesos de origen intramembranoso, en los cuales incluso el volumen final tiende a aumentar.50 En nuestro estudio, a pesar del origen endocondral del hueso de tibia, se evidenció una tasa de reabsorción baja y un hueso de características clínicas adecuadas para la colocación de implantes.
La extracción de injertos de hueso autólogo implica una mayor morbilidad posoperatoria debido a la intervención en un segundo sitio quirúrgico, con mayor riesgo de complicaciones según el sitio donante elegido.51 Por esta razón, la elección del sitio donante de un injerto autólogo debe buscar un equilibrio entre las características que van a promover un mejor comportamiento del injerto y el menor riesgo de complicaciones o secuelas importantes para el paciente.
El hueso de tibia proximal es uno de los sitios donantes que ha sido explorado.6,16,30,34,51,52 Los esfuerzos para estudiar este sitio de donación se basaron en la facilidad del acceso, el volumen de hueso disponible y la poca morbilidad observada en un grupo de 206 pacientes de trauma ortopédico reportados por O’Keefe y colegas, quienes realizaron 230 injertos de hueso de tibia en el manejo de fracturas de extremidades inferiores, con excelentes resultados.18
La técnica de recolección de hueso de tibia permite la obtención de hueso esponjoso, desde 10 cc hasta 42 cc de hueso medular, con promedio de 28 cc,6,16,30,34,51,52,53,54,55 de la zona proximal lateral o medial de la tibia a través de una incisión de 2 a 3 cm de longitud.6 En nuestro estudio no fue necesaria la extracción superior a 10 cc de tibia, incluso en los casos de elevación bimaxilar, conservando la integridad estructural de la zona donante.
Esta técnica presenta ventajas sobre otros tipos de abordajes usados con frecuencia, como el de cresta iliaca.32,34 Dentro de dichas ventajas, podemos mencionar las siguientes:
Es bien tolerada por el paciente usando solo anestesia local;51,55 por lo tanto, los costos disminuyen ya que el procedimiento podrá hacerse en consultorio, no en quirófano, en una sola sesión y podrá ser realizado en su totalidad por el cirujano maxilofacial,
La morbilidad postoperatoria es menor: después de una extracción de injerto de cresta iliaca, el paciente requiere incapacidad de 5 a 14 días,7,12,56 y presentará dificultades para caminar hasta por dos semanas, mientras que al extraerse de hueso de tibia, el paciente estará incapacitado por máximo tres días, el postoperatorio esperado después de extraer el injerto es mucho más manejable, y solo hay una ligera alteración de la marcha, que se recupera en su totalidad a partir del segundo a quinto día posquirúrgico,16,51 pero de todos modos recomendando al paciente no elevar objetos pesados ni realizar actividades deportivas que impliquen impactos a las piernas, como jugar fútbol, durante unas tres semanas, que es el tiempo mínimo necesario para un adecuado llenado de los espacios medulares de la epífisis tibial.55
Además, el riesgo de complicaciones quirúrgicas es muy bajo (1,7% de complicaciones menores), comparado con el abordaje quirúrgico de la cresta iliaca.56,57 En nuestra muestra, solo un paciente presentó una infección como complicación menor asociada a la extracción del injerto de tibia, la cual se manejó sin eventualidades con terapia antibiótica.
Los aloinjertos o injertos homólogos21,40 provienen de individuos de la misma especie que el receptor y se dividen en tres categorías principales: congelado, congelado-seco o liofilizado y congelado-seco desmineralizado. Han sido usados desde la década de los setenta por sus propiedades osteoconductivas.22,58 En 1996 se reconoció que cumplían con los criterios para inducir regeneración periodontal.13 Su ventaja principal es que se puede disponer de ellos en las cantidades que sean necesarias, sin la necesidad de sitios quirúrgicos adicionales.59,60 Sin embargo, no presentan propiedades de osteogénesis, lo cual se refleja en su comportamiento histológico durante la reparación, que se caracteriza por rodearse de partículas de hueso nuevo cuando las partículas de DFDB se encuentran cerca a hueso nativo, pero cuando están a distancia muestran una escasa remineralización o poca formación de nuevo hueso29 Se ha sugerido que el uso combinado del DFDB con otros biomateriales puede mostrar mejores resultados.58,61 Nuestra muestra de DFDB humano presentó grados de formación ósea variables que, debido al tamaño de la muestra, no pueden ser tomados como conclusiones aplicables clínicamente.
Se han reportado elevaciones de seno maxilar con otros materiales diversos, como injertos aloplásticos1,59,60,62,63,64 y xenoinjertos,15,24,65 así como con proteínas morfogenéticas (BMP).19,66,67,68 El uso de este tipo de materiales se ha documentado ampliamente, con diferentes grados de éxito.
El hueso de tibia es una opción que ofrece ventajas sobre otras, como el hueso de cresta iliaca y el DFDB, específicamente en procedimientos de elevación de seno maxilar. Según los resultados de nuestra muestra, el hueso de tibia mostraría características superiores a los resultados obtenidos con DFDB y tejidos similares en sus patrones de cicatrización, capacidad osteogénica y estabilidad a largo plazo, al ser comparado con hueso de cresta iliaca, con evidencia de menor morbilidad posoperatoria y de una mejor tolerancia por parte del paciente para estos procedimientos; sin embargo, no podemos definir de manera concluyente si existen diferencias histológicas importantes entre los dos tipos de injerto.
Cabe anotar además que el rechazo que pueda presentar el injerto óseo autólogo de tibia en algunas personas, por ser un sitio extraoral, está ampliamente compensado por la sencillez de su técnica y la facilidad de su obtención en manos entrenadas; de este sitio es posible obtener grandes cantidades de hueso sin mayores eventualidades para el paciente.
Es innegable la versatilidad de los sitios donantes intraorales, pero el uso de la epífisis proximal de tibia para obtener hueso esponjoso debe tomarse en consideración principalmente en aquellos casos en los que se requieran grandes elevaciones de piso de seno en combinación con mínima altura ósea, para la instalación de múltiples implantes oseointegrados.
Hacen falta más estudios que permitan comparar directamente el comportamiento del injerto de tibia con el de cresta iliaca y el obtenido de sitios intraorales y con otras opciones como el hueso liofilizado, ya sea homólogo o heterólogo, para poder confirmar o refutar nuestros hallazgos. Los resultados encontrados en nuestra muestra solo son aplicables a la misma y hace falta una mayor cantidad de pacientes para aportar resultados que puedan ser aplicados a la población general.
AGRADECIMIENTOS
Agradecemos la invaluable colaboración de la doctora Leonor González Pérez, patóloga oral adscrita al Departamento de Ciencias Básicas de la Facultad de Odontología de la Universidad de Antioquia, por el procesamiento y análisis de las muestras histológicas.
REFERENCIAS
1. Wheeler S. Sinus augmentation for dental implants: the use of alloplastic materials. J Oral Maxillofac Surg 1997; 55(11): 1287-1293. [ Links ]
2. Misch CM. Comparison of intraoral donor sites for onlay grafting prior to implant placement. Int J Oral Maxillofac Implants 1997; 12(6): 767-776. [ Links ]
3. Triplett RG, Schow S. Autologous bone grafts and endosseous implants: complementary techniques. J Oral Maxillofac Surg 1996; 54(4): 486-494. [ Links ]
4. Jensen J, Sindet-Pedersen S, Oliver AJ. Varying treatment strategies for reconstruction of maxillary atrophy with implants: results in 98 patients. J Oral Maxillofac Surg 1994; 52(3): 216-218. [ Links ]
5. Becker W, Becker BE, Polizzi G, Bergstrom C. Autogenous bone grafting of bone defects adjacent to implants placed into immediate extraction sockets in patients: a prospective study. Int J Oral Maxillofac Implants 1994; 9(4): 389-396. [ Links ]
6. Catone GA, Reimer BL, McNeir D, Ray R. Tibial autogenous cancellous bone as an alternative donor site in maxillofacial surgery: a preliminary report. J Oral Maxillofac Surg 1992; 50(12): 1258-1263. [ Links ]
7. Raghoebar GM1, Brouwer TJ, Reintsema H, Van Oort RP. Augmentation of the maxillary sinus floor with autogenous bone for the placement of endosseous implants: a preliminary report. J Oral Maxillofac Surg 1993; 51(11):1198-203 [ Links ]
8. Misch CM, Misch CE, Resnik RR, Ismail YH. Reconstruction of maxillary alveolar defects with mandibular symphysis grafts for dental implants: a preliminary procedural report. Int J Oral Maxillofac Implants 1992; 7(3): 360-366. [ Links ]
9. Proussaefs P, Lozada JL, Kleinman A, Rohrer MD. The use of ramus autogenous block grafts for vertical alveolar ridge augmentation and implant placement: a pilot study. Int J Oral Maxillofac Implants 2002; 17(2): 238-248. [ Links ]
10. Johansson LA, Isaksson S, Lindh C, Becktor JP, Sennerby L. Maxillary sinus floor augmentation and simultaneous implant placement using locally harvested autogenous bone chips and bone debris: a prospective clinical study. J Oral Maxillofac Surg 2010; 68(4): 837-844. DOI: 10.1016/j.joms.2009.07.093 URL:https://dx.doi.org/10.1016/j.joms.2009.07.093 [ Links ]
11. Pejrone G, Lorenzett M, Mottati M, Valente G, Schierano GM. Sinus floor augmentation with autogenous iliac bone block grafts: a histological and histomorphometrical report on the two-step surgical technique. Int J Oral Maxillofac Surg 2002; 31(4): 383-388. DOI: 10.1054/ijom.2002.0286 URL: https://dx.doi.org/10.1054/ijom.2002.0286 [ Links ]
12. Daelemans P, Hermans M, Godet F, Malevez C. Autologous bone graft to augment the maxillary sinus in conjunction with immediate endosseous implants: a retrospective study up to 5 years. Int J Periodontics Restorative Dent 1997; 17(1): 27-39. [ Links ]
13. Jensen O, Shulman LB, Block MS, Jacono VJ. Report of the sinus consensus conference of 1996. Int J Oral Maxillofac Implants 1998; 13(Suppl): 11-45. [ Links ]
14. Blus C, Szmukler-Moncler S, Salama M, Salama H, Garber D. Sinus bone grafting procedures using ultrasonic bone surgery: 5-year experience. Int J Periodontics Restorative Dent 2008; 28(3): 221-229. [ Links ]
15. Hallman M, Sennerby L, Zetterqvist L, Lundgren S. A 3-year prospective follow-up study of implant-supported fixed prostheses in patients subjected to maxillarysinus floor augmentation with an 80: 20 mixture of deproteinized bovine bone and autogenous bone clinical, radiographic and resonance frequency analysis. Int J Oral Maxillofac Surg 2005; 34(3): 273-280. DOI:10.1016/j.ijom.2004.09.009 URL:https://doi.org/10.1016/j.ijom.2004.09.009 [ Links ]
16. Ilankovan V, Stronczek M, Telfer M, Peterson LJ, Stassen LF, Ward-Booth P. A prospective study of trephined bone grafts of the tibial shaft and iliac crest. Br J Oral Maxillofac Surg 1998; 36(6): 434-439. [ Links ]
17. Lundgren S, Nyström E, Nilson H, Gunne J, Lindhagen O. Bone grafting to the maxillary sinuses, nasal floor and anterior maxilla in the atrophic edentulous maxilla. A two-stage technique. Int J Oral Maxillofac Surg 1997; 26(6): 428-434. [ Links ]
18. O’Keefe RM Jr, Riemer BL, Butterfield SL. Harvesting of autogenous cancellous bone graft from the proximal tibial metaphysis. A review of 230 cases. J Orthop Trauma 1991; 5(4): 469-474 [ Links ]
19. Serra-e-Silva FM, Albergaria-Barbosa JR, Mazzonetto R. Clinical evaluation of association of bovine organic osseous matrix and bovine bone morphogenetic protein versus autogenous bone graft in sinus floor augmentation. J Oral Maxillofac Surg 2006: 64(6): 931-935. DOI:10.1016/j.joms.2006.02.026 URL: https://dx.doi.org/10.1016/j.joms.2006.02.026 [ Links ]
20. Lee SH, Choi BH, Li J, Jeong SM, Kim HS, Ko CY. Comparison of corticocancellous block and particulate bone grafts in maxillary sinus floor augmentation for bone healing around dental implants. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007; 104(3): 324-328. DOI:10.1016/j.tripleo.2006.12.020 URL:https://dx.doi. org/10.1016/j.tripleo.2006.12.020 [ Links ]
21. Minichetti J, D`Amore J, Hong A, Cleveland D. Human histologic analysis of mineralized bone allograft (Puros) placement before implant surgery. J Oral Implantol 2004; 30(2): 74-82. DOI:10.1563/0.693.1 URL:https://dx.doi.org/10.1563/0.693.1 [ Links ]
22. Piattelli A, Scarano A, Corigliano M, Piatelli, M. Comparison of bone regeneration with the use of mineralized and demineralized freeze-dried bone allografts: a histological and histochemical study in man. Biomaterials 1996; 17(11): 1127-1131. [ Links ]
23. Piattelli A, Scarano A, Piattelli M. Microscopic and histochemical evaluation of demineralized freeze-dried bone allograft in association with implant placement: a case report. Int J Periodontics Restorative Dent 1998; 18(4): 355-361. [ Links ]
24. Galindo-Moreno P, Avila G, Fernandez-Barbero JE, Aguilar M, Sanchez-Fernandez E, Cutando A et al. Evaluation of sinus floor elevation using a composite bone graft mixture. Clin Oral Impl Res 2007; 18(3): 376-382. DOI:10.1111/j.1600-0501.2007.01337.x URL:https://dx.doi.org/10.1111/j.1600-0501.2007.01337.x [ Links ]
25. Kim YK, Yun PY, Kim SG, Lim SC. Analysis of the healing process in sinus bone grafting using various grafting materials. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009: 107(2); 204-211. DOI:10.1016/j.tripleo.2008.07.021 URL:https://dx.doi.org/10.1016/j.tripleo.2008.07.021 [ Links ]
26. Rosenberg E, Rose LF. Biological and clinical consideration for autografts and allografts in periodontal regeneration therapy. Dent Clin North Am 1998; 42(3): 467-490. [ Links ]
27. Misch CE, Dietsh F. Bone grafting materials in implant dentistry. Implant Dent 1993; 2(3): 158-167. [ Links ]
28. Moy PK, Lundgren S, Holmes RE. Maxillary sinus augmentation: histomorphometric analysis of graft materials for maxillary sinus floor augmentation. J Oral Maxillofac Surg 1993; 51(8): 857-862. [ Links ]
29. Scarano A, Degidi M, Lezzi G, Pecora G, Piattelli M, Orsini G et al. Maxillary sinus augmentation with different biomaterials: a comparative histologic and histomorphometricstudyinman. Implant Dent 2006;15(2):197-207. DOI:10.1097/01.id.0000220120.54308.f3 URL:https://doi.org/10.1097/01.id.0000220120.54308. f3 [ Links ]
30. Van-Damme PA, Merkx MA. A modification of the tibial bone-graft-harvesting technique. Int J Oral Maxillofac Surg 1996; 25(5): 346-348. [ Links ]
31. Van-den-Bergh J, Ten-Bruggenkate CM, Krekeler G, Tuinzing DB. Sinus floor elevation and grafting with autogenous iliac crest bone. Clin Oral Impl Res 1998; 9(6): 429-435. DOI:10.1034/j.1600-0501.1996.090608.x URL:http://dx.doi.org/10.1034/j.1600-0501.1996.090608.x [ Links ]
32. Sivarajasingam V, Pell G, Morse M, Shepherd J. Secondary bone grafting of clefts: a densitometric comparison of iliac and tibial bone grafts. Cleft Palate Craniofac J 2001; 38(1): 11-14. DOI:10.1597/1545-1569(2001)038<0011:SB-GOAC>2.0.CO;2 URL:http://dx.doi.org/10.1597/1545-1569(2001)038<0011:SBGOAC>2.0. CO;2 [ Links ]
33. Marchena JM, Block MS, Stover JD. Tibial bone harvesting under intravenous sedation: morbidity and patient experiences. J Oral Maxillofac Surg 2002; 60(10): 1151-1154. [ Links ]
34. Silva RG. Donor site morbidity and patient satisfaction after harvesting iliac and tibial bone. J Oral Maxillofac Surg 1996; 54: 28-34. [ Links ]
35. Domínguez JS, Aguilar G, Guerra L, Contreras N, Aristizabal AM. Validación de la panorámica tomográfica como herramienta diagnóstica para patología de seno maxilar. Rev Fac Odontol Univ Antioq 2013; 24(2): 232-242. [ Links ]
36. Testori T, Trisi P, Del-Fabbro M, Francetti L, Taschieri S, Parenti A et al. Gestione intraoperatoria di ampie perforazioni della membrana del seno mascellare: caso clinico. Ital Oral Surg 2007; 6(1): 21-28. [ Links ]
37. Boyne PJ, Lilly LC, Marx RE, Moy PK, Nevins M, Spagnoli DB et al. De novo bone induction by recombinant human bone morphogenetic protein-2 (rhBMP-2) in maxillary sinus floor augmentation. J Oral Maxillofac Surg 2005; 63(12): 1693-1707. DOI:10.1016/j.joms.2005.08.018 URL:https://dx.doi.org/10.1016/j.joms.2005.08.018 [ Links ]
38. Martinez A, Franco J, Saiz E, Guitian F. Maxillary sinus floor augmentation on humans: Packing simulations and 8 months histomorphometric comparative study of anorganic bone matrix and β-tricalcium phosphate particles as grafting materials. Mater Sci Eng C Mater Biol Appl 2010; 30(5): 763-769. DOI:10.1016/j.msec.2010.03.012 URL:https://dx.doi.org/10.1016/j.msec.2010.03.012 [ Links ]
39. Lekholm U, Zarb GA. Patient selection and preparation. En: Branemark PI, Zarb GA, Albrektsson T. Tissue integrated prostheses: osseointegration in clinical dentistry. Chicago: Quintessence; 1985. [ Links ]
40. Becker W, Becker BE, Caffesse R. A comparison of demineralized freeze-dried bone and autologous bone to induce bone formation in human extraction sockets. J Periodontol 1994; 65(12): 1128-1133. DOI:10.1902/jop.1994.65.12.1128 URL: https://dx.doi.org/10.1902/jop.1994.65.12.1128 [ Links ]
41. Orsini G, Bianchi AE, Vinci R, Piattelli A. Histologic evaluation of autogenous calvarial bone in maxillary onlay bone grafts: a report of two cases. Int J Oral Maxillofac Implants 2003; 18(4): 594-598. [ Links ]
42. Raghoebar GM, Vissink A, Reintsema H, Batenburg RH. Bone grafting of the floor of the maxillary sinus for placement of endosseous implants. B Oral Maxillofac Surg 1997; 35(2): 119-125. [ Links ]
43. Peleg M, Garg AK, Misch CM, Mazor Z. Maxillary sinus and ridge augmentations using a surface-derived autogenous bone graft. J Oral Maxillofac Surg 2004; 62(12): 1535-1544. [ Links ]
44. Hoexter DL. Bone regeneration graft materials. J Oral Implantol 2002; 28(6): 290-294. DOI: 10.1563/1548-1336(2002)028<0290:BRGM>2.3.CO;2 URL:https://dx.doi.org/10.1563/1548-1336(2002)028<0 290:BRGM>2.3.CO;2 [ Links ]
45. Ten-Bruggenkate CM, Kraaijenhagen HA, van-der-Kwast WA, Krekeler G, Oosterbeck HS. Autogenous maxillary bone grafts in conjunction with placement of I.T.I endosseous implants. A preliminary report. Int J Oral Maxillofac Surg 1992; 21(2): 81-84. [ Links ]
46. Kainulainen VT, Sàndor GK, Oikarinen KS, Clokie CM. Zygomatic bone: an additional donor site for alveolar bone reconstruction. Technical note. Int J Oral Maxillofac Implants 2002; 17(5): 723-728. [ Links ]
47. Jackson IT, Helden G, Marx R. Skull bone grafts in maxillofacial and craniofacial surgery. J Oral Maxillofac Surg 1986; 44(12): 949-955 [ Links ]
48. Marx RE. Bone harvest from the posterior ilium. Atlas Oral Maxillofac Surg Clin North Am 2005; 13(2); 109-118. DOI:10.1016/j.cxom.2005.06.001 URL:https://dx.doi.org/10.1016/j.cxom.2005.06.001 [ Links ]
49. Nkenke E, Weisbach V, Winchler E, Kessler P, Schultze-Mosgau S, Wiltfang J et al. Morbidity of harvesting bone graft from the iliac crest for preprosthetic augmentation procedures: a prospective study. Int J Oral Maxillofac Surg 2004; 33(2): 157-163. DOI:10.1054/ijom.2003.0465 URL:https://dx.doi.org/10.1054/ijom.2003.0465 [ Links ]
50. Smith JD, Abramson M. Membranous vs endochondrial bone autografts. Arch Otolaryngol 1974: 99(3): 203-205. [ Links ]
51. Burchardt H. Biology of bone transplantation. Orthop Clin North Am 1987; 18(2): 187-196. [ Links ]
52. Kushner GM. Tibia bone graft harvest technique. Atlas Oral Maxillofac Surg Clin North Am 2005;13(2): 119-126. DOI:10.1016/j.cxom.2005.05.001 URL:http://dx.doi.org/10.1016/j.cxom.2005.05.001 [ Links ]
53. Herford AS, King BJ, Audia F, Becktor J. Medial approach for tibial bone graft: anatomic study and clinical technique. J Oral Maxillofac Surg 2003; 61(3): 358-363. DOI:10.1053/joms.2003.50071 URL:https://dx.doi.org/10.1053/joms.2003.50071 [ Links ]
54. Lung GYC. Quantitative analysis of proximal tibial cancellous bone available for augmentation of maxillofacial defects. J Oral Maxillofacial Surg 1995; 53(Suppl): 93-94. [ Links ]
55. Lee CY. An in-office technique for harvesting tibial bone: outcomes in 8 patients. J Oral Implantol 2003; 29(4): 181-184. DOI:10.1563/1548-1336(2003)029<0181:AITF-HT>2.3.CO;2 URL:http://dx.doi.org/10.1563/1548-1336(2003)029<0181:AITFHT>2.3.CO;2 [ Links ]
56. Marx RE, Morales MJ. Morbidity from bone harvest in major jaw reconstruction: A randomized trial comparing the lateral anterior and posterior approaches to the ilium. J. Oral Maxillofac Surg 1998; 46(3): 196-203. [ Links ]
57. Alt V, Nawab A, Seligson D. Bone grafting from the proximal tibia. J Trauma 1999; 47(3): 555-557. [ Links ]
58. Donath K, Piattelli A. Bone tissue reactions to demineralized freeze-dried bone in conjunction with e-PTFE barrier membranes in man. Eur J Oral Sci 1996; 104(2(Pt 1)): 96-101. [ Links ]
59. Froum S, Cho SC, Rosenberg E, Rohrer M, Tarnow D. Histological comparison of healing extraction sockets implanted with bioactive glass or demineralized freeze-dried bone allograft: a pilot study. J Periodontol 2002; 73(1): 94-102. DOI:10.1902/jop.2002.73.1.94 URL:https://dx.doi.org/10.1902/jop.2002.73.1.94 [ Links ]
60. Karabuda C, Ozdemir O, Tosun T, Anil A, Olgaç V. Histological and clinical evaluation of 3 different grafting materials for sinus lifting procedure based on 8 cases. J Periodontol 2001; 72(10): 1436-1442. DOI:10.1902/jop.2001.72.10.1436 URL:https://dx.doi.org/10.1902/jop.2001.72.10.1436 [ Links ]
61. Wallace SS, Froum SJ. Effect of maxillary sinus augmentation on the survival of endosseous dental implants. A systematic review. Ann Periodontol 2003; 8(1): 328-343. DOI:10.1902/annals.2003.8.1.328 URL:https://dx.doi.org/10.1902/annals.2003.8.1.328 [ Links ]
62. Knapp CI, Feuille F, Cochran DL, Melloning JT. Clinical and histologic evaluation of bone-replacement grafts in the treatment of localized alveolar ridge defects. Part 2: bioactive glass particulate. Int J Periodontics Rest Dent 2003; 23(2): 129-137. [ Links ]
63. Ashman A, Lopinto J. Placement of implants into ridges grafted with bioplant HTR synthetic bone: histological long-term case history reports. J Oral Implantol 2000; 26(4): 276-290. DOI:10.1563/1548-1336(2000)026<0276:POIIRG>2.3.CO;2 URL:http://dx.doi.org/10.1563/1548-1336(2000)026<0 276:POIIRG>2.3.CO;2 [ Links ]
64. Kirmeier R, Payer M, Wehrschuetz M, Jakse N, Platzer S, Lorenzoni M. Evaluation of three-dimensional changes after sinus floor Augmentation with different grafting materials. Clin Oral Implants Res 2008; 19(4): 366-372. DOI:10.1111/j.1600-0501.2007.01487.x URL:https://dx.doi.org/10.1111/j.1600-0501.2007.01487.x [ Links ]
65. Hallman M, Hedin M, Sennerby L, Lundgren S. A prospective 1-year clinical and radiographic study of implants placed after maxillary sinus floor augmentation with bovine hydroxyapatite and autogenous bone. J Oral Maxillofac Surg 2002; 60(3): 277-284. [ Links ]
66. Da-Costa-Filho LC, Taga R, Taga EM. Rabbit bone marrow response to bovine osteoinductive proteins and anorganic bovine bone. Int J Oral Maxillofac Implants 2001; 16(6): 799-808. [ Links ]
67. Groeneveld EH, Van-Den-Bergh JP, Holzmann P, ten-Bruggenkate CM, Tuinzing DB, Burger EH. Histomorphometrical analysis of bone formed in human maxillary sinus floor elevations grafted with OP-1 device, demineralized bone matrix or autogenous bone. Comparison with non-grafted sites in a series of case reports. Clin Oral Implants Res 1999; 10(6): 499-509. [ Links ]
68. Groeneveld EH, Burger EH. Bone morphogenetic proteins in human bone regeneration. Eur J Endocrinol 2000; 142(1): 9-21. [ Links ]
Recibido: 23 de Mayo de 2013; Aprobado: 15 de Septiembre de 2015











 text in
text in