Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Odontología Universidad de Antioquia
Print version ISSN 0121-246X
Rev Fac Odontol Univ Antioq vol.28 no.2 Medellín Jan./June 2017
https://doi.org/10.17533/udea.rfo.v28n2a4
Articles
ANÁLISIS DE ENTEROCOCCUS FAECALIS, STAPHYLOCOCCUS AUREUS Y CANDIDA ALBICANS EN NÚCLEOS COLADOS EN METAL BASE
1 PhD in Biotechnology. Professor of Oral Microbiology, researcher at the GIOMET. School of Dentistry, Universidad Cooperativa de Colombia, Villavicencio, Colombia. Email: maria.angaritad@campusucc.edu.co
2DMD, Magister in Management. Program Head, School of Dentistry. Universidad Cooperativa de Colombia, Villavicencio, Colombia.
3Ninth semester dental students. School of Dentistry. Universidad Cooperativa de Colombia, Villavicencio, Colombia.This article is one of the requirements to qualify for the title of DMD.
Introducción:
el tratamiento odontológico debe considerar rigurosamente la cadena de asepsia para reducir el fracaso, incluso cuando se realizan procedimientos endodónticos. A pesar de ser una recomendación clave en este tipo de intervenciones, esta afirmación no tiene el suficiente alcance, debido a que algunos estudiantes y profesionales no consideran la esterilización de los núcleos antes de utilizarlos. Para generar conciencia en torno a esta práctica, el objetivo de este estudio consistió en demostrar la presencia de microorganismos desencadenantes del fracaso, como Enterococcus faecalis, Staphylococcus aureus y Candida albicans, en los núcleos sin esterilizar.
Métodos:
de las clínicas odontológicas de la Universidad Cooperativa de Colombia, sede Villavicencio, se recolectaron núcleos colados fabricados durante el primer semestre de 2016. Los núcleos fueron colocados en solución salina y se realizaron diluciones hasta 10-4, para finalmente sembrarlas por duplicado en medios diferenciales para los microorganismos objeto de estudio. Posteriormente se cuantificaron y seleccionaron las colonias candidatas para los microorganismos estudiados y se realizó la identificación y confirmación en un laboratorio clínico certificado.
Resultados:
en uno de los núcleos utilizados en la clínica se detectó la presencia de E. faecalis (3,2%), cuantificado en 5x104 UFC/ml. No se identificó la presencia de S. aureus ni C. albicans, pero se encontraron otros microorganismos, como Candida parapsilopsis (35,5%), Candida tropicalis (6,5%), Kokuria kristinae (16,1%), Staphylococcus saprophyticus (12,9%) y Stenotrophomona maltophilia (3,2%).
Conclusión:
de los microorganismos analizados en este estudio, solo se identificó la presencia de E. faecalis. Sin embargo, se identificaron otros microorganismos asociados al fracaso endodóntico o a otro tipo de complicaciones.
Palabras claves: perno muñón; análisis microbiológico; Enterococcus faecalis; Staphylococcus aureus; Candida albicans
Introduction:
all dental treatments should strictly follow aseptic protocols in order to reduce failure, especially when performing endodontic procedures. Despite being a key recommendation in this type of interventions, this statement is generally ignored, as students and clinicians tend to neglect the sterilization of posts prior to their use. To raise awareness on this practice, the objective of this study was to demonstrate the presence of microorganisms that cause failure, such as Enterococcus faecalis, Staphylococcus aureus and Candida albicans, in non-sterile cores.
Methods:
during the first half of 2016, fabricated cast cores were collected in the dental clinics of Universidad Cooperativa de Colombia at Villavicencio. The cores were immersed in saline solution making dilutions to up to 10-4, and finally inserted in duplicate into differential mediums for the microorganisms under study. The candidate colonies were then quantified and selected for the microorganisms under study, performing identification and confirmation in a certified clinical laboratory.
Results:
the presence of E. faecalis was detected in one of the cores (3.2%) used in the clinic, quantified in 5x104 CFU/ml. The presence of S. aureus or C. albicans was not identified, but other microorganisms were found, such as Candida parapsilopsis (35.5%), Candida tropicalis (6.5%), Kokuria kristinae (16.1%), Staphylococcus saprophyticus (12.9%) and Stenotrophomona maltophilia (3.2%).
Conclusion:
out of the microorganisms analyzed in this study, only E. faecalis was identified. However, other microorganisms associated with endodontic failure or other type of complications were identified.
Key words: cast core; microbiological analysis; Enterococcus faecalis; Staphylococcus aureus; Candida albicans.
INTRODUCCIÓN
En odontología, el manejo de la asepsia es fundamental para evitar las infecciones cruzadas, los fracasos pos- tratamiento, la innecesaria prescripción de antibióticos y las complicaciones que ponen en riesgo la vida del paciente.1,2,3 A pesar del manejo de este concepto, existen algunos profesionales y estudiantes que no lo tienen claro.4,5,6,7,8 Esto se evidencia en la utilización de antibióticos como medida preventiva para las inapropiadas técnicas de asepsia,9,10 y en la ausencia de protocolos de esterilización o desinfección de algunos materiales de uso por primera vez, así como en la inadecuada manipulación de estos antes de ser utilizados en procedimientos odontológicos.8,11,12
Durante el tratamiento de endodoncia, el especialista busca eliminar los microorganismos presentes en el canal radicular y prevenir el establecimiento de nuevos microorganismos mediante la producción de condiciones inhóspitas para éstos.13,14,15 Estas condiciones se pueden lograr mediante la insuficiente o casi nula cantidad de nutrientes, la limitación de espacio, la alteración de los potenciales redox, la baja concentración de oxígeno y la presencia de sustancias antimicrobianas.16 Sin embargo, los estudios demuestran que hay varios microorganismos implicados en procesos infecciosos capaces de adaptarse a estas condiciones,15,17,18 y son prueba de la necesidad de utilizar materiales y aditamentos en las condiciones más asépticas posibles.
Entre los microorganismos implicados en el fracaso en- dodóntico y cuyas características los hacen resistentes a condiciones extremas, están Enterococcus faecalis, Staphylococcus aureus y Candida albicans .18,19,20,21 Estos microorganismos son considerados como los más resistentes en la cavidad oral.19,22E. faecalis es de los microorganismos que se encuentran en alto número en el fracaso endodóntico y se caracteriza por entrar durante el tratamiento.23,24 Estas bacterias son cocos Gram positivos y facultativos, caracterizados por sobre- vivir en condiciones que son comúnmente letales para otros microorganismos, como crecer en ambientes con bajo contenido de nutrientes, tener un alto potencial redox, poseer resistencia en condiciones anaeróbicas, establecerse en un amplio rango de temperatura, pH y concentraciones de sal, así como presentar resistencia a sustancias como el hidróxido de calcio.18,20 Además, tienen la capacidad de invadir el túbulo dentinal, utilizar el colágeno de la dentina y formar biopelícula.21,25,26
Staphylococcus aureus es otra de las bacterias que también se ha encontrado en lesiones después de un tratamiento endodóntico, aunque en menor frecuencia que E. faecalis. Son cocos Gram positivos y anaerobios facultativos, que se caracterizan por sobrevivir en condiciones adversas durante periodos prolongados y por resistir a los cambios de temperatura y a la deshidratación. La mayoría de estas bacterias han sido capaces de desarrollar resistencia a los antimicrobianos.27,28
Una especie de levadura aislada frecuentemente de canales radiculares infectados es Candida albicans.18,29 Este microorganismo presenta características similares a E. faecalis, como la supervivencia en las monoinfecciones y en ambientes con limitada cantidad de nutrientes, así como en rangos extremos de pH. Además, invade el túbulo dentinal, resiste a varios agentes antimicrobianos y tiene la capacidad de producir biopelículas en diferentes superficies. Esta levadura cuenta también con enzimas colagenolíticas que le permiten degradar el colágeno de la dentina humana.29,30
Este estudio se realizó con el propósito de intervenir a los estudiantes y profesores de odontología de la Universidad Cooperativa de Colombia, sede Villavicencio, sobre la necesidad de esterilizar los núcleos colados antes de ser cementados en el paciente. El objetivo del estudio consistió en identificar y cuantificar la presencia de E. faecalis, S. aureus y C. albicans en núcleos colados fabricados para las clínicas de la universidad, durante el primer semestre de 2016.
MATERIALES Y MÉTODOS
Estudio descriptivo con muestreo por conveniencia, que consistió en dos fases:
Fase 1. Recolección de los núcleos
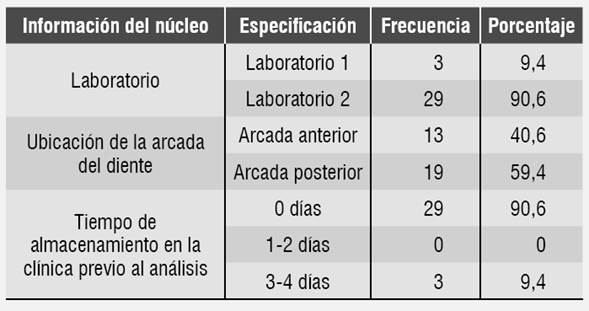
La recolección de núcleos colados fabricados se realizó durante el primer semestre de 2016 en las clínicas de la Universidad Cooperativa de Colombia, sede Villavicencio. Para el estudio de los núcleos se tuvieron en cuenta los principios éticos, solicitando un consentimiento informado a los propietarios de los núcleos. Se recolectaron 32 núcleos que cumplieran los criterios de inclusión, como estar fabricados en metal base, ya que es la aleación de mayor uso en esta población, y contar con el consentimiento del paciente para quien se elaboró el núcleo. Se recopiló información del núcleo, como fecha de fabricación, laboratorio dental, ubicación de la arcada del diente y tiempo de almacenamiento antes del análisis, en un instrumento valorado por un endodoncista y un microbiólogo.
Fase 2. Análisis microbiológico
Medios y condiciones de crecimiento
Los núcleos fueron colocados en condiciones estériles en microtubos que contenían 1 ml de solución salina.31 Se agitaron los microtubos manualmente durante 30 o 40 s. A partir de este tubo se realizaron diluciones hasta 10-4 y se sembraron 100 µl de la dilución por duplicado, en medios diferenciales para los microorganismos estudiados. Para E. faecalis se utilizó el medio CHROMAgar UTI®32, para S. aureus el medio Baird Parker®33 y para C. albicans el medio Cromo Candida.34 Estos medios fueron adquiridos en una empresa certificada que distribuye medios con control de calidad mediante cepas de referencia. Una vez realizada la siembra, los medios fueron incubados a 35 °C durante 24 a 48 horas. Posterior a este proceso, los núcleos fueron llevados de nuevo a la clínica odontológica, para realizar el proceso de esterilización y así ser cementados en los pacientes.
Identificación y confirmación de los microorganismos
Para la identificación de los microorganismos, se seleccionaron y describieron las colonias que presentaban la coloración y característica de estos microorganismos en los medios utilizados Figura 1. Para el caso del CHROMAgar UTI, se seleccionaban las colonias de color azul, para el medio Baird Parker las colonias negras, y para el medio Chromo Candida se buscaban colonias de color verde. La morfología de las células de las colonias fue observada al microscopio mediante la coloración Gram. En el medio CHROMAgar UTI, las colonias que presentaban cocos Gram positivos se les realizaba la prueba de la catalasa, buscando los microorganismos catalasa negativa como candidatos para identificar Figura 1. En el medio Baird Parker, las colonias negras que presentaban cocos Gram positivos, y aunque no formaran halo alrededor, se les realizaba la prueba de la catalasa y la coagulasa, buscando las colonias catalasa y coagulasa positivas Figura 1.
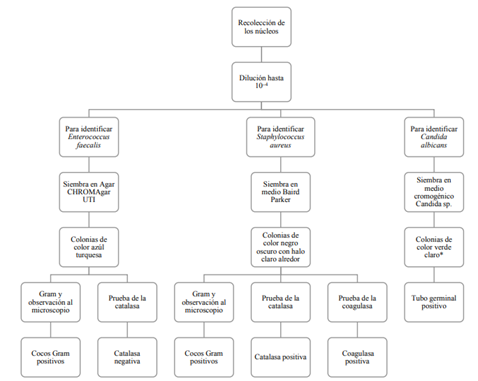
*En este medio no se detectaron colonias de color verde.
Figura 1 Procedimiento para la detección de Enterococcus faecalis, Staphylococcus aureus y Candida albicans en núcleos colados. Fuente: Elaboración propia.
Una vez seleccionadas las colonias de interés, se sem- braron en agar sangre y se enviaron a un laboratorio certificado para confirmar su identificación. Esto mismo se realizó con algunos de los microorganismos que fueron observados con mayor frecuencia. La técnica de identificación utilizada en el laboratorio fue el sistema automa- tizado VITEK.35
Cuantificación de las colonias
Se cuantificaron las colonias que presentaban la coloración esperada en el medio diferencial, así como las identificadas como positivas para los microorganismos estudiados. Se calculó el número de UFC/ml de cada uno de los núcleos, calculando primero el promedio entre copias y transformando posteriormente la cuantificación de microlitros a mililitros.
RESULTADOS
El 90,6% (n=29) de los núcleos analizados en este estudio fueron fabricados en el laboratorio dental N.° 2. Respecto a la posición en el arco dental, el 59,4% (n=19) pertenecían a la arcada posterior y el 40,6% (n=13) pertenecían a la anterior. El 90,6% (n=29) de los núcleos fueron analizados en el laboratorio, en el mismo momento que llegaron a la clínica, y el 9,4% (n=3) estuvieron almacenados entre 3 y 4 días Tabla 1.
Análisis microbiológico de E. faecalis, S. aureus y C. albicans.
La utilización de los medios CHROMAgar UTI, Baird Parker y Chromo Candida permitió la diferenciación de colonias y orientó hacia un aislamiento más selectivo de los microorganismos estudiados. La media de colonias posibles para E. faecalis en el medio CHROMAgar UTI fue de 3,7x104 ± 1,5x105 y para S. aureus en el medio Baird Parker fue de 1,7x104 ± 7,8x103 Tabla 2. Respecto a colonias que pudieran ser C. albicans, no se observó ninguna.
Tabla 2 Presencia de las colonias candidatas en los medios diferenciales
| Medio | Media (UFC/ml) | Desviación estándar |
|---|---|---|
| Colonias azules en el medio CHROMAgar UTI | 3,7x104 | 1,5x105 |
| Colonias negras en el medio Baird Parker | 1,7x104 | 7,8x103 |
| Colonias verdes en el medio Chromo Candida | 0 | 0 |
Los núcleos N.° 2, 16, 17, 26, 27, 28, 30 y 32 presentaron un mayor número de colonias posibles para E. faecalisFigura 2. Entre las colonias se observó la predominancia de bacilos Gram negativos (cortos y largos), seguidos por cocos Gram positivos Figura 3. En la prueba de la catalasa realizada a las colonias que presentaban cocos Gram positivos, se determinó que las correspondientes al núcleo #26 fue catalasa (-) y se identificó como E. faecalis. Esta bacteria se cuantificó en 5x104 UFC/ml Tabla 3. La característica de este núcleo es que fue fabricado en el laboratorio 2, pertenecía a la arcada del diente posterior y no fue almacenado antes del análisis.
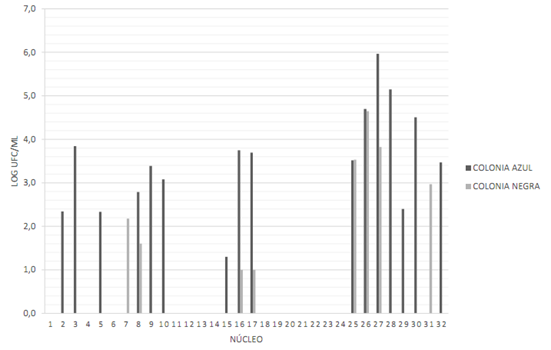
Figura 2 Presencia y cuantificación de las posibles colonias candidatas para los microorganismos estudiados. Datos transformados a log UFC/ml. Medio CHROMAgar UTI (colonia de color azul) y medio Baird Parker (colonia negra). Fuente: Elaboración propia.
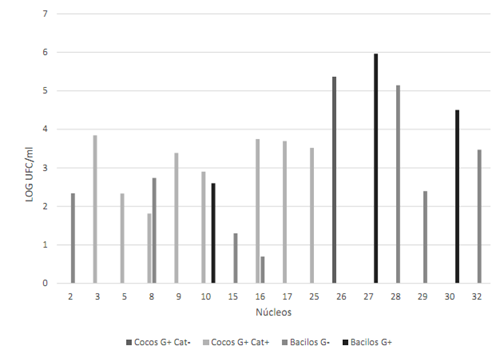
Figura 3 Morfología celular de las colonias azules presentes en el medio CHROMAgar UTI. Datos transformados a log UFC/ml. Los bacilos observados presentaban diferentes características (largos, cortos, con y sin esporas). Fuente: Elaboración propia.
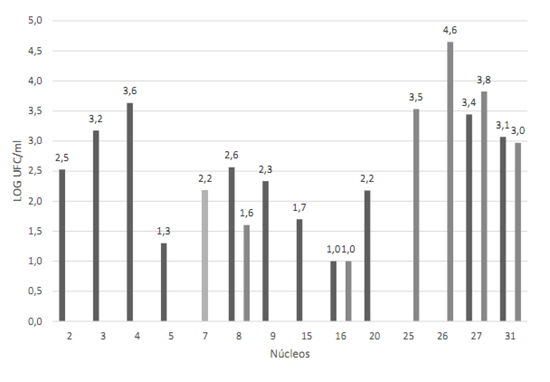
Figura 4 Morfología celular de las colonias presentes en el medio Baird Parker. Datos transformados a log UFC/ml. Fuente: Elaboración propia.
Los núcleos N.° 7, 25, 26, 27 y 31 presentaron un mayor número de colonias de color negro Figura 2, aunque sin la formación de un halo. Para asegurar la ausencia de S. aureus, se realizó la coloración Gram, la prueba de la catalasa y la coagulasa, resultando cocos Gram positivos, catalasa positiva y coagulasa negativa Figura 4, lo que permitió descartar que fueran colonias de S. aureus.
Otros microorganismos identificados
En el medio CHROMAgar UTI, además de encontrar Enterococus faecalis, se identificó Kokuria kristinae en 4 núcleos (16,1%) con una concentración media de 3,6x12 UFC/ml ± 1,3x103 y Stenotrophomona maltophilia en un núcleo (3,2%) con una concentración de 4,4x102 UFC/ml. En el medio Baird Parker, se detectó en 4 núcleos (12,9%) la presencia de S. saprophyticus con una concentración media de 1,7x103 UFC/ml ± 7x103, y la levadura Candida parapsilosis en 11 núcleos (35,5%) con una media 3,4x102 ± 9x102 Tabla 3.
Tabla 3 Presencia de E. faecalis, S. aureus, C. albicans y otros microorganismos en los núcleos fabricados para la clínica odontológica UCC, Villavicencio
| Microorganismo | Frecuencia del microorganismo | Cantidad del microorganismo |
|---|---|---|
| E. faecalis | 1 (3,2%) | 5x104 UFC/ml |
| S. aureus | 0 | 0 |
| C. albicans | 0 | 0 |
| Otros microorganismos identificados | ||
| S. saprophyticus | 4 (12,9%) | Media: 1,7x103 UFC/ml ± 7x103 |
| C. parapsilopsis | 11 (35,5%) | Media: 3,4 x102 ± 9x102 |
| C. tropicalis | 2 (6,5%) | Media: 3x101 UFC/ml ± 1x102 |
| K. kristinae | 5 (16,1%) | Media: 3,6x102 UFC/ml ± 1,3x103 |
| S. maltophilia | 1 (3,2%) | 4,4x102 UFC/ml |
Fuente: elaboración propia. ± Desviación estándar.
Respecto al medio para cuantificar C. albicans, como se mencionó anteriormente, ninguno de los núcleos presentó la formación de colonias de color verde claro. Sin embargo, dos núcleos presentaron colonias de color azul oscuro (6,5%), que fueron identificadas como Candida tropicalis con una concentración media de 3x101 UFC/ml ± 1x102 Tabla 3.
DISCUSIÓN
Los estudios han demostrado que la microbiota presente en los canales radiculares de raíces con tratamientos endodónticos difiere de las que normalmente se encuentran en los dientes no tratados.36,37 Esto indica el papel que cumplen los microorganismos de origen externo en el fracaso endodóntico y, por tanto, la importancia de mantener la cadena de asepsia durante todos los pasos del tratamiento.38 De lo contrario, se estarían transfiriendo microorganismos y sus derivados al interior del conducto, que pueden llegar hasta el área apical e incluso hasta el hueso alveolar.2,38
Aunque es previsible encontrar microorganismos en los núcleos colados después de la fabricación, se hizo necesario identificar la presencia de microorganismos que pueden generar el fracaso endodóntico. Esto con el fin de demostrar que este tipo de aditamentos pueden ser portadores de microorganismos capaces de generar infecciones postratamiento, y concientizar a la comunidad académica sobre la necesidad de su esterilización antes de utilizarlos en el paciente.
En este estudio, al igual que en el realizado por Ensinas et al,39 se encontró E. faecalis en núcleos colados. Aunque el hábitat natural de este microorganismo es el tracto gastrointestinal, también se puede encontrar en el ambiente, como en agua, suelo, materiales fabricados por el hombre o productos fermentados, debido a su gran resistencia a las condiciones extremas.40 Por tanto, es normal encontrar esta bacteria en los núcleos, los cuales, de no ser esterilizados pueden transferirla al conducto tratado y ocasionar una infección. 20,24
E. faecalis fue cuantificado en 5x104 UFC/ml, concentración que resultó ser alta para poder ocasionar infección. En un estudio realizado por Melo et al, los autores determinaron que, con una concentración de 101 y 102 UFC de E. faecalis, en canales radiculares de ratones gnotobióticos, fue suficiente para la instauración de la bacteria en el 83,33% de los casos.41 Además, la literatura reporta que solo unas pocas células viables de microorganismos capaces de establecerse después de realizar los tratamientos endodónticos es suficiente para generar el fracaso.42
Aunque los microorganismos S. aureus y C. albicans no se identificaron en los núcleos colados analizados, Ensinas et al los reportaron en su análisis microbiológico.39 Esto puede deberse a que los materiales analizados en este estudio no estuvieron en contacto con S. aureus y C. albicans o que otros tipos de microorganismos pudieron causar su inhibición.43,44 Otra razón es la metodología utilizada, ya que el grupo de Ensinas colocó los núcleos en medio de enriquecimiento antes de sembrarlos en medios comunes, aumentando así la concentración de células de estos microorganismos.
Es decir, si solo hay una célula en los núcleos, al colocarlos en medio de enriquecimiento aumenta la concentración de estas y, por tanto, es más probable su identificación. En este estudio, con el fin de determinar la cuantificación de los microorganismos analizados, se realizaron diluciones y las siembras en los medios diferenciales, sin previo enriquecimiento.
Los otros microorganismos identificados en los núcleos de este estudio también han sido implicados en el fracaso endodóntico o en otras infecciones. En este estudio se identificaron dos levaduras pertenecientes al género Candida. Entre estas está C. tropicalis, la cual, después de C. albicans, C. glabrata y C. krusei, es de las levaduras más frecuentemente aisladas en los canales radiculares infectados.45 Esta levadura causa infecciones a nivel global, después de C. albicans es la más prevalente, y comparte muchos rasgos patogénicos con esta levadura, como la capacidad de formación de biopelículas y la resistencia a algunos antifúngicos como el fluconazol, así como al hidróxido de calcio. Además, C. tropicalis se ha relacionado con fungemias y meningitis.46,47,48,49,50
Otra levadura identificada en este estudio es Candida parapsilopsis, la cual está entre los tres agentes etiológicos más frecuentes de candidiasis en el mundo. En América Latina, la frecuencia de candidiasis invasiva debido a esta levadura se ha incrementado recientemente.50 Al igual que C. albicans, C. parapsilopsis tiene la capacidad de formar biopelícula crecer en ambientes con bajo contenido de oxígeno y exhibir resistencia al hidróxido de calcio y al gluconato de clorhexidina, así como al fluconazol.50,51 Además, se ha aislado en canales radiculares infectados y en periodontitis apical aguda.49,52,53
Una bacteria encontrada en este estudio fue K. kristinae, la cual es conocida por causar bacteremias relacionadas con el uso de catéteres y endocarditis infecciosa. Además, se ha identificado en muestras de infección aguda dental en población pediátrica.54 Otra bacteria identificada fue Stenotrophomona maltophilia, la cual es considerada como una bacteria oportunista capaz de producir bacteremia, septicemia, endocarditis, meningitis, abscesos, entre otras complicaciones. Esta bacteria tiene resistencia intrínseca a los agentes antimicrobianos β-lactámicos.55 Finalmente, también se identificó S. saprophyticus, cuya característica es la generación de infecciones del tracto urinario, pero también se ha llegado a relacionar en bacteremias.56
Respecto a la metodología utilizada en este estudio, se agilizó el proceso de análisis para determinar la presencia de E. faecalis, S. aureus y C. albicans en materiales de odontología. Estos medios permitieron la diferenciación de colonias y la posterior identificación de uno de los microorganismos estudiados, mediante pruebas sencillas y económicas, como la coloración de Gram, la catalasa y la coagulasa.
CONCLUSIONES
En este estudio se identificó E. faecalis en uno de los núcleos fabricados (3,2%) para la clínica odontológica de la Universidad Cooperativa de Colombia, sede Villavicencio. A pesar de no encontrar S. aureus ni C. albicans, se encontraron otros microorganismos que pueden generar infecciones endodónticas u otro tipo de complicaciones, como C. parapsilopsis (35,5%), C. tropicalis (6,5%), K. kristinae (16,1%), S. saprophyticus (12,9%) y S. maltophilia (3,2%). Por lo tanto, es de gran importancia establecer protocolos de esterilización de estos materiales antes de su utilización.
RECOMENDACIONES
Es necesario optimizarlos procedimientos enodontología, no sólo por el éxito del tratamiento sino además por la reducción en las infecciones que puedan comprometer la salud y la vida del paciente. Además, es importante tener presente que el establecimiento estricto de protocolos de asepsia en todos los pasos del tratamiento endodóntico contribuirá también a disminuir la prescripción de antibióticos o antifúngicos. Finalmente, se recomienda utilizar la metodología desarrollada en este estudio para el análisis de este tipo de microorganismos en materiales de odontología o de otro tipo.
REFERENCIAS
1. Li X, Kolltveit KM, Tronstad L, Olsen I. Systemic diseases caused by oral infection. Clin Microbiol Rev 2000; 13(4): 547-558. [ Links ]
2. Shweta S, Prakash SK. Dental abscess: a microbiological review. Dent Res J (Isfahan) 2013; 10(5): 585-591. [ Links ]
3. Carrotte P. Endodontics: part 1. The modern concept of root canal treatment. Br Dent J 2004; 197(4): 181-183. DOI:10.1038/sj.bdj.4811565 URL:https://doi.org/10.1038/sj.bdj.4811565 [ Links ]
4. Mwangi KJ. Knowledge and practice of aseptic techniques among dental students in the University of Nairobi dental hospital [Internet]. Nairobi: University of Nairobi; 2006. Disponible en: http://dental-school.uonbi.ac.ke/print/9435 [ Links ]
5. Naik S, Khanagar S, KumarA,Vadavadagi S, Neelakantappa H, Ramachandra S. Knowledge, attitude, and practice of hand hygiene among dentists practicing in Bangalore city.A cross-sectional survey. J Int Soc Prev Community Dent 2014; 4(3): 159-163. DOI:10.4103/2231-0762.142013 URL:https://doi.org/10.4103/2231-0762.142013 [ Links ]
6. Yüzbasioglu E, Saraç D, Canbaz S, Saraç YS, Cengiz S. A survey of cross-infection control procedures: knowledge and attitudes of Turkish dentists. J Appl Oral Sci 2009; 17(6): 565-569. [ Links ]
7. Helmly SB, Coulton KM, Adams DP. A study of aseptic techniques in a dental hygiene educational clinic. J Dent Hyg 2007; 81(4) [ Links ]
8. Matsuda JK, Grinbaum RS, Davidowicz H. The assessment of infection control in dental practices in the municipality of São Paulo. Braz J Infect Dis 2011; 15(1): 45-51. DOI:10.1016/S1413-8670(11)70139-8 URL: http://dx.doi.org/10.1016/S1413-8670(11)70139-8 [ Links ]
9. Al-Haroni M, Skaug N. Knowledge of prescribing antimicrobials among Yemeni general dentists. Acta Odontol Scand 2006; 64(5): 274-280. DOI:10.1080/00016350600672829 URL:https://doi.org/10.1080/00016350600672829 [ Links ]
10. Fuentes R, Weber B, Flores T, Oporto G. Uso de profilaxis antibiótica en implantes dentales: revisión de la literatura. Int J Odontostomat 2010; 4(1): 5-8. DOI:10.4067/S0718-381X2010000100001 URL:http://dx.doi.org/10.4067/S0718-381X2010000100001 [ Links ]
11. Barzuna M, Lara D. Descripción del manejo aséptico pre-trans colocación de espiga colada/poste prefabricado. Asociación Costarricense Congresos Odontológicos 2006; 13: 80-86. Disponible en:http://www.endobarzuna.com/sites/default/files/art-13.pdf [ Links ]
12. Aslam A, Panuganti V, Nanjundasetty JK, Halappa M, Krishna V. Knowledge and attitude of endodontic postgraduate students toward sterilization of endodontic files: a cross-sectional study. Saudi Endod J 2014; 4(1): 18-22. DOI:10.4103/1658-5984.127982 URL:http://dx.doi.org/10.4103/1658-5984.127982 [ Links ]
13. Abbott PV, Salgado JC. Strategies for the endodontic management of concurrent endodontic and periodontal diseases. Aust Dent J 2009; 54(Suppl 1): S70-S85. DOI:10.1111/j.1834-7819.2009.01145.x URL: https://doi.org/10.1111/j.1834-7819.2009.01145.x [ Links ]
14. Wong AW, Zhang C, Chu CH. A systematic review of nonsurgical single-visit versus multiple-visit endodontic treatment. Clin Cosmet Investig Dent 2014; 6: 45-56. DOI:10.2147/CCIDE.S61487 URL:https://doi.org/10.2147/CCIDE.S61487 [ Links ]
15. Baumgartner JC, Bakland LK, Sugita EI. Microbiology of endodontics and asepsis in endodontic practice. En: Ingle J, Bakland L (ed). Endodontics. 5 ed. London: BC Decker Inc; 2002. 63-93. [ Links ]
16. Trope M, Bergenholtz G. Microbiological basis for endodontic treatment: can a maximal outcome be achieved in one visit? Endod Top 2002; 1: 40-53. [ Links ]
17. Farber PA, Seltzer S. Endodontic Microbiology . I . Etiology. J Endod 1988; 14(7): 363-371. DOI: 10.1016/S0099-2399(88)80200-0 URL:https://doi.org/10.1016/S0099-2399(88)80200-0 [ Links ]
18. Peciuliene V, Maneliene R, Balcikonyte E, Drukteinis S, Rutkunas V. Microorganisms in root canal infections: a review. Stomatologija 2008; 10(1): 4-9. [ Links ]
19. Peciuliene V, Reynaud AH, Balciuniene I, Haapasalo M. Isolation of yeasts and enteric bacteria in root-filled teeth with chronic apical periodontitis. Int Endod J 2001; 34(6): 429-434. [ Links ]
20. Duggan JM, Sedgley CM. Biofilm formation of oral and endodontic enterococcus faecalis. J Endod 2007; 33(7): 815-818. DOI:10.1016/j.joen.2007.02.016 URL:https://doi.org/10.1016/j.joen.2007.02.016 [ Links ]
21. Silva-Herzog D, Garcia CC, Rodríguez MH, González AM. Invasión por Candida albicans y Enterococcus faecalis en dentina humana. Rev Nal Odontol Mex 2011; 3(7): 4-8. [ Links ]
22. Gomes BP, Ferraz CC, Vianna ME, Rosalen PL, Zaia AA, Teixeira FB et al. In vitro antimicrobial activity of calcium hydroxide pastes and their vehicles against selected microorganisms. Braz Dent J 2002; 13(3): 155-161. [ Links ]
23. Peciuliene V, Balciuniene I, Eriksen HM, Haapasalo M. Isolation of enterococcus faecalis in previously Root-Filled Canals in a Lithuanian Population. J Endod 2000; 26(10): 593-595. DOI:10.1097/00004770-200010000-00004 URL:https://doi.org/10.1097/00004770-200010000-00004 [ Links ]
24. Zhang C, Du J, Peng Z. Correlation between Enterococcus faecalis and Persistent Intraradicular Infection Compared with Primary Intraradicular Infection: A Systematic Review. J Endod; 2015; 41(8): 1207-1213. DOI:10.1016/j.joen.2015.04.008 URL:http://dx.doi.org/10.1016/j.joen.2015.04.008 [ Links ]
25. Stevens RH, Grossman LI. Evaluation of the antimicrobial potential of calcium hydroxide as an intracanal medicament. J Endod 1983; 9(9): 372-374. DOI:10.1016/S0099-2399(83)80187-3 URL:https://doi.org/10.1016/S0099-2399(83)80187-3 [ Links ]
26. Hubble TS, Hatton JF, Nallapareddy SR, Murray BE, Gillespie MJ. Influence of Enterococcus faecalis proteases and the collagen-binding protein, Ace, on adhesion to dentin. Oral Microbiol Immunol 2003; 18(2): 121-126. [ Links ]
27. Reader CM, Boniface M, Bujanda-Wagner S. Refractory endodontic lesion associated with Staphylococci aureus. J Endod 1994; 20(12): 607-609. DOI:10.1016/S0099-2399(06)80087-7 URL:https://doi.org/10.1016/S0099-2399(06)80087-7 [ Links ]
28. Hegde AM, Pallavi L. Prevalence of selected microorganisms in the pulp space of human deciduous teeth with irreversible pulpitis. Endodontology 2013; 25(1): 107-111. [ Links ]
29. Gomes C, Fidel S, Fidel R, de-Moura-Sarquis MI. Isolation and taxonomy of filamentous fungi in endodontic infections. J Endod 2010; 36(4): 626-629. DOI:10.1016/j.joen.2010.01.016 URL:https://doi.org/10.1016/j.joen.2010.01.016 [ Links ]
30. Siqueira JF Jr, Sen BH. Fungi in endodontic infections. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2004; 97(5): 632-641. DOI:10.1016/S1079210404000046 URL:https://doi.org/10.1016/S1079210404000046 [ Links ]
31. Pan H, Zhang Y, He GX, Katagori N, Chen H. Acomparison of conventional methods for the quantification of bacterial cells after exposure to metal oxide nanoparticles. BMC Microbiol 2014; 14(1): 222. DOI:10.1186/s12866-014-0222-6 URL:https://doi.org/10.1186/s12866-014-0222-6 [ Links ]
32. Samra Z, Heifetz M, Talmor J, Bain E, Bahar J. Evaluation of use of a new chromogenic agar in detection of urinary tract pathogens evaluation of use of a new chromogenic agar in detection of urinary tract pathogens. J Clin Microbiol 1998; 36(4): 990-994. [ Links ]
33. Kroning IS, Iglesias MA, Sehn CP, Valente Gandra TK, Mata MM, da Silva WP. Staphylococcus aureus isolated from handmade sweets: biofilm formation, enterotoxigenicity and antimicrobial resistance. Food Microbiol 2016; 58: 105-111. DOI:10.1016/j.fm.2016.04.001 URL:https://doi.org/10.1016/j.fm.2016.04.001 [ Links ]
34. Odds FC, Bernaerts R. CHROMagar Candida, a new differential isolation medium for presumptive identification of clinically important Candida species. J Clin Microbiol 1994; 32(8): 1923-1929. [ Links ]
35. Romeu B, Salazar P, Navarro A, Lugo D, Hernández U; Rojas N et al. Utilidad del sistema VITEK en la identificación y determinación de la susceptibilidad antimicrobiana de bacterias aisladas de ecosistemas dulceacuícolas. Rev CENIC Ciencias Biol 2010; 41: 1-9. [ Links ]
36. Lana A, Ribeiro-Sobrinho AP, Stehling R, Garcia GD, Silva BK, Hamdan JS et al. Microorganisms isolated from root canals presenting necrotic pulp and their drug susceptibility in vitro. Oral Microbiol Immunol 2001; 16(2): 100-105. [ Links ]
37. Pinheiro ET, Gomes BP, Ferraz CC, Teixeira FB, Zaia AA, Souza-Filho FJ. Evaluation of root canal microorganisms isolated from teeth with endodontic failure and their antimicrobial susceptibility. Oral Microbiol Immunol 2003; 18(2): 100-103. [ Links ]
38. Ingle JI, Bakland LK, Baumgartner JC. Ingle’s endodontics 6. 6 ed. Bindner P, editor. Hamilton, Ontario: BC Decker; 2008. [ Links ]
39. Ensinas P, Zacca R, Iriarte M. Estudio microbiológico de pernos colados antes de ser cementados en el conducto radicular. Canal Abierto 2006; 14-17. [ Links ]
40. Kristich CJ, Rice LB, Arias CA. Enterococcal infection: treatment and antibiotic resistance. En: Gilmore MS. Enterococci: from commensals to leading causes of drug resistant infection. Boston: Massachusetts Eye and Ear Infirmary; 2014. [ Links ]
41. Melo-Maltos SM. Influência da dose infectante na colonização bacteriana do sistema de canais radiculares e na translocação para linfonodos submandibulares em camundongos gnotobióticos. [Trabajo de grado maestría en Endodoncia]. Belo Horizonte: Universidade Federal de Minas Gerais. Faculdade de Odontologia; 2001 . [ Links ]
42. Friedman S. Prognosis in the treatment of teeth with endodontic infections. En: Fouad AF. Endodontic microbiology. 1 ed. Singapore: Wiley-Blackwell; 2009. 281-319. [ Links ]
43. Hibbing ME, Fuqua C, Parsek MR, Peterson SB. Bacterial competition: surviving and thriving in the microbial jungle. Nat Rev Microbiol 2010; 8(1): 15-25. DOI:10.1038/nrmicro2259 URL:https://doi.org/10.1038/nrmicro2259 [ Links ]
44. Park B, Nizet V, Liu GY. Role of Staphylococcus aureus catalase in niche competition against Streptococcus pneumoniae. J Bacteriol 2008; 190(7): 2275-2278. DOI:10.1128/JB.00006-08 URL:https://doi.org/10.1128/JB.00006-08 [ Links ]
45. Slack G. The resistance to antibiotics of microorganisms isolated from root canals. Br Dent 1957; 18: 493-494. [ Links ]
46. Kothavade RJ, Kura MM, Valand AG, Panthaki MH. Candida tropicalis: Its prevalence, pathogenicity and increasing resistance to fluconazole. J Med Microbiol 2010; 59(8): 873-880. DOI:10.1099/jmm.0.013227-0 URL:https://doi.org/10.1099/jmm.0.013227-0 [ Links ]
47. Fernandes T, Silva S, Henriques M. Candida tropicalis biofilm’s matrix-involvement on its resistance to amphotericin B. Diagn Microbiol Infect Dis 2015; 83(2): 165-169. DOI:10.1016/j.diagmicrobio.2015.06.015 URL:https://doi.org/10.1016/j.diagmicrobio.2015.06.015 [ Links ]
48. Fernández-Ruiz M, Puig-Asensio M, Guinea J, Almirante B, Padilla B, Almela M et al. Candida tropicalis bloodstream infection: incidence, risk factors and outcome in a population-based surveillance. J Infect 2015; 71(3): 385-394. DOI:10.1016/j.jinf.2015.05.009 URL:https://doi.org/10.1016/j.jinf.2015.05.009 [ Links ]
49. Silva S, Negri M, Henriques M, Oliveira R, Williams DW, Azeredo J. Candida glabrata, Candida parapsilosis and Candida tropicalis: Biology, epidemiology, pathogenicity and antifungal resistance. FEMS Microbiol Rev 2012; 36(2): 288-305. DOI:10.1111/j.1574-6976.2011.00278.x URL:https://doi.org/10.1111/j.1574-6976.2011.00278.x [ Links ]
50. Pfaller MA, Diekema DJ. Epidemiology of invasive candidiasis: Apersistent public health problem. Clin Microbiol Rev 2007; 20(1): 133-163. DOI:10.1128/CMR.00029-06 URL:https://doi.org/10.1128/CMR.00029-06 [ Links ]
51. Rossignol T, Ding C, Guida A, d’Enfert C, Higgins DG, Butler G. Correlation between biofilm formation and the hypoxic response in Candida parapsilosis. Eukaryot Cell 2009; 8(4): 550-559. DOI:10.1128/EC.00350-08 URL:https://doi.org/10.1128/EC.00350-08 [ Links ]
52. Singh R, Parija SC. Candida parapsilosis: an emerging fungal pathogen. Indian J Med Res 2012; 136(4): 671-673. [ Links ]
53. George M, Ivancaková R. Root canal microflora. Acta Medica (Hradec Králové) 2007; 50(1): 7-15. [ Links ]
54. Kutllovci TA, Iljovska S, Begzati A, Jankulovska M, Popovska M, Rexhepi A et al. Bacteriological identification of selected pathogens in infected primary and young permanent teeth associated with clinical symptoms. Open J Med Microbiol 2015; 5(2): 59-68. DOI:10.4236/ojmm.2015.52007 URL: http://dx.doi.org/10.4236/ojmm.2015.52007 [ Links ]
55. Garcia DDO, Timenetsky J, Martinez MB, Francisco W, Sinto SI, Yanaguita RM. Proteases (caseinase and elastase), hemolysins, adhesion and susceptibility to antimicrobials of Stenotrophomonas maltophilia isolates obtained from clinical specimens. Braz J Microbiol 2002; 33(2): 157-162. DOI:10.1590/S1517-83822002000200012 URL:http://dx.doi.org/10.1590/S1517-83822002000200012 [ Links ]
56. Choi SH, Woo JH, Jeong JY, Kim NJ, Kim MN, Kim YS et al. Clinical significance of Staphylococcus saprophyticus identified on blood culture in a tertiary care hospital. Diagn Microbiol Infect Dis 2006; 56(3): 337-339. DOI:10.1016/j.diagmicrobio.2006.08.012 URL:https://doi.org/10.1016/j.diagmicrobio.2006.08.012 [ Links ]
Angarita-Díaz MP, Forero-Escobar D, Gutiérrez NF, Yañez FT, Romero CA. Analysis of Enterococcus Faecalis, Staphylococcus Aureus and Candida Albicans in cast metal posts [Análisis de Enterococcus faecalis, Staphylococcus aureus y Candida albicans en núcleos colados en metal base]. Rev Fac Odontol Univ Antioq 2017; 28(2): 292-310. DOI: 10.17533/udea.rfo.v28n2a4 URL: http://dx.doi. org/10.17533/udea.rfo.v28n2a4
Recibido: 13 de Septiembre de 2016; Aprobado: 24 de Enero de 2017











 text in
text in