Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Odontología Universidad de Antioquia
Print version ISSN 0121-246X
Rev Fac Odontol Univ Antioq vol.28 no.2 Medellín Jan./June 2017
https://doi.org/10.17533/udea.rfo.v28n2a6
Articles
CONTAMINACIÓN DE LOS CONOS DE GUTAPERCHA PARA USO CLÍNICO POR PARTE DE ODONTÓLOGOS Y ENDODONCISTAS1
2 DDS, MSc in Endodontics, Estácio de Sá University, Rio de Janeiro, Brazil
3 DDS, MSc, PhD Post Graduation Program in Endodontics at Estácio de Sá University, Rio de Janeiro, Brazil
Introducción:
el presente estudio consiste en una evaluación de la contaminación microbiana de los conos de gutapercha procedentes de paquetes usados clínicamente por odontólogos generales y endodoncistas.
Métodos:
se seleccionaron dos conos de gutapercha de cada uno de 30 paquetes que estaban siendo utilizados en clínica dental. Los conos fueron llevados a tubos que contenían caldo de tioglicolato e incubados a 37 °C durante 21 días en aerobiosis. Todas las pruebas se realizaron por triplicado. Los fragmentos procedentes de los tubos que presentaban turbidez fueron tratados con agar CLED y tinción de Gram.
Resultados:
de las cajas de conos de gutapercha evaluadas, 9 (30%) presentaron contaminación bacteriana en los conos evaluados, 4 (13%) de los cuales provenían de odontólogos y 5 (17%) de endodoncistas. No hubo ninguna diferencia significativa en cuanto a la contaminación de los conos con respecto a su origen (p > 0,05).
Conclusión:
los resultados del presente estudio resaltan la necesidad de que tanto odontólogos como especialistas en endodoncia implementen un estricto protocolo de desinfección antes de usar los conos de gutapercha, dado que las contaminaciones son frecuentes.
Palabras clave: contaminación bacteriana; infección en endodoncia; gutapercha; endodoncia; conducto radicular
Introduction:
the present study evaluated the microbial contamination of gutta-percha cones proceeding from packages used clinically by endodontic specialists and general practitioners.
Methods:
two gutta-percha cones were selected from 30 original packages, already in clinical use, in dental clinics. The cones were transferred directly to test tubes containing thioglycolate broth and incubated at 37 °C for 21 days in aerobiosis. All tests were done in triplicate. Fractions proceeding from the tubes that presented turbidity were plated in CLED agar and Gram staining.
Results:
among the gutta-percha cone boxes tested, 9 (30%) showed bacterial contamination in the tested cones, 4 (13%) of those coming from general practitioners and 5 (17%) coming from specialists. There was no significant difference in the contamination of cones in relation to their origin (p>0,05).
Conclusion:
the results of the present study reinforce the need for both clinical dentists and endodontics specialists to implement a strict disinfection protocol before using gutta-percha cones, due to the frequency of contamination.
Key words: bacterial contamination; endodontic infection; gutta-percha; endodontic treatment; root canal
INTRODUCCIÓN
El tratamiento de endodoncia tiene como objetivo eliminar los microorganismos del sistema de conductos radiculares y prevenir la introducción de nuevos patógenos en dicho sistema. Estos microorganismos pueden provenir de una infección primaria, o bien pueden introducirse durante las manipulaciones de la endodoncia. Algunos estudios señalan que los microorganismos y sus productos están relacionados con el fracaso del tratamiento endodóntico y con la permanencia de las enfermedades periapicales,1,2 y se consideran como los principales agentes etiológicos de la necrosis pulpar y la periodontitis apical.3,4 Aunque los factores no microbianos también pueden contribuir al fracaso endodóntico, las evidencias científicas señalan que las infecciones persistentes dentro del conducto radicular, o las infecciones secundarias, son la principal causa del fracaso endodóntico.2,5 Por lo tanto, debe prestarse atención a la presencia de microorganismos en la estructura dental: la cavidad pulpar, el sistema de conductos radiculares y los túbulos dentinarios, así como a los productos metabólicos de bacterias con potencial acción antigénica.
Cuando la total desinfección del conducto radicular se logra por medio de la preparación química y mecánica, es importante mantener esta desinfección. En primer lugar, se debe evitar la introducción de nuevos microorganismos durante los procedimientos endodónticos, ya que su eliminación es importante. Por lo tanto, es de suma importancia que las herramientas o los materiales introducidos dentro del sistema de conductos radiculares no contribuyan a la reinfección, o incluso a la persistencia de la patología endodóntica.6 Es por eso que los conos de gutapercha deben estar libres de contaminación microbiana al momento de usarse.
La literatura científica señala que los conos de gutapercha que se sacan de las cajas del fabricante antes del primer uso no deben ser esterilizados. La contaminación ocurre principalmente por el manejo continuo de las cajas, y puede ocurrir por la exposición al medio físico, por un inadecuado manejo por parte del endodoncista o por contaminación accidental.7,8,9
Los estudios sobre endodoncia recomiendan que los conos de gutapercha sean descontaminados antes de ser colocados dentro de conductos radiculares. Sin embargo, todavía hay desacuerdos en cuando a la incidencia de la contaminación.7,9,10
Existen bastantes estudios que evalúan la contaminación de los conos de gutapercha antes del primer uso o de los protocolos de desinfección; sin embargo, se carece de estudios que evalúen esta situación en las clínicas dentales. Por eso el objetivo de este estudio consistió en evaluar la ocurrencia de la contaminación de los conos de gutapercha almacenados en las cajas manipuladas por odontólogos y especialistas.
MÉTODOS
Se evaluaron conos medianos de gutapercha de diferentes marcas comerciales. Se obtuvieron treinta cajas de uso clínico: quince de consultorios odontológicos y quince de consultorios de endodoncia. Las cajas fueron cerradas y envueltas en papel grado quirúrgico previamente esterilizado y con película Figura 1A). Las cajas permanecieron selladas hasta el momento de realización de las pruebas. Todo el experimento se llevó a cabo bajo estrictas condiciones asépticas.
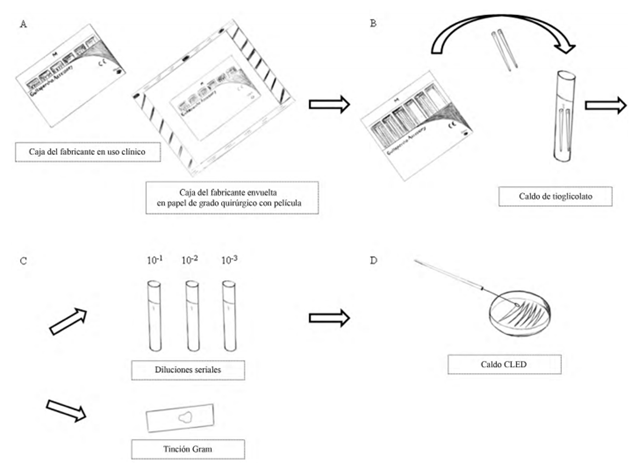
Figura 1 Diagrama de materiales y métodos. Procedimientos: (A) caja del fabricante en uso clínico envuelta en papel de grado quirúrgico; (B) conos de gutapercha transferidos al caldo de tioglicolato; (C) fragmentos de soluciones con turbidez que fueron diluidos en serie, en tinción de Gram, (D) e inmersas en agar CLED.
En el laboratorio de Microbiología, se llevaron a cabo nuevos procedimientos dentro de una cabina de flujo laminar Bio Protector 09 (Veco, Campinas, SP, Brasil), previamente descontaminado con etanol al 70% y esterilizado con luz ultravioleta durante 15 min; el operario utilizó guantes quirúrgicos e instrumentos esterilizados. Se retiraron dos conos de cada una de las 30 cajas utilizando pinzas de algodón, los cuales fueron llevados inmediatamente a un tubo que contenía 15 ml de medio de cultivo tioglicolato (medio de cultivo tioglicolato, Merck, Darmstadt, Alemania) Figura 1B). Las cajas de gutapercha presentaban algunas divisiones, y los conos se retiraron de las secciones más vacías. Para cada caja de conos se utilizó una pinza diferente. Los procedimientos mencionados anteriormente se realizaron por triplicado en cada caja, para un total de 180 conos medianos y 90 tubos de ensayo Figura 1C).
Los tubos se incubaron durante 21 días a 37 °C en aerobiosis, y se analizaron diariamente para observar la aparición de turbidez. Los tubos que presentaron turbidez durante la inspección visual fueron llevados al vórtex durante 30 s. Las soluciones fueron expuestas a una solución salina estéril con diluciones de diez veces hasta 10-³. Para la identificación bacteriológica selectiva durante la evaluación cualitativa, se insertaron alícuotas de 0,1 ml de esas soluciones en agar cistina-lactosa deficiente en electrólitos (CLED) (Merck, Darmstadt, Alemania). El cultivo se realizó en platinas de suspensión estériles. Las placas de agar fueron incubadas a 37 ºC en condiciones aerobias y evaluadas después de 24 h Figura 1D). Una alícuota de cada caldo de tioglicolato que presentaba turbidez fue sometida a tinción Gram. Se utilizó un microscopio Nikon ECLIPSE E200 para evaluar las placas.
Para separar los tubos de control (no contaminados) que presentaban turbidez, la prueba se realizó por duplicado utilizando el medio de tioglicolato en las mismas condiciones de incubación de temperatura y aerobiosis descritas anteriormente, y durante 48 horas.
Se realizó un análisis estadístico para verificar la diferencia entre los odontólogos y los especialistas en cuanto a la presencia o ausencia de contaminación. Se utilizó la prueba Chi-cuadrado. Se estableció un nivel de significancia del 5%.
Controles
Como control negativo del medio de cultivo tioglicolato, se utilizó un tubo que contenía el medio de cultivo, pero sin ninguna muestra, y se usa una placa de agar CLED sin ningún cono inoculado para el mismo propósito. Como control positivo se utilizaron dos conos de un nuevo paquete (Dentsply, Brasil) que fueron intencionalmente contaminados con Staphylococcus aureus (ATCC29213) durante 24 h en caldo tripticasa soya. Este control positivo se hizo por triplicado. La solución con Staphylococcus aureus (ATCC29213) fue llevada a una placa de agar CLED como control positivo. Todos los tubos y las placas se incubaron en las mismas condiciones descritas anteriormente.
RESULTADOS
De las 30 cajas evaluadas, los tubos de tioglicolato de 14 cajas presentaron densidad óptica modificada (turbidez) en diferentes momentos: 6 muestras después de 48 horas; 5 muestras después de siete días y 3 muestras después de 21 días. Los controles positivos y negativos mostraron los resultados esperados. De las muestras que presentaron turbidez en tioglicolato, 9 cajas (9/30 = 30%) presentaron contaminación bacteriana en la tinción Gram, 4 muestras (4/15 = 13%) presentaron contaminación bacteriana, y 5 muestras (5/30) no la presentaron. Cuatro cajas (4/15 = 13%) provenían de consultorios de odontólogos, y cinco (5/15 = 17%) de especialistas (16,6%). No hubo diferencias significativas en cuanto al nivel de contaminación de los conos con respecto a su origen (p > 0,05). Se observaron barras Gram negativas y Gram positivas, así como cocos y hongos Gram negativos Tabla 1. En el agar CLED, dos placas mostraron crecimiento bacteriano, lo que confirma la presencia de Staphylococcus aureus en dos de las cajas.
DISCUSIÓN
El desarrollo o la persistencia de enfermedades periapicales después de los procedimiento endodónticos se relacionan principalmente con la presencia de bacterias dentro del sistema de conductos radiculares.2,5,11 Se debe tratar de eliminar completamente los microorganismos de los conductos radiculares,9,10,11,12 y prevenir la introducción de otros microorganismos en el sistema durante y después del tratamiento endodóntico.
Los estudios de cultivos bacterianos en los cuales se han evaluado los datos cuantitativos para determinar la conexión entre la persistencia de microorganismos y los resultados del tratamiento endodóntico han demostrado que la aparición de cultivos positivos es causa de un mal pronóstico.2,3,4 Por lo tanto, los profesionales deben establecer protocolos terapéuticos efectivos para eliminar los microorganismos, manteniendo rigurosas condiciones asépticas para evitar la sobreinfección durante el tratamiento.5,10,11,13
Desde su implementación en la endodoncia, la gutapercha ha sido considerada el material ideal para sellar los conductos radiculares.14 Este material presenta algunos compuestos cuyo porcentaje varía según el fabricante;15,16 sin embargo, las distintas marcas incluyen un componente que muestra actividad antimicrobiana: el óxido de zinc.17
Para mejorar las propiedades antibacterianas de los conos de gutapercha, se ha propuesto adicionar varios componentes en su fórmula, como polyvinilpyrrolidoneyodo,18,19 hidróxido de calcio (CA (OH)2,19,20 clorhexidina (CHX),(19)20 y yodoformo.21 La actividad antibacteriana de los conos, cuando se asocia con otras sustancias, como la CHX, el CA(OH)2 o el yodoformo, no presenta ventajas con respecto a los conos comunes.19
Incluso cuando son tomados directamente de los paquetes cerrados, los conos de gutapercha pueden contaminarse incluso después del primer contacto con el medio ambiente. Los estudios de Higgins et al21 demostraron que el riesgo de contaminación de los conos de gutapercha inmediatamente después de ser retirados de su paquete no debía ser motivo de preocupación. Sin embargo, Namazikhah et al 22 concluyeron que, si la gutapercha no estaba contaminada intencionalmente, no hay necesidad de descontaminarla antes del sellamiento del canal radicular.
Varios estudios atribuyen la colonización microbiana de los conos de gutapercha a la propiedad antimicrobiana debida a la presencia de óxido de zinc en su composición;6,17 por otra parte, los selladores endodónticos también tienen actividad antimicrobiana. Otros estudios han demostrado el crecimiento bacteriano en muestras de conos extraídas de cajas sin abrir.7,9 Estas conclusiones deben ser analizadas cuidadosamente. Debe considerarse que, cuando el cono de gutapercha es recubierto con el sellante, algunas zonas pueden permanecer descubiertas durante la inserción en el canal, o incluso durante el recubrimiento de los conos con el sellante. Justificar la presencia de espacios en los sellantes del canal radicular sin aplicar un sellador ha sido señalado frecuentemente por la literatura, y esto es un problema grave.23,24,25
Da Motta et al25 señalan que la sola exposición de los conos al medio ambiente no es de mayor importancia. Sin embargo, nosotros hacemos énfasis en que debe respetarse el principio básico del control de la infección, pues diversos estudios han demostrado la contaminación microbiana durante la frecuente manipulación de los paquetes de gutapercha.7,9,18
El uso de material endodóntico inadecuadamente esterilizado puede inducir a fracasos en la terapia, aumentando los riesgos de introducción de microorganismos en los sistemas de conductos radiculares.6,26 Indiscutiblemente, el operador debe mantener una rigurosa bioseguridad, previniendo la contaminación de los instrumentos y materiales de sellado. Diversos estudios hacen énfasis en la necesidad de descontaminar los conos de guta-percha inmediatamente antes de su utilización.7,9,10,27 Se pueden llevar a cabo algunos protocolos de desinfección de la gutapercha, como sumergir los conos en NaOCl al 5,25% por 1 minuto,6 usar NaOCl al 2.5% o soluciones de clorhexidina al 2% por el mismo período de tiempo,28,29 o ácido peracético al 1% durante 1 minuto para una rápida desinfección.30
En el presente estudio se observó contaminación en el 30% (14/30) de las cajas de conos de gutapercha evaluadas que ya estaban siendo utilizadas en la clínica. 13,3% (4/15) de estas corresponden a muestras de odontólogos y 16,6% (9/15) a muestras de endodoncistas. Pang et al 29 hallaron un porcentaje de contaminación parecido (19,4%) en un estudio similar. Los autores evaluaron la contaminación y la desinfección de 150 conos de gutapercha procedentes de clínicas endodónticas divididos en dos grupos. El primer grupo se evaluó mediante la medición de turbidez después de ser inmersos en NaOCl al 5,25%, CHX al 2% y ChloraPrep (Medi-flex, KS) por 1, 5, 10 o 30 minutos, después de lo cual fueron secados; y el segundo grupo se evaluó por el método de reacción en cadena de polimerasa. Sus resultados indican que el 19.4% de los conos de gutapercha estaban contaminados con Staphylococcus spp. En relación con el protocolo de desinfección, los tres desinfectantes químicos fueron efectivos para la desinfección rápida contra Staphylococcus spp, y la inmersión de los conos de gutapercha durante 1 minuto fue adecuada.
Se esperaba que la contaminación fuera mayor en los conos de los especialistas porque sus cajas son usadas con mayor frecuencia debido a la gran cantidad de tratamientos de conducto radicular que realizan, en comparación con los odontólogos generales; por lo tanto, los paquetes están continuamente expuestos durante el trabajo clínico y pueden ser sujetos a mayor contaminación. Sin embargo, esta hipótesis no fue confirmada, ya que el análisis estadístico demostró que la diferencia no fue significativa. Es posible que la sólida formación de estos profesionales los haga más conscientes con respecto a la bioseguridad, manteniendo un equilibrio entre la contaminación y el manejo frecuente de los paquetes de gutapercha. Otra posible explicación es que, debido a que realizan un mayor número de tratamientos, los conos de las cajas se acaban más rápidamente, lo que los hace menos susceptibles a la contaminación del medio ambiente. Otra hipótesis es que los odontólogos generales realizan menos tratamientos endodónticos rutinariamente, y por lo tanto sus cajas pueden ser más susceptibles a la contaminación debido a la gran exposición ambiental. En consecuencia, a mayor exposición, mayor será la contaminación.
En cuanto a las técnicas de detección de microorganismos utilizadas en el presente estudio, la principal ventaja del cultivo técnico es la naturaleza de la amplia gama que cubre, que puede identificar una gran variedad de especies en la muestra, aunque requiere mucho tiempo para la evaluación e identificación de bacterias insidiosas y exigentes.31
El caldo de tioglicolato fue el principal medio de enriquecimiento utilizado en este experimento, pues proporciona los nutrientes adecuados para el crecimiento de los microorganismos que generalmente se presentan en pocas cantidades, con un crecimiento lento, o son insidiosos y exigentes. En aquellos tubos en los que el medio de cultivo tioglicolato mostró un cambio de densidad óptica detectado visualmente, la contaminación fue confirmada con el método de Gram. El resultado indica que la turbidez posiblemente se originó por la liberación de algún tinte orgánico utilizado por diversos fabricantes, como lo ha reportado la literatura.32 Esto explica el hecho de que algunas muestras no presentaron contaminación, sino que produjeron turbidez en el medio. Sólo dos muestras mostraron crecimiento en el agar CLED, que es un medio de cultivo para la diferenciación, aislamiento y enumeración de bacterias en orina. Este medio fue desarrollado originalmente para sustentar el crecimiento de agentes patógenos y contaminantes urinarios; además, fue utilizado debido a la facilidad para identificar patógenos importantes asociados con infecciones cruzadas, siendo conveniente para el aislamiento de muchos microorganismos en crecimiento aeróbico, aunque puede hacerse una diferenciación según la fermentación de la lactosa y algunas pruebas de diagnóstico directamente en este medio.
La contaminación microbiana observada en las pruebas del presente estudio coincide con la de muchos estudios que también concluyen que es necesario descontaminar la gutapercha inmediatamente antes de rellenar los conductos radiculares -especialmente aquellos estudios que investigan la presencia de contaminación microbiana de la gutapercha en paquetes sin abrir-9,23,30,32 y también coincide con otros estudios que evalúan esta contaminación en paquetes que ya están siendo utilizados en la clínica.23,30
La adecuada esterilización de los conos de gutapercha puede considerarse difícil o imposible de lograr en la práctica clínica diaria. Sin embargo, varios estudios demuestran la eficacia de los procedimientos de desinfección de los conos, como la inmersión durante 1 minuto en NaOCl al 5,25%,6 en NaOCl al 2,5%, en soluciones de clorhexidina al 2%, 8,29 o en ácido peracético al 1% para una rápida desinfección.30
CONCLUSIÓN
Nuestro estudio demuestra que la contaminación bacteriana de los conos de gutapercha en cajas para uso clínico es frecuente, y no se presentan diferencias entre los odontólogos generales y los especialistas en endodoncia. Estos resultados pueden incluso acentuar la importancia de aplicar un estricto protocolo de desinfección antes de usar los conos de gutapercha, debido a lo frecuentes que son las contaminaciones.
AGRADECIMIENTOS
Este estudio recibió subvenciones de la Fundação Carlos Chagas Filho de Amparo à Pesquisa Estado Rio de Janeiro (FAPERJ). Los autores agradecen a Marlei G. Silva por sus valiosas ayudas técnicas.
REFERENCIAS
1. Sundqvist G, Figdor D, Persson S, Sjögren U. Microbiologic analysis of teeth with failed endodontic treatment and the outcome of conservative re-treatment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998; 85(1): 86-93. [ Links ]
2. Kakehashi S, Stanley HR, Fitzgerald RJ. The effects of surgical exposures of dental pulps in germ-free and conventional laboratory rats. Oral Surg Oral Med Oral Pathol 1965; 20: 340-349. [ Links ]
3. Sundqvist G. Bacteriological studies of necrotic dental pulps. Odontological Dissertation. Umea, Sweden: University of Umea; 1976. [ Links ]
4. Siqueira JF Jr. Aetiology of root canal treatment failure: why well-treated teeth can fail. Int Endod J 2001; 34(1): 1-10. [ Links ]
5. Vianna ME, Horz HP, Conrads G, Zaia AA, Souza- Filho FG, Gomes BP. Effect of root canal procedures on endotoxins and endodontic pathogens. Oral Microbiol Immunol 2007; 22(6): 411-418. DOI:10.1111/j.1399-302X.2007.00379.x URL:https://doi.org/10.1111/j.1399-302X.2007.00379.x [ Links ]
6. Gomes BP, Vianna ME, Matsumoto CU, Rossi-Vde P, Zaia AA, Ferraz CC et al. Disinfection of gutta-percha cones with chlorhexidine and sodium hypochlorite. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 100(4): 512-517. DOI:10.1016/j.tripleo.2004.10.002 URL:https://doi.org/10.1016/j.tripleo.2004.10.002 [ Links ]
7. Seabra-Pereira OL, Siqueira JF Jr. Contamination of gutta-percha an Resilon cones taken directly from the manufacturer. Clin Oral Investig 2010; 14(3): 327-330. DOI:10.1007/s00784-009-0295-z URL: https://doi.org/10.1007/s00784-009-0295-z [ Links ]
8. Kayaoglu G, Gürel M, Omürlü H, Bek ZG, Sadik B. Examination of gutta-percha cones for microbial contamination during chemical use. J Appl Oral Sci 2009; 17(3): 244-247. [ Links ]
9. Siqueira JF Jr, Silva CH, Cerqueira MC, Lopes HP, de Uzeda M. Effectiveness of four chemical solutions in eliminating Bacillus subtilis spores on gutta-percha cones. Endod Dent Traumatol 1998; 14(3): 124-126: [ Links ]
10. Siqueira JF Jr, Rôças IN. Update on endodontic microbiology: candidate pathogens and patterns of colonisation. ENDO 2008; 2(1): 7-20. [ Links ]
11. Siqueira JF Jr, Rôças IN. Clinical implications and microbiology of bacterial persistence after treatment procedures. J Endod 2008; 34(11): 1291-1301. DOI:10.1016/j.joen.2008.07.028 URL:https://doi.org/10.1016/j.joen.2008.07.028 [ Links ]
12. Torabinejad M, Kutsenko D, Machnick TK, Ismail A, Newton CW. Levels of evidence for the outcome of nonsurgical endodontic treatment. J Endod 2005; 31(9): 637-646. [ Links ]
13. Schilder H. Filling root canals in three dimensions. J Endod 2006; 32(4): 281-290. DOI:10.1016/j.joen.2006.02.007 URL:https://doi.org/10.1016/j.joen.2006.02.007 [ Links ]
14. Friedman CM, Sandrik JL, Heuer MA, Rapp GW. Composition and mechanical properties of gutta-percha endodontic points. J Dent Res 1975; 54(5): 921-925. DOI:10.1177/00220345750540052901 URL:https://doi.org/10.1177/00220345750540052901 [ Links ]
15. Friedman CE, Sandrik JL, Heuer MA, Rapp GW. Composition and physical properties of gutta-percha endodontic filling materials. J Endod 1977; 3(8): 304-308. DOI:10.1016/S0099-2399(77)80035-6 URL:https://doi.org/10.1016/S0099-2399(77)80035-6 [ Links ]
16. Moorer WR, Genet JM. Evidence for antibacterial activity of endodontic gutta-percha cones. Oral Surg Oral Med Oral Pathol 1982; 53(5): 503-507. [ Links ]
17. Montgomery S. Chemical decontamination of gutta-percha cones with polyvinylpyrrolidone-iodine. Oral Surg Oral Med Oral Pathol 1971; 31(2): 258-266. [ Links ]
18. Podbielski A, Boeckh C, Haller B. Growth inhibitory activity of gutta-percha points containing root canal medications on common endodontic bacterial pathogens as determined by an optimized quantitative in vitro assay. J Endod 2000; 26(7): 398-403. DOI:10.1097/00004770-200007000-00005 URL:https://doi.org/10.1097/00004770-200007000-00005 [ Links ]
19. Lui JN, Sae-Lim V, Song KP, Chen NN. In vitro antimicrobial effect of chlorhexidine-impregnated gutta-percha points on Enterococcus faecalis. Int Endod J 2004; 37(2): 105-113. [ Links ]
20. Chogle S, Mickel AK, Huffaker SK, Neibaur B. An in vitro assessment of iodoform gutta-percha. J Endod 2005; 31(11): 814-816. [ Links ]
21. Higgins JR, Newton CW, Palenik CJ. The use of paraformaldehyde powder for the sterile storage of gutta-percha cones. J Endod 1986; 12(6): 242-248. DOI:10.1016/S0099-2399(86)80255-2 URL:https://doi.org/10.1016/S0099-2399(86)80255-2 [ Links ]
22. Namazikhah MS, Sullivan DM, Trnavsky GL. Gutta-percha: a look at the need for sterilization. J Calif Dent Assoc 2000; 28(6): 427-432. [ Links ]
23. Anbu R, Nandini S, Velmurugan N. Volumetric analysis of root fillings using spiral computed tomography: an in vitro study. Int Endod J 2010; 43(1): 64-68. DOI:10.1111/j.1365-2591.2009.01638.x URL:https://doi.org/10.1111/j.1365-2591.2009.01638.x [ Links ]
24. James BL, Brown CE, Legan JJ, More BK, Bail MM. An in vitro evaluation of the contents of root canals. J Endod 2007; 33(11): 1359-1363. DOI: 10.1016/j.joen.2007.07.021 URL:https://doi.org/10.1016/j.joen.2007.07.021 [ Links ]
25. da-Motta PG, de-Figueiredo CB, Maltos SM, Nicoli JR, Ribeiro-Sobrinho AP, Maltos KL et al. Efficacy of chemical sterilization and storage conditions of gutta-percha cones. Int Endod J 2001; 34(6): 435-439. [ Links ]
26. Attin T, Zirkel C, Pelz K. Antibacterial properties of electron beam sterilized gutta-percha cones. J Endod 2001; 27(3): 172-174. DOI:10.1097/00004770-200103000-00006 URL:https://doi.org/10.1097/00004770-200103000-00006 [ Links ]
27. Siqueira JF Jr, Rôças IN. Exploiting molecular methods to explore endodontic infections: Part I- Current molecular technologies for microbial diagnosis. J Endod 2005; 31(6): 411-423. [ Links ]
28. Nabeshima CK, Machado ME, Britto ML, Pallotta RC. Effectiveness of different chemical agents for disinfection of gutta-percha cones. Aust Endod J 2011; 37(3): 118-121. DOI:10.1111/j.1747-4477.2010.00256.x URL:https://doi.org/10.1111/j.1747-4477.2010.00256.x [ Links ]
29. Pang NS, Jung IY, Bae KS, Baek SH, Lee WC, Kum KY. Effects of short-term chemical disinfection of gutta-percha cones: identification of affected microbes and alterations in surface texture and physical properties. J Endod 2007; 33(5): 594-608. DOI:10.1016/j.joen.2007.01.019 URL:https://doi.org/10.1016/j.joen.2007.01.019 [ Links ]
30. Subha N, Prabhakar V, Koshy M, Abinaya K, Prabu M, Thangavelu L. Efficacy of peracetic acid in rapid disinfection of Resilon and gutta-percha cones compared with sodium hypochlorite, chlorhexidine, and povidoneiodine. J Endod 2013; 39(10): 1261-1264. DOI:10.1016/j.joen.2013.06.022. URL: https://doi.org/10.1016/j.joen.2013.06.022. [ Links ]
31. Marciano J, Michailesco PM, Abadie MJ. Stereochemical structure characterization of dental gutta-percha. J Endod 1993; 19(1): 31-34. [ Links ]
32. Marciano J, Michailesco PM. Dental gutta-percha: chemical composition, X-ray identification, enthalpic studies, and clinical implications. J Endod 1989; 15(4): 149-153. DOI:10.1016/S0099-2399(89)80251-1 URL: https://doi.org/10.1016/S0099-2399(89)80251-1 [ Links ]
Recibido: 23 de Febrero de 2016; Aprobado: 21 de Mayo de 2017











 text in
text in 



