Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Odontología Universidad de Antioquia
Print version ISSN 0121-246X
Rev Fac Odontol Univ Antioq vol.28 no.2 Medellín Jan./June 2017
https://doi.org/10.17533/udea.rfo.v28n2a10
Articles
PATOGÉNESIS DE LA FLUOROSIS DENTAL: MECANISMOS BIOQUÍMICOS Y CELULARES1
2 DMD, Universidad Nacional de Colombia, Bogotá, Colombia. Master’s Degree in Basic Biomedical Sciences, Universidad El Bosque. Associate Professor. UNICA - Unidad de Investigación en Caries. Universidad El Bosque, Bogotá, Colombia
3 DMD, Pontificia Universidad Javeriana. Pediatric Dentist, Universidad El Bosque. PhD in Health Sciences, University of Copenhagen. Professor, UNICA - Unidad de Investigación en Caries
4 DMD, Universidad Nacional de Colombia. Master’s Degree in Pharmacology and PhD in Sciences-Chemistry, Universidad Nacional de Colombia, Bogotá, Colombia. Professor, School of Dentistry, Universidad Nacional de Colombia
5 Microbiologist, Universidad de los Andes. Master’s Degree in Biochemistry and PhD in Sciences-Chemistry, Universidad Nacional de Colombia. Associate Professor. UNICA - Unidad de Investigación en Caries. Universidad El Bosque, Bogotá, Colombia
Los mecanismos involucrados en el desarrollo de la fluorosis dental aún no se conocen a cabalidad. El desarrollo de modelos in vivo e in vitro que utilizan concentraciones de fluoruro biológicamente relevantes para la aparición de fluorosis ha permitido el planteamiento de hipótesis que aportan cada vez más al conocimiento de los mecanismos que generan este defecto del desarrollo del esmalte, de alta prevalencia en Colombia. Esta revisión presenta una actualización sobre los mecanismos normales de la formación del esmalte y cómo estos se ven afectados por la exposición a altas concentraciones de fluoruro. Se presenta una revisión en detalle de los efectos deletéreos del fluoruro sobre las células y sobre la matriz extracelular, especialmente durante la etapa de maduración, que tendrán como consecuencia el retraso de la remoción de la matriz proteica de amelogeninas y se traducirá en la apariencia de esmalte moteado, característica de la fluorosis dental. Por último, se muestran las perspectivas del estudio de este defecto del desarrollo del esmalte desde la bioquímica y la biología celular y molecular.
Palabras clave: fluorosis dental; amelogénesis; amelogenina; proteínas del esmalte dental
The mechanisms involved in the development of dental fluorosis are still unknown. The development of in vivo and in vitro models using biologically relevant concentrations of fluoride for the emergence of fluorosis has allowed suggesting hypotheses that contribute to the understanding of the mechanisms that produce this defect in enamel development, with high prevalence in Colombia. This topic review presents an update on the normal mechanisms of the formation of enamel and how they are affected by exposure to high concentrations of fluoride. This is a thorough review of the deleterious effects of fluoride on the cells and the extracellular matrix, especially during the maturation stage, resulting in a delay of the removal of the protein matrix of amelogenins, as well as the appearance of mottled enamel-a characteristic of dental fluorosis. Finally, it shows the perspectives of the study of this defect in enamel development from biochemistry and cellular and molecular biology.
Key words: dental fluorosis; amelogenesis; amelogenin; dental enamel proteins
INTRODUCCIÓN
El uso de fluoruros ha demostrado tener un efecto positivo sobre la prevención de caries dental y se ha catalogado como una de las medidas de salud pública más relevantes del siglo XX.1,2 Su administración (que puede ser tópica o sistémica) tiene el objetivo último de mantener una concentración constante de iones fluoruro (F-) en la cavidad oral para favorecer la incorporación de estos a los cristales de la superficie del esmalte erupcionado -disminuyendo la tasa de desmineralización y aumentando la tasa de remineralización-.3 Sin embargo, actualmente se conoce que la ingestión excesiva de F- tiene efectos deletéreos sobre el esmalte en desarrollo, generando un fenotipo hipomineralizado, poroso y de menor dureza.4 Además de las consecuencias estéticas y funcionales, un estudio in vitro realizado en la Unidad de Investigación en Caries (UNICA), sobre dientes extraídos con fluorosis moderada provenientes de pacientes colombianos, sugiere que la porosidad del esmalte con fluorosis lo hace más susceptible a la desmineralización.5
A diferencia del factor etiológico de la fluorosis dental -que está plenamente identificado como la exposición crónica a altas concentraciones de F- entre los 0 y 5 años-,6 se conoce poco sobre los mecanismos celulares y moleculares afectados por el F- que llevan al desarrollo de fluorosis. En el caso de Colombia, contamos con reportes epidemiológicos7 y de identificación de las fuentes de ingesta de F- posiblemente responsables de la alta prevalencia,8,9 pero no se ha investigado sobre la patogénesis del defecto.
Sabemos que la presencia crónica y sostenida del ion F- en el plasma aumenta la probabilidad de su incorporación a los tejidos en proceso de mineralización,10 pero existe la percepción errónea de que la hipomineralización observada en la fluorosis dental es consecuencia única de la incorporación excesiva de F- en el esmalte. En esta revisión de la literatura, comprenderemos que el fenotipo hipomineralizado de la fluorosis es el desenlace de una serie de efectos que el ion F- puede tener sobre la fisiología celular y las proteínas responsables de guiar la mineralización del esmalte (biomineralización). Primero, realizaremos una breve introducción al proceso normal de biomineralización del esmalte, y posteriormente estudiaremos la evidencia disponible sobre los efectos del F- en momentos claves del proceso.
Amelogénesis y biomineralización del esmalte
El esmalte es una biocerámica nanocompuesta,11 con un 95% de material inorgánico, 4% de agua y 1% de materia orgánica.12,13 Para la formación del esmalte son necesarios cuatro elementos: células, iones, proteínas y un compartimento en el que se lleva a cabo la reacción de mineralización (matriz extracelular).12 El proceso de formación del esmalte se denomina en conjunto amelogénesis, mientras que el proceso de mineralización como tal, que se da entre iones y proteínas secretadas por las células, se denomina biomineralización. Las células formadoras de esmalte se denominan ameloblastos, y durante el proceso atraviesan una serie de cambios resumidos en las siguientes etapas: diferenciación, secreción, maduración y transición.14 En la etapa de secreción de los ameloblastos, estos transportan iones desde el plasma hacia el interior de la célula: el tipo de ion que ingrese dependerá, entre otros factores, de su disponibilidad en ese momento en el plasma.15 Es por este motivo que el mineral del esmalte (que es semejante al mineral puro hidroxiapatita) contiene usualmente una variedad de iones en su.estructura, como HPO42-, CO32-, Na+ y F-16
Además de transportar y secretar iones, los ameloblastos sintetizan y secretan una gran cantidad de proteínas, que son el componente mayoritario del esmalte en formación (> 90%).(17) Dentro de las proteínas secretadas están, en primer lugar, las de la matriz extracelular (amelogenina, ameloblastina y enamelina) y en segundo lugar las proteasas: metaloproteinasa de matriz 20 (MMP-20) y calicreína 4 (KLK-4). La enamelina y la ameloblastina funcionan como nucleadores, atrayendo iones a su estructura proteica para favorecer el depósito organizado de las sales de fosfato de calcio en forma de cristales.18
Por otro lado, la amelogenina asume una organización supramolecular superior (nanoesferas de 20 nm) y funciona como un “andamio” que direcciona el crecimiento de los cristales para la formación de prismas.19 El papel de la ameloblastina es menos claro, pero se ha encontrado que tiene funciones en la adhesión y el control de la diferenciación de los ameloblastos.20 La MMP-20 degrada paulatinamente y de forma selectiva el soporte proteico durante las etapas de secreción y maduración, para permitir el ensanchamiento de los cristales de esmalte que previamente crecieron en longitud.21 En el inicio de la etapa de maduración, las células dejan de producir MMP-20 y comienzan a producir KLK-4, la proteasa que finaliza el proceso de degradación del material proteico del esmalte.22 La KLK-4 corta los restos de las proteínas estructurales en péptidos pequeños que pueden procesarse en la célula.23 Al final de este proceso ordenado de la etapa de maduración, el componente proteico será menor al 1%11 y el esmalte resultante tendrá una porosidad mínima y una apariencia clínica traslúcida, brillante y lisa al tacto.
De la mano de la evidencia sobre los mecanismos normales de formación del esmalte (resumida anteriormente), se han desarrollado estudios de inducción de fluorosis para comprender qué etapas del proceso se ven afectadas por el fluoruro, como se describirá a continuación.
¿Qué concentraciones de fluoruro se utilizan en experimentos in vivo e in vitro para la inducción de fluorosis dental?
A pesar de la existencia de modelos estandarizados (descritos más adelante), no existe consenso en cuanto a la concentración de F- biológicamente relevante para la inducción de fluorosis dental tanto en estudios in vivo como in vitro. Por un lado, una línea de evidencia utiliza en sus estudios concentraciones de F- del orden micromolar (µM) y considera biológicamente relevantes las concentraciones de 2-12 µmol/L.24,25,26,27 Otra línea de evidencia argumenta que, en condiciones normales, existen niveles basales de F- en el fluido del esmalte que se elevan proporcionalmente al aumento de la concentración de F- en plasma y exponen a los ameloblastos a concentraciones milimolares (mM) de F-.28 Las dificultades en el consenso y la relación directamente proporcional entre la dosis de F- y las respuestas celulares hacen necesario que los efectos reportados para el F- se examinen siempre acompañados de la concentración utilizada en los experimentos.
Modelos in vivo e in vitro estandarizados para el estudio de la fluorosis dental
Se han establecido dos modelos in vitro: el primero consiste en una línea de células inmortalizadas, similares a ameloblastos, derivadas del órgano del esmalte del primer molar de ratones Swiss-Webster recién nacidos. Esta línea se obtuvo con la transfección de células del epitelio del órgano del esmalte con el oncogen del virus SV40 y se denomina LS8.29 El segundo modelo consiste en cultivos primarios estandarizados de células del epitelio del órgano del esmalte de fetos humanos de 21 semanas.30 Este último representa el modelo in vitro ideal para el estudio de fluorosis, por provenir de células humanas y expresar mayor número de marcadores que la línea de ratón; sin embargo, la obtención de las muestras tiene implicaciones éticas y dificultades técnicas que hacen que el modelo de células LS8 sea el más conveniente y de mayor uso.
En cuanto a los modelos in vivo, se han empleado mamíferos como ratas,31 ratones,32 hamsters,33 conejos34 y especies mayores, como cerdos35 y ovejas.36 El modelo de rata ha demostrado ser el más apropiado para el estudio de la fluorosis dental,31 dado que los incisivos de los roedores erupcionan de forma continua, y en un solo diente se pueden apreciar las diferentes etapas del desarrollo del esmalte; además, existe evidencia de que en humanos y otros animales, los niveles de F- en plasma requeridos para la aparición de defectos fluoróticos en esmalte son muy similares.25,31,37,38
A nivel molecular, la fluorosis dental es consecuencia del retraso en la remoción de las proteínas de la matriz extracelular, principalmente durante la fase de maduración del esmalte.
La inducción de fluorosis en modelos celulares y animales ha permitido determinar en qué medida el F- que circula en el plasma en concentraciones excesivas durante la amelogénesis tiene efectos deletéreos sobre las diferentes etapas, incluyendo la etapa de secreción.39 En esta etapa se ha reportado que el fluoruro induce alteraciones en el transporte vesicular de los ameloblastos40 y en la degradación intracelular de proteínas de la matriz por parte del sistema lisosomal.41,42 Sin embargo, los estudios experimentales de fluorosis se han enfocado específicamente en la etapa de maduración del esmalte (cuando suceden la secuencia ordenada de crecimiento cristalino, la digestión proteolítica por enzimas diferentes y la absorción de los residuos proteicos), pues ha demostrado ser la más sensible a los efectos negativos del F-. Esto se fundamenta en estudios in vivo realizados en ratas, en la cuales se demostró que el consumo de altas cantidades de F- retrasa la eliminación de las proteínas (especialmente de amelogeninas).24,25 La capacidad disminuida para la eliminación de amelogeninas desencadenada por el F- impide el engrosamiento de los cristales de esmalte y lleva a que la mineralización se dé de forma incompleta.43
En la misma etapa de maduración, en la que los ameloblastos regulan el pH con la secreción de bicarbonato y el uso de transportadores iónicos para absorber protones de la matriz,44 la gran cantidad de protones (H+) liberados como consecuencia de la alta tasa de precipitación de cristales de esmalte genera fluctuaciones de pH (de neutro a ácido),45 y la presencia de altas concentraciones de F- en un ambiente ácido tiene efectos deletéreos, como presentaremos más adelante en esta revisión. Aunque el efecto del F- sobre la maduración es crítico, su efecto nocivo sobre las demás etapas tampoco es despreciable y podría ser acumulativo, si tenemos en cuenta que la severidad de la fluorosis responde a una exposición sostenida y prolongada.43
Efectos del fluoruro sobre la fisiología de los ameloblastos
Se ha registrado que a una concentración de 10 µM de F- ocurre una disminución en la expresión de MMP-20,46,47 a concentraciones de entre 10 y 20 µM F- se da un aumento de la apoptosis, y a concentraciones mayores a 1 mM se presenta una alteración de la proliferación celular.47 Además, concentraciones de 120 µM de F- reducen la expresión de mensajeros de amelogenina, ameloblastina, enamelina y MMP-20, así como factores de vascularización como el factor de crecimiento endotelial (VEGF), las proteínas quimio-atrayentes de monocitos (MCP-1) y la proteína inducible por interferón (IP-10).48
La regulación del pH es fundamental para el crecimiento cristalino: la precipitación de los iones durante la maduración del esmalte libera gran cantidad de protones (H+), después de lo cual sigue la reacción [10Ca2+ + 6HPO42+ 2H2O Ca10 (PO4)6(OH)2 + 8H+], y el pH de la matriz extracelular pasa de neutro a levemente ácido.45 Estos cambios de pH se ven reflejados en la alteración de la morfología de estas células, que se observan de extremos rugosos ante un pH ácido y de extremos lisos ante un pH neutro. En el desarrollo normal del esmalte se presenta una alternancia de estas morfologías; sin embargo, en estudios in vitro se ha observado que la modulación entre la morfología lisa y rugosa se retarda, con predominio de la rugosa.47 Por lo tanto, como consecuencia de la presencia de fluoruro, el pH de la matriz extracelular permanece ácido por un tiempo prolongado.
De la exposición de células LS8 a concentraciones de 250-2000 µM de F- se han desprendido observaciones interesantes: el aumento en la concentración de protones (H+), en presencia de una alta concentración de iones F-, conduce a la formación del ácido fluorhídrico (HF), que es absorbido por las células y causa cambios severos en el metabolismo celular.49 Estos hallazgos sugieren una hipótesis interesante: el exceso de F- citoplasmático en el ameloblasto induce estrés en el retículo endoplásmico y la activación de un mecanismo de defensa llamado “respuesta a proteínas mal plegadas” (UPR, unfolded protein response), que tiene como consecuencia la disminución de la síntesis y secreción de KLK-4, indispensable para la eliminación de la matriz proteica de amelogenina y la maduración final de los prismas del esmalte.50,51,52
Cuando el F- atraviesa la membrana citoplasmática hacia el frente de mineralización, se registra otra cadena de efectos, demostrada por estudios in vitro recientes, que describen que la llegada masiva de F- al frente de mineralización genera una capa hipermineralizada de esmalte que se podría comportar como una barrera física que impediría la difusión de iones y proteínas a la subsuperficie del frente de mineralización.53 Este evento molecular podría dificultar el ingreso de la “materia prima” necesaria para la mineralización completa de los cristales y, de esta manera, contribuir a la hipomineralización del esmalte fluorótico.
Efectos del fluoruro sobre la actividad de las proteasas de la matriz extracelular
Se conoce que el F- es un inhibidor de la actividad de las proteasas de la matriz extracelular del esmalte. Aunque el número de estudios es limitado, los resultados no han podido demostrar una inhibición directa de la actividad enzimática,54,55,56 por lo que hasta ahora se descarta al F- como inhibidor de proteasas dentro de la patogénesis de la fluorosis.
Efectos del fluoruro sobre la cinética de la biomineralización
La incorporación de F- a los cristales de esmalte durante su formación aumenta la fuerza de unión de la amelogenina al cristal 57 y disminuye su tasa de hidrólisis.58 Esta evidencia se ha recogido en ensayos con amelogenina recombinante unida a hidroxiapatita sintética con concentraciones de F- similares a las encontradas en dientes humanos con fluorosis. Es posible que la unión de las proteínas a cristales con alto contenido de F- desencadene cambios en su conformación, “ocultando” algunos sitios de corte y disminuyendo el acceso de las proteasas,57 disminuyendo la velocidad de remoción de las proteínas de la matriz e impidiendo el engrosamiento y la maduración del cristal. Estos estudios proporcionan evidencia suficiente para sugerir que la fluorosis dental es consecuencia del retraso en la remoción de proteínas durante la etapa de maduración del esmalte. Además, sería posible que las proteínas se retengan en el esmalte erupcionado.
Siguiendo la lógica anterior, se han realizado estudios sobre la retención de amelogenina en el esmalte erupcionado con fluorosis.58,59 El bajo contenido proteico del esmalte erupcionado (<1% en el esmalte sano), y las dificultades para la extracción de proteínas atrapadas en la matriz mineral, han limitado los estudios orientados a extraer, identificar y cuantificar el material proteico del esmalte.
Con el fin de ampliar el estudio de la fluorosis dental en Colombia, en la Unidad de Investigación en Caries (UNICA) estandarizamos un método para la extracción e identificación de proteínas del esmalte a través de cromatografía líquida acoplada a espectrometría de masas, el cual se aplicó a una muestra de dientes de pacientes colombianos.60 Usando este método, comparamos las proteínas identificadas en el esmalte erupcionado de dientes sanos y con fluorosis. Con nuestro análisis encontramos amelogenina, ameloblastina y enamelina; esta última con mayor frecuencia en el esmalte fluorótico, lo cual sugiere un posible papel de esta proteína en los eventos que desencadenan la fluorosis. Además, mediante la cuantificación relativa de los péptidos identificados de amelogenina, no encontramos diferencias en el contenido proteico entre el esmalte sano y con fluorosis.11 Los reportes existentes sobre este tema son contradictorios,58,59,61 y a la fecha no podemos hablar de una retención de proteínas en el esmalte fluorótico, sino de una alteración en la velocidad de remoción de las mismas, que retrasa el proceso de maduración del cristal de esmalte.43
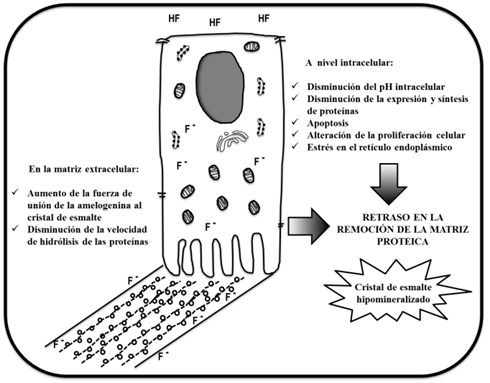
En la figura 1 se resume la evidencia disponible sobre los mecanismos bioquímicos y celulares reportados a la fecha, posiblemente relacionados con la patogénesis de la fluorosis dental.
CONCLUSIONES Y PERSPECTIVAS
Los mecanismos celulares y moleculares mediante los cuales se produce la fluorosis dental no se han dilucidado por completo. Tampoco existe consenso sobre las concentraciones biológicamente relevantes de F- que generan fluorosis dental en seres humanos. En modelos in vitro e in vivo se ha observado que, cuando el F- se encuentra en altas concentraciones y de forma sostenida, tiene efectos nocivos sobre los ameloblastos. Estos efectos deletéreos son proporcionales a las dosis de F- empleadas y tienen como consecuencia la disminución de la capacidad del ameloblasto para la síntesis y la secreción de proteínas, especialmente en la etapa de maduración. La susceptibilidad de esta etapa en especial puede deberse a las fluctuaciones de pH que experimentan los ameloblastos debido a la alta concentración de protones liberados durante la precipitación de cristales. Aunque se ha pensado en el F- como inhibidor directo de las proteasas MMP-20 y KLK-4 (como posible causa de la retención de proteínas), la evidencia disponible a la fecha descarta esa hipótesis. Por ahora, se conoce que el F- afecta la cinética de la biomineralización, disminuye la velocidad de la hidrólisis de las proteínas e interrumpe el proceso de eliminación de la matriz proteica, desencadenando la mineralización incompleta de los cristales de esmalte y dando origen al esmalte poroso característico de la fluorosis dental.
Se espera que futuras investigaciones, orientadas al estudio de la patogénesis de la fluorosis dental, aporten evidencia al estudio de las concentraciones de fluoruro biológicamente relevantes (por ejemplo, fluoruro en plasma de habitantes de zonas endémicas de fluorosis), para así homologarlas a estudios in vivo e in vitro. Es importante, además, bajo dichas concentraciones, realizar estudios sobre otros efectos del F- sobre la fisiología celular y la cinética de la biomineralización in vitro que permitan dilucidar por completo los mecanismos que conllevan al defecto y replicar estudios que -ante la evidencia contradictoria- confirmen si efectivamente hay o no retención de proteínas en el esmalte con fluorosis.
AGRADECIMIENTOS
A la doctora Margarita Úsuga Vacca, por su revisión crítica del manuscrito.
REFERENCIAS
1. Sampaio FC, Levy SM. Systemic fluoride. Monogr Oral Sci 2011; 22: 133-45. DOI: 10.1159/000325161 URL: https://doi.org/10.1159/000325161 [ Links ]
2. Marinho VC, Higgins JP, Sheiham A, Logan S. One topical fluoride (toothpastes, or mouthrinses, or gels, or varnishes) versus another for preventing dental caries in children and adolescents. Cochrane Database Syst Rev 2004; 1: CD002780. DOI:10.1002/14651858.CD002780.pub2 URL: https://doi.org/10.1002/14651858.CD002780.pub2 [ Links ]
3. Robinson C, Shore RC, Brookes SJ, Strafford S, Wood SR, Kirkham J. The chemistry of enamel caries. Crit Rev Oral Biol Med 2000; 11(4): 481-495. [ Links ]
4. Aoba T, Fejerskov O. Dental fluorosis: chemistry and biology. Crit Rev Oral Biol Med 2002; 13(2): 155-170. [ Links ]
5. Marín LM, Cury JA, Tenuta LMA, Castellanos JE, Martignon S. Higher fluorosis severity makes enamel less resistant to demineralization. Caries Res 2016; 50: 407-413. [ Links ]
6. Dean HT. Chronic endemic dental fluorosis (mottled enamel). J Am Med Assoc 1936; 107(16): 1269-1273. DOI:10.1001/jama.1936.02770420007002 URL:https://doi.org/10.1001/jama.1936.02770420007002 [ Links ]
7. Agudelo-Suárez AA, Martínez-Flórez LM, Madrid- Gutiérrez LM, Vivares-Builes AM, Rocha-Buelvas A. Panorama de la fluorosis dental en Colombia: una revisión exploratoria de la literatura. Univ Odontol 2013; 32(68): 133-145. [ Links ]
8. Franco AM, Martignon S, Saldarriaga A, González MC, Arbeláez MI, Ocampo A et al. Total fluoride intake in children aged 22-35 months in four Colombian cities. Community Dent Oral Epidemiol 2005; 33(1): 1-8. [ Links ]
9. Franco AM, Saldarriaga A, Martignon S, González MC, Villa AE. Fluoride intake and fractional urinary fluoride excretion of Colombian preschool children. Community Dent Health 2005; 22(4): 272-278. [ Links ]
10. Angmar-Mansson B, Ericsson Y, Ekberg O. Plasma fluoride and enamel fluorosis. Calcif Tissue Res 1976; 22: 77-84. [ Links ]
11. Boyde A. Microstructure of enamel. Ciba Found Symp 1997; 205: 18-27 [ Links ]
12. Simmer JP, Fincham AG. Molecular mechanisms of dental enamel formation. Crit Rev Oral Biol Med 1995; 6(2): 84-108. [ Links ]
13. Deakins M, Volker J. Amount of organic matter in enamel from several types of human teeth. J Dent Res. 1941; 20(2): 117-121. [ Links ]
14. Simmer JP, Hu JC. Dental enamel formation and its impact on clinical dentistry. J Dent Educ 2001; 65(9): 896-905. [ Links ]
15. Reith EJ, Boyde A. The enamel organ, a control gate for calcium influx into the enamel. J Dent Res 1979 Mar; 58(Spec Issue B): 980. [ Links ]
16. Young RA. Biological apatite vs hydroxyapatite at the atomic level. Clin Orthop Relat Res 1975; (113): 249-262. [ Links ]
17. Termine JD, Belcourt AB, Christner PJ, Conn KM, Nylen MU. Properties of dissociatively extracted fetal tooth matrix proteins. I. Principal molecular species in developing bovine enamel. J Biol Chem 1980; 255(20): 9760-9768. [ Links ]
18. Moradian-Oldak J. Protein-mediated enamel mineralization. Front Biosci 2012; 17: 1996-2023 [ Links ]
19. Beniash E, Simmer JP, Margolis HC. The effect of recombinant mouse amelogenins on the formation and organization of hydroxyapatite crystals in vitro. J Struct Biol 2005; 149(2): 182-190. [ Links ]
20. Fukumoto S, Kiba T, Hall B, Iehara N, Nakamura T, Longenecker G et al. Ameloblastin is a cell adhesion molecule required for maintaining the differentiation state of ameloblasts. J Cell Biol 2004; 167(5): 973-983. [ Links ]
21. Caterina JJ, Skobe Z, Shi J, Ding Y, Simmer JP, Birkedal- Hansen H et al. Enamelysin (matrix metalloproteinase 20)-deficient mice display an amelogenesis imperfecta phenotype. J Biol Chem 2002; 277(51): 49598-49604. [ Links ]
22. Ryu O, Hu JC, Yamakoshi Y, Villemain JL, Cao X, Zhang C et al. Porcine kallikrein-4 activation, glycosylation, activity, and expression in prokaryotic and eukaryotic hosts. Eur J Oral Sci 2002; 110(5): 358-365. [ Links ]
23. Moradian-Oldak J, Leung W, Simmer JP, Zeichner- David M, Fincham AG. Identification of a novel proteinase (ameloprotease-I) responsible for the complete degradation of amelogenin during enamel maturation. Biochem J 1996; 318 (Pt 3): 1015-1021. [ Links ]
24. DenBesten PK, Crenshaw MA. The effects of chronic high fluoride levels on forming enamel in the rat. Arch Oral Biol 1984; 29: 675-679. [ Links ]
25. DenBesten PK. Effects of fluoride on protein secretion and removal during enamel development in the rat. J Dent Res 1986; 65: 1272-1277. [ Links ]
26. DenBesten PK, Crenshaw MA, Wilson MH. Changes in the fluoride-induced modulation of maturation stage ameloblasts of rats. J Dent Res 1985; 64: 1365-1370. [ Links ]
27. Yan Q, Zhang Y, Li W, Denbesten PK. Micromolar fluoride alters ameloblast lineage cells in vitro. J Dent Res 2007; 86: 336-340. [ Links ]
28. Riksen EA, Kalvik A, Brookes S, Hynne A, Snead ML, Lyngstadaas SP, Reseland JE. Fluoride reduces the expression of enamel proteins and cytokines in an ameloblast-derived cell line. Arch Oral Biol 2011; 56(4): 324-330. [ Links ]
29. Chen LS, Couwenhoven RI, Hsu D, Luo W, Snead ML. Maintenance of amelogenin gene expression by transformed epithelial cells of mouse enamel organ. Arch Oral Biol 1992; 37(10): 771-778. [ Links ]
30. DenBesten PK, Machule D, Zhang Y, Yan Q, Li W. Characterization of human primary enamel organ epithelial cells in vitro. Arch Oral Biol 2005; 50(8): 689- 694. [ Links ]
31. Angmar-Månsson B, Whitford GM. Plasma fluoride levels and enamel fluorosis in the rat. Caries Res 1982; 16(4): 334-339. [ Links ]
32. Everett ET, McHenry MA, Reynolds N, Eggertsson H, Sullivan J, Kantmann C et al. Dental fluorosis: variability among different inbred mouse strains. J Dent Res 2002; 81(11): 794-798. [ Links ]
33. Bronckers AL, Jansen LL, Wöltgens JH. Long-term (8 days) effects of exposure to low concentrations of fluoride on enamel formation in hamster tooth-germs in organ culture in vitro. Arch Oral Biol 1984; 29(10): 811-819. [ Links ]
34. Susheela AK, Bhatnagar M. Fluoride toxicity: a biochemical and scanning electron microscopic study of enamel surface of rabbit teeth. Arch Toxicol 1993; 67(8): 573-579. [ Links ]
35. Andersen L, Richards A, Care AD, Andersen HM, Kragstrup J, Fejerskov O. Parathyroid glands, calcium, and vitamin D in experimental fluorosis in pigs. Calcif Tissue Int 1986; 38(4): 222-226. [ Links ]
36. Milhaud GE, Charles E, Loubière ML, Kolf-Clauw M, Joubert C. Effects of fluoride on secretory and postsecretory phases of enamel formation in sheep molars. Am J Vet Res 1992; 53(7): 1241-1247. [ Links ]
37. Bronckers AL, Lyaruu DM, DenBesten PK. The impact of fluoride on ameloblasts and the mechanisms of enamel fluorosis. J Dent Res 2009; 88(10): 877-893. [ Links ]
38. Martínez-Mier EA, Soto-Rojas AE, Ureña-Cirett JL, Stookey GK, Dunipace AJ. Fluoride intake from foods, beverages and dentifrice by children in Mexico. Community Dent Oral Epidemiol 2003; 31(3): 221-230. [ Links ]
39. Kierdorf H, Kierdorf U. Disturbances of the secretory stage of amelogenesis in fluorosed deer teeth: a scanning electron-microscopic study. Cell Tissue Res 1997; 289: 125-135. [ Links ]
40. Matsuo S, Inai T, Kurisu K, Kiyomiya K, Kurebe M. Influence of fluoride on secretory pathway of the secretory ameloblast in rat incisor tooth germs exposed to sodium fluoride. Arch Toxi-col 1996; 70: 420-429. [ Links ]
41. Bronckers AL, Lyaruu DM, Bervoets TJ, Woltgens JH. Fluoride enhances intracellular degradation of amelogenins during secretory phase of amelogenesis of hamster teeth in organ culture. Connect Tissue Res 2002; 43: 456-465. [ Links ]
42. Monsour P, Harbrow J, Warshawsky H. Effects of acute doses of sodium fluoride on the morphology and the detectable calcium associated with secretory ameloblasts in rat incisors. J Histchem Cytochem 1989; 37: 463-471 [ Links ]
43. Denbesten P, Li W. Chronic fluoride toxicity: dental fluorosis. Monogr Oral Sci 2011 ; 22: 81-96. [ Links ]
44. Zheng L, Zhang Y, He P, Kim J, Schneider R, Bronckers AL et al. NBCe1 in mouse and human ameloblasts may be indirectly regulated by fluoride. J Dent Res 2011; 90: 782-787. [ Links ]
45. Sasaki S, Takagi T, Suzuki M. Cyclical changes in pH in bovine developing enamel as sequential bands. Arch Oral Biol 1991; 36: 227-231. [ Links ]
46. Zhang Y, Yan Q, Li W, DenBesten PK. Fluoride down- regulates the expression of matrix metalloproteinase-20 in human fetal tooth ameloblast-lineage cells in vitro. Eur J Oral Sci 2006; 114(Suppl 1): 105-110. [ Links ]
47. Zhang Y, Li W, Chi HS, Chen J, Denbesten PK. JNK/c- Jun signaling pathway mediates the fluoride-induced down-regulation of MMP-20 in vitro. Matrix Biol 2007; 26(8): 633-641. [ Links ]
48. Riksen EA, Kalvik A, Brookes S, Hynne A, Snead ML, Lyngstadaas SP et al. Fluoride reduces the expression of enamel proteins and cytokines in an ameloblast-derived cell line. Arch Oral Biol 2011; 56(4): 324-330. [ Links ]
49. Sierant ML, Bartlett JD. A Potential Mechanism for the Development of Dental Fluorosis. Interface Oral Health Science 2011 2012: 408-412. [ Links ]
50. Kubota K, Lee DH, Tsuchiya M, Young CS, Everett ET, Martinez-Mier EA et al. Fluoride induces endoplasmic reticulum stress in ameloblasts responsible for dental enamel formation. J Biol Chem 2005; 280(24): 23194- 23202. [ Links ]
51. Sharma R, Tsuchiya M, Skobe Z, Tannous BA, Bartlett JD. The acid test of fluoride: how pH modulates toxicity. PLoS One 2010; 5(5): e10895. [ Links ]
52. DenBesten PK, Yan Y, Featherstone JD, Hilton JF, Smith CE, Li W. Effects of fluoride on rat dental enamel matrix proteinases. Arch Oral Biol 2002; 47(11): 763- 770. [ Links ]
53. Lyaruu DM, Medina JF, Sarvide S, Bervoets TJ, Everts V, Denbesten P et al. Barrier Formation: A Potential Molecular Mechanism of Enamel Fluorosis J Dent Res 2014; 93: 96-102. [ Links ]
54. Gerlach RF, de Souza AP, Cury JA, Line SR. Fluoride effect on the activity of enamel matrix proteinases in vitro. Eur J Oral Sci 2000; 108(1): 48-53. [ Links ]
55. Tye CE, Antone JV, Bartlett JD. Fluoride does not inhibit enamel protease activity. J Dent Res 2011; 90: 489-494. [ Links ]
56. Tanimoto K, Le T, Zhu L, Chen J, Featherstone JD, Li W et al. Effects of fluoride on the interactions between amelogenin and apatite crystals. J Dent Res 2008; 87: 39- 44. [ Links ]
57. DenBesten PK, Zhu L, Li W, Tanimoto K, Liu H, Witkowska HE. Fluoride incorporation into apatite crystals delays amelogenin hydrolysis. Eur J Oral Sci 2011; 119 Suppl 1: 3-7. [ Links ]
58. Wright JT, Chen SC, Hall KI, Yamauchi M, Bawden JW. Protein characterization of fluorosed human enamel. J Dent Res 1996; 75(12): 1936-1941. [ Links ]
59. Eastoe J, Fejerskov O. Composition of mature enamel proteins from fluorosed teeth. In: Tooth Enamel IV. Amsterdam: Elsevier 1984; 326-330. [ Links ]
60. Castiblanco GA, Rutishauser D, Ilag LL, Martignon S, Castellanos JE, Mejía W. Identification of proteins from human permanent erupted enamel. Eur J Oral Sci 2015 Dec; 123(6): 390-395 [ Links ]
61. Castiblanco GA, Ilag LL, Castellanos JE, Martignon S, Mejía W. Protein characterization of sound and fluorosed enamel. J Dent Res 2014; 93(Spec Iss B): 671. [ Links ]
Recibido: 09 de Junio de 2016; Aprobado: 16 de Agosto de 2016











 text in
text in