Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Odontología Universidad de Antioquia
Print version ISSN 0121-246X
Rev Fac Odontol Univ Antioq vol.29 no.2 Medellín Jan./June 2018
https://doi.org/10.17533/udea.rfo.v29n2a6
Original article
CARACTERÍSTICAS SALIVARES EN PERSONAS CON ENFERMEDAD DE ALZHEIMER FAMILIAR POR LA MUTACIÓN E280A
1 DMD. School of Dentistry, Universidad de Antioquia, Medellín, Colombia.
2 DMD. MA in Education, PhD in Philosophy, Universidad de Antioquia, Medellín, Colombia.
3 DMD. Specialist in Epidemiology. Universidad CES. MSc in Social Gerontology, Universidad de Barcelona, Barcelona. España.
Introducción:
la enfermedad de Alzheimer es una alteración neurodegenerativa caracterizada por la pérdida de funciones cognitivas. Existe una alta prevalencia de esta enfermedad a nivel mundial, por lo que resulta oportuno tener una mayor comprensión de las necesidades y condiciones de salud bucal de los sujetos con este desorden. El presente estudio se llevó a cabo en una población con mutación E280A para la enfermedad de Alzheimer. El objetivo consistió en describir las características salivares de las personas con enfermedad de Alzheimer familiar precoz, con el fin de detectar cambios en el microbioma bucal que puedan orientar el manejo odontológico de estos pacientes.
Métodos:
estudio transversal en 37 participantes que habitan el Área Metropolitana de la ciudad de Medellín, con una edad promedio de 53 ± 6 años, en diferentes estadios de la enfermedad: leve: 8, moderada: 7 y grave: 22, evaluados mediante pruebas neuropsicológicas. Se tomaron muestras salivares, se evaluó la tasa de secreción salivar y la capacidad buffer de la saliva y se efectuó un análisis microbiano de las principales especies presentes en boca.
Resultados:
el 45,9% de los participantes presentaron una tasa disminuida de secreción salivar estimulada; la capacidad buffer salivar estuvo disminuida en el 83,87% de los participantes, con valores promedios de pH luego de la prueba de Ericsson de 3,449 ± 0,89. La capacidad buffer se encontró alterada tanto en los participantes con tasa de secreción disminuida como en aquellos con tasa de secreción salivar no alterada. Se observó alto crecimiento microbiano, principalmente de Streptococcus mutans y Candida albicans.
Conclusiones:
este estudio sugiere que pueden existir otros factores, además de los farmacológicos, que afectan la tasa de flujo salivar en los pacientes con enfermedad de Alzheimer familiar precoz, como la edad y la severidad de la enfermedad.
Palabras clave: enfermedad de Alzheimer familiar; xerostomía; capacidad buffer; saliva estimulada
Introduction:
Alzheimer’s disease is a neurodegenerative disorder characterized by the loss of cognitive functions. The prevalence of this disease worldwide is high, and therefore it is important to have a better understanding of the oral health needs and conditions of individuals with this disorder. The present study was carried out in a population with E280A mutation for Alzheimer’s disease. The goal was to describe the salivary characteristics of persons with early familial Alzheimer’s disease, in order to detect changes in the oral microbiome that can guide the dental management of these patients.
Methods:
transversal study in 37 participants living in the Metropolitan Area of the city of Medellín, aged 53 ± 6 years in average, in different stages of the disease: mild: 8, moderate: 7, and severe: 22, and evaluated by neuropsychological tests. Salivary samples were collected, evaluating saliva secretion rate and saliva buffer capacity, and conducting microbial analysis of the species most commonly found in the mouth.
Results:
45.9% of participants showed a decreased rate of stimulated salivary secretion; salivary buffer capacity was decreased in 83.87% of participants, with average pH values of 3.449 ± 0.89 after the Ericsson test. Buffer capacity was altered in participants with decreased secretion rate and in those with no alteration in salivary secretion rate. High levels of microbial growth were observed, mainly for Streptococcus mutans and Candida albicans.
Conclusions:
This study suggests that other factors besides the pharmacological ones, like age and disease severity, may affect the salivary rate flow in patients with early familial Alzheimer’s disease.
Key words: familial Alzheimer’s disease; xerostomia; buffer capacity; stimulated saliva
INTRODUCCIÓN
La enfermedad de Alzheimer (EA) es un trastorno neurodegenerativo caracterizado por una pérdida progresiva de las funciones cognitivas.1 Es una enfermedad de alta prevalencia: cerca de un 10 a 12% de la población mundial mayor de 65 años padece el trastorno, y se cree que habrá un crecimiento exponencial de la cifra.2 Como consecuencia, la demanda de servicios odontológicos se ha incrementado, por lo que se hace necesario una mayor comprensión de las necesidades y condiciones de salud bucal de los sujetos con EA.
Existen dos formas de presentación de la afección: enfermedad de Alzheimer esporádica (EAE) y familiar (EAF). La anatomía patológica es similar en ambas entidades, y se caracteriza por ovillos neurofibrilares, placas seniles, cambios granulo-vasculares y gliosis. No obstante, la EAF se desarrolla a edades más tempranas que la EAE (antes de los 65 años de edad).3
Diferentes cromosomas han sido asociados con la aparición de enfermedad de Alzheimer familiar precoz: 21, 14, 19 y 1.4 El Grupo de Neurociencias de Antioquia (GNA) ha identificado y estudiado la población más grande del mundo con esta entidad, asociada a la mutación E280A del cromosoma 14. Este foco está conformado por 42 extensas genealogías con más de 5.000 herederos, distribuidos por todo el departamento de Antioquia y el país. La causa de esta mutación es la sustitución del ácido glutámico por alanina, en el codón 280 del gen de la presenilina-1, en el cromosoma 14, por lo que se conoce como mutación E280A, o mutación paisa. Esta población ha adquirido importancia en el estudio de demencias a nivel mundial, dado que se constituye en el mayor grupo familiar afectado con EAF.5
Las evidencias reportadas en la literatura respecto a la salud buco-dental de las personas con EA han identificado cambios significativos en las condiciones bucales, como hiposalivación, susceptibilidad a riesgo de infecciones, ardor de mucosas y lengua, alteraciones del gusto, dislalia, alteraciones en la deglución, síndrome de boca seca, fisuras y ulceraciones en mucosa y lengua.6 Sin embargo, todos estos hallazgos han sido identificados en la forma esporádica de la enfermedad. No se ha realizado ningún estudio en personas con EAF.
El propósito del presente estudio consistió en describir las características salivares de personas con enfermedad de Alzheimer familiar precoz, buscando detectar alteraciones en la saliva que podrían desencadenar cambios en el microbioma bucal. Esto permitirá implementar protocolos de atención en salud bucal en esta población, antes y después de que aparezcan signos y síntomas de la EA.
MATERIALES Y MÉTODOS
Mediante un estudio descriptivo transversal, se contactaron todos los sujetos registrados en las bases de datos del Grupo de Neurociencias de Antioquia, todos ellos residentes en el Área Metropolitana del Valle de Aburrá. En el estudio se incluyeron inicialmente 41 sujetos correspondientes al universo (N = 41). De ellos, un sujeto falleció antes de poder realizar la toma de la muestra, y tres rechazaron la participación en el estudio, por lo que se evaluaron 37 sujetos con enfermedad de Alzheimer familiar, la mayoría de ellos procedentes de Medellín y Angostura. Se hizo una entrevista preliminar, en la que se registraron datos sociodemográficos de los sujetos, como edad, estrato socioeconómico y años de escolaridad, y aspectos clínicos, como el uso de medicamentos. El diagnóstico de la severidad de la enfermedad se basó en criterios médicos y pruebas neuropsicológicas, como Mini Mental State Examination (MMSE), quejas de memoria familiar (QF) y del paciente (QP), escala de deterioro global (EDG), Functional Assessment Staging (FAST) y evocación. En la Tabla 1 se muestran los criterios para la clasificación del estadio de la enfermedad.7
Tabla 1 Clasificación del estadio de la enfermedad de Alzheimer basada en algunas pruebas neuropsicológicas. 7
| Estadio | MMSE | EDG | FAST |
|---|---|---|---|
| Leve | 30-23 | 1-3 | 1-3 |
| Moderado | 23-12 | 4-5 | 4-5 |
| Grave | 12-0 | 6-7 | 6a-7f |
Los participantes y cuidadores se contactaron a través del GNA; se realizaron visitas domiciliarias y se informó sobre la finalidad del estudio y su libertad para participar en esta investigación. Se firmó el consentimiento informado aprobado por el comité de ética de la Facultad de Odontología de la Universidad de Antioquia.
Para la toma de muestra de saliva, se les dieron algunas indicaciones a los cuidadores antes de la toma de la muestra: evitar el consumo de alimentos sólidos una hora antes de la prueba y realizar la higiene bucal y de prótesis dentales media hora antes de la evaluación. La toma de las muestras se realizó entre 09:00 h y 11:00 h para minimizar las variaciones asociadas al ciclo circadiano.
Inspección clínica
Se le solicitó al participante abrir la boca para observar el estado de salud bucal. Se registró el número total de dientes presentes en la boca y el uso de prótesis dentales, estableciendo el tipo de prótesis usada en tres categorías: fija, removible y total.
Evaluación salivar
A cada participante se le pidió masticar un trozo de cera estéril e inclinar la cabeza hacia abajo, y por el método de sustracción manual con pipetas Pasteur plásticas estériles, se recolectó saliva del piso de la boca, la cual se llevó a tubos Falcon® de 50ml (VWR International, Pensilvania) para su transporte. Se registró la cantidad de saliva presente (mL) durante 5 minutos y se calculó la tasa de secreción salivar. Se continuó con la toma de las muestras hasta obtener por lo menos 5 mL de saliva, para realizar las demás pruebas en el Laboratorio de Microbiología e Histopatología Oral de la Facultad de Odontología de la Universidad de Antioquia. Las muestras fueron transportadas para su análisis en una nevera portátil. Para evaluar la capacidad buffer salivar, se siguió el método de Ericsson.8 Para ello, se midió el pH salivar inicial de 1 mL de saliva, con el uso de pH-metro WTW 330 (Weight Watchers International, Inc. New York). Inmediatamente después, a la muestra se le agregaron 3 mL de ácido clorhídrico al 0,005 N, se mezcló en agitador magnético y a los 20 minutos se evaluó el pH final.
Recuento microbiano
El recuento de microorganismos se realizó con la muestra de saliva total obtenida de los participantes. De la muestra total de saliva, se realizaron diluciones seriadas en Brain Heart Infusion (BHI) (Oxoid, Basingstoke, UK) en viales de vidrio (Thermo Ficher Science, Massachusetts, US) con 0,9 mL de BHI, agregando 0,1 mL de saliva total en 0,9 mL de BHI para la dilución de 10-1. Se prepararon diluciones de 10-2 a 10-5, agregando 0,1 mL de la dilución inmediatamente anterior; en medio de cada dilución se agitaron los viales en vortex.
Para el aislamiento de Streptococcus mutans, se tomó 0,1 mL de las diluciones 10-4 y 10-5 y se extendió, con la ayuda de un hisopo estéril, en cajas de petri (Waldner Laboreinrichtungen GmbH & Co, Allgäu) con agar mitis salivarius (Beckton & Dickinson, Nueva Jersey, US), preparado con 20% de sacarosa, 1% de telurito y 0,1% de bacitracina. Las cajas se incubaron en un ambiente microaerófilo a 37 °C durante 72 horas, momento en el cual se interrumpió la incubación y se realizó el recuento de las unidades formadoras de colonias. El cultivo para la búsqueda de Candida albicans se realizó en agar saboureaud dextrosa (Merck, Darmstadt), tomando 0,1 mL de la muestra de saliva total con técnica de siembra en superficie. Se incubó en ambiente microaerófilo a 37 ºC durante 72 horas; luego se registró la cantidad de colonias.
Para la obtención de Lactobacillus spp se utilizó agar rogosa 25 mL (Merck, Darmstadt) con la técnica de siembra en profundidad, para recrear el ambiente anaerobio. Para esto, se agregó 1 mL de la dilución 10-3. Se incubó por 72 horas en un ambiente anaerobio a 37 ºC. Se realizó lectura y se registraron los hallazgos.
Para el recuento de colonia de cada especie se utilizó estereomicroscopio MS-2 20x (Optika, Ponteranica BG, Italia) y contador de colonias (Acequilabs, Bogotá, Colombia). Se seleccionaron estos microorganismos como parte importante de la flora patógena asociada con las enfermedades más prevalentes en boca.
Los resultados se analizaron pasadas las 72 horas y se hizo la lectura utilizando la carta de Frost. Se registró el número de bacterias en función de las unidades formadoras de colonia por mL (UFC/mL); se reportó como “cultivo negativo” cuando no hubo crecimiento bacteriano, y como “incontable” cuando la cantidad de colonias en el agar fue muy grande y no permitía hacer un recuento con precisión.
Análisis estadístico
Los datos se analizaron con el programa IBM-SPSS Statistics para Windows versión 23.0 (Armonk, NY: IBM corp.). Se hizo análisis descriptivo con las medidas de resumen (promedio, desviación estándar, mínimos y máximos) para todas las variables cuantitativas. Las variables cualitativas se describieron con las frecuencias absolutas y relativas expresadas de manera porcentual. Se utilizó un análisis estadístico exploratorio, para el cual se usó la prueba de Shapiro Wilk para evaluar la normalidad de las variables salivares. Se usó la prueba de ANOVA para comparar la edad y las variables salivares de las personas con Alzheimer respecto al estadio de la enfermedad. Su utilizó la prueba t Student para comparar el uso o no de medicamentos respecto a las variables salivares. Adicionalmente, se utilizó el coeficiente de correlación de Pearson para evaluar la relación entre las variables salivares. Siempre se utilizó un nivel de significancia del 0,05 para todo el análisis estadístico exploratorio.
RESULTADOS
Perfil sociodemográfico
Se evaluaron 37 participantes, 15 hombres (40,5%) y 22 mujeres (59,5%), diagnosticados con enfermedad de Alzheimer familiar por la mutación E280A en diferentes estadios: leve: 8 (21,6%), moderada: 7 (18,9%) y severa: 22 (59,5%). La edad promedio de los participantes fue de 53 ± 6 años, con un promedio de edad de 54 ± 5 años (mujeres) y 51 ± 5 años (hombres). La distribución de la edad cambia con respecto al estadio de la enfermedad; el promedio de edad fue mayor en el estadio severo, con diferencias estadísticamente significativas con respecto a los estadios moderado y leve; valores p < 0,04 y 0,05 respectivamente (Tabla 2).
La mayoría de los participantes (94,6%) eran de los estratos socioeconómicos 1, 2 y 3, y los demás pertenecían al estrato 4. La escolaridad media de los participantes era de 8,0 ± 4,7 años.
En la evaluación clínica se encontró que los participantes tenían en promedio 15,3 ± 10,8 dientes. La muestra fue heterogénea en cuanto a esta variable, pues hubo desde participantes con edentulismo (18,9%) hasta participantes con dentición permanente completa (5,4%). El 24,3% de los sujetos utilizaba algún tipo de prótesis, en su mayoría (10,8%) prótesis parcial removible superior o inferior. En los estadios leve, moderado y severo, los participantes presentaron 23 ± 9,6, 18 ± 10,6 y 12 ± 9,7 dientes, respectivamente, con un coeficiente de correlación de Pearson de 0,45.
Examen salivar completo
1. Tasa de secreción salivar estimulada (TSSE)
Se encontró que el promedio de la tasa de secreción salivar estimulada fue de 0,59 ± 0,41 mL/min. El 45,9% de la muestra tenía una TSSE disminuida.9) Con un promedio de 54,4 ± 7,7 años, y con un consumo de 1,9 ± 1,2 medicamentos, estos se encontraban en un estadio de la enfermedad de moderado a severo, mientras que aquellos con una tasa de secreción adecuada tenían una edad promedio de 51,9 ± 6,9 años, consumían 2,3 ± 1,3 medicamentos y presentaban un estadio de la enfermedad de leve a moderado. En la Tabla 3 se muestran los valores de secreción salivar según el estadio de la enfermedad, con diferencias estadísticamente significativas en la tasa de secreción salivar entre el estadio leve y el moderado y el estadio leve y el severo, con valores de p de 0,003 y 0,000, respectivamente.
2. Capacidad buffer salivar (CBS)
Se encontró un pH inicial promedio de 7,0 ± 0,7. La CBS se observó disminuida en el 83,9% de los participantes, encontrándose un promedio de pH de 3,5 ± 0,9 luego de someterlo a ácido clorhídrico, lo que indica un valor por debajo del pH crítico salivar de 5.
En la Figura 1 se presenta un gráfico de dispersión de puntos que muestra la poca correlación de las variables: capacidad buffer salivar y tasa de secreción salivar con un coeficiente de correlación de Pearson de 0,277, que sugiere que la tasa de secreción es independiente de la capacidad buffer.
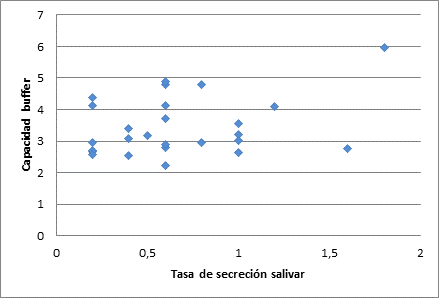
Figura 1 Correlación entre la capacidad buffer y la tasa de secreción salivar en personas con Alzheimer
3. Recuento microbiano
Durante la evaluación de los recuentos microbianos en saliva, se encontró que el promedio de UFC de S. mutans fue de 3,39*106 UFC/mL, con valores entre 0 y 2,4*107 UFC/mL. Al realizar el recuento de Lactobacillus spp, el promedio fue de 2,58*104 UFC/mL, con valores entre 0 y 1,5*105 UFC/mL. Por otra parte, para el cultivo de C. albicans se encontró un recuento promedio alto (>102 UFC/mL) en el 73% de los participantes.
Tabla 3 Variables del análisis salivar según el estadio de la enfermedad.
| n | X ± D.E | |||
|---|---|---|---|---|
| Tasa de secreción salivar mL/min | Leve | 8 | 1,14 ± 0,38 | |
| Moderado | 7 | 0,59 ± 0,21 | ||
| Severo | 22 | 0,40 ± 0,28 | ||
| Total | 37 | 0,59 ± 0,41 | ||
| Capacidad buffer | Leve | 8 | 3,93 ± 1,21 | |
| Moderado | 7 | 3,47 ± 0,53 | ||
| Severo | 16 | 3,20 ± 0,77 | ||
| Total | 31 | 3,45 ± 0,89 | ||
| Recuento de S. Mutans (UFC/mL) | Leve | 8 | 3,19*106 ± 5,89*106 | |
| Moderado | 7 | 5,94*106 ± 9,23*106 | ||
| Severo | 22 | 2,65*106 ± 4,68*106 | ||
| Total | 37 | 3,39*106 ± 5,94*106 | ||
| Recuento de Lactobacillus (UFC/mL) | Leve | 8 | 4,43*104 ± 3,96*104 | |
| Moderado | 7 | 2,51*104 ± 5,52*104 | ||
| Severo | 22 | 1,93*104 ± 2,35*104 | ||
| Total | 37 | 2,58*104 ± 3,52*104 | ||
Tipos de medicamentos y asociación con variables salivares
En la Tabla 4 se muestran los tipos de medicamentos utilizados por los participantes en este estudio y su porcentaje de uso. La mayor cantidad de medicamentos consumidos fueron los anticonvulsivantes y antipsicóticos, asociados ampliamente con la disminución de la secreción salivar.
Tabla 4 Resumen de los medicamentos usados por las personas con Alzheimer y el porcentaje de uso
| Inhibidores de colinesterasa | Anticonvulsivantes | Antipsicóticos | Antidepresivos | Antagonistas de los receptores NMDA | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| % | % | % | % | % | ||||||
| Rivastigmina | 16,2 | Ácido valproico | 48,6 | Quetiapina | 43,2 | Trazodona | 21,6 | Memantina | 13,5 | |
| Donepezilo | 10,8 | Clonazepam | 5,4 | Olanzapina | 16,2 | Fluoxetina | 8,1 | |||
| Gabapentina | 2,7 | Clozapina | 2,7 | Sertralina | 8,1 | |||||
| Carbamazepina | 2,7 | Haloperidol | 2,7 | Escitalopram | 2,7 | |||||
| Levetiracetam | 2,7 | Levomepromazina | 2,7 | |||||||
| Fenitoina | 2,7 | |||||||||
| Fenobarbital | 2,7 | |||||||||
Las variables salivares evaluadas en este estudio mostraron una diferencia estadísticamente significativa (p < 0,005) entre el uso de antidepresivos y la tasa de secreción salivar, sin influir en las otras variables salivares analizadas. Por otra parte, también se encontró una diferencia estadísticamente significativa entre el uso de anticonvulsivantes, la tasa de secreción salivar (p < 0,003) y la capacidad buffer de la saliva (p < 0,009) (Tabla 5).
En la Tabla 5 se observa el comportamiento de las variables salivares con los diferentes grupos de medicamentos consumidos por los participantes.
Tabla 5 Medicamentos y asociación con variables salivares
| Tasa de secreción salivar | Capacidad buffer | Recuento de S. Mutans | Recuento de Lactobacillus | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Medicamentos | Uso | n | 𝑿 ± DEp | 𝑿 ± DEp | 𝑿 ± DEp | 𝑿 ± DEp | |||||
| Inhibidores de Colinesterasa | No | 27 | 0,53 ± 0,40 | ,005 | 3,40 ± 0,88 | ,79 | 3,06*106 ± 5,87*106 | 1,11 | 2,11*104 ± 2,87*104 | 3,01 | |
| Sí | 10 | 0,75 ± 0,43 | 3,57 ± 0,96 | 4,26*106 ± 6,39*106 | 3,84*104 ± 4,82*104 | ||||||
| Anticonvulsivantes | No | 16 | 0,69 ± 0,40 | ,003 | 3,62 ± 0,88 | ,009 | 3,69*106 ± 6,89*106 | ,193 | 3,23*104 ± 3,51*104 | ,905 | |
| Sí | 21 | 0,51 ± 0,41 | 3,31 ± 0,90 | 3,16*106 ± 5,28*106 | 2,09*104 ± 3,53*104 | ||||||
| Antipsicóticos | No | 16 | 0,59 ± 0,37 | ,028 | 3,56 ± 0,84 | ,071 | 2,67*106 ± 4,58*106 | 1,26 | 2,57*104 ± 3,42*104 | ,125 | |
| Sí | 21 | 0,60 ± 0,45 | 3,36 ± 0,95 | 3,93*106 ± 6,87*106 | 2,59*104 ± 3,67*104 | ||||||
| Antidepresivos | No | 23 | 0,51 ± 0,32 | ,099 | 3,47 ± 0,80 | ,510 | 3,74*106 ± 6,61*106 | ,340 | 3,09*104 ± 3,94*104 | ,132 | |
| Sí | 14 | 0,73 ± 0,52 | 3,42 ± 1,06 | 2,81*106 ± 4,82*106 | 1,74*104 ± 2,61*104 | ||||||
| Antagonistas de los receptores NMDA | No | 32 | 0,61 ± 0,43 | ,297 | 3,44 ± 0,89 | ,220 | 3,45*106 ± 6,26*106 | ,505 | 2,65*104 ± 3,62*104 | ,174 | |
| Sí | 5 | 0,48 ± 0,31 | 3,49 ± 1,12 | 2,96*106 ± 3,70*106 | 2,12*104 ± 3,04*104 | ||||||
DISCUSIÓN
Se evaluaron 37 participantes portadores de la mutación E280A para enfermedad de Alzheimer familiar precoz. Esta y otras formas genéticas constituyen cerca del 1% de la enfermedad en el mundo.(10 Por tanto, la muestra estudiada es representativa, en contraste con la baja prevalencia del mal. Estudios epidemiológicos en EA han informado que existe una mayor prevalencia de esta entidad en mujeres que en hombres.2 En los resultados de este estudio, se aprecia un comportamiento semejante en los individuos estudiados, pues se halló que el 59,5% de la muestra eran mujeres, quienes tenían en promedio 2,6 años más que los hombres.
En el análisis sociodemográfico del estudio se evidenció un bajo nivel socioeconómico y un bajo grado de escolaridad.11
La literatura ha sugerido que hay un mayor riesgo de enfermar de Alzheimer cuando existe un menor nivel de escolaridad y un bajo nivel socioeconómico.12 No obstante, las variables sociodemográficas cumplen un rol secundario en las formas de presentación genética de la enfermedad.13,14
Otros estudios que han analizado los problemas de salud bucal en personas con EA no especifican el tipo de enfermedad de Alzheimer estudiada, y en dichos estudios las edades promedio exceden los 60 años,15,16 cuando las condiciones o el estado de salud buco-dental pueden presentar alteraciones mayores, inherentes a un mayor deterioro orgánico. Este estudio cobra validez, dado que da claridad sobre el tipo de enfermedad de Alzheimer y estudia sujetos con edades inferiores.
Durante la exploración clínica, se evaluó el número de dientes naturales presentes en los participantes y se encontró una prevalencia de edentulismo del 18,9%, el cual es un valor bajo si se compara con los resultados de otros estudios, que oscilan entre el 50 y el 70%.17,18 Esta investigación sugiere que existe una correlación positiva entre el número de dientes y el estadio de la enfermedad, observándose una menor proporción de dientes en los sujetos con EA familiar de moderada a severa. En un grupo de 60 pacientes evaluados en la Universidad Estatal Paulista Júlio de Mesquita Filho (Brasil), 30 con EA y 30 en el grupo control, Ribeiro et al (2012) encontraron valores de COP-D mayores en personas con estadio moderado y severo de la enfermedad (p = 0,0191).15 Sin embargo, Machado et al, en un estudio realizado en el mismo país, no encontraron una significancia estadística entre la severidad de la enfermedad y el número de dientes naturales (p = 0,346).16
En el examen de la saliva, se encontró que el promedio de la tasa de secreción salivar estimulada fue de 0,59 ± 0,41 mL/min. Estos hallazgos son ligeramente inferiores a los encontrados por Leal et al en un estudio realizado en 40 voluntarios, 20 de ellos con demencia senil, en los que la tasa de secreción salivar estimulada fue de 0,69 ± 0,39.6 Se ha reportado que valores de 0,5 a 0,7 mL/min para el flujo salivar estimulado son indicadores de sialopenia o hiposalivación.9,19 Los resultados de este estudio muestran que el 45,9% de la muestra tiene una tasa de secreción salivar disminuida. Dicha disminución ha sido explicada en algunos estudios,20-22 en los que se ha relacionado el consumo de medicamentos en personas con EA con el flujo salivar reducido. Sin embargo, en este estudio se observó que las personas con secreción salivar reducida (en estadios moderado a severo) presentaron una mayor edad, junto a un menor consumo de medicamentos, que aquellos con secreción salivar adecuada (en estadio leve a moderado). De este modo, al comparar a los participantes con tasa salivar no alterada con los participantes con flujo salivar reducido, se puede sugerir que otras variables adicionales a los factores farmacológicos analizados en este estudio, como la edad y la severidad de la enfermedad, pueden influir en el comportamiento de la fisiología salivar.
Adicionalmente, Lopez-Jornet y Bermejo-Fenoll explican la influencia de la edad en el flujo salivar, indicando que el parénquima de las glándulas salivares sufre cambios degenerativos con la edad, lo que puede explicar un menor flujo salivar en personas mayores;23 esta premisa refuerza los hallazgos de este estudio, que muestran una reducción del flujo salivar en los participantes de mayor edad. Por otra parte, un estudio de la Universidad de Oxford ha demostrado que personas con EA no medicadas presentan una hiposalivación, limitada a la glándula submandibular, de causa no demostrada.24 Por tanto, las causas de dicha hiposalivación en las personas con EA son susceptibles de nuevas confrontaciones científicas.
En condiciones de salud, se ha reportado que el pH de la saliva en reposo se mantiene en un estrecho rango, entre 6,7 y 7,4.25 Al evaluar el pH inicial de los participantes se encontraron rangos de 7,021 ± 0,743, resultados que sugieren un pH salivar adecuado. La capacidad buffer de la saliva se observó disminuida en la mayoría de los participantes, pues se encontró un promedio de pH, luego de someterlo a ácido clorhídrico, de 3,449 ± 0,89, valor que expresa una CBS reducida, con incapacidad de estabilizar el pH crítico de la boca, que es de 5,5.26 Existe una asociación positiva entre la reducción del flujo salivar y una disminución de la capacidad buffer.27 Sin embargo, los participantes que no tienen alteración en el flujo salivar exhiben una disminución significativa de la capacidad buffer de la saliva, como puede observarse en la figura 1 -resultados que sugieren que las personas con EA familiar evaluadas en este estudio tienen una CBS disminuida, independientemente de la tasa de secreción salivar-.
Dentro de la microbiota oral, S. mutans cumple un importante rol en el inicio de la enfermedad de caries, siendo el microorganismo aislado con mayor frecuencia en lesiones cariosas en humanos.28,29 Los recuentos superiores a 105 UFC/mL de S. mutans indican mayor riesgo de caries dental.30 Lactobacillus spp es otra de las bacterias implicadas en el proceso cariogénico; normalmente, se encuentra bajo recuento de este microorganismo en saliva, pero aumenta al establecerse S. mutans en la cavidad oral.31 Hidalgo et al han reportado que el alto grado de infección por lactobacilos (> 106 UFC/mL) se relaciona con elevada actividad de caries.32
El presente estudio muestra que el promedio de UFC de S. mutans fue de 3,3878*106 UFC/mL, con valores entre 0 y 2,4*107 UFC/mL, lo cual indica un recuento alto de este microorganismo en personas con EAF. Los participantes con edentulismo (18,9%) presentaron crecimiento bajo o negativo de esta especie bacteriana, que coloniza principalmente superficies sólidas del medio bucal.33 Por otra parte, el recuento promedio de Lactobacillus spp fue de 2,5784*104 UFC/mL, con valores entre 0 y 1,5*105 UFC/mL, lo que coincide con valores de referencia.
La presencia de placa dento-bacteriana se ha asociado con altos recuentos de S. mutans y Lactobacillus.34 La capacidad cognitiva y motriz disminuida en los pacientes con EA dificulta las prácticas de cuidado bucal y limita la remoción efectiva de los depósitos de placa dental, condición que indiscutiblemente predispone al desarrollo de caries dental en estas personas. Sin embargo, la sola colonización de estos microorganismos, asociados a procesos cariogénicos, no es un factor predictor de lesiones activas por sí solo, por lo que se debe realizar un análisis individualizado, para confirmar la presencia de lesiones activas clínicamente.
Otra especie encontrada en el análisis microbiológico fue C. albicans, colonizador frecuente de la cavidad bucal; valores superiores a 102 UFC/mL demuestran un alto recuento en cavidad oral.35 Este estudio encontró un recuento alto de esta especie en el 73% de los participantes; el uso de prótesis fija y removible se asoció con un alto crecimiento del hongo. Este resultado es equiparable al encontrado por Müjgan Güngör et al en un estudio realizado en Turquía mediante inspección clínica, en el que se detectó una alta incidencia de estomatitis asociada a prótesis.36 Sin embargo, este estudio demuestra que el 56,7% de los participantes no portadores de prótesis presentan un recuento aumentado de C. albicans. Por lo tanto, el uso de estos aparatos no puede asociarse de manera exclusiva con la presencia de infecciones por C. albicans en pacientes con EAF.
Por otra parte, autores como Taybos han reportado que una baja velocidad en el flujo salivar podría explicar un aumento en el número de S. mutans y Lactobacillus, favoreciendo la aparición de caries dental. Esto se puede explicar porque la saliva está comprometida con la integridad dentaria por medio de su acción de limpieza mecánica, despeje de carbohidratos, regulación del medio iónico y suministro de capacidad de remineralización, siendo esencial en el balance ácido-base de la placa dental.37 Sin embargo, según Dowd, existe poca evidencia acerca de que las variaciones del flujo salivar puedan influir en el desarrollo de nuevas lesiones de caries.38
Al considerar el tipo de medicamentos y la asociación con las variables salivares, se debe recordar que la primera línea de manejo farmacológico en personas con EA es el uso de inhibidores de colinesterasa (IC), debido a que en la fisiopatología de esta enfermedad se experimenta una reducción de los niveles cerebrales de acetilcolina y pérdida de neuronas colinérgicas; estos medicamentos han demostrado ser efectivos en la preservación de las funciones cognitivas en pacientes con EA de leve a moderada. Los IC se han asociado con el aumento de la producción salivar. No obstante, cuando el deterioro cognitivo ha alcanzado niveles superiores, la terapia con los inhibidores de colinesterasa no ofrece ventajas adicionales, y es común que los pacientes en estadios más avanzados de la enfermedad no usen IC. La terapia coadyuvante en la EA busca minimizar los síntomas de comportamiento y trastornos en el estado de ánimo mediante el uso de medicamentos psicotrópicos, como antipsicóticos, antidepresivos, ansiolíticos y anticonvulsivantes. El efecto colateral de manifestación bucal más común de este tipo de medicamentos es la xerostomía;20 esto podría explicar por qué las personas en estadios más avanzados de la enfermedad muestran depósitos salivares más bajos (ver Tabla 3). Por otra parte, este estudio encontró una relación significativa entre la tasa de secreción salivar baja y el uso de antidepresivos y anticonvulsivantes -medicamentos que en algunos estudios y revisiones sistemáticas han sido asociados con la reducción salivar-.6,20-22
La principal limitación del presente estudio es la carencia de un grupo control, que pudiese agregar elementos analíticos en las variables de estudio. Por otra parte, el tamaño muestral limita en alguna medida el análisis estadístico. Así mismo, la cantidad limitada de literatura científica que aborda el tema dificulta el establecimiento de parámetros de comparación.
CONCLUSIONES
Las personas con EA familiar precoz que participaron en este estudio presentaron características salivares alteradas, como la tasa de secreción salivar, la capacidad amortiguadora de la saliva y un aumento de la flora bacteriana bucal. Dicha reducción o alteración de las características salivares se ha atribuido ampliamente al consumo de medicamentos. Sin embargo, este estudio sugiere que otros factores podrían explicar la hiposalivación de los pacientes con EAF, como la edad y la severidad de la enfermedad, las cuales desencadenan unos estados mayores de dependencia y, por tanto, pérdida de las capacidades de autocuidado.
Según la revisión de la literatura, se evidencia que no hay estudios sobre salud bucal en esta población, que constituye el mayor grupo familiar afectado con EAF en el mundo, por lo que este artículo se establece como innovador.
El presente estudio sugiere que se realicen investigaciones en población no enferma y no medicada que sea portadora del gen autosómico dominante para EA familiar precoz, con el fin de detectar cambios tempranos en las variables estudiadas.
AGRADECIMIENTOS
Los autores agradecen las contribuciones del Grupo de Neurociencias de Antioquia, en especial las del doctor Francisco Lopera, así como a la Facultad de Odontología de la Universidad de Antioquia y al Laboratorio de Microbiología e Histopatología Oral de la misma dependencia.
REFERENCIAS
1. NCBI. Medical Subject Heading MeSH. Alzheimer disease [Internet]. Available from: https://www.ncbi.nlm.nih.gov/mesh/68000544 [ Links ]
2. Alberca-Serrano R, López-Pousa S. Enfermedad de Alzheimer y otras demencias. 3 ed. Madrid: Médica Panamericana; 2006. [ Links ]
3. Lopera F, Ardilla A, Martínez A, Madrigal L, Arango-Viana JC, Lemere CA et al. Clinical features of early-onset Alzheimer disease in a large kindred with an E280A presenilin-1 mutation. JAMA. 1997; 277(10): 793-799. [ Links ]
4. Llibre-Rodríguez J de J, Guerra Hernández M. Actualización sobre la enfermedad de Alzheimer. Rev Cubana Med Gen Integr. 2002; 18(4): 264-269 [ Links ]
5. Lopera F, Arcos M, Madrigal L, Kosik K, Cornejo W, Ossa J. Demencia tipo Alzheimer con agregación familiar en Antioquia , Colombia. Acta Neurol Colomb. 1994; 10(4): 173-187. [ Links ]
6. Leal SC, Bittar J, Portugal A, Falcão DP, Faber J, Zanotta P. Medication in elderly people: its influence on salivary pattern, signs and symptoms of dry mouth. Gerodontology. 2010; 27(2) 129-133. DOI: https://doi.org/10.1111/j.1741-2358.2009.00293.x [ Links ]
7. Reisberg B, Ferris SH, De-Leon MJ, Crook T. The Global Deterioration Scale for assessment of primary degenerative dementia. Am J Psychiatry. 1982; 139(9): 1136-1139. DOI: https://doi.org/10.1176/ajp.139.9.1136 [ Links ]
8. Ericson D, Bratthall D. Simpliefied method to estimate salivary buffer capacity. Eur J Oral Sci. 1989; 97(5): 405-407. DOI: https://doi.org/10.1111/j.1600-0722.1989.tb01453. [ Links ]
9. López-Jornet P. Alteraciones de las glándulas salivales. Murcia: Universidad de Murcia; 2002. [ Links ]
10. Toledo-Atucha J. Epidemiología descriptiva y analítica de la enfermedad de Alzheimer. Alzheimer Real Invest Demenc. 2011; 47(7) 16-23. [ Links ]
11. Colombia. Ministerio de Educación. Niveles de la educación básica y media [Internet]. Bogotá: MinEducación; [update 2010 may 31]. [about 2 screen]. Available from: Available from: http://www.mineducacion.gov.co/1759/w3-article-233834.html [ Links ]
12. Karp A, Kåreholt I, Qiu C, Bellander T, Winblad B, Fratiglioni L. Relation of education and occupation-based socioeconomic status to incident Alzheimer’s disease. Am J Epidemiol. 2004; 159(2): 175-183. [ Links ]
13. Lucatelli JF, Barros AC, Maluf SW, Andrade FM. Influencia genetica sobre a doenca de Alzheimer de inicio precoce. Rev Psiquiatr Clín. 2009; 36(1): 25-31. DOI: http://dx.doi.org/10.1590/S0101-60832009000100004 [ Links ]
14. Lopera-Restrepo F. La peste de la memoria en Antioquia. Medellin: Universidad de Antioquia; 2002. [ Links ]
15. Ribeiro GR, Costa JL, Ambrosano GM, Garcia RC. Oral health of the elderly with Alzheimer’s disease. Oral Surg Oral Med Oral Pathol Oral Radiol. 2012; 114(3): 338-343. DOI: https://doi.org/10.1016/j.oooo.2012.03.028 [ Links ]
16. Machado MC, Lopes GH, Marchini L. Oral health of Alzheimer’s patients in São José dos Campos, Brazil. Geriatr Gerontol Int. 2012. 12(2): 265-270. DOI: https://doi.org/10.1111/j.1447-0594.2011.00763.x [ Links ]
17. Lund JP, Mojon P, Pho M, Feine JS. Alzheimer’s disease and edentulism. Age Ageing. 2003; 32(2): 228-229. [ Links ]
18. Syrjälä AM, Ylöstalo P, Ruoppi P, Komulainen K, Hartikainen S, Sulkava R et al. Dementia and oral health among subjects aged 75 years or older. Gerodontology . 2012; 29(1): 36-42. DOI: https://doi.org/10.1111/j.1741-2358.2010.00396.x [ Links ]
19. Küstner EC, Marques SMS. Boca ardiente y saliva. Med Oral B. 2002; 7: 244-253. [ Links ]
20. Turner LN, Balasubramaniam R, Hersh EV, Stoopler ET. Drug therapy in Alzheimer disease: an update for the oral health care provider. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008; 106(4): 467-476. DOI: https://doi.org/10.1016/j.tripleo.2008.06.009 [ Links ]
21. Friedlander AH, Norman DC, Mahler ME, Norman KM, Yagiela JA. Alzheimer’s disease: psychopathology, medical management and dental implications. J Am Dent Assoc. 2006; 137(9): 1240-1251. [ Links ]
22. Liu B, Dion MR, Jurasic MM, Gibson G, Jones JA. Xerostomia and salivary hypofunction in vulnerable elders: prevalence and etiology. Oral Surg Oral Med Oral Pathol Oral Radiol . 2012; 114(1): 52-60. DOI: https://doi.org/10.1016/j.oooo.2011.11.014 [ Links ]
23. Lopez-Jornet MP, Bermejo-Fenoll A. Is there an age-dependent decrease in resting secretion of saliva of healthy persons? A study of 1493 subjects. Braz Dent J. 1994; 5(2): 93-98. [ Links ]
24. Ship JA, DeCarli C, Friedland RP, Baum BJ. Diminished submandibular salivary flow in dementia of the Alzheimer type. J Gerontol. 1990; 45(2): M61-M66. [ Links ]
25. Aframian DJ, Davidowitz T, Benoliel R. The distribution of oral mucosal pH values in healthy saliva secretors. Oral Dis. 2006; 12(4): 420-423. DOI: https://doi.org/10.1111/j.1601-0825.2005.01217.x [ Links ]
26. Núñez DP, García Bacallao L. Bioquímica de la caries dental. Rev Haban Cienc Méd. 2010; 9(2): 156-166. [ Links ]
27. Carolina C. El pH, Flujo salival y capacidad buffer en relación a la formación de la placa dental. ODOUS Cient. 2008; 9(1): 25-32 [ Links ]
28. Tanzer JM, Livingston J, Thompson AM. The microbiology of primary dental caries in humans. J Dent Educ; 2001; 65(10): 1028-1037 [ Links ]
29. Marsh PD, Martin MV, Lewis M, Williams DW. Oral microbiology. 5 ed. Edinburgh: Churchill Livingstone, 2009. [ Links ]
30. Duque-de-Estrada RJ, Pérez-Quiñonez JA, Hidalgo-Gato-Fuentes I. Caries dental y ecología bucal, aspectos importantes a considerar. Rev Cubana Estomatol. 1995, Editorial Ciencias Médicas; 2006; 43(1). [ Links ]
31. Newbrun E. Preventing dental caries: breaking the chain of transmission. J Am Dent Assoc . 1992; 123(6): 55-59. [ Links ]
32. Pérez-Quiñones JA, Duque-de-Estrada-Riverón J, Hidalgo-Gato-Fuentes I. Asociación del Estreptococos mutans y lactobacilos con la caries dental en niños. Rev Cubana Estomatol . 2007; 44(4). [ Links ]
33. Carlsson J, Söderholm G, Almfeldt I. Prevalence of Streptococcus sanguis and Streptococcus mutans in the mouth of persons wearing full-dentures. Arch Oral Biol. 1969; 14(3): 243-249. [ Links ]
34. Ojeda-Garcés JC, Oviedo-García E, Salas LA. Streptococcus mutans and dental caries. CES Odontol. 2013; 26(1): 44-56. [ Links ]
35. Scully C, el-Kabir M, Samaranayake LP. Candida and oral candidosis: a review. Crit Rev Oral Biol Med. 1994; 5(2): 125-157. [ Links ]
36. Hatipoglu MG, Kabay SC, Güven G. The clinical evaluation of the oral status in Alzheimer-type dementia patients. Gerodontology . 2011; 28(4): 302-306. DOI: https://doi.org/10.1111/j.1741-2358.2010.00401.x [ Links ]
37. Taybos GM. Xerostomia. Common patient complaint and challenging dental management problem. Miss Dent Assoc J. 1998; 54(3): 24-25. [ Links ]
38. Dowd FJ. Saliva and dental caries. Dent Clin North Am. 1999; 43(4): 579-597. [ Links ]
Recibido: 24 de Enero de 2017; Aprobado: 28 de Noviembre de 2017











 text in
text in 



