INTRODUCCIÓN
Son múltiples las causas que conllevan a padecer defectos óseos, estas alteraciones son el resultado de adaptaciones celulares, muerte celular, traumatismos, tumores, entre otras, que tienen gran relevancia. Estas situaciones resultan ser un gran desafío para la medicina moderna regenerativa por la complejidad que se presenta al momento de corregirlas, sin embargo, la terapia de regeneración celular a partir de células madre derivadas de la pulpa dental puede ser una gran alternativa y a diario va cobrando más notoriedad para tratar estas alteraciones óseas que con el tiempo podría reemplazar a los injertos de tejido óseo ubicados como el segundo trasplante realizado a mansalva para corregir estos trastornos.1-9
Las Células Madre Mesenquimales (MSC) son células madre multipotentes que poseen una característica en particular, pueden regenerarse y diferenciarse según el tipo de tejido a reemplazar. Estas células se ubican en diversas partes del cuerpo, siendo una fuente de ellas la pulpa dental. Las Células Madre Mesenquimales de la Pulpa Dental (DPSC) han despertado la atención en la comunidad científica debido a las características que poseen. A las DPSC se les asocia una considerable capacidad de proliferación, como también, de poder diferenciarse en cualquier tipo de célula. Asimismo, algunos estudios afirman que estas células permiten la osteogénesis, además es mucho más factible acceder a estas y aislarlas.1,4,10-18
Son varios los estudios que encaminan el uso de DPSC para la regeneración de tejido óseo. Algunos estudios comparativos causan cierta controversia debido a que algunos autores indican que las DPSC presentan mayores ventajas de regeneración que las Células Madre Mesenquimales de la Médula Ósea (BMSC), mientras que otros autores mencionan lo contrario. No obstante, la escasa información no nos permite discriminar cuál de los dos tipos de células presenta mayores ventajas proliferativas ya que ambas comparten gran cantidad de características en común.1,4,11,19-21
La limitada información que se ha publicado refiere estudios in vivo de regeneración ósea en animales pequeños, sin embargo, también hay que considerar las regiones anatómicas en las cuales se aplican estas células y el ambiente en donde se siembran. Diversos estudios han empleado modelos calvariales en ratones NOD.CB17-Prkdcscid/J (NOD SCID), porque pueden recibir trasplantes celulares alogénicos y xenoinjertos, sin presentar respuestas autoinmunes debido a que carecen de células T.20,21,28,29 Por ello, es de suma importancia resaltar las ventajas de las DPSC en los procedimientos de regeneración ósea para que se instaure como un eventual tratamiento.22-25
Por tal motivo, el objetivo de la siguiente revisión es evaluar la eficacia de la regeneración ósea a partir de las DPSC, analizando estudios in vivo realizados en ratones NOD.CB17- Prkdcscid/J (NOD SCID) inmunocompetentes con defectos calvariales.
MÉTODOS
Criterios de elegibilidad
La pregunta pico que se planteó en la investigación fue: ¿Las DPSC pueden llegar a regenerar el tejido óseo en ratones NOD.CB17-Prkdcscid/J (NOD SCID) inmunocompetentes?
La búsqueda se realizó en las siguientes bases de datos: Pubmed, ScienceDirect y Lilacs, obteniendo un total de 2.080 artículos recolectados. Dichos estudios tenían que cumplir con los criterios de inclusión y exclusión establecidos previamente para el desarrollo de esta revisión.
Se incluyeron estudios realizados en ratones inmunocompetentes que presentaron defectos óseos calvariales de tipo críticos, aquellos que aplicaban células madre de la pulpa dental humana, y los que emplearon pacientes adultos (edad ³18 años), a los cuales se les extrajo la pulpa dental, se consideraron ensayos clínicos; y aquellos estudios que abordaron la regeneración ósea a partir de células madre. Se excluyeron revisiones sistemáticas, cartas al editor, reportes de casos, y todos los estudios que no tenían una conclusión definida y aquellos que no especificaron el tipo de animal que se empleó.
Fuentes de información
Del 16 al 20 de agosto de 2021 se llevó a cabo la recolección de la literatura en las siguientes bases de datos: Pubmed, ScienceDirect y Lilacs, en las cuales se usó AND como operador booleano para recolectar información que se ajustaba al objetivo, previamente establecido. Se usaron tres combinaciones de términos libres y términos estandarizados (DeCS), diferentes en cada base de datos.
Estrategia de búsqueda
La cobertura de la búsqueda en las bases de datos fue desde 2016 hasta el 2020, y se realizó la búsqueda del 16 al 20 de agosto de 2021. En Pubmed se aplicó: (Bone Regeneration AND Stem Cells AND Dental Pulp); en ScienceDirect (Bone AND Regeneration AND Stem Cells AND Dental Pulp), y en Lilacs (Bone Regeneration AND Stem Cells AND Dental Pulp). Los términos de búsqueda empleados se reconocieron a través de la lectura de los títulos, resúmenes y el texto completo. A partir de los criterios de elegibilidad, la búsqueda no se limitó a un idioma específico. Los dos artículos seleccionados se encontraron a través de Pubmed. La estrategia de búsqueda fue desarrollada por los autores y revisada por los mismos. La revisión consistió en corregir la ortografía y verificar los términos estandarizados.
Proceso de selección de los estudios
Cuatro investigadores revisaron de forma independiente los títulos y resúmenes de los primeros 1.859 registros y discutieron las inconsistencias hasta que se obtuvo un consenso. Luego los investigadores examinaron de forma independiente los títulos y resúmenes de todos los artículos seleccionados. Como primer filtro de selección, solo con la lectura del título, se eligieron 59, descartando 1.800 estudios. Como segundo filtro de selección, se procedió a la lectura de los resúmenes siendo excluidos 28 estudios por no cumplir con los criterios de inclusión, siendo solo 31 los artículos seleccionados en esta segunda fase. En la tercera fase de filtración, se procedió a leer el texto completo, seleccionando 2 estudios debido a que se acercaron claramente al objetivo que fue la regeneración ósea a partir de células madre derivadas de la pulpa dental, aplicado en defectos calvariales de ratones.
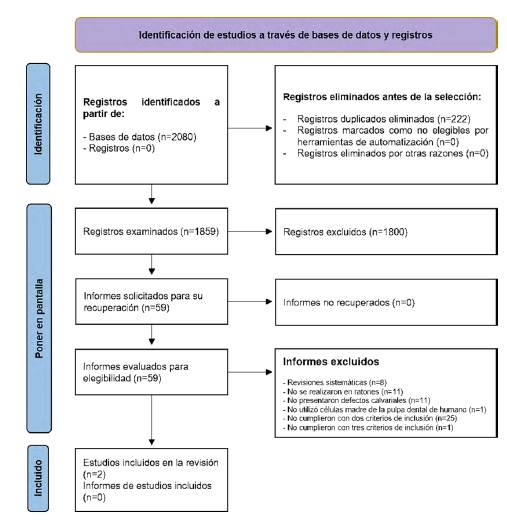
El resultado de los estudios en cada fase se registró y se manifestó en un diagrama de flujo PRISMA 202026, como se muestra en la Figura 1.
Proceso de extracción de los datos
Se diseñó un formulario para compilar los datos utilizando Microsoft Excel 365, el cual fue empleado para organizar los datos de los estudios seleccionados. Cuando la información de los estudios no estaba clara, eran descartados.
Lista de los datos
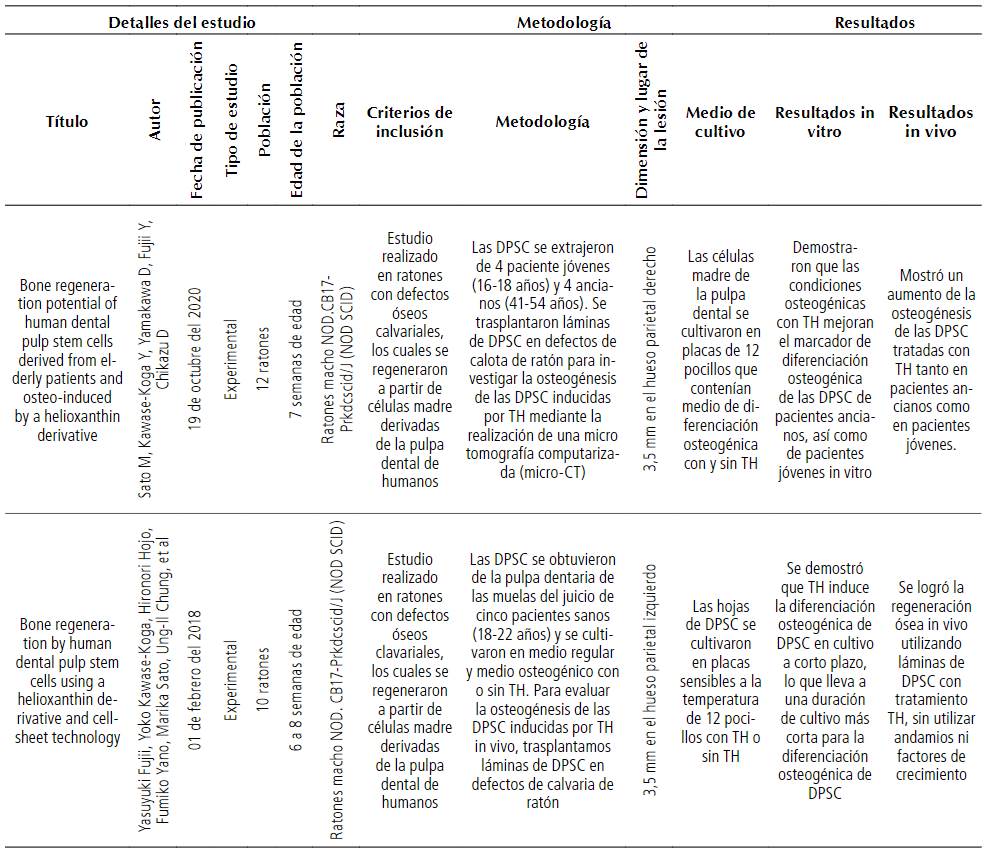
Se realizó una síntesis narrativa de las pruebas divididas en secciones, se examinaron los detalles, métodos de estudio, resultados in vitro e in vivo, población, métodos de cultivo, dimensiones del defecto óseo, como se evidencia en la Tabla 1.
Tabla 1 Descripción de los estudios seleccionados para la revisión sistemática
Fuente: por los autores
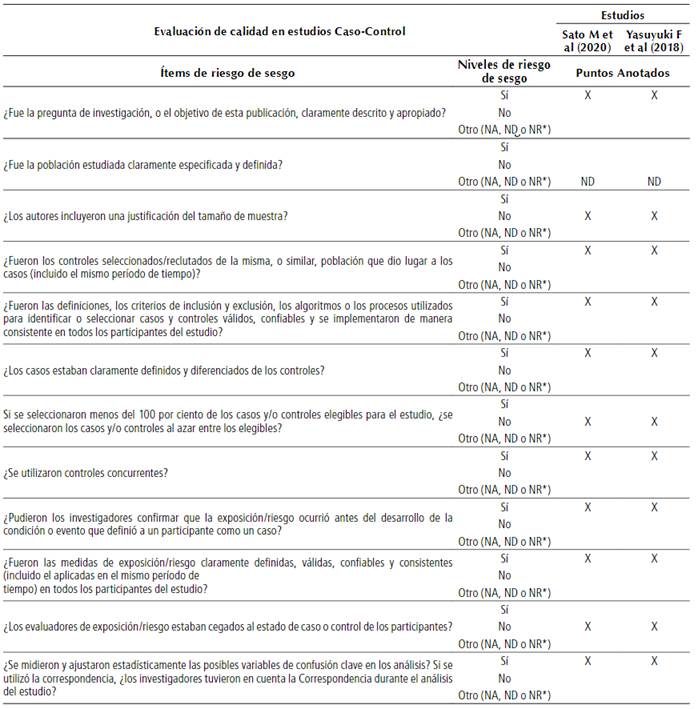
La evaluación de la calidad y del riesgo de sesgo se realizó considerando los criterios expuestos en la herramienta National Heart Lung and Blood Institute (NHLBI)27 para investigaciones de caso-control. Se aplicó este análisis a cada estudio seleccionado porque presentaron una metodología similar, como se puede apreciar en la Tabla 2.
RESULTADOS
De las 2.080 publicaciones identificadas en las 3 bases de datos, 222 publicaciones fueron duplicadas; con lo cual, quedaron 1.859 para su revisión como se puede apreciar en la Figura 1.
La primera revisión fue centrada en los títulos empleando una tabla de análisis, mediante el uso del programa Microsoft Excel, en la cual se excluyeron 1.800 estudios y quedaron 59 para la posterior discusión. La segunda revisión de los artículos fue centrada en los resúmenes, en la cual se excluyeron 28 estudios y quedaron 31 para la posterior discusión. En la fase de revisión del texto completo se excluyeron 25 estudios, cuyos motivos fueron colocados en una hoja de Microsoft Excel 365, quedando así 6 publicaciones.
Se extrajeron datos de los 6 artículos elegidos, los cuales fueron ubicados en una hoja de cálculo de Microsoft Excel 365 con los criterios de detalles del estudio, metodología del análisis y resultados. De los 6 estudios quedaron excluidos 4, debido a que no emplearon ratones inmunocompetentes NOD.CB17-Prkdcscid/J (NOD SCID) para el análisis in vivo, además, 2 de ellos no abordaban defectos de tipo calvarial. Por tal motivo, quedaron 2 estudios para el desarrollo de esta revisión sistemática y sus datos extraídos se ubican en la Tabla 1.
En los 2 estudios a evaluar, de Sato M et al28 y Fujii Yasuyuki et al29, son de regular calidad, ya que presentaron negatividad en 3 ítems de la evaluación de calidad, entre ellos: los autores no incluyeron una justificación del tamaño de la muestra, y cuando se seleccionó, menos del 100 por ciento de los casos y/o controles elegibles para el estudio no se seleccionaron al azar, y los evaluadores de exposición/riesgo no estaban cegados al estado de caso o control de los participantes. La evaluación de la calidad de los artículos se encuentra en la Tabla 2.
DISCUSIÓN
A partir de esta revisión, el objetivo general fue evaluar la eficacia de la regeneración ósea a partir de células madre de la pulpa dental realizadas en ratones NOD.CB17-Prkdcscid/J (NOD SCID) inmunocompetentes. Los objetivos específicos fueron, analizar estudios in vitro, realizados en ratones inmunocompetentes NOD.CB17-Prkdcscid/J (NOD SCID) con defectos calvariales y analizar estudios in vivo, realizados en ratones inmunocompetentes NOD.CB17-Prkdcscid/J (NOD SCID) con defectos calvariales. Los resultados nos muestran que existe una regeneración de hueso inducida por las células madre derivadas de la pulpa dental. Además, se muestra la eficacia de las DPSC con respecto a su potencial osteogénico y se demostró que existe una eficacia de las DPSC para promover una mejor formación de hueso nuevo.
Tales hallazgos coinciden con diversos estudios, entre ellos: Sato M et al28 donde se evidenció que las DPSC inducidas por TH (helioxantina 4- (4-metoxifenil) pirido [40,30: 4, 5] tieno [2,3-b] piridina-2-carboxamida) muestran una mejora de la diferenciación osteogénica y, por lo tanto, son una fuente potencial útil de células para la terapia regenerativa ósea en pacientes de edad avanzada. Así mismo, Lee Y-C et al1 encontraron que las DPSC ofrecerían una gran fuente de MSC, y con las BMSC, promueven la regeneración ósea en calota de conejo, aunadas a xenoinjertos Bio-Oss. Además, Fujii Y et al29 evidenciaron que las DPSC influenciadas por TH fomentan la diferenciación osteogénica y, en láminas de DPSC, la osteogénesis. Un aspecto similar se repite al aplicar SrFO (folato de estroncio) y TCP (beta fosfato tricálcico) según Martín-Del-Campo M et al30, ya que promueven una significativa formación ósea en tejido comprometido.
Por otro lado, Wongsupa N et al31, también respaldaron el uso de hDPSC para potencializar la regeneración ósea a través de andamios PCL (poli-ɛ caprolactona) -BCP (fosfato cálcico bifásico) de mMSMD (técnica de estiramiento en fusión modificado y deposición multicapa). No obstante, Yasui T et al32, corroboraron que las células derivadas de la pulpa dental LNGFR (Low +) THY-1 (High +) generan una sobresaliente alternativa para la regeneración ósea. Contrariamente, Stuepp RT et al19 demuestran que no se puede afirmar que las hDPSC puedan generar hueso en los defectos óseos mandibulares no críticos.
Tras el análisis de los resultados se dispone que las células madre de la pulpa dental promueven eficazmente la regeneración ósea porque poseen capacidades significativas de diferenciación osteogénica, promueven la osteogénesis y el hueso nuevo se adosa muy bien al hueso existente. Cabe precisar que la influencia del tipo del medio de cultivo de las DPSC predispone una mejor capacidad del potencial de regeneración de estas células.
Estos resultados son similares a otros, entre ellos: los estudios de Sato M et al28, en el que manifiestan que es posible cultivar DPSC con un alto potencial de proliferación y diferenciación. En su estudio, para evaluar si la TH se puede utilizar en las DPSC derivadas de pacientes ancianos, examinaron el efecto de la TH sobre el potencial de diferenciación osteogénica de las DPSC de pacientes ancianos en un modelo de defecto calvarial de ratón y lo comparan con el de las DPSC de jóvenes pacientes. Según los hallazgos sugirieron que no se ha demostrado la senescencia celular de las DPSC de edad avanzada; además, las DPSC de edad avanzada podrían mantener las características funcionales de la madre en el cultivo a corto plazo. Así mismo, evidenciaron que también existen algunas limitaciones para su estudio. Compararon DPSC jóvenes y ancianos utilizando las células en cultivo a corto plazo en particular en este estudio, sin embargo, para detectar el cambio de «envejecimiento», necesitan estudios utilizando las células en cultivo a largo plazo. Además, se desconoce cómo sería la expresión de los marcadores osteogénicos después del trasplante de láminas de DPSC jóvenes y mayores a ratones, por tanto, se necesitan más investigaciones.
Por otro lado, Fuji Y et al29 evidenciaron que las DPSC tratadas con TH indujeron más significativamente la diferenciación osteogénica, así mismos estudios como el de Martín- Del-Campo M et al30, que preparó dos grupos (TCP) y (TCP /SrFO), demostrando que ambos grupos mostraron un llenado progresivo con tejido mineralizado y tasas moderadas de crecimiento óseo en el defecto. Además, Wongsupa N et al31 también demostraron el potencial osteogénico de las células de la pulpa dental mediante el análisis de citometría de flujo de las DPSCs a través de andamios PCL- BCP; evidenciaron más del 99% de potencial osteogénico. También Yasui T et al32 preparó 2 marcadores de superficie celular LNGFR (CD271) y THY-1, las cuales representaron una población sumamente enriquecida de células clonogénicas. Así mismo, Lee Y-C et al1 demuestran que DPSC y BMSC poseían una capacidad de proliferación muy similar in vitro, sin embargo, las BMSC evidenciaban una ligera superioridad. Por otro lado, Stuepp RT et al19 aislaron las hDPC y hallaron células malignas, por ende, no se puede afirmar hDPSC puedan generar hueso en los defectos óseos mandibulares no críticos. Al analizar los resultados se determina que las células madre de la pulpa dental promueven eficazmente la regeneración ósea ya que poseen capacidades significativas de diferenciación osteogénica demostradas in vitro, es preciso resaltar que esto dependerá del tipo del medio de cultivo de las hDPSCs, la cual condiciona una mejor capacidad del potencial de regeneración de estas células.
Los resultados encontrados se pueden evidenciar en los estudios de Sato M et al28, en donde el examen in vivo mostró un aumento en la osteogénesis de las DPSC tratadas con TH en pacientes jóvenes y ancianos. Tales resultados sugieren que el potencial de diferenciación osteogénica de las DPSC en pacientes ancianos es tan alto como el de las DPSC en pacientes más jóvenes. Además, las DPSC inducidas por TH muestran un mayor potencial para la diferenciación osteogénica y, por lo tanto, son una fuente potencial de células útiles para la terapia osteogénica en pacientes de edad avanzada. Así mismo, Lee Y-C et al1 descubrieron que los defectos óseos calvariales de conejo sembrados con material de injerto óseo de Bio-Oss con DPSC o BMSC, mostraron una mayor cantidad de puentes óseos y una mayor cantidad de hueso recién formado, y una menor cantidad de partículas de material de injerto Bio-Oss. Además, Fuji Y et al29 evidenciaron que los defectos óseos calvariales de ratones utilizando láminas de DPSC tratadas con TH inducían la regeneración ósea de forma más extensa. No obstante, Wongsupa N. et al31 demuestran que los defectos óseos de la calota de los conejos, empleando andamios de PCL-BCP de mMSMD con hDPSCs, promueven significativamente la regeneración ósea. En este contexto, Martín-Del-Campo M et al30 también descubrieron, que los defectos calvariales de las ratas empleando dos grupos de andamios de TCP y SrFO con TCP tratadas con HDPSC muestran un llenado progresivo con tejido mineralizado y tasas moderadas de crecimiento óseo en el defecto calvarial. Por otro lado, Yasui T et al32 demuestran que los defectos calvariales de los ratones utilizando hDPSC en LNGFRLow+ THY-1High+ proporcionan una excelente fuente de material para la regeneración ósea. Diferente es la postura de Stuepp RT et al19, en donde demuestran que no se puede asegurar que las hDPSC en los defectos óseos mandibulares en ratas puedan generar alguna regeneración ósea. Al analizar los resultados se determina que las células madre de la pulpa dental fomentan eficazmente la regeneración ósea, esto va a depender del predominio del tipo del medio de cultivo de las hDPSCs, la cual condiciona un mejor potencial de regeneración de estas células madre.
Los criterios de inclusión y exclusión al realizar la búsqueda, nos permitieron tener más precisión con respecto al tema, debido a esto no se pudo abarcar diversos estudios porque no cumplían con los parámetros establecidos. Por otro lado, al realizar la revisión, algunos estudios no compartían la misma metodología, o no usaban una cantidad similar de población, esto impedía realizar un análisis más extenso. Se requieren de más estudios que nos permitan afianzar la regeneración ósea a partir de células madre, para que posteriormente se puedan aplicar en humanos.
CONCLUSIONES
Los resultados obtenidos en este estudio muestran una regeneración ósea, en defectos óseos calvariales de ratones NOD.CB17-Prkdcscid/J (NOD SCID) inmunocompetentes, inducida por las células madre derivadas de la pulpa dental ya que poseen capacidades significativas de diferenciación osteogénica, promueven la osteogénesis y el hueso nuevo se adosa satisfactoriamente al hueso existente. Por otro lado, el análisis de estudios in vitro demuestra que las DPSC pueden ofrecer una buena fuente osteogénica para la regeneración ósea.
Por ende, los estudios in vivo corroboran que los medios de cultivos juegan un papel muy importante para mejorar la regeneración ósea en defectos de huesos en animales. Por lo tanto, se requieren de más estudios para corroborar que las DPSC son una fuente alternativa para afianzar la formación del hueso nuevo en la medicina moderna regenerativa.