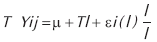Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
ORINOQUIA
On-line version ISSN 0121-3709
Orinoquia vol.16 supl.1 Meta Dec. 2012
El glifosato (Roundup®) y Cosmoflux® 411F inducen estrés oxidativo en cachama blanca (Piaractus brachypomus)
Glyphosate (Roundup®) and Cosmoflux® 411F induce oxidative stress in red-bellied pacu (Piaractus brachypomus)
Glifosato (Roundup®) e Cosmoflux® 411F induzir estresse oxidativo em pacu (Piaractusbrachypomus)
Iang S. Rondón-Barragán1,2,3
Gira A. Marin-Mendez1,3
Roberto A. Chacón-Novoa1,3
Leidy Naranjo-Suarez1
David Pardo-Hernández1,2,3
Pedro R. Eslava-Mocha2
1 Grupo de Investigación en Inmunología y Fisiopatología Animal - IFA, Departamento de Sanidad Animal, Facultad de Medicina Veterinaria y Zootecnia, Universidad del Tolima.
Email: isrondon@ut.edu.co.
2 Grupo de Investigación en Sanidad de Organismos Acuáticos, Instituto de Acuicultura de los Llanos - IALL.
3 Grupo de Investigación en Enfermedades Neurodegenerativas - END.
Resumen
En la actualidad existe evidencia de los efectos deletéreos de la exposición de diferentes especies animales a xenobióticos, incluyendo herbicidas, pesticidas y plaguicidas.. En la literatura se han descrito los efectos de herbicidas tales como el glifosato en sistemas orgánicos como el respiratorio y el tegumentario en peces, sin embargo, reportes acerca del efecto de dichos productos en el sistema inmune de animales acuáticos son tan escasos como necesarios. La alteración de la dinámica y equilibrio de la respuesta inmune pudiera estar generando efectos importantes sobre la capacidad del pez para sobrevivir en el medio. El presente trabajo evaluó el efecto del glifosato (Roundup®) y surfactantes acompañantes (Cosmoflux® 411F), sobre el estado oxidativode la cachama blanca (Piaractus brachypomus) en un periodo de 14 días de exposición crónica subletal. Se evidenció que el glifosato(Roundup®) así como la mezcla de este con el surfactante induce aumento de la actividad oxidativa (estrés oxidativo) en los animales expuestos. Estos efectos fueron mayores cuando se expusieron a la mezcla atribuyendo un efecto importante al surfactante. De la misma manera el artículo se aproxima al soporte fisiopatológico de estos hallazgos.
Palabras clave: Cachama blanca, Cosmoflux® 411F, estrés oxidativo, glifosato, inmunotoxicología.
Abstract
Currently, there is evidence of deleterious effects of xenobiotic exposure (including herbicides, pesticides and plaguicides) in several animal species. Effects of glyphosate on organic systems such as respiratory and tegumentary system have been described; however, the effects of this kind of xenobiotics on immune system of non-target animals, including aquatic animals are as scarce as necessary. Dynamic and equilibrium alterations of the immune response could be eliciting important effects on ability of fish to survive in the environment challenge. This current work assessed the effect of glyphosate (Roundup®) and added surfactants (Cosmoflux® 411F), on oxidative status of red-bellied pacu (Piaractus brachypomus) in a 14-day period of chronic sublethal exposure. It was evident that glyphosate Roundup® as well as its mixture with surfactant induce an increase on oxidative activity (oxidative stress) in exposed animals. These effects were higher in animal exposed to the mixture than Roundup® alone, giving an important role of surfactant on the effect. In the same way, article approaches to pathophysiological support of these findings.
Key words: Cachama blanca, Cosmoflux® 411F, oxidative stress, glyphosate, immunotoxicology.
Resumo
Actualmente, não existe evidência de efeitos deletérios da exposição xenobióticos (incluindo herbicidas, pesticidas, etc) em diversas espécies animais. Efeitos do glifosato em sistemas orgânicos, tais como as vias respiratórias e tegumentar têm sido descritos, no entanto, os efeitos deste tipo de xenobióticos sobre o sistema imune de animais não-alvo, incluindo os animais aquáticos são tão escassos que for necessário. Alterações dinâmicas e equilíbrio da resposta imunitária poderia ser provocando efeitos importantes sobre a capacidade de peixe para sobreviver no ambiente desafio. O presente trabalho avaliou o efeito de glifosato (Roundup®) e surfactantes (agregado Cosmoflux® 411F), sobre o estado oxidativo de Cachama blanca (Piaractusbrachypomus) em um período de 14 dias de exposição subletal crônica. Era evidente que Roundup®, assim como a sua mistura com um agente tensioactivo induzir um aumento na actividade oxidativa (stress oxidativo) nos animais expostos. Estes efeitos foram mais elevados em animais expostos à mistura de Roundup® por si só, dar um importante papel de agente tensioactivo sobre o efeito. Da mesma forma, o artigo aborda a apoio fisiopatológico dessas descobertas.
Palavras chave: Cachama blanca, Cosmoflux® 411F, estresse oxidativo, o glifosato, imunotoxicologia.
Introducción
El sistema inmune es capaz de modular y generar respuestas, celulares o humorales, frente a los factores medioambientales, principalmente agentes potencialmente lesivos así como a fenómenos propios del cuerpo como la remoción de células senescentes, procesos autoinmunes o neoplásicos. En la literatura se encuentran descritos los efectos de herbicidas tales como el glifosato en sistemas orgánicos como el respiratorio y el tegumentario en peces, sin embargo, reportes acerca del efecto de estos productos en el sistema inmune de animales acuáticos son tan escasos como necesarios (Neskovic et al., 1996; Szarek et al., 2000; Jiraungkoorskul et al., 2002; Eslava-Mocha et al., 2007; Ramírez-Duarte et al., 2008).
La alteración de la dinámica y equilibrio de la respuesta inmune podría estar generando efectos importantes sobre la capacidad del pez para sobrevivir en el medio. Dada además por alteraciones metabólicas y enzimáticas (incremento en los niveles de glucosa, alteración de la función colinesterasa; (Glusczak et al., 2006; Glusczak et al., 2007; Suarez et al., 2007) las cuales pueden repercutir en el desempeño de funciones inmunes básicas y en la dinámica del sistema nervioso, con lo cual se hace hincapié en la necesidad de dilucidar estos procesos.
Se han encontrado evidencias anatomopatológicas de alteraciones del sistema respiratorio, sistema digestivo y del sistema nervioso central (SNC) de la cachama blanca (Piaractus brachypomus) expuestas a Glifosato y surfactantes acompañantes (Eslava-Mocha et al., 2007; Rondón-Barragán et al., 2007; Ramírez-Duarteet al., 2008). En las lesiones del SNC se han involucrado células granulares eosinofílicas/células mast (EGC/CM) y células gliales asociadas a somas neuronales, los cuales presentan cambios degenerativos y muerte celular, posiblemente relacionados con fenómenos de apoptosis. Las EGC/CM así como células gliales corresponden a líneas celulares pertenecientes al sistema inmune y que regulan la dinámica de reparación: remoción a nivel cerebral así como median algunos procesos vasculares importantes, la dilucidación del efecto de dicho xenobióticos sobre el sistema inmune permitirá la comprensión más amplia de los fenómenos de respuesta subyacentes. Los posibles mecanismos del efecto de los herbicidas sobre el sistema inmune ya han sido revisados anteriormente (Rondón-Barragán et al., 2010).
El glifosato (N-fosfonometil glicina, GP) es un herbicida sistémico, no selectivo de amplio espectro (WHO, 1994), el cual se ha usado para el control de plantas anuales y perennes (WHO, 1994; Kaczewer, 2002) y que ejerce su acción mediante la inhibición de la síntesis de aminoácidos aromáticos - triptófano, fenilalanina y tirosina - en las plantas (Williams et al., 2000), a través de la supresión de una enzima de la vía del chikimato (Haney et al., 2002), lo cual reduce la producción de proteína de la planta y, de este modo, inhibe el crecimiento de la misma (Williams et al., 2000). La vía del ácido chikímico está ausente en mamíferos, peces, aves, reptiles e insectos (Murtaza & Stallings, 2001). En Colombia es utilizado el producto Roundup® (p.a. Glifosato) en la aspersión de cultivos, para la desecación de granos y, por vía aérea, como madurante de la caña de azúcar y como desecante del sorgo (Nivia & Sánchez, 2001).
Para permitir al glifosato atravesar y adherirse fuertemente a la superficie cuticular de las hojas se le adicionan diversas sustancias tales como emulsificantes, solventes y surfactantes (como la Polioxietilamina -POEA, incluido en la presentación comercial), en sus diferentes presentaciones comerciales; los cuales son químicos que pueden llegar a ser más peligrosos que el principio activo. El Glifosato junto con el POEA ha evidenciado un efecto sinérgico entre ellos, demostrándose además que el surfactante es más tóxico que el glifosato mismo. Se ha demostrado que el POEA contenido en el Roundup® puede interferir con la respiración cutánea de las ranas y la respiración branquial en renacuajos (Folmar et al., 1979), al igual que producir alteraciones en el tejido branquial de los peces, y su toxicidad tiende a ser mayor con periodos de exposición más prolongados. En Colombia, específicamente, se estableció el uso del Cosmoflux® 411F como surfactante, pero su composición aún no ha sido detallada.También se adiciona el compuesto antiespumante Cosmo-in D (Nivia & Sánchez, 2001). Además, al conocimiento de los investigadores no existen suficientes estudios sobre los efectos del aditivo, solo o en combinación con Roundup Ultra®; de este modo, no hay bases que respalden la seguridad de su uso sobre la población, cultivos de alimento y fuentes de agua.
El GP solo es considerado levemente tóxico para los peces (CL50 mayor a 10 mg/L), mientras el Roundup® es considerado tóxico para algunas especies de peces, teniendo CL50s para Roundup® en un rango de 2 a 55 mg/L (WHO, 1994) y, en ensayos realizados en cachama blanca (Piaractus brachypomus), se ha estimado un valor de 97,47 mg/L (Ramírez-Duarte et al., 2008). Los efectos subletales del GP sobre los peces incluyen nado errático, dificultad respiratoria y alteraciones en la alimentación, migración y reproducción, además de incrementar la probabilidad de ser predados (Morgan et al., 1991; McComb et al., 2008; Eslava-Mocha et al., 2007).
Los posibles mecanismos por los cuales los surfactantes pueden ejecutar efectos biológicos o influir en la toxicidad del glifosato incluyen: a) reducción de la tensión superficial; b) alteración de la permeabilidad de membranas biológicas y barreras de difusión o procesos de transporte de membrana, incluyendo la permeabilidad al glifosato y/o interactuando directamente con el glifosato modificando, de este modo, la disposición del herbicida (Diamond & Durkin, 1997). En trabajos de Rondón-Barragán et al., (2007) se han descrito los efectos tóxicos asociados a la exposición al surfactante Cosmoflux 411F®, además se determinó una CL50 a 96 horas de 4417,99 mg/L en cachama blanca evidenciándose lesiones branquiales, hepáticas y en el sistema nervioso central similares a las descritas para el Roundup®.
Se ha demostrado el efecto deletéreo de la exposición a herbicidas sobre el sistema inmunede diversos animales incluyendo bovinos (Šivikova & Dianovský, 2006), ovinos (Pistl et al., 2002; Pistl et al., 2003), ratones (Studnicka et al., 2000; Sheil et al., 2006; Pinchuk et al., 2007), ranas (Kiesecker, 2002), almejas (Elandalousi et al., 2008), langostas (Sun & Ye, 2009) así como en el ser humano (Lima & Vega, 2005; Cabassi, 2007; Martínez et al., 2007; McClure et al., 2001). Particularmente en peces, Fatima et al. (2007) han demostrado que una mezcla de herbicidas, genera un bloqueo del sistema de defensa antioxidante enzimático, causando daño celular y estrés oxidativo; lo cual interfiere con la actividad fagocítica y lisosómica, generando inmunosupresión. Por otra parte, Rice et al. (1996) describen que la capacidad de respuesta inmune en los peces se ve afectada negativamente tras la exposición a diferentes pesticidas y herbicidas incluyendo metales. Recientemente, Salazar-Lugo et al., (2009) demostraron que en tambaqui (Colossoma macropomum) expuestos a Paraquat se evidencia una disminución significativa en la capacidad bactericida de los leucocitos así como una disminución en la concentración de leucocitos circulantes, principalmente neutrófilos.
El sistema inmune es más sensible a los xenobióticos y reacciona más rápidamente que otro sistema, incluso a concentraciones más bajas que las requeridas para evocar una respuesta tóxica sistémica aguda (Salazar-Lugo et al., 2009), por lo tanto sus componentes son candidatos para ser utilizados como biomarcadores en estudios de inmunotoxicología. El presente trabajo tiene como objetivo evaluar el efecto del glifosato y surfactantes acompañantes, así como de su mezcla, sobre la respuesta inmune de la cachama blanca (Piaractus brachypomus), intentando aproximarse a la fisiopatología de dichos hallazgos.
Materiales y métodos
Animales
En el presente trabajo se utilizaron alevinos de cachama blanca (Piaractus brachypomus), de 3,96 ± 0,65 g de peso, clínicamente sanos, obtenidos de la estación piscícola del Instituto de Acuicultura de los Llanos Orientales (IALL), criados en estanques en tierra. El trabajo se realizó en el Laboratorio de Toxicología de la Universidad del Tolima, (Ibagué, Tolima) y en el laboratorio de Diagnóstico Veterinario de la Universidad del Tolima, adscrito a la Facultad de Medicina Veterinaria y Zootecnia.
Los animales fueron alojados en acuarios de vidrio a una densidad menor o igual a 1g/L como lo indica la OECD (1992) para la aclimatación y experimentación, acondicionados con aireación constante, sin filtro. Los peces fueron alimentados dos veces al día con concentrado MOJARRA al 30 % de proteina (elaborado por SOLLA®) con una ración correspondiente al 2 % de la biomasa total, siendo adicionado el alimento a cada acuario acorde con el peso total de cada grupo, de forma gradual hasta el cese en el consumo.
Diariamente, durante el periodo de aclimatación y en el transcurso de la fase experimental, en cada grupo, para cada ensayo, fueron medidos los parámetros de calidad de agua correspondientes a: pH, sólidos disueltos, temperatura (pHMeter Multiparametric Hanna Instruments®) y oxígeno disuelto (OXXI 330i/set Germany). Igualmente, se realizó recambio diario del 50 % del volumen de agua con mantenimiento de la concentración correspondiente en cada grupo experimental mediante la adición de la mitad de la sustancia experimental requerida.
Sustancias experimentales
El RoundupSL ® (MONSANTO COMPANY) es un herbicida compuesto de 48% de sal Isopropilamina de glifosato, surfactante POEA y agua. Los componentes descritos del RoundupSL ® son los mismos del Roundup Ultra®, difiriendo en la concentración de sus componentes.
El Cosmoflux® 411F (COSMOAGRO, Colombia) es un surfactante que contiene como ingredientes activos una mezcla de sustancias tensoactivas estereoespecíficas no-iónicas basados en alcoholes lineales etoxilados propoxilados con pequeñas cantidades de un compuesto aril etoxilado y aceite isoparafínico.
Ensayo de toxicidad crónica
Se realizaron dos experimentos correspondientes a los ensayos, siendo el primero con RoundupSL ® y el segundo con la mezcla RoundupSL ® y Cosmoflux® 411F. Para cada uno de los experimentos se utilizaron dos replicas. Cada grupo experimental constó de 20 animales. Previo al experimento los peces fueron sometidos a un período de aclimatación de 15 días. Antes de la aclimatación, los peces fueron sometidos a un baño con cloruro de sodio (NaCl) al 3 % durante 20 minutos con el objetivo de eliminar ectoparásitos de acuerdo con lo descrito por Floyd (1995). Se utilizaron alevinos de cachama blanca y fueron dispuestos según las normas de la OECD (1992). El tiempo experimental fue de 14 días a exposición crónica basada en la concentración letal reportada por Eslava-Mocha et al., (2007), Rondón-Barragán et al., (2007) y Ramírez-Duarte et al., (2008), siendo de 10 µg/L (Tratamiento I), 100 µg/L (Tratamiento II), 1000 µg/L (Tratamiento III) de glifosato y a 1000 µg/L de Roundup® más 22,7 µg/L Cosmoflux® 411F, en una proporción 44:1 Roundup®: Cosmoflux® 411F (Tratamiento IV). Con su respectivo grupo control (Tratamiento 0).
Hematología
Se realizó extracción de sangre por venipunción caudal a la altura de la inserción de la aleta anal, 1 a 1,5 cm por debajo de la línea lateral,con uso de jeringa con capacidad para 1 mL con heparina sódica como anticoagulante y aguja número 30. Se determinó el hematocrito mediante el uso de capilares para microhematocrito, centrifugandoa 2500 g por 5 minutos. Seguidamente, fue determinado el leucograma mediante análisis de extendidos sanguíneos, los cuáles fueron teñidos con Hemacolor® (Merck Chemicals, Germany), para realizar los recuentos diferenciales y estudiar las características morfológicas pos exposición.
Explosión respiratoria
Para evaluar la respuesta inmune se utilizó el método de reducción de nitroblue tetrazolium (NBT) por ensayo espectrofotométrico descrito en Mohanty & Sahoo (2010). Brevemente, 0,1 mL de sangre se dispuso en una placa de microtítulos (fondo en U de 96 pozos) y luego se adicionó una cantidad igual de solución al 0,2% de NBT. Después de la incubación a temperatura a 25 °C por 30 min, se remueve 0,05 mL de la suspensión NBT-células sanguíneasy se agrega a un tubo que contenía 1,0 mLde N,N dimetil formamida. Después de la centrifugación a 2000 g x 5 minutos, se realizó la lectura de la densidad óptica del sobrenadante en lector de placas ELISA (espectrofotómetro) (ELx-800; Biotek® Instruments, Inc. USA) a 620 nm.
Índice hepatosomático
El índice hepatosomático de cada animal se determinó en cada etapa muestreal por medio de la fórmula:
Índice hepatosomático: Peso hígado/Peso corporal x 100.
Los hígados al igual que los peces completos fueron pesados mediante balanza analítica (ADAM® 250 x 0,0001 g).
Muestreo de los peces
Para cada uno de los ensayos, previo al inicio del periodo de aclimatación, los animales fueron anestesiados con Eugenol (30 mg/L) para morfometría.
Los muestreos fueron realizados los días 1, 4, 8, 11 y 14 post-exposición tomando en cada uno de los días 4 animales por tratamiento. Al cabo de la fase experimental se registró la mortalidad de cada grupo. A los peces de cada tratamiento se les realizó examen necropscópico según los lineamientos descritos por Reimschuessel et al. (1988) y Yanong (2003). El hígado fue extraido en su totalidad para calcular el índice somático.
A los órganos que lo ameritaron a la necropsia se les tomó muestra para histopatología las cuales fueron fijadas en formalina bufferada al 3,7 %, y cortadas de 4 - 5 µm de grosor para procedimientos histopatológicos teñidos con hematoxilina y eosina (H&E). La evaluación histopatológica fue realizada en un microscopio óptico Leitz Aristoplan (Germany).
Análisis estadístico
Se utilizó un diseño experimental completamente aleatorizado efecto fijo balanceado con la técnica de ANOVA y MANOVA donde las variables de respuesta fueron: densidad óptica, hematocrito, leucograma, porcentaje de neutrófilos, linfocitos, monocitos, basófilos, eosinófilos y proporción neutrófilos: linfocitos e índice hepatosomático. El modelo se ajustó de acuerdo al siguiente diagrama:
Donde µ es la media, Ti el efecto tratamiento, y εj(i) el error experimental.
Se utilizaron las pruebas de comparación múltiple de Tukey y análisis canónico de índice ortogonal con un 95 % de confiabilidad. Se validaron los supuestos del modelo y se empleó un análisis descriptivo exploratorio unidimensional para hallar media, desviación y coeficiente de variación. Los datos se transformaron mediante arco seno debido al incumplimiento de los mismos. Los datos son presentados como el promedio ± error estándar de la media (ESM). Los resultados fueron analizados mediante el software SAS/STAT® versión 9.0.
Resultados
Referente a los parámetros de calidad de agua no se evidenciaron diferencias significativas entre tratamientos y réplicas experimentales. Dichos parámetros estuvieron dentro del rango de confort descrito para la especie (temperatura 27,2 ± 0,11; pH 6,28 ± 0,07; Dureza 28 ± 0,1 mg/L).
De la misma manera los animales experimentales no presentaron diferencias significativas en su peso (Tabla 1). El peso del hígado solo presentó diferencias significativas en los animales al día 8 del muestreo siendo mayor este peso para los animales expuestos al tratamiento IV, i.e. mezcla de 1000 µg/L Roundup®: 22,7 µg/L Cosmoflux® 411F; con respecto a los demás grupos experimentales incluyendo el grupo control. No obstante, no se presentaron diferencias en el índice hepatosomático, indicando así que esta diferencia es relativa a los animales de los grupos experimentales más no una hepatomegalia.
No se presentó mortalidad durante el período de aclimatación ni en la fase experimental en ninguno de los tratamientos incluido el grupo control, esto debido principalmente al carácter subletal de la prueba. Los animales del tratamiento I, II y III, redujeron moderadamente su consumo de alimento y demostraron menos avidez, en comparación con los animales del grupo control. Al examen de necropsia, el hígado de los animales del tratamiento III y IV mostró una coloración blanquecina, principalmente en la porción caudal así como arborización, diciente de procesos congestivos (Figura 1A-B). Dicha arborización fue más evidente en la cara visceral del órgano. Además, los hígados presentaron consistencia friable y en solo 3 animales se observó aparente hepatomegalia.
Histopatología
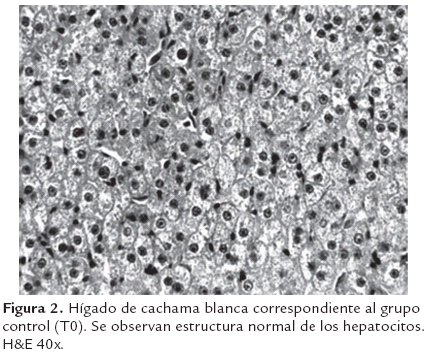
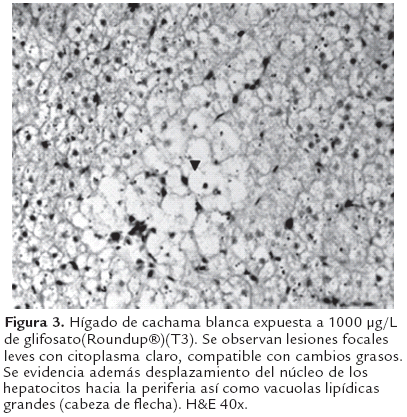
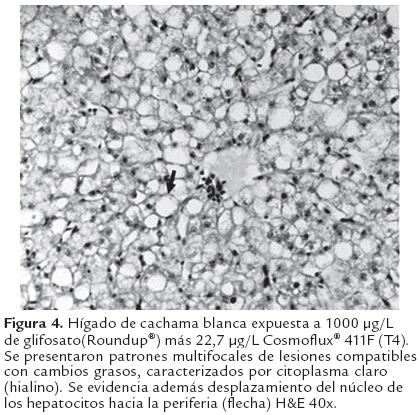
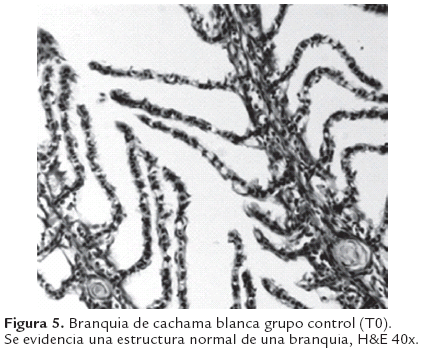
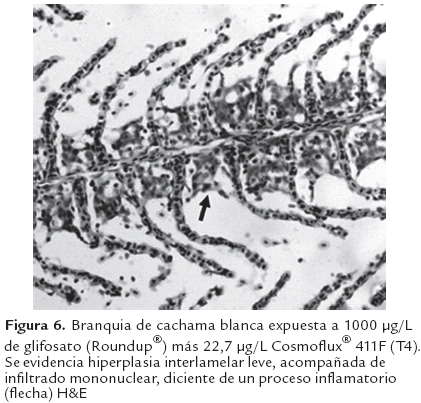
Al análisis histopatológico del hígado en los animales expuestos a glifosato (Roundup®) así como para los expuestos a la mezcla con Cosmoflux® 411F, se observaron lesiones focales caracterizadas por hepatocitoscon una menor densidad celular, citoplasma claro, compatible con cambios grasos (Figura 3 y 4); estas lesiones fueron dependientes de la concentración siendo más severas en las concentraciones altas. Además se evidenció desplazamiento del núcleo de los hepatocitos hacia la periferia así como vacuolas lipídicas grandes. Estos hallazgos no fueron evidentes en el grupo control (Figura 2). Así mismo a nivel branquial se evidenció, en los animales expuestos a los xenobióticos, hiperplasia interlamelar de leve a moderada acompañada de infiltración de células mononucleares, en una manera dependiente de la concentración (Figura 6). Estos cambios no se presentaron en el grupo control (Figura 5).
Hematología
Los animales de los tratamientos III y IV, evidenciaron la sangre de color oscura con respecto a los demás tratamientos incluyendo el control. Con respecto al hematocrito se evidenció un aumento de este parámetro en los animales expuestos en todos los tratamientos con respecto al grupo control al día 14 de exposición. Se evidenciaron diferencias significativas en los animales expuestos a los xenobióticos con respecto al control a excepción del día 8 cuando no se presentan tales diferencias (Figura 7).
Actividad de explosión respiratoria
La explosión respiratoria presentó diferencias significativas en todos los animales expuestos a los xenobióticos con respecto al control, excepto del octavo día post-exposición (dpe) en el cual no se evidenciaron dichas diferencias. Para el 1 dpe se evidenció en el tratamiento I niveles disminuidos de actividad oxidativa, con respecto a los demás tratamientos. No obstante estos niveles se elevaron el día 14 donde presentó niveles de actividad oxidativa por encima de los evidenciados en el grupo control. El11 dpe los niveles de actividad oxidativa de los tratamientos tuvieron una tendencia al incremento sin diferenciarse estadísticamente de los animales del grupo control (Figura 8).
Los animales experimentales no mostraron diferencias significativas en los valores de recuento diferencial leucocitario, sin embargo el valor de monocitos se encontró en el límite superior. La proporción deneutrófilos y linfocitos fue mayor en los animales expuestos a concentraciones de 1000 µg de Glifosato (Roundup®) (0,2 ± 0,04) así como a la mezcla con Cosmoflux® 411F (0,25 ± 0,03)comparados con el control (0,08 ± 0,01) (p<0,05). En el presente trabajo fue posible evidenciar en los animales experimentales un nivel más alto de células blásticas en los individuos expuestos frente a los animales del grupo control. No obstante la presentación de estas células blásticas no fue mayor a concentraciones más altas.
Discusión
En el presente estudio, los alevinos de cachama blanca expuestos a diferentes concentraciones de Glifosato (Roundup®) así como de la mezcla con Cosmoflux® 411 F, evidenciaron un incremento en la actividad de explosión respiratoria (estrés oxidativo), así como una alteración de la proporción de neutrófilos y linfocitos sanguíneos.Además fueron evidentes cambios histopatológicos hepáticos (compatibles con cambios grasos) y lesiones branquiales (hiperplasia interlamelar leve).
En el presente estudio no se evidenció cambios en el índice hepatosomático de los animales experimentales, similar a lo descrito en otros trabajos (Velisek et al., 2010). Eason & Scanlon (2002) demostraron que la exposición a atrazina y glifosato no indujoaumento de peso del hígado. No obstante, los animales expuestos a glifosato mostraron un mayor porcentaje de grasa hepática en comparación con los expuestos a atrazina y el grupo control. Por otra parte, Yi et al., (2007a) y Mikula et al., (2009) encontraron que en carpa, Carassius auratus, expuesta crónicamente al herbicida Alachlor presentaron una disminución del índice hepatosomático; como también fue descrito por Ariyoshi et al., (1990); Ariyoshi et al., (1991) en animales expuestos a surfactantes. Sin embargo, existen algunos trabajos que demuestran un elevado índice hepatosomático en animales expuestos a herbicidas (Figueiredo- Fernandes et al., 2006; Stephensen et al., 2000; Yi et al., 2007b; Yang et al., 2010).
Los cambios blanquecinos en superficie del hígado, compatibles con degeneración grasa hepática, fueron leves en los animales expuestos en los tratamientos T3 y T4. Dichos cambios han sido reportados en animales expuestos a xenobióticos y específicamente glifosato (Roundup®), al surfactante (Cosmoflux® 411F) así como a su mezcla (Eslava-Mocha et al., 2007; Rondón- Barragán et al., 2007; Ramírez-Duarte et al., 2008; Velisek et al., 2010).
Esta degeneración grasa puede estar relacionada con la hipoxia sistémica (debido a hiperplasia interlamelar leve, que limita la difusión del oxígeno a la sangre (Figuras 5 y 6) que conduce a una inhibición del proceso de beta-oxidación de las grasas, permitiendo así la acumulación de las mismas en el tejido hepático. Sin embargo esta acumulación pueden ser consecuencia de un daño mitocondrial que disminuye la beta oxidación de los ácidos grasos a cetonas (Myers y McGavin, 2007). Szarek et al., (2000) demostraron daño mitocondrial en hepatocitos de carpas expuestas a la formulación comercial Roundup® así como la formación de figuras de mielina en el tejido hepático, las cuales corresponden en su gran mayoría a fosfolípidos destruidos y acumulados en el citoplasma (Myers & McGavin, 2007). Además, pueden presentarse leves alteraciones en la síntesis proteica, específicamente de lipoproteínas necesarias para la liberación y transporte de los lípidos desde los hepatocitos (Jones et al., 1997). No obstante, algunos autores han descrito dichas vacuolizaciones como estrategias para disminuir la disponibilidad de xenobióticos lipofílicos (Cooley et al., 2000; Sarkar et al., 2005). Estas vacuolizaciones han sido descritas en otras especies expuestas al glifosato (McComb et al., 2008) así como en otros tejidos diferentes al hepático (Dallegrave et al., 2007). Acorde con estudios previos en otras especies de peces, los hallazgos de este trabajo sugieren que los compuestos Glifosato y Cosmoflux 411® F, tienen la capacidad de inducir degeneración grasa del hígado de la Cachama blanca en forma leve o moderada. El efecto moderado de dichos compuestos podría deberse a la dosis y tiempo de exposición evaluada. Se hacen necesario estudios adicionales e incluir tiempos de exposición prolongados, así como los efectos agudos dentro de los primeras 24 h de exposición, dado que esta especie aparentemente tiene un alto grado de adaptación metabólica.
Hematología
Los cambios en la coloración de la sangre (apariencia más oscura) en los tratamientos expuestos a los tóxicos pueden deberse a la formación de carboxihemoglobina. No obstante el origen de esta carboxihemoglobina se descarta por efecto del Eugenol, pues aun cuando este produce depresión del centro respiratorio, los animales fueron venipunzados antes del cese de los movimientos operculares, además estuvieron expuestos el mismo tiempo de anestesia que el grupo control. Por otra parte la coloración oscura de la sangre puede deberse a fenómenos de hipoxia generados por hiperplasia interlamelar que disminuye la difusión del oxígeno al espacio vascular branquial, sin embargo, dicha hiperplasia fue leve en los animales expuestos. Estas lesiones de hiperplasia interlamelar branquial han sido descritas por otros autores como respuestas adaptativas frente a polutantes en el agua (Mallat, 1985; Nescovik et al., 1996; Eslava-Mocha et al., 2007; Rondón-Barragán et al., 2007; Ramírez-Duarte et al., 2008).
Por otro lado, la exposición a surfactantes reduce la hematosis branquial provocando una disminución en su actividad fisiológica de forma reversible (Fonseca et al., 1997). Cabral et al. (1999) encontraron que el Genapol® a concentraciones subletales (0,75 mg/L) induce cambios dramáticos en el consumo de oxígeno asociados con una reducción en la tasa metabólica, debido al desarrollo de daños branquiales en el "mosquitofish". Estos daños branquiales han sido descritos como lisis de células epiteliales branquiales Onchorhynchus mykiss (Partearroyo et al., 1991) así como se han descrito otras lesiones vasculares, tales como el aneurisma (Eslava et al., 2007; Rondón-Barragán et al., 2007; Ramírez-Duarte et al., 2008; Jiraungkoorskul et al., 2002) las cuales no fueron evidentes en el presente trabajo. Así se concluye que la exposición subletal de alevinos de cachama blanca a las concentraciones evaluadas de Glifosato y Cosmoflux® 411F induce lesiones branquiales. Se sugiere además la evaluación de los efectos agudos de dicha exposición dentro de las primeras 24 horas, pudiendo correlacionarse con la capacidad de adaptación metabólica de la especie.
Diversos estudios han demostrado cambios en los parámetros hematológicos en animales expuestos a pesticidas (Velisek et al., 2009; Salbego et al., 2010). En el presente estudio se evidenció un aumento en el hematocrito de los animales expuestos a Roundup® y a la mezcla con Cosmoflux® 411F, en comparación con el grupo control, esto se debe posiblemente a una respuesta adaptativa (compensatoria) a fenómenos hipóxicos o procesos de hemolisis.Sin embargo parecen existir diferencias en la respuesta en diversas especies, e.g. en la Piava (Leporinus abtusidens) expuestas al glifosato, se observó una reducción en el valor del hematocrito (Salbego et al., 2010).
Además, este incremento en el hematocrito puede deberse a un incremento en el número total eritrocitos inducido por la exposición al toxicó. Así, Velisek et al., (2010) observaron incremento en el recuento de eritrocitos en carpa común (Cyprinus carpio) expuestas al herbicida Terbuteryn, estos cambios se evidencian durante situaciones de estrés para incrementar la captación de oxígeno y así suplir las demandas de oxígeno de los órganos mayores en respuesta a la alta demanda metabólica.
Cavalcante et al., (2008) demostraron que este herbicida induce daño eritrocitario en Curimba (Prochilodus lineatus) lo cual está acorde con lo evidenciado en los frotis sanguíneos, donde se presentó mayor hemolisis en animales expuestos a la mezcla de herbicida más surfactante. Estos autores asocian tales fenómenos a la interacción que existe entre el ADN y las especies de oxígeno reactivo (ROS) generadas en el metabolismo de dicho xenobiótico (Cavas et al., 2007). Así también se han descrito lesiones en las membranas celulares que pueden inducir fallas en la regulación iónica así como muerte celular (Elie-Caille et al., 2010).
Explosión respiratoria
Los niveles elevados de actividad oxidativa de los animales expuestos a los xenobióticos en este estudio pueden deberse a un incremento en el estrés oxidativo generado por el Roundup® así como por la mezcla de Roundup® más Cosmoflux® 411F. Peixoto (2005) demostró que la exposición al glifosato indujo estrés oxidativo y que este era mayor cuando se acompañaba del surfactante en alevinos de cachama blanca (Piaractus brachypomus). Se ha demostrado que el Roundup® así como el glifosato grado técnico inducen una depresión de la función del citocromo P450 y de las enzimas Glutation-S- transferasa y G-6-P deshidrogenasa, las cuales son vitales para el procesamiento de tóxicos en animales, así como la Superóxido dismutasa (SOD) y catalasa (CAT) (Acquavella et al., 2004; Gehin et al., 2005; Costa et al., 2008; Elie-Caille et al., 2010). La exposición a surfactantes ha evidenciado también la disminución en la actividad de la citocromo P450, citocromo b5 y del grupo hemo microsomal (Ariyoshi et al., 1990; Ariyoshi et al., 1991). La alteración de la actividad enzimática puede presentarse dada la unión de los surfactantes a proteínas, modificando su solubilidad y estructura (Cserháti, 1995) lo cual puede explicar la mayor actividad oxidativa en los animales expuestos al herbicida más el surfactante. Martinez-Coscollá et al., (1993) demostraron que los surfactantes incrementan la absorción de xenobióticos en tejido epiteliales, pudiendo ser por tanto esta inhibición enzimática causada por una mayor entrada de xenobiótico a los tejidos.
La exposición a glifosato y surfactantes induce lesiones en las membranas celulares (disminución de las protrusiones) de células epiteliales así como daños asociados a desorganización del citoesqueleto (Elie-Caille et al., 2010). Estos daños de membrana se relacionan con liberación citosólica de componentes así como pérdida de la regulación iónica. Por otra parte, Elie-Caille et al., (2010) demostraron que las células expuestas a glifosato evidencian cambios característicos de procesos apoptóticos. Estos fenómenos pueden derivarse de la lesión mitocondrial ya descrita en la exposición a estas sustancias (Szarek et al., 2000).
Salbego et al., (2010) describen que los peces expuestos al Roundup® probablemente usan su energía para detoxificar este compuesto y alteran su metabolismo de carbohidratos y proteínas, acorde con los descrito en otros trabajos (Ramírez et al., 2007). Zilinskans et al., (1975) reportan que el incremento en el porcentaje de linfocitos reductores de NBT se debe a la activación de la vía de monofosfato de hexosa, dicha ruta metabólica convierte la glucosa en pentosa más CO2 y libera energía para su uso por parte de la célula y es acelerada por el NADP+ (Tizard, 2009) durante el proceso de explosión respiratoria.
Así trabajos con estos xenobióticos en cachama blanca han indicado un incremento en la presencia de centros melanomacrófagos (CMM) cuando son sometidos a concentraciones letales y subletales (Ramírez-Duarteet al., 2008; Rondón-Barragán et al., 2007). Estos cambios son compatibles con el incremento en la actividad oxidativa dada la acción barredora de radicales libres que cumplen estos centros, también son coherentes con procesos de reparación tisular del epitelio tubular renal. Ya otros autores han destacado los CMM como bioindicadores de cambios ambientales bruscos así como de la exposición a xenobióticos (Agius & Roberts, 2003).
Algunos autores han argumentado que los animales en exposiciones crónicas pueden adaptarse a las concentraciones de glifosato, esto evidenciado por cambios en la concentración de cortisol (Salbego et al., 2010), diferente a lo hallado en ensayos de exposición aguda donde estos niveles se elevan y mantienen (Cericato et al., 2008).
Cambios tales como incremento en el recuento de monocitos, bandas y PMNs, han sido categorizados como alteraciones de la inmunidad no especifica (Velisek et al., 2009). Estos cambios no fueron evidentes en el presente estudio, no obstante el nivel de monocitos se ubicó en el límite superior en los animales expuestos al tóxico. Además, se evidenciaron células blásticas de la línea mieloide, monoblastos principalmente. No obstante dada la carencia de medula ósea para la maduración celular es posible encontrar dichas células en el torrente sanguíneo. Los cambios en la proporción neutrófilos:linfocitos han sido relacionados con alteración de la respuesta inmune (Knowles et al., 2006; Van Rijn y Reina, 2010) probablemente por un efecto depresivo de la línea linfocítica por niveles altos de cortisol.
Conclusiones
La exposición crónica subletal de alevinos de cachama blanca (Piaractus brachypomus) a concentraciones subletales de Glifosato (Roundup®) así como de la mezcla Roundup® más Cosmoflux® 411F incrementa la actividad oxidativa, así como induce cambios hematológicos, e histopatológicos en branquias e hígado, importantes que pueden comprometer la capacidad del pez para responder a los desafíos del medio.
En el presente trabajo se postula que la vía por la cual se induce el estrés oxidativo en alevinos de cachama blanca expuestos al glifosato así como a la mezcla se puede deber a la alteración/inhibición del sistema antioxidante, dependiente de diferentes componentes enzimáticos tales como SOD, CAT, Glutatión Peroxidasa, entre otros, los cual se soporta en reportes previos (Wu et al., 2004; Hultberg, 2007). Además se sugiere la revisión de efectos subletales agudos (antes de las 24 horas) así como la exploración de actividad anticolinesterasa que pueda estar ejerciendo efecto inmunomoduladores post-exposición (Salbego et al., 2010; Rondón et al., 2010).
Agradecimientos
A CORMACARENA por la financiación del proyecto "Estudio sobre los efectos del glifosato y surfactantes acompañantes en cachama blanca (Piaractus brachypomus)" Convenio UNILLANOS - CORMACARENA 2007. No. 2.8.205.007-07. Al laboratorio de Toxicología de la Universidad del Tolima, dirigido por el Profesor Ángel Céspedes. A Jackson Tapiero, Rodrigo Palomino, Anyi Torres, Tania Hernández, Viviana Ramírez y Luis Ortiz por su valiosa colaboración para el desarrollo del trabajo.
Bibliografía
Acquavella, J.F., Bruce, H., Alexander, B.H., Mandel, J.S., Gustin, C., Baker, B., 2004. Glyphosate biomonitoring for farmers and their families: results from the farm family exposure study. Environmental Health Perspective 2004; 112, 321-326. [ Links ]
Agius C, Roberts R. Melano-macrophage centers and their role in fish pathology. Journal of Fish Disease 2003; 26: 499-509. [ Links ]
Ariyoshi T, Hasegawa H, Matsumoto H, Arizono K. Effects of surfactants on the contents of metallothionein, heme, and hemoproteins and on the activities of heme oxygenase and drug-metabolizing enzymes in rats pretreated with phenobarbital or ß-naphtoflavone. Bulletin of Environmental Contamination Toxicology 1991; 46:120-127. [ Links ]
Ariyoshi T, Shiiba S, Hasegawa H, Arizono K. Profile of metal-binding proteins and heme oxigenase in red carp treated with heavy metals, pesticides and surfactants. Bulletin of Environmental Contamination Toxicology 1990; 44:643-649. [ Links ]
Cabassi E. Immune system and exposure to xenobiotics in animals. Veterinary Research Communications 2007; 31(supp 1): 115-120. [ Links ]
Cabral J, Ávila S, Marques J. Acute and sublethal effects of a nonionic surfactant, Genapol OXD-080, on mosquitofish Gambusia holbrooki (Girard). Ecotoxicology. 1999; 8, 245-252. [ Links ]
Cavalcante DGSM., Martinez CBR., Sofia SH. Genotoxic effects of Roundup® on the fish Prochilodus lineatus. Mutation Research/Genetic Toxicology and Environmental Mutagenesis 2008; 655: 41-46. [ Links ]
Cavas T., Konen S. Detection of cytogenetic and DNA damage in peripheral erythrocytes of goldfish (Carassius auratus) exposed to a glyphosate formulation using the micronucleus test and the comet assay. Mutagenesis 2007; 22:263-268. [ Links ]
Cericato L., Machado JGS., Fagundes M., Kreutz LC., Quevedo RM., Finco J., Roa JGS., Koakoski G., Centenaro L., Pottker E., Anziliero D., Barcellos LJG. Cortisol response to acute stress in jundia Rhambdia quelen acutely exposed to sub-lethal concentrations of agrichemicals. Comparative Biochemistry and Physiology - Part C: Toxicology & Pharmacology 2008; 148: 281-286. [ Links ]
Cooley, H.M., Evans, R.E., Klaverkamp, J.F. Toxicology of dietary uranium in lake whitefish (Coregonus clupeaformis). Aquatic Toxicology 2000; 48: 495-515. [ Links ]
Costa M., Monteiro D., Oliveira A., Rantin F., Kalinin A. Oxidative stress biomarkers and heart function in bullfrog tadpoles exposed to Roundup Original®. Ecotoxicology 2008; 17:153-163. [ Links ]
Cserháti T. Alkyl ethoxylated and alkylphenol ethoxylated nonionic surfactants: interaction with bioactive compounds and biological effects. Environmental Health Perspective 1995; 103: 358-364. [ Links ]
Dallegrave E., Mantese FD., Oliveira RT., Andrade AJM., Dalsenter PR., Langeloh A. Pre- and postnatal toxicity of the commercial glyphosate formulation in Wistar rats. Archives of Toxicology 2007; 81:665-673. [ Links ]
Diamond G, Durkin P. Effects of surfactants on the toxicitiy of glyphosate, with specific reference to RODEO. Animal and Plant Health Inspection Service (APHIS), Biotechnology, Biologics and Environmental Protection, Environmental Analysis and Documentation, United States Department of Agriculture, Unit 149 4700 River Road, SERA TR 97-206-1b. 1997. Febrero 6. [ Links ]
Eason TH., Scanlon PF. Effects of atrazine and glyphosate ingestion on body weight and nutritional well-being of Coturnix quail. Zeitschrift für Jagdwissenschaft 2002; 48: 281-285. [ Links ]
Eile-Caille C., Heu C., Guyon C., Nicod L. Morphological damages of glyphosate-treated human keratinocyte cell line revealed by a micro- to nanoscale microscopic investigation. Cell Biology Toxicology 2010; 26:331-339. [ Links ]
Elandalousi LM, Leite RB, Rodrigues PM, Afonso R, Cancela ML. Effects of herbicide Roundup® on Perkinsus olsen in vitro proliferation and in vivo survival when infecting a permissive host, the claim Ruditapes decussatus. Bulletin of Environmental Contamination Toxicology 2008; 80: 512-515. [ Links ]
Eslava-Mocha PR, Ramírez-Duarte WF, Rondón-Barragán IS. Sobre los efectos del glifosato y sus mezclas: Impacto sobre peces nativos. Villavicencio-Meta, Editorial Juan XXIII. Universidad de los Llanos. 2007. p 150. [ Links ]
Fatima M, Mandiki SNM, Douxfils J, Silvestre F, Coppe P, Kestemont P. Combined effects of herbicides on biomarkers reflecting immune- endocrine interactions in goldfish immune and antioxidant effects. Aquatic Toxicology 2007, 81: 159-167. [ Links ]
Figueiredo-Fernandes A., Fontaínhas-Fernandes A., Peixoto F., Rocha E., Reis-Henriques MA. Effects of gender and temperature on oxidative stress enzymes in Nile Tilapia Oreochromis niloticus exposed to paraquat. Pesticide Biochemistry Physiology 2006; 85:97-103. [ Links ]
Floyd R. The use of salt in aquaculture. Fact Sheet VM 86. Series of the Department of Large Animal Clinical Sciences, Florida Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida. (http://hammock.ifas.ufl.edu). 1995. [ Links ]
Folmar L, Sanders H, John A. Toxicity of the herbicides glyphosate and several of it's formulation to fish and aquatic invertebrates. Archives of Environmental Contamination and Toxicology 1979; 269-278. [ Links ]
Fonseca J, Marques J, Madeira V. 1997. Citado por: Cabral J, Ávila S, Marques J. Acute and sublethal effects of a non-ionic surfactant, Genapol OXD-080, on mosquitofish Gambusia holbrooki (Girard). Ecotoxicology 1999; 8; 245-252. [ Links ]
Gehin A., Guillaume YC., Millet J., Guyon C., Nicod L. Vitamins C and E reverse effect of herbicide-induced toxicity on human epidermal cells HaCat: a biochemometric approach. International Journal of Pharmacology 2005; 288: 219-226. [ Links ]
Glusczak L, Dos Santos D, Crestani M, Braga M, De Araújo F, Frescura M, Pimentel VL. Effect of glyphosate herbicide on acethylcolinesterase activity and metabolic and hematological parameters in piava (Leporinus obtusidens). Ecotoxicology and Environmental Safety 2006; 65: 237-241. [ Links ]
Glusczak L, Dos Santos D, Silveira B, Rodrigues R, Chitolina MR, Morsch V, Loro V. Acute effects of glyphosate herbicide on metabolic and enzymatic parameters of silver catfish (Rhamdia quelen). Comparative Biochemistry and Physiology - Part C: Toxicology & Pharmacology 2007; 146: 519-524. [ Links ]
Haney R, Senseman S, Hons F. Effect of RoundUp Ultra on microbial Activity and biomass from selected soils. J Environ Qual. 2002. 31(3): 730-735. [ Links ]
Hultberg M. Cysteine turnover in human cell lines is influenced by glyphosate. Environmental Toxicology and Pharmacology 2007; 24: 19-22. [ Links ]
Jiraungkoorskul W, Upatham ES, Kruatrachue M, Sahaphong S, Vichasri-Grams S, Pokethitiyook P. Histopathological effects of Roundup, a glyphosate herbicide, on Nile tilapia (Oreochromis niloticus). Science Asia 2002; 28: 121-127. [ Links ]
Jones T, Hunt R, King N. Veterinary Pathology. 1997. Sixth Edition. Lippincott Williams & Wilkins. [ Links ]
Kaczewer J. Toxicología del glifosato: Riesgos para la salud humana. Universidad Nacional de Buenos Aires. 2002. [ Links ]
Kiesecker JM. Synergism between trematode infection and pesticide exposure: a link to amphibian limb deformities in nature? PNAS 2002, 99: 9900-9904. [ Links ]
Knowles S, Hrubec TC, Smith SA, Bakal RS. Hematology and plasma chemistry reference intervals for cultured shortnose sturgeon (Acipenser brevirostrum). Veterinary Clinical Patholology 2006; 35(4):434-40. [ Links ]
Lima A, Vega L. Methyl-parathion and organophosphorous pesticides metabolites modify the activation status and interleukin-2 secretion of human peripheral blood mononuclear cells. Toxicology Letters 2005; 158: 30-38. [ Links ]
Mallatt J. Fish gill structural changes induced by toxicants and other irritants: A statistical review. Canadian Journal of Fish Aquatic Science 1985; 42: 630-648. [ Links ]
Martínez A, Reyes I, Reyes N. Citotoxicidad del glifosato en células mononucleares de sangre periférica humana. Biomédica 2007; 27:594-604. [ Links ]
Martinez-Coscollá A., Miralles-Loyola E., Garrigues TM., Sirvent MD., Salianas E., Casabó VG. Studies on the reliability of a novel absorption-lipophilicity approach to interpret the effects of the synthetic surfactant on drug and xenobiotic absorption. Arzneim Forsch 1993; 43:699-705 (Abstract). [ Links ]
McClure GYH, Helm RM, Stine K, Burks AW, Jones SM, Gandy J. Evaluation of immune parameters in propanil-exposed farm families. Archives of Environmental Contamination and Toxicology 2001; 41: 104-111. [ Links ]
McComb B., Curtis L., Chambers C., Newton M., Bentson K. Acute toxic hazard evaluation of glyphosate herbicide on terrestrial vertebrates of the Oregon Coast Range. Environmental Science and Pollution Research 2008; 15:266-272. [ Links ]
Mikula P., Blahova J., Kruzikova K., Havelkova M., Nemethova D., Hulak M., Svobodova Z. Effects of herbicide LASSO MTX (alachlor 42% W/V) on biometric parameters and liver biomarkers in the common carp (Cyprinus carpio). Pesticide Biochemistry and Physiology 2009; 93:13-17. [ Links ]
Mohanty BR., Sahoo PK. Immune responses and expression profiles of some immune-related genes in Indian major carp, Labeo rohita to Edwardsiella tarda infection. Fish & Shellfish Immunology 2010; 28:613-621. [ Links ]
Morgan J, Vigers G, Farrell A, Janz D, Manville J. Acute avoidance reactions and behavioral responses of juvenile rainbow trout (Oncorhynchus mykiss) to Garlon 4©, Garlon 3A© and Vision© herbicides. Environmental Toxicology and Chemistry 1991; 10:73-79. [ Links ]
Murtaza F, Stallings W. Closing down on Glyphosate inhibition - with a new structure for drug discovery. PNAS. 2001. 8(6): 2944-2946. [ Links ]
Myers RK, McGavin MD. Cellular and tissue response to injury. En: McGavin MD; Zachary JF. Pathologic basis of veterinary disease. Fourth Edition. Mosby Elsevier. p38-43. [ Links ]
Neskovic NK, Poleksic V, Elezovic I, Karan V, Budimir M. Biochemical and histopathological effects of glyphosate on carp, Cyprinus carpio L. Bulletin of Environmental Contamination and Toxicology 1996; 56: 295-302. [ Links ]
Nivia E, Sánchez L. Cultivos ilícitos. ¿sustitución o erradicación? Notas aclaratorias sobre el uso del Roundup en Colombia. RAPALMIRA. PAN: Pesticide Action Network. 2001. [ Links ]
OECD. Test No 204 Adopted: 4 April 1984. OECD GUIDELINE FOR TESTING OF CHEMICALS "Fish, Prolonged Toxicity Test: 14- day Study. [ Links ]
Partearroyo MA, Pilling SJ, Jones MN. The lysis of isolated fish (Oncorhynchus mykiss) gill epithelial cells by surfactants. Comparative Biochemistry and Physiology - Part C: Toxicology & Pharmacology 1991; 100c:381388. [ Links ]
Peixoto F. Comparative effects of the Roundup and glyphosate on mitochondrial oxidative phosphorylation. Chemosphere 2005; 61: 1115-1122. [ Links ]
Pinchuk L, Lee S-R, Filipov NM. In vitro atrazine exposure affects the phenotypic and functional maturation of dendritic cells. Toxicology and Applied Pharmacology 2007; 223: 206-217. [ Links ]
Pistl J, Kovalkovicová N, Legáth J, Novotný J, Holovská V, Mikula I. Metabolic activity of sheep peripheral blood phagocytes after exposure to selected pesticides in vitro. Bulletin of the Veterinary Institute in Pulawy 2002; 46: 247-253. [ Links ]
Pistl J, Kovalkovicová N, Reichel P, Holovská V, MLynarcíková H, Legáth J, Kovác G, Mikula I. Influence of herbicide chloridazone on haematological parameters and functional activity of leukocytes in sheep. Bulletin of the Veterinary Institute in Pulawy 2003; 47: 145-152. [ Links ]
Ramírez-Duarte WF, Rondón-Barragán IS, Eslava-Mocha PR. Acute toxicity and histopathological alterations of Roundup® herbicide on "cachama blanca" (Piaractus brachypomus). Pesquisa Veterinária Brasileira 2008; 28 (11):547-554. [ Links ]
Reimschuessel R, May E, Bennett R, Lipsky M. Necropsy examination of fish. Vet Clin North Amer: Tropical Fish Medicine: Small Animal Practice. 1988. 18(2): 427-433. [ Links ]
Rice CD, Kergosien DH, Adams SM. Innate immune function as a bioindicator of pollution stress in fish. Ecotoxicology Environmental Safety 1996; 33: 186-192. [ Links ]
Rondón-Barragán IS, Pardo-Hernández D, Eslava-Mocha PR. Efectos de los herbicidas sobre el sistema inmune en peces. Revista Complutense de Ciencias Veterinarias - RCCV. 2010; 4(1): 1-22. [ Links ]
Rondón-Barragán IS, Ramírez-Duarte WF, Eslava-Mocha PR. Evaluación de los efectos tóxicos y concentración letal 50 del surfactante Cosmoflux®411F sobre juveniles de cachama blanca (Piaractus brachypomus). Revista Colombiana de Ciencias Pecuarias 2007; 20(4): 431-446. [ Links ]
Salazar-Lugo R, Estrella A, Oliveros A, Rojas-Villarroel E, Villalobos L, Lemus M. Paraquat and temperatura affect nonspecific immune response of Colossoma macropomum. Environmental Toxicology and Pharmacology 2009; 27: 312-326. [ Links ]
Salbego J., Pretto A., Gioda CR., Cavalheiro de Menezes C., Lazzari R., Radünz J., Baldisserotto B., Loro VL. Herbicide formulation with glyphosate affects growth, acetylcholinesterase activity, and metabolic and hematological parameters in Piava (Leporinus obtusidens). Archives of Environmental Contaminationand Toxicology 2010; 58: 740-745. [ Links ]
Sarkar, B., Chatterjee, A., Adhikari, S., Ayyappan, S. Carbofuran and cypermethrin-induced histopathological alterations in the liver of Labeo rohita (Hamilton) and its recovery. Journal of Applied Ichthyology 2005; 21, 131-135. [ Links ]
Sheil JM, Frankenberry MA, Schell TD, Brundage KM, Barnett JB. Propanil exposure induces delayed but sustained abrogation of cell-mediated immunity through direct interference with cytotoxic T-lymphocyte effectors. Environmental Health Perspective 2006; 114(7): 1059-1064. [ Links ]
Sivikova K, Dianovský J. Cytogenetic effect of technical glyphosate on cultivated bovine peripheral lymphocytes. International Journal of Hygiene and Environmental Health 2006; 209: 15-20. [ Links ]
Stephensen E., Svavarsson J, Sturve J., Ericon M., Adolfson-Erici G., Förlin L. Biochemical indicators of pollution exposure in shorthorn sculpin (Myoxocephalus scorpius), caught in four harbours on the south-west coast of Iceland. Aquatic Toxicology 2000; 48:431-442. [ Links ]
Studnicka M, Siwicki AK, Morand M, Rymuszka A, Bownik A, Terech-Majewska E. Modulation of nonspecific defence mechanisms and specific immune responses after suppression induced by xenobiotics. Journal of Applied Ichthyology 2000; 16:1-7. [ Links ]
Suárez RO, Gonzales, JF. Actividad colinesterasa cerebral, muscular, hepática y plasmática en juveniles de cachama blanca (Piaractus brachypomus): efecto inhibidor del clorpirifos (LORSBAN 4EC®). Revista Medicina Veterinaria Zootecnia 2007; 54 (2):180. [ Links ]
Sung H-H, Ye Y-Z. Effect of nonylphenol on giant freshwater prawn (Macrobrachium rosembergii) via oral treatment: Toxicity and messenger RNA expression on hemocyte genes. Aquatic Toxicology 2009; 91: 270-277. [ Links ]
Szarek J, Siwicki A, Andrzejewska A, Terech-Majewska E, Banaszkiewicz T. Effects of the herbicide RoundupTM on the ultrastructural pattern of hepatocytes in carp (Cyprinus carpio). Marine Environmental Research 2000; 50: 263-266. [ Links ]
Tizard I. Chapter 3 - How inflammation is triggered. Chapter 12 - Helper T cells and their response to antigens En: Veterinary immunology. 8 edition. Saunders Elsevier 2009. 11-27. [ Links ]
Van Rijn JA, Reina RD. Distribution of leukocytes as indicators of stress in the Australian swellshark, Cephaloscyllium laticeps. Fish & Shellfish Immunology 2010; 29(3):534-538. [ Links ]
Velisek J., Sudova E., Machova J., Svobodova Z. Effects of sub-chronic exposure to terbuterym in common carp (Cyprinus carpio L.). Ecotoxicology and Environmental Safety 2010; 73:384-390. [ Links ]
Velisek J., Svobodova Z., Piackova V., Sudova E. Effects of acute exposure to metribuzin on some hematological, biochemical and histopathological parameters of common carp (Cyprinus carpio L.). Bulletin of Environmental Contamination Toxicology 2009; 82: 492-495. [ Links ]
Williams G, Kroes R, Munro L. Safety evaluation and risk assessment of the herbicide Roundup and Its active ingredient, Glyphosate, for humans. Regulatory Toxicology and Pharmacology 2000; 31:117 - 165. [ Links ]
WORLD HEALTH ORGANIZATION (WHO), UNITED NATIONS ENVIRONMENT PROGRAMME, THE INTERNATIONAL LABOUR ORGANIZATION. 1994. Glyphosate. Environmental Health Criteria #159. Geneva, Switzerland. [ Links ]
Wu G., Fang YZ., Yang S., Lupton JR., Turner ND. Glutathione metabolism and its implications for health. Journal of Nutrition 2004; 134: 489-492. [ Links ]
Yang L., Zha J., Zhang X., Li W., Li Z., Wang Z. Alterations in mRNA expression of steroid receptors and heat shock proteins in the liver o rare minnow (Grobiocypris rarus) exposed to atrazine. Aquatic Toxicology 2010; 98:381-387. [ Links ]
Yanong R. Necropsy Techniques for fish. Seminars in Avian and Exotic Pet Medicine. 2003; 13(2): 89-105. [ Links ]
Yi X., Ding H., Lu H., Liu H., Zhang H., Jiang W. Effects of long-term alachlor exposure on hepatic antioxidant defense and detoxifying enzyme activity in crucian carp (Carassius auratus). Chemosphere 2007a; 68: 1576-1581. [ Links ]
Yi X., Liu H., Lu Y., Tao J., Ding H., Zhang M. Altered serum levels of sex steroids and biotransformation enzyme activities by long-term Alachlor exposure in crucian carp (Carassius auratus). Bulletin of Environmental Contamination Toxicology 2007; 79: 283-287. [ Links ]
Zilinskas J., Zekonis J., Zekonis G., Valantiejiene A., Periokaite R. The reduction of nitroblue tetrazolium by total blood in periodontitis patients and the aged. Stomatologija. Baltic Dental and Maxillofacial Journal 2007; 9:105-108. [ Links ]