Introducción
La restricción alimenticia es el fenómeno mediante el cual se disminuye en un animal la posibilidad de adquirir alimento o se disminuye la calidad nutricional del mismo; diversas especies ícticas pasan naturalmente por periodos de privación de alimento a causa de fluctuaciones ambientales, que alteran su disponibilidad (Wang et al., 2006). Otras especies experimentan épocas de ayuno en el medio natural relacionadas con la reproducción, bien sea por las migraciones reproductivas (MacKenzie et al., 1998) o por el cuidado parental que ejercen sobre sus crías.
Cuando los individuos experimentan escasez en la disponibilidad de alimento deben usar la energía almacenada para su metabolismo, actividad física, crecimiento y reproducción. La resistencia de un pez a la falta de alimento refleja su habilidad para almacenar energía y controlar la utilización de sus reservas durante circunstancias extremas (Rossi et al., 2015). Diferentes especies de peces tropicales pueden mantener el crecimiento aún con bajos niveles de energía; además, algunos de ellos en condiciones de ayuno son capaces de reducir su actividad, al igual que su temperatura corporal (Wang et al., 2006). No obstante, es casi generalizado que ante la ausencia de alimento los animales cesan su crecimiento e incluso presentan pérdida de peso hasta tanto se restablezcan las condiciones óptimas (Eroldoğan et al., 2006).
Existe la posibilidad de que durante la restricción los animales desarrollen cambios fisiológicos irreversibles que van en detrimento de su bienestar y en ocasiones, incluso, pueden ocasionar la muerte (Rossi et al., 2015). Estos efectos dependen del estadio de desarrollo en el que se encuentre el individuo y de la severidad del ayuno al que se someta (Cho et al., 2006), pero en todos los casos, la adaptación del individuo va a ser en términos de gasto energético, que supone el mantenimiento de sus funciones vitales. Generalmente, las reservas de energía se encuentran bajo la forma de glucógeno, tejido adiposo y proteína (Barcellos et al., 2010), siendo esta última la que tiende a ser preservada ante condiciones de privación de alimento. Los peces son capaces de adaptarse a la falta de alimento a través de diversos mecanismos etológicos, metabólicos y fisiológicos que incluyen la utilización de sus reservas corporales y la disminución de su metabolismo, lo cual evidencia cambios importantes en metabolitos como la glucosa, los triglicéridos y las proteínas, entre otros. Todos esos cambios deben ser restablecidos durante la fase de realimentación (Soengas et al., 1996) porque si no es así, sucederían daños irreversibles que impedirán la recuperación de los animales (Morales et al., 2004). Adicionalmente, con el restablecimiento de la alimentación los animales tienen la capacidad de experimentar el denominado crecimiento compensatorio, el cual es una fase de desarrollo acelerado que se evidencia cuando las condiciones favorables retornan, después de un periodo de disminución del crecimiento ocasionado por la falta de alimento; dicha fase se caracteriza por la restauración de las trayectorias de crecimiento somático y de las reservas lipídicas (Cho et al., 2006; Turano et al., 2008), incluso a niveles superiores a las de animales alimentados continuamente. Gracias a esta característica, existen diversas investigaciones que han demostrado que la tasa de crecimiento de los peces depende además de la composición química de la ración, de la cantidad de alimento ofrecido y de la frecuencia de suministro (Houlihan et al., 2001) y que periodos de restricción alimenticia podrían favorecer el desempeño productivo de los peces, al tiempo que disminuirían el vertimiento de nutrientes a los efluentes y los costos de producción (Johansen y Overturf, 2006; Reigh et al., 2006), aspectos fundamentales para el productor. Por esta razón el estudio y entendimiento de todos los procesos implicados en el crecimiento de los peces, puede facilitar la implementación de estrategias alimenticias que, aun disminuyendo los costos de alimentación, garantizan el bienestar animal y permitan una exigencia biológica al sistema para desencadenar respuestas como el crecimiento compensatorio.
Es así que el presente trabajo buscó evaluar el efecto de la restricción alimenticia sobre el metabolismo energético, el crecimiento compensatorio y la calidad del músculo en juveniles de cachama blanca Piaractus brachypomus, principal especie nativa cultivada en Colombia.
Materiales y métodos
Localización
El experimento fue desarrollado en la Estación Piscícola La Terraza, adscrita a la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia, ubicada en Villavicencio (Meta-Colombia). Los análisis de laboratorio fueron llevados a cabo en los Laboratorios Clínico, de Fisiología de Peces y de Nutrición Animal de la misma facultad.
Material experimental y tratamientos
Se utilizaron 177 juveniles de cachama blanca (212,58 ± 12,07 g de peso vivo y 22,43 ± 0,40 cm de longitud estándar obtenidos de un mismo lote, los cuales fueron distribuidos (90 y 87 individuos) en dos estanques en tierra (72 y 61,6 m2) a una densidad de siembra de 1,25 peces/m3, simulando las condiciones normales del cultivo y asignados al azar a los siguientes tratamientos:
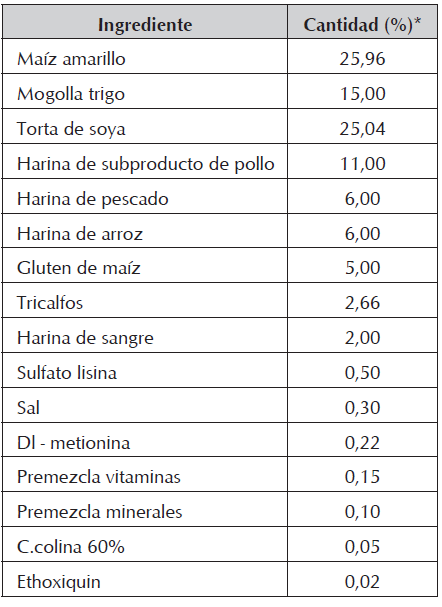
Se utilizó un alimento extrudizado, específicamente formulado y fabricado para el experimento (Tabla 1).
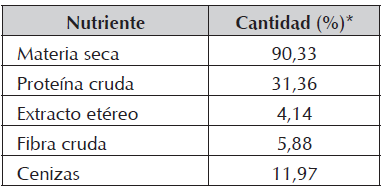
La alimentación se ofreció según cada tratamiento, al 3% de la biomasa durante las primeras 4 semanas (hasta el día 28) y al 2,5% durante el resto del experimento (días 29 a 84), ofreciendo tres raciones diarias. La composición del alimento utilizado que se determinó mediante análisis proximal se presenta en la Tabla 2.
Muestreos, análisis de muestras y variables respuesta
El experimento tuvo una duración de 84 días, periodo durante el cual se realizaron muestreos los días 1, 28, 42, 56, 70 y 84.
Para cada muestreo, previo ayuno de 24 horas, 7 animales de cada tratamiento fueron anestesiados (eugenol 50 ppm) para realizar colectas de sangre a través de punción en la vena caudal, para determinación del hematocrito mediante micro centrifugación a 2500 x G durante 5 minutos y hemoglobina, utilizando un analizador hematológico automatizado (Nihon Kuhkohben®).
Posteriormente la sangre restante fue centrifugada durante 10 minutos a 5000 rpm para obtener el plasma y suero en donde fueron determinados los siguientes parámetros:
Proteína total plasmática: en refractómetro digital (PCE Instruments®).
Glucosa, lactato, triglicéridos y colesterol plasmáticos: en analizador Vitros DT60II y sus módulos complementarios Vitros DTSII y Vitros DTEII (Jhonson & Jhonson®).
Cortisol e insulina séricos: mediante la técnica de Enzyme-linked Inmunosorbent Assay (ELISA) (Stat Fax® 303 Awareness Tecnology Inc®).
Después de tomadas las muestras de sangre, los animales fueron pesados (peso total) y medidos (longitud total y estándar). Luego fueron sacrificados para retirar el hígado, las vísceras y la grasa visceral, con el propósito de calcular los índices hepatosomático (IHS), viscerosomático (IVS) y de grasa visceral (IGV), de acuerdo con las siguientes expresiones matemáticas:
IHS = 100 * [Peso hígado (g)/Peso animal (g)]
IVS = 100 * [Peso vísceras (g)/Peso animal (g)]
IGV = 100 * [Peso grasa visceral (g)/Peso animal (g)]
Adicionalmente, en el muestreo final del día 84, se retiró una porción de músculo (filete) y se conservó a -70°C para realización de análisis proximal y de energía, de acuerdo con las metodologías estandarizadas de la AOAC (2012).
Diseño experimental y análisis de resultados
Para el análisis de las variables, se empleó un modelo lineal mixto de efectos fijos, con 2 tratamientos y 6 muestreos, donde la variable respuesta fue afectada por la media, el tratamiento y el muestreo anidado en los tratamientos. Para el análisis de los datos se utilizó un análisis de varianza (ANAVA) y en los casos en que hubo diferencias significativas (P<0,05) se empleó la prueba de Tukey-Krammer para la comparación de medias.
En el caso del análisis proximal de los filetes, el diseño experimental fue completamente al azar con dos tratamientos y siete repeticiones (siete peces). Los valores obtenidos también se sometieron a ANAVA y comparación de medias a través de la prueba de Tukey (P<0,05). Todos los análisis se realizaron utilizando el paquete estadístico SAS® V 9.0
Resultados
Parámetros sanguíneos
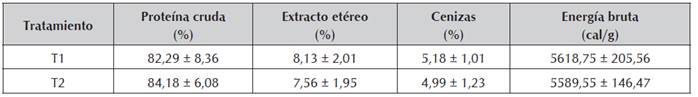
Los resultados mostraron que el hematocrito presentó diferencia significativa entre los tratamientos en los días 56 y 84, siendo superior en T1 en el día 56 e inferior en el día 84 (Figura 1). La hemoglobina (Figura 2) fue superior en el T1 en los días 1 y 42, no existiendo diferencias entre los tratamientos en los demás tiempos de muestreo. Por otro lado, la proteína plasmática tuvo un aumento significativo en el T1 el día 42 el cual se mantuvo hasta el día 56, volviendo a la normalidad en el muestreo posterior (día 70) y manteniéndose así hasta el final del ensayo (Figura 3).
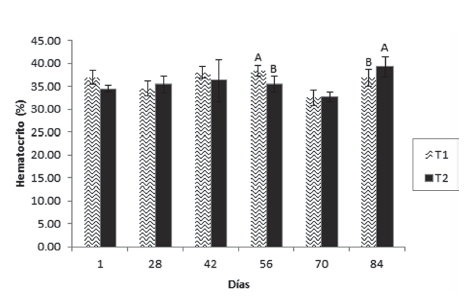
Figura 1 Valores medios ± desviación estándar de hematocrito en juveniles de cachama blanca, sin (T1) y con (T2) restricción alimenticia. Barras con letras diferentes indican diferencias significativas (P<0,05) entre los tratamientos dentro de cada día de muestreo.
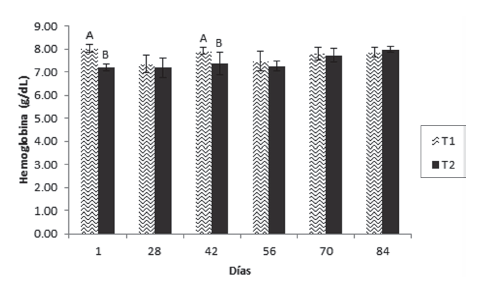
Figura 2 Valores medios ± desviación estándar de hemoglobina en juveniles de cachama blanca sin (T1) y con (T2) restricción alimenticia. Barras con letras diferentes indican diferencias significativas (P<0,05) entre los tratamientos dentro de cada día de muestreo.
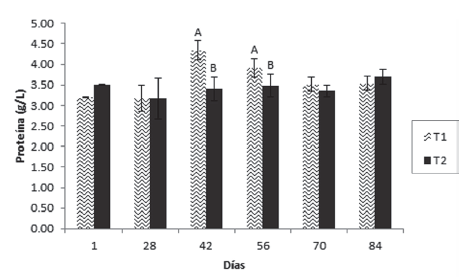
Figura 3 Valores medios ± desviación estándar de proteína en juveniles de cachama blanca sin (T1) y con (T2) restricción alimenticia. Barras con letras diferentes indican diferencias significativas (P<0,05) entre los tratamientos dentro de cada día de muestreo.
Respecto a la glucosa (Figura 4), la insulina (Figura 5) y el lactato (Figura 6), se presentaron diferencias significativas el día 28, en el cual las dos primeras fueron superiores en el T1, mientras que el lactato lo fue en el T2.
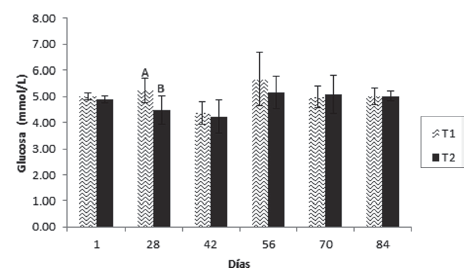
Figura 4 Valores medios ± desviación estándar de glucosa en juveniles de cachama blanca sin (T1) y con (T2) restricción alimenticia. Barras con letras diferentes indican diferencias significativas (P<0,05) entre los tratamientos dentro de cada día de muestreo.
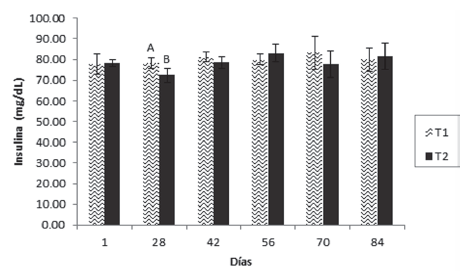
Figura 5 Valores medios ± desviación estándar de insulina en juveniles de cachama blanca sin (T1) y con (T2) restricción alimenticia. Barras con letras diferentes indican diferencias significativas (P<0,05) entre los tratamientos dentro de cada día de muestreo.
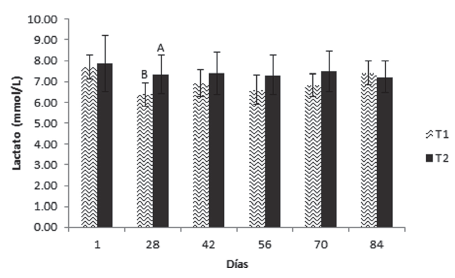
Figura 6 Valores medios ± desviación estándar de lactato en juveniles de cachama blanca sin (T1) y con (T2) restricción alimenticia. Barras con letras diferentes indican diferencias significativas (P<0,05) entre los tratamientos dentro de cada día de muestreo.
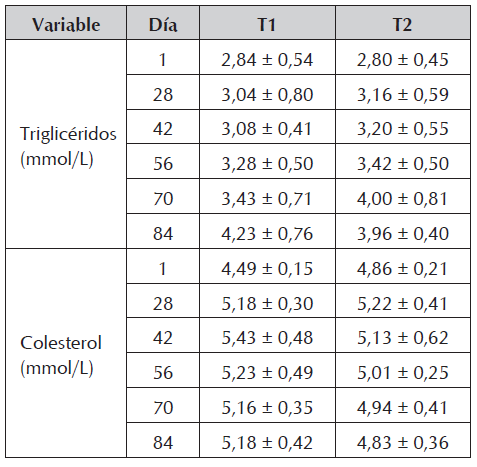
Por último, para triglicéridos y colesterol no hubo diferencias significativas entre los tratamientos en ninguno de los tiempos de colecta (Tabla 3). De igual manera, el cortisol se mantuvo constante y sin diferencias significativas entre los dos tratamientos durante todo el ensayo (T1: 20,56 ± 2,82 µg/dL y T2: 20,76 ± 2,59 µg/dL).
Peso, longitud e índices corporales
Aunque se presentaron diferencias significativas en peso los días 42 y 70 y en longitud (total y estándar) el día 42, al final del experimento no hubo diferencias significativas entre los tratamientos en ninguna de las dos variables (Tabla 4). Un comparativo del peso entre los tratamientos en cada día de muestreo se presenta en la Figura 7.
Tabla 4 Valores medios ± desviación estándar de longitudes en juveniles de cachama blanca sin (T1) y con (T2) restricción alimenticia.
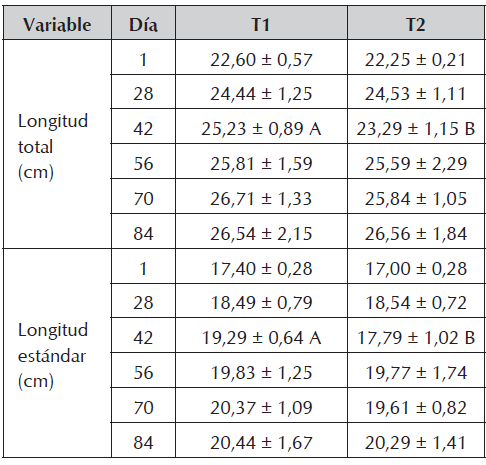
Letras diferentes en las filas indican diferencias significativas (P<0,05) entre los tratamientos dentro de cada día de muestreo.
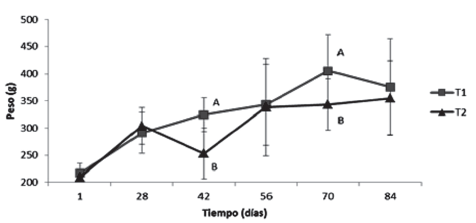
Figura 7 Valores medios ± desviación estándar de peso en los dos grupos experimentales sin (T1) y con (T2) restricción alimenticia. Letras diferentes indican diferencias significativas (P<0,05) entre los tratamientos en cada día de muestreo.
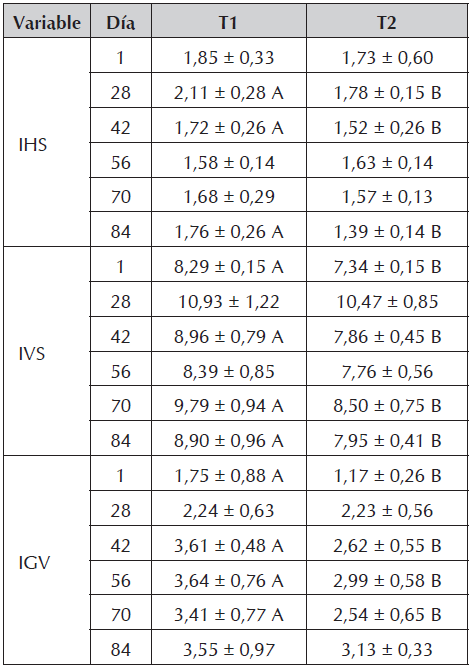
Los índices hepatosomático y viscerosomático presentaron diferencias significativas al concluir el ensayo, siendo superiores en T1. Sin embargo, el índice de grasa visceral no presentó diferencias entre los tratamientos durante ese día, a pesar de haberlas presentado en casi todos los demás muestreos con excepción del día 28 (Tabla 5).
Composición del filete
El análisis proximal y de energía de los filetes de los dos tratamientos al finalizar el ensayo se presenta en la Tabla 6, donde se observa que no hubo diferencias significativas en ninguno de los componentes evaluados.
Discusión
Para el hematocrito fueron encontradas diferencias significativas entre los tratamientos en los días 56 y 84, siendo superior en T1 en el día 56 e inferior en el día 84, situación que no parece ser atribuible a los tratamientos pues no presenta un patrón de comportamiento usual. Al respecto, Cho (2005) menciona que la variable hematocrito no necesariamente se puede asociar a la carencia o presencia de alimento y que en ese sentido el entendimiento e interpretación de su lectura podría ser complejo. Así, sorprende que durante el periodo final del experimento (días 43 a 84) en dos de los tres muestreos realizados, se hayan presentado diferencias significativas entre los tratamientos, pero que en uno de ellos sea a favor de T1 y en el otro a favor de T2. Por lo anterior, esta variable no se asoció directamente a la restricción alimenticia, sino a oscilaciones normales que existen en todas las especies (Lagardère et al., 1998). A pesar de lo anterior, varios autores reportan que el hematocrito, como indicador de estrés por hipoxia o deshidratación, es una variable importante de evaluación del bienestar en animales restrictos (Rios et al., 2005; Abdel et al., 2006), situación no verificada en el presente ensayo, en el cual los valores encontrados fueron similares a los reportados para la especie por Rodríguez y Landines (2011). Cabe anotar que en varias especies como Dicentrarchus labrax, Pagellus bogaraveo y Brycon amazonicus la restricción tampoco parece tener efecto sobre el nivel de hematocrito de los animales (Caruso et al., 2011; Zamudio y Landines, 2018).
Por otro lado, con la hemoglobina, se encontraron diferencias significativas entre los tratamientos en los días 1 y 42, siendo superior en los animales que recibieron alimentación constante, contrario a lo reportado para otras especies tropicales, que al ser restringidas presentan mayores valores del parámetro (Rios et al., 2005). De forma similar, la hemoglobina aumentó en juveniles de cachama blanca restrictos en el 50% de su alimentación (Rodríguez y Landines, 2011). Con excepción de los dos días mencionados (1 y 42), siempre hubo tendencia al aumento; este resultado es opuesto al de Abdel et al., (2006) en tilapia nilótica, especie en la cual la hemoglobina disminuyó a medida que el periodo de restricción avanzó. A pesar de la diferencia encontrada entre los grupos durante el primer periodo experimental, durante el periodo final y hasta la conclusión del ensayo, no existieron diferencias significativas entre los grupos, indicando que el descenso en la hemoglobina fue una situación momentánea y reversible que en ningún caso comprometió la salud de los peces.
En relación con la proteína plasmática, se observó un aumento significativo en el T1 el día 42 el cual se mantuvo hasta el día 56, volviendo a la normalidad posteriormente y manteniéndose así hasta el final del ensayo. Resultados similares fueron obtenidos por Hung et al., (1997), quienes afirman que los niveles de proteínas plasmáticas disminuyen en animales restrictos, porque están siendo utilizadas como fuente de energía (al igual que el lactato), convirtiéndose en una reserva energética importante y de primera mano, que permitiría al individuo adaptarse a la situación de reducción o carencia de alimento (Pottinger et al., 2003), lo cual también fue comprobado por Rossi et al., (2015) en Hoplosternum littorale. A pesar de ello, Power et al., (2000) afirman que los niveles circulantes de proteínas plasmáticas se mantienen constantes antes, durante y después de la restricción alimenticia en los peces, situación observada en la mayoría de muestreos del presente ensayo y en otro trabajo también con Piaractus brachypomus reportado por Rodríguez y Landines (2011).
Respecto a la glucosa y la insulina, se encontraron diferencias significativas el día 28, en el cual fueron superiores en el T1, resultado que concuerda con lo encontrado para diferentes especies de peces (Pottinger et al., 2003; Montserrat et al., 2007; Rossi et al., 2015); ha sido reportado que es esperado que el nivel de glucosa e insulina descienden en condiciones de restricción alimenticia (Figueiredo-Garutti et al., 2002). Sin embargo, Caruso et al., (2011) no encontraron diferencias para glucosa en Dicentrarchus labrax y Pagellus bogaraveo restrictos; de forma similar, Rodríguez y Landines (2011) no hallaron diferencias en los niveles de ambos parámetros en juveniles de Piaractus brachypomus. No obstante, aunque el comportamiento fue similar para glucosa en Brycon amazonicus, no lo fue para insulina, parámetro en el cual los niveles fueron menores en los animales restrictos (Zamudio y Landines, 2018).
El hecho de que únicamente en ese muestreo se hayan presentado diferencias significativas para esos dos parámetros, no indica necesariamente que las mismas (para ese día) se puedan atribuir totalmente a los tratamientos y que probablemente serían provocadas por alteraciones propias de los animales en un momento dado (Lagardère et al., 1998). Por el contrario, la constante (con excepción del día 28) de los dos parámetros, permite suponer que ciclos de restricción y realimentación alternados y continuos, no se traducen en cambios significativos en las dos variables y que probablemente periodos de restricción mayores (superiores a 3 días) seguidos de periodos de realimentación, sí generarían tal alteración debido a que el metabolismo de la glucosa en primera instancia (ayuno) se deprime, pero cuando las condiciones vuelven a ser favorables (realimentación) se activa rápidamente, recuperando su estatus normal (Power et al., 2000).
Para lactato hubo diferencias significativas el día 28, encontrando valores superiores en el T2, lo cual se explicaría por la directa relación que existe entre el lactato con los niveles circulantes de glucosa, los cuales también presentaron diferencias significativas durante ese día; como es sabido, en los peces el sistema nervioso central regula la utilización de glucosa y lactato, de acuerdo al régimen alimenticio del animal, pudiéndolos utilizar como fuentes de energía, según exista abundancia o ausencia de alimento (Soengas y Aldegunde, 2002). En el presente ensayo, los niveles constantes de lactato (excepto el día 28) demuestran que no hubo alteración importante en la regulación energética, a través de esta vía, derivada de la ausencia parcial de alimento, contrario a lo reportado por otros autores, quienes observaron un descenso significativo en los niveles de lactato por efecto de la restricción alimenticia (Hemre et al., 1990; Blasco et al., 1992; Soengas et al., 1996). Incluso en la misma especie, Rodríguez y Landines (2011) reportaron diferencias significativas entre animales restrictos mediante diferentes ciclos de ayuno-realimentación y alimentados a diario, lo cual explicaría una de las vías metabólicas que utilizan los peces para soportar la restricción, cual es el uso de lactato como fuente energética. No obstante, como se mencionó, tal vía no se evidenció en el presente estudio.
Los resultados mostraron que los valores de triglicéridos y colesterol no presentaron diferencias significativas entre los tratamientos en ninguno de los tiempos de colecta, contrario a lo mencionado por Pérez-Jiménez et al., (2007), quienes encontraron que los animales sometidos a un ciclo de restricción-realimentación (nueve y doce días respectivamente) presentan reducciones importantes en ambos de estos componentes ocasionados por la utilización permanente de energía de origen lipídico. Resultados similares al presente estudio fueron reportados para triglicéridos por Rodríguez y Landines (2011) en juveniles de Piaractus brachypomus restrictos, sugiriendo que probablemente los animales utilizan otra fuente de energía para suplir sus necesidades ante el ayuno o que aparentemente la restricción no fue lo suficientemente drástica para desencadenar tal disminución. En este sentido, Zamudio y Landines (2018) encontraron en Brycon amazonicus disminución en el nivel de triglicéridos cuando se sometió a restricción severa, pero no cuando la restricción fue moderada. No obstante, Rossi et al., (2015) reportan que ambos componentes lipídicos disminuyen en Hoplosternum littorale sometidos a restricción 7 y 28 días.
Respecto al colesterol, Rossi et al., (2015) reportaron una disminución importante en animales restrictos; por su parte, Rodríguez y Landines (2011) encontraron valores inferiores en juveniles de Piaractus brachypomus alimentados a diario al compararlos con peces sometidos a diferentes ciclos de ayuno-realimentación. Por otro lado, Zamudio y Landines (2018) encontraron que el colesterol disminuyó 35 días después de restringir juveniles de Brycon amazonicus, pero volvió a la normalidad a los 84 días. En el presente ensayo no fueron encontradas diferencias significativas entre los tratamientos ni entre los tiempos de muestreo, lo cual podría sugerir que en el grupo restricto hubo una elevada producción endógena, la cual generalmente es asociada al hígado. Por el contrario, el grupo alimentado diariamente, pudo haber utilizado el alimento como fuente para formación de colesterol (Engelhardt y Breves, 2006) sin acudir a reservas corporales (principalmente hepáticas) para mantener su nivel normal. Lo anterior explicaría el hecho de que en el último día de muestreo los índices hepato y víscero somáticos fueran significativamente mayores que en el grupo tratado. Así, la producción endógena de colesterol verificada en el grupo tratado podría estar relacionada con la disminución en tales índices en el último día de muestreo.
En cuanto al cortisol, no hubo diferencias significativas entre los tratamientos en ninguno de los tiempos de colecta, indicando que por lo menos bajo la evaluación de este parámetro, lo animales no sufrieron un estrés adicional al del manejo normal del cultivo o que probablemente se adaptaron de manera adecuada ante la falta de alimento, disminuyendo su demanda energética durante el periodo experimental, pues como es sabido, los corticoesteroides tienen papel fundamental en el metabolismo energético de los peces (Takei y Loretz, 2006). Resultados similares fueron reportados por Caruso et al., (2011) en Dicentrarchus labrax y Pagellus bogaraveo, al someter a un ciclo de ayuno de 31 días; así como en ciclos de ayuno-realimentación por Rodríguez y Landines (2011) en Piaractus brachypomus y Zamudio y Landines (2018) en Brycon amazonicus. Sin embargo, otros autores reportan disminuciones o aumentos del cortisol ante situaciones de carencia de alimento. En el primer caso se habla de adaptación (tal como en el presente ensayo) (Small, 2005), mientras que, en el segundo, se menciona que los peces son incapaces de realizar tal proceso adaptativo, siendo necesaria la realimentación para que restablezcan sus valores normales (Barcellos et al., 2010).
En cuanto a las variables de peso y longitud, aunque se presentaron diferencias significativas en peso los días 42 y 70 y en longitud (total y estándar) el día 42, al final del experimento no hubo diferencias significativas entre los tratamientos, demostrando la capacidad de la especie para manifestar crecimiento compensatorio completo (Figura 7), fenómeno reportado en varias especies de peces como: Pagrus major (Oh et al., 2007), Rutilus caspicus (Abolfathi et al., 2012), Brycon amazonicus (Urbinati et al., 2014), Oncorhynchus mikiss (Azodi et al., 2015), Catla catla, Labeo rohita y Cirrhinus mrigala (Mohanta et al., 2016), entre otras. Lo anterior se explica con la teoría expuesta en la revisión de Ali et al., (2003), que mencionan que los peces sometidos a restricción de alimento, exhiben una trayectoria de crecimiento superior a la de los peces alimentados permanentemente, evento comprobado en el presente ensayo para Piaractus brachypomus. Adicionalmente también se reporta que, aunque el crecimiento compensatorio sea parcial, demuestra la capacidad de los peces para adaptarse a la restricción de alimento, siempre y cuando después tengan acceso al mismo (Xiao et al., 2013; Malpica et al., 2014; Mohanty, 2015; Yang et al., 2015; El Sayed et al., 2016). No obstante lo anterior, los índices hepato y víscero somáticos sí presentaron diferencias significativas al concluir el ensayo, siendo superiores en T1, situación explicada por el comportamiento de triglicéridos y colesterol que se presentó al inicio de la discusión.
Por otro lado, los parámetros del análisis proximal y la energía del filete no presentaron diferencias entre los tratamientos, lo cual podría explicarse porque el tiempo de ayuno no fue prolongado (solo un día), lo cual no afectó significativamente los componentes musculares, como consecuencia de la adaptación de la especie a la restricción. Tal situación la explican Zhu et al. (2005) en Leiocassis longirostris, quienes argumentan sus resultados en el hecho de que la restricción no fue prolongada, por lo cual los peces no necesitaron movilizar proteína para mantenerse. En la especie objeto de estudio, Rodríguez y Landines (2011) bajo condiciones de laboratorio, y Riaño et al., (2011) que evaluaron diferentes regímenes de ayuno-realimentación, ya habían demostrado que la restricción moderada de alimento no causa deterioro de la calidad nutricional del producto final.
A partir de los resultados encontrados se puede afirmar que los juveniles de cachama blanca (Piaractus brachypomus) pueden adaptarse a situaciones de restricción moderada de alimento, alternado, días de alimentación con días de ayuno sin modificación de los indicadores de estrés como el cortisol, con cambios no significativos y reversibles en las variables metabólicas. Asimismo, se verificó que la restricción aplicada, no fue suficiente para modificar la composición del músculo blanco.