Introducción
Las zonas tropicales del planeta poseen mayor diversidad y riqueza de especies en relación con las franjas templadas y polares (Blanco et al., 2017). A nivel estructural de las coberturas vegetales, se observa que los bosques maduros con dosel alto y denso, generan complejidad en los ecosistemas, incrementos de grupos funcionales, composición y riqueza de especies (Acevedo-Charry y Aide, 2019), en cambio, las coberturas arbustivas y de sabanas, la diversidad y riqueza de especies disminuye por incidencias directas de los procesos antrópicos de fragmentación y perdida de hábitat (Bogaert et al., 2011).
A nivel mundial la batracofauna está estimada en 8120 especies, distribuidas en 7164 anuros (ranas y sapos), caudata (salamandras) en 742 y 214 para Gymnophiona (Cecilias) (Frost-Darrel, 2019). En Colombia se estima 778, 26 y 33 especies para anuros, salamandras y cecilias respectivamente (Acosta-Galvis, 2019), la diversidad en el neotrópico está correlacionada con procesos ecológicos, históricos, producto de las condiciones de humedad, temperatura, heterogeneidad vegetal, orogenia, disponibilidad de recursos y la especificidad de algunas especies por bosques húmedos andinos y tierras adyacentes a la Amazonía (Padial et al., 2012). Cerca del 53% de la diversidad de los anfibios se encuentran en el neotrópico (Young et al., 2004), producto del levantamiento de la cordillera de los Andes, los procesos de glaciación del Mioceno al Holoceno (Muñoz-Ortiz et al., 2015; Wiens, 2011), la extensa selva amazónica, las barreras geográficas que contribuyen a los procesos de especiación a través del tiempo en esta parte del planeta (Daza et al., 2009; Wiens, 2011; Wiens et al., 2011).
La diversidad puede verse favorecida por la historia de vida de las especies, tales como los modos reproductivos, especificidad a hábitats, patrones de colonización y efectos locales de clima (Haddad y Prado, 2005; Haddad y Sawaya, 2000). Existen diferentes variables físicas y biológicas que aportan a los procesos evolutivos y la diversidad de anfibios; por consiguiente, en los últimos años se ha afrontado desafíos académicos para llenar lagunas o vacíos de conocimiento en los campos de la filogenia, biogeografía, diversidad, modelos de distribución y preferencias de hábitats, para resolver los procesos de diversificación, tamaños poblacionales y ecología de las especies (Bonetti y Wiens, 2014; Daza et al., 2009; Rivera-Prieto et al., 2014). No obstante, sin desconocer diferentes factores antrópicos, motores de fragmentación y pérdida de hábitat, operan de manera sinérgica en vía de la extinción de las especies, tales como la fragmentación de bosques, expansión de monocultivos, explotación minera, enfermedades derivadas del hongo Batrachochytrium dendrobatidis (Bd), contaminación de agua y suelo por productos químicos y orgánicos (Angulo et al., 2006; Lips et al., 2001; Rengifo y Lynch, 2010; Stuart et al., 2008).
Las tres cordilleras andinas que presenta Colombia y que atraviesan el país de sur a norte, posee el 60% aproximadamente de la fauna anura, en donde la cordillera Occidental y Central son las más diversas, mientras que, la Cordillera Oriental presenta los grados de endemismos más altos, y su diversidad es comparable con la Amazonia (Acosta-Galvis, 2000; Arroyo et al., 2003; Lynch et al.,1997), donde los grupos taxonómicos con mayor grado de endemicidad para el país son Centrolenidae y Craugastoridae presentes en la Cordillera Oriental y su piedemonte (Lynch et al., 1997).
En el país se han identificado catorce (14) familias de anuros (Acosta-Galvis, 2019), de las cuales doce (12) se encuentran en la Orinoquía colombiana (Meta, Casanare, Vichada y Arauca). Acosta-Galvis y Alfaro, (2011) reportaron 102 especies con distribución geográfica en uno o más de estos cuatro departamentos, mientras que (Acosta-Galvis, 2019) registra 35 especies de ranas para Arauca, equivalente al 4,9 % de los anuros del país.
Otros estudios en la Orinoquía colombiana son los de (Lynch, 2006), quien reportó 45 especies de ranas para el piedemonte llanero, por otro lado, Cáceres-Andrade y Urbina-Cardona (2009) registraron 16 especies en tres coberturas vegetales diferentes para departamento del Meta. En Casanare Zorro (2007), reportó 17 especies en cinco hábitats y dos temporadas climáticas, Camacho y Camacho, (2010) estudiaron las composición de larvas en humedales con un registro de 13 taxones, los estudios de (Pedroza et al., 2014) es el más completo con 46 especies, basado en las colecciones biológicas de los principales museos del país y registros en campo, por otro lado, Angarita (2014) reporta 25 especímenes de ranas, Acosta-Galvis et al., (2016) hacen un nuevo reporte del genero Pipa para la Orinoquía colombiana y finalmente, Acosta-Galvis, (2017) obtiene un listado total de 26 especies en bosques de niebla y estribaciones del piedemonte llanero para el municipio de Yopal.
En general la Orinoquía colombiana presenta bajas tasas de diversidad y de endemicidad, no obstante, las abundancias son altas, estas condiciones son atribuidas a escenarios ambientales alterados, procesos de intervención antrópica, entre ellos la ganadería, monocultivos, quemas, deforestación, fragmentación y exploraciones petroleras, definidos como motores de la perdida de la diversidad y cambios poblacionales de anfibios (Angarita, 2014); reflejado en el incremento de especies generalistas y reducción en grupos con especificidad de hábitats (Bogaert et al., 2011).
Acosta (2000) indica que hay regiones de Colombia que científicamente están inexploradas, como el piedemonte Araucano, Casanare, Meta y las planicies del Guaviare, Vaupés y Vichada. Sin embargo, la problemática central de los anuros, es la reducción de la diversidad y los tamaños poblaciones a nivel nacional y mundial donde estos factores operan en su contra de manera sinérgica (Stuart et al., 2008; Young et al., 2004), por tal motivo, surge la necesidad de elaborar estudios de investigación sobre la diversidad de anfibios para la Orinoquía colombiana, puesto que, este grupo en su mayoría son bioindicadores del estado de calidad y conservación de los ecosistemas, la estabilidad ecosistémica y el rol primordial que juegan en las cadenas y redes tróficas (García et al., 2005; Rengifo y Lynch, 2010). El presente estudio busca identificar la composición y la diversidad de especies de anuros en tres coberturas vegetales (bosques de galería, sabanas y humedales) y la variación de especies de tipo espacial y temporal en dos periodos climáticos en la cuenca baja del Río Bojabá.
Materiales y métodos
Área de estudio
Esta investigación se desarrolló en el Municipio de Saravena (6° 57’ 17’’ N, -71° 52’ 36’’ W) a 208 m de altitud, ubicado al noroccidente del departamento de Arauca y en el municipio de Cubará (7°00’03’’ N, 72°06’29’’ W) a 367 m, situado al nororiente del departamento de Boyacá (PIU Saravena, 2009; POT Saravena, 2000). Los dos municipios presentan condiciones ambientales influenciadas directamente por la Sierra Nevado del Cocuy, debido a su aproximación, el área de estudio cuenta con un régimen de precipitación de carácter unimodal, con lluvias en gran parte del año, media anual de 2945,5 mm, una humedad relativa media anual del 84% y una temperatura promedio anual de 25,5°C (IDEAM, 2012).
El Río Bojabá es la fuente abastecedora de acueductos veredales de los municipios de Cubará y Saravena (PIU Saravena, 2009); este río cuenta con una extensión máxima de 60 km, desde su origen en Laguna Verde en el Parque Nacional Natural el Cocuy a 4200 m, hasta su desembocadura en el río Arauca a 140 m de altitud. La cuenca baja del Río Bojabá presenta una extensión aproximada de 16 km de longitud Figura 1, dentro de este tramo se tomaron tres coberturas vegetales, con diferentes grados de intervención antrópica para el estudio de la fauna anura (Bosque de galería, sabanas y humedales), se tuvo en cuenta las coberturas vegetales más representativas de cada sector de muestreo, debido a la baja extensión en área de las demás coberturas vegetales para este sector de la cuenca.
Muestreo
La recopilación de los datos de campo se llevó a cabo durante un periodo de 15 días en la estación de lluvias en el mes de septiembre de 2013 y de 15 días en la estación seca del mes de marzo de 2014. Se definieron tres coberturas vegetales a lo largo de la cuenca baja del Río Bojabá (bosques de galería, sabanas y humedales) entre los 140 a 367 m de altitud, se demarcaron cuatro transectos lineales de 100 m x 2 m por cobertura, adicionalmente, se realizó un muestreó complementario con la técnica de encuentros visuales (VES) para cada sitio de estudio (Angulo et al., 2006; Heyer et al., 2001).
La búsqueda por encuentros visuales se llevó a cabo a lo largo de los transectos y áreas circundantes, lejos de senderos o caminos principales para disminuir los sesgos de encontrar especies comunes a lo largo de los caminos con el objeto de aumentar la variedad de especies de la comunidad (Villacampa et al., 2019). Los transectos fueron definidos dos días antes del muestreo para disminuir los sesgos por perturbación, los transectos fijados en la cobertura de bosque de galería se instalaron a más de 100 m desde el borde del bosque, para disminuir el efecto borde.
Cada cobertura vegetal fue muestreada por cuatro días y cuatro noches, los muestreos diurnos se realizaron entre las 8:00 am y las 12:00 m y en la noche entre las 6:00 pm y 10:00 pm. Se registró todos los anuros detectados en una banda de dos metros del transecto y tres metros de altura, el muestreo se realizó a un ritmo de 20 minutos por transecto con dos observadores, los ejemplares registrados fueron depositados en bolsas de tela para su posterior identificación taxonómica. El esfuerzo de muestreo por cobertura vegetal fue de 64 horas/observador para cada temporada climática, para un total de 128 horas/observador por cobertura vegetal y un esfuerzo total de muestreo de 384 horas/observador (Angulo et al., 2006; Heyer et al., 2001; Lips et al., 2001).
Análisis de datos
En esta investigación se empleó un diseño de Muestreo Aleatorizado Sistemático (MAS) (Otzen y Manterola, 2017), se definió como tratamiento los diferentes sectores de muestreo (humedal, pastizal y bosques de galería) con sus respectivas temporadas climáticas (lluvias y sequía); los datos originales no presentaron una distribución normal, por tanto, se elaboró una transformación de los datos mediante el programa estadístico Past 2.17, utilizando el método (normalizar la longitud de la fila) que divide todos los valores por la distancia euclidiana del vector de cada fila de los datos (Hammer et al., 2001).
Para la estimación de los índices de diversidad verdadera o números efectivos de Hill (Hill, 1973) se utilizó el programa estadístico R Versión 3.6.2 (R Core Team, 2019). Calculamos la diversidad alfa para cada cobertura vegetal mediante el uso de los números efectivos de Hill: q0 = Riqueza observada, q1= entropía de Shannon y q2=diversidad de Simpson, mediante el paquete estadístico de R iNEXT (Hsieh et al., 2016). Extrapolamos la riqueza observada a un tamaño de muestra (n=38) equivalente al doble de la muestra más pequeña, el máximo extrapolado de manera confiable (Villacampa et al., 2019) con un bootstrap de 500 y un intervalo de confianza del 95%.
Calculamos la diversidad beta o grado de reemplazo de la composición taxonómica mediante el coeficiente de Bray-Curtis con el programa estadístico de Past 2.17 (Hammer et al., 2001). Realizamos un análisis de componentes principales que permita explicar la mayor cantidad de varianzas en los datos multidimensionales a solo dos componentes, para ello se utilizó los datos transformados de las abundancias, aplicando una matriz de covarianza y un bootstrap de 500 (Harper, 1999).
Resultados
Se registraron 231 ejemplares en total, pertenecientes a 18 especies, agrupadas en diez géneros y cinco familias, las familias Hylidae y Leptodactylidae representaron respectivamente 44% y 33% de las especies registradas, seguido de las familias, Bufonidae 11%, Craugastoridae y Ranidae 6% Figura 2.
Las especies que se reportaron en las tres coberturas vegetales fueron Scinax rostratus, Scinax ruber, Scinax wandae, Boana xerophylla, Dendropsophus mathiassoni, Leptodactylus fuscus, Physalaemus fischeri y Engystomops pustulosusTabla 1.
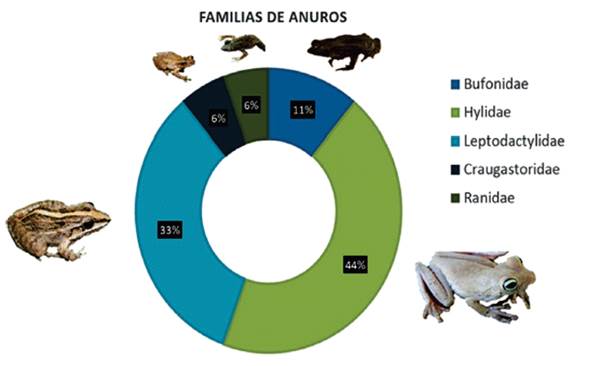
Figura 2 Representatividad de anuros en la cuenca baja del río Bojabá. (Arauca-Saravena y Cubará-Boyacá).
Tabla 1 Lista de especies y su respectiva abundancia relativa de la fauna anura en la cuenca baja del Río Bojabá (Arauca-Saravena, Cubará-Boyacá). Identificó: Rivera-Correa Mauricio & Escarraga-Saavedra Alcibiades (2014).
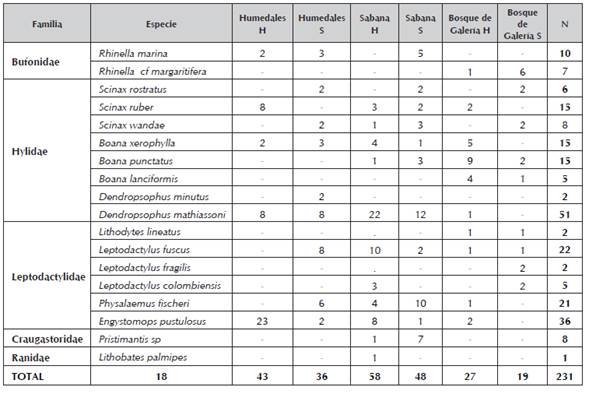
Las especies que se encontraron únicamente en las coberturas de humedales y sabanas son: Rhinella marina, D. minutos, Pristimantis sp y Lithobates palmipes; mientras que, Leptodactylus colombiensis y Boana xerophylla compartieron las coberturas de bosques de galería y sabana. Los taxones exclusivos por cobertura fueron: en humedales D. minutus, para sabanas Pristimantis sp y L. palmipes mientras que, Rhinella cf margaritifera, B. lanciformis, Lithodytes lineatus y Leptodactylus fragilis fueron exclusivas para bosque de galería con bajas abundancias.
Los géneros Scinax, Boana y Leptodactylus presentaron la mayor riqueza de especies con tres taxones cada uno, seguido de Rhinella y Dendropsophus con dos. Dendropsophus mathiassoni fue el anuro más común con 51 ejemplares, equivalente al 22,1% de las abundancias relativas, de los cuales 34 corresponden a sabanas con preferencia a la época de lluvias. Engystomops pustulosus presentó el 15,6% de las abundancias, con valores altos para los humedales en la estación de lluvias; en tercer y cuarto lugar se observó a las especies de L. fuscus y P. fischeri respectivamente con 9,5% y 9,1% de las abundancias.
Los números efectivos de Hills muestran el orden de la diversidad obtenida para la cuenca baja del río Bojabá, en cuanto al análisis de diversidad de orden q=0 insensible a las abundancias (riqueza de especies) Figura 3; esta refleja que los humedales en estación lluviosa (HuLl) obtienen el menor número de especies (5.0), HuSe = 7.53, mientras que, las sabanas-lluvias SaLl = 11, sabanas-seca SaSe = 11 especies, con una cobertura de muestreo del 93% y 96% respectivamente, los bosques de galería en la estación lluviosa BoLl y bosques de galería estación seca BoSe ostentan 10 y 9.0 especies, con un estimador de la cobertura de muestreo del 82% y 86 %, con la extrapolación basada en el tamaño de la muestra, se podrán encontrar hasta 13.02 y 11.24 especies respectivamente para los BoLl y BoSe. La diversidad de orden q=1 (Figura 3, panel central) cuenta a los individuos de igual proporción (diversidad de Shannon), los números efectivos fueron: HuLl = 2.73, HuSe = 6.09, SaLl = 5.23, SaSe= 6.27, BoLl = 3.27 y BoSe = 5.19.
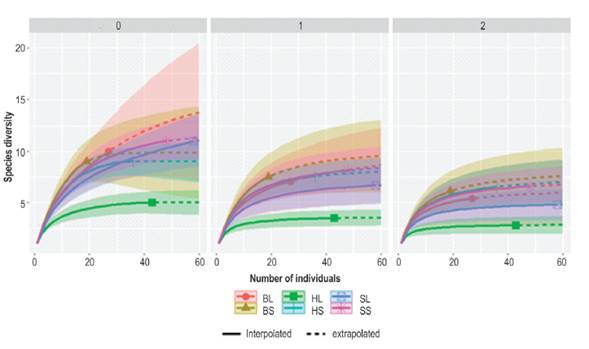
Figura 3 Curvas de muestreo basadas en el tamaño de la muestra, rarefacción basada en el número de individuos muestreados (línea continua) y extrapolación (línea discontinua) con intervalos de confianza del 95% (áreas sombreadas). Diversidad de orden q=0 (riqueza de especies, panel izquierdo), q=1 (diversidad de Shannon, panel central), q=2 (diversidad de Simpson, panel derecho).
El análisis de la diversidad de orden q=2, la cual es sensible a los números efectivos de las especies dominantes (panel derecho) muestra los siguientes valores, HuLl = 2.73, HuSe= 4.96, SaLl = 3.30, SaSe = 4.82, BoLl=2.61 y BoSe = 3.92, donde los humedales en época seca presentan la mayor diversidad de los números efectivos de Simpson.
Analizamos la representatividad del esfuerzo de muestreo para el estudio en la cuenca baja del Río Bojabá, se realizó una curva de completitud de la muestra Figura 4, se obtuvo que los humedales han abarcado el 100% de los estimadores de coberturas de referencia, es decir se registró todas las especies posibles en esta cobertura vegetal, las SaLl y SaSe abarcaron el 93% y 96% de la especies y finalmente, los BoLl y BoSe estimaron el 82% y 86% de las especies respectivamente para la cobertura boscosa.
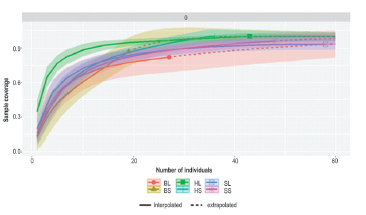
Figura 4 Curva de completitud de la muestra de la anuro-fauna asociada a la cuenca del Río Bojabá (Saravena-Arauca, Cubará-Boyacá), y = Cobertura de la muestra, x = tamaño de la muestra.
El análisis de similaridad del coeficiente de correlación de Bray-Curtis, identificó cuatro agrupaciones, las SaLl y SaSe y los HuSe representan un 60% de similaridad de especies, los BoLL y BoSe presenta los escenarios más desiguales con el 27% de la similaridad y una disimilitud superior al 80% con otras coberturas vegetales Figura 5. Estadísticamente las coberturas de muestreo no reflejan diferencias significativas, pero a nivel ecológico se observó variaciones en abundancias y riqueza de especies Tabla 1.
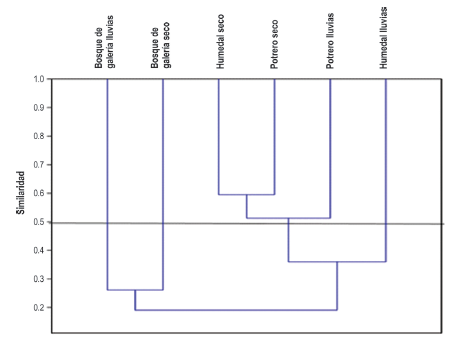
Figura 5 Dendograma de similaridad de Bray-Curtis de las áreas de muestreo versus las dos temporalidades (Saravena-Arauca, Cubará-Boyacá).
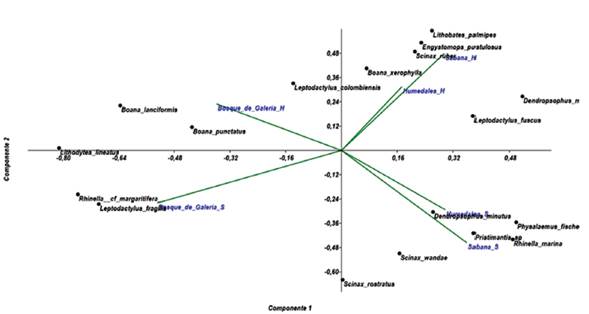
El análisis de componentes principales (ACP) refleja que las especies tienden a establecerse en varias coberturas vegetales, la Figura 6, muestra la distribución espacio-temporal de los anuros registrados para la cuenca baja del Río Bojabá, los vectores indican el área y la temporalidad; E. pustulosus, S. ruber, L. palmipes y B. xerophylla revelan preferencias por los HuLl y SaLl, de igual manera, D. mathiassoni está asociada a SaLl, L. fuscus predomina en humedales y sabanas, mientras que, P. fischeri, D. minutus, R. marina y Pristimantis sp prefieren las áreas de SaSe y HuSe, de manera similar, Rhinella cf margaritifera y L. fragilis prefieren los BoSe, finalmente, B. lanciformis y B. punctatus presentan exclusividad por el BoLl, en cambio, S. wandae, S. rostratus, L. lineatus y L. colombiensis coexisten en diferentes coberturas.
Discusión
El grupo Hylidae es el más diverso entre los anfibios, particularmente en el neotrópico (Faivovich et al.,2005; Frost-Darrel, 2019). En Colombia ésta familia es la segunda más diversa, con predominancia por los ecosistemas boscosos (Suárez, 1999), sabanas y áreas abiertas (Lynch, 2006) dado que, este grupo presentan diferentes modos reproductivos asociados a cuerpos de agua lenticos y loticos (Haddad y Prado, 2005; Haddad y Sawaya, 2000), lo cual fue una condición dada y registrada durante el estudio.
Los representantes Leptodactylidae, grupo con predominancia en tierras bajas, altamente tolerantes a las actividades antropogénicas como la agricultura y ganadería (Lynch, 2006), con adaptaciones estrategias para sobrevivir largos periodos de sequía, cambios de patrones de actividad, habilidad para la captación de agua y estrategias para evitar la deshidratación (Saboyá-Acosta et al., 2015), en las coberturas de sabanas se observó a este grupo realizar actividades de escavar, utilizar agujeros hechos por vacunos y equinos en el suelo para resguardarse y la deposición de huevos en cámaras subterráneas.
Las 18 especies registradas para la cuenca baja del Río Bojabá representan el 2,31% de la fauna anura del país, lo cual refleja una baja diversidad para la región de la Orinoquía. En contraste, con la región amazónica Wiens et al., (2011) plantean las áreas potenciales de la diversidad de anuros a modo de distribución biogeográfica en el neotrópico, en la cordillera de los Andes y selva amazónica especialmente por factores de orogenia, barreras geográficas y patrones locales específicos; muchas de estas especies amazónicas han ido colonizando áreas durante los periodos del Mioceno y Pleistoceno hacia la Orinoquía colombiana, no obstante, existen evidencias de tal suceso como expansión del género Pipa para Orinoquia colombiana y nuevos registros en localidades pocos estudiadas (Acosta-Galvis et al., 2016).
De igual manera, se evidencia en la composición de especies reportada por diferentes investigadores en la Orinoquia, Galeano et al., (2006) reportaron 158 especies para la región amazónica colombiana, Suarez, (1999) reportó un listado preliminar de 55 especies para en el departamento de Caquetá, Lynch (2006) registró 48 especies en el departamento del Meta, Pedroza et al., (2014) encontraron 46 especies para Casanare y finalmente Acosta-Galvis, (2019) ha logrado consolidar una base de datos online donde el departamento de Arauca registra 35 especies; trabajos que respaldan la línea de tendencia gradual de diversidad de anuros propuesta por Wiens et al., (2011) hacia el norte de la Amazonía en la región cisandina de la Orinoquía.
Los índices de diversidad verdadera (números efectivos de Hill) para el orden de diversidad q=0 reflejó que las sabanas presentan la mayor diversidad de especies, mientras que, el orden q=1 los HuSe y SaSe obtuvieron mayores números efectivos de Shannon, de igual manera, los órdenes de diversidad q=2 mostraron el mismo patrón; según las bases estadísticas del paquete de R iNEXT (Hsieh et al., 2016; Villacampa et al., 2019) y la curva de muestreo basadas en el número de individuos de la muestra y los intervalos de confianza, estiman que con un mismo tamaño de muestra y cobertura la curva de rarefacción refleja un mayor número de especies para los boques de galería (Figura 3, panel izquierdo), a nivel ecológico, desde las propiedades biológicas de los anfibios, esta afirmación es respaldada dado que las estructuras boscosas presentan mayor complejidad ecosistémica, existencia de especies cripticas, alta disponibilidad de hábitats y micro hábitats (Acevedo-Charry y Aide, 2019) permiten que especies cripticas no hayan sido censadas en campo.
Las temporalidades secas en la cuenca baja del Río Bojabá presentó alta diversidad en relación con la estación húmeda, este fenómeno puede estar explicado en gran medida al comportamiento de las variables ambientales del municipio de Saravena y alrededores (IDEAM, 2012; PIU Saravena, 2009), donde se evidencia altas concentraciones de humedad atmosférica en la región durante el año (87% media anual), de igual manera, la cuenca baja del Río Bojabá presenta una formación de choque térmico entre las corrientes cálidas de aire de la planicie de la Orinoquía y las corrientes frías que descienden de la Sierra Nevada del Cocuy, fenómeno que provoca una zona de baja presión, dando origen a una alta nubosidad, humedad en el ambiente y precipitaciones inusuales durante el año, lo que puede generar temporadas de transición inusuales, factores que favorecen al establecimiento y comportamiento reproductivo de los anuros (Haddad y Prado, 2005; Rengifo y Lynch, 2010).
Además, otro factor de la región que influye en la diversidad de los anuros en ambos periodos, es que gran parte de las especies registradas en la cuenca baja del Bojabá, presentan adaptaciones fisiológicas para tolerar y coexistir en ambientes de estrés hídrico, hábitats intervenidos y transformados por el hombre, caso puntual de los géneros Leptodactylus, Rhinella y algunas especies de Hylidos (Haddad y Prado, 2005). Los resultados obtenidos difieren drásticamente con lo reportado en la Orinoquía colombiana en estudios previos, donde el aumento de diversidad y riqueza de especies está estrechamente relacionado con las temporadas de lluvias, sin embargo, las abundancias fueron superiores en la temporada de lluvias, coincidiendo con los registros de (Zorro, 2007). En contraste, gran parte de los estudios de diversidad en anuros para el neotrópico muestran una sincronía con los regímenes de precipitación (Young et al., 2004), sin embargo, existen algunos lugares que no siguen este modelo; por otro lado, Muñoz-Ortiz et al., (2015) encontraron que las tendencias climáticas locales inciden directamente en el comportamiento de los anfibios, tasas de reproducción, abundancia y riqueza de especies, entre ellas: la alta humedad relativa, la heterogeneidad del hábitat, las fluctuaciones climáticas locales, factores extrínsecos e intrínsecos.
El análisis de componentes principales permitió situar algunos anuros en un campo bidimensional y georreferenciado, con base en las abundancias; las especies y las coberturas vegetales de muestreo establecidas para cada temporalidad climática, reportó que cinco especies B. lanciformis, B. punctatus, L. lineatus R. cf margaritifera y L. fragilis presentaron tendencias por los bosques de galería, la historia de vida demuestra que B. lanciformis y B .punctatus son de hábitos arborícolas, nocturnos con presencia en áreas poco intervenidas por el hombre y bosques nativos (Lynch, 2006). Las especies L. lineatus R. cf margaritifera y L. fragilis se observaron durante el día en hojarasca, sustratos con humedad, protección y camuflaje en áreas con baja incidencia solar, factor que coincide con los resultados del ACP.
Para el caso de P. fischeri, D. minutus, D. mathiassoni, E. pustulosus, L. palmipes, S. ruber, S. rostratus, S. wandae y L. fuscus, estas especies presentan adaptaciones fisiológicas y modos reproductivos que inciden en el establecimiento de las especies en coberturas con tensiones ambientales, tales como, sabanas inundables que están expuestas a la radiación solar, y los humedales sujetos a las condiciones atmosféricas de temporalidad. Una de las estrategias reproductivas de la familia Hylidae y Leptodactylidae es la liberación de sustancias gelatinosas o espumosas, las cuales permiten conservar la humedad y evitan la resequedad por el efecto de las fuertes temperaturas que pueden cambiar drásticamente en trascurso del día (Chejanovski y Wiens, 2014), aunado a las estrategias de excavación, uso de cámaras subterráneas, resguardo en agujeros hechos por animales domésticos y permanencia en lugares adyacentes a cuerpos de agua, les permite a las especies establecerse en diferentes coberturas vegetales (Wiens et al., 2011).
Conclusiones
La diversidad taxonómica de anuros para el estudio del Río Bojabá fue baja, dado que se registraron cinco familias, Bufonidae, Leptodactylidae, Hylidae, Craugastoridae y Ranidae, representadas en 10 géneros y 18 especies; equivalente al 2,31% de los anuros reportados para Colombia.
Las sabanas registraron el 45,8% de las abundancias, con 11 especies para cada temporada climática, la riqueza observada muestra que las sabanas presentaron la mayor riqueza de especies, sin embargo, los índices de diversidad verdadera de orden q=0, estiman que los bosques de galería pueden registrar más especies, puesto que, los análisis de cobertura de muestreo fueron del 82% y 86% respectivamente para la época de lluvias y sequía en los bosques, versus las sabanas que registraron el 93% y 96% y finalmente los humedales con un 100% de cobertura de muestreo para las dos temporadas.
Los anfibios registrados en el presente estudio muestran propiedades de especies generalistas, visto que, el análisis de componentes principales no refleja asociaciones de especies para alguna cobertura vegetal en particular, esto puede darse a razón de que el área de estudio presenta altos niveles de intervención antrópica.