Introducción
Los procesos fisiológicos relacionados con el crecimiento y degeneración de los folículos ováricos durante el ciclo estral en bovinos han sido tema de los grupos de investigación durante las últimas décadas. El desarrollo folicular es un proceso dinámico caracterizado por la proliferación y diferenciación celular, cuyo fin es proporcionar un medioambiente óptimo para la maduración del oocito y posterior preparación para su fecundación (Amstrong y Webb, 1996). El entendimiento de la dinámica y el proceso de maduración requiere del conocimiento de los diversos aspectos que lo influencian como la esteroidogénesis, la participación de sustancias en el fluido folicular (FF) que intervienen en la diferenciación celular, el crecimiento del folículo y la ovulación (Petrucci et al., 2014), así como su efecto en las diversas formas de competencia adquiridas por el oocito. Así mismo los estudios de la composición del FF han llegado a generar indicaciones de requerimientos celulares que pueden ser usados como una guía en la formulación de medios de cultivo celular en procesos de producción de embriones in vitro (Gerard et al., 2002).
El FF contiene proteínas entre otras moléculas que inciden en los procesos de maduración nuclear y citoplasmática del oocito (Sirard et al., 1998), es específico de cada especie y puede presentar variaciones en su composición, dependientes del estado fisiológico. Dentro los procesos de maduración oocitaria se encuentran modificaciones moleculares (Kubelka et al., 2000), redistribución de organelos intracelulares (Stojkovic et al., 2001) y los mecanismos de liberación de Ca2+ (Wang et al., 2003).
Los cambios estructurales en el oocito están acompañados de una serie de procesos bioquímicos, que establecen una compleja cascada de eventos de fosforilación y desfosforilación de proteínas, que involucran el reinicio y la regulación de la meiosis (Sousa et al., 2004, Dekel 2005 y Dumont et al., 2005). La pérdida de sincronía de este tipo de eventos va a influir negativamente en el desempeño y calidad de los oocitos que originaría una baja de producción de embriones viables.
Los estudios adelantados en Colombia sobre dinámica folicular han empleado herramientas como el ultrasonido y la determinación de perfiles bioquímicos en sangre. Como se mencionó anteriormente la determinación de proteínas en el FF proporcionan una comprensión más profunda en los procesos de desarrollo folicular y maduración oocitaria por la cual el objetivo de este estudio fue determinar los cambios en los perfiles de las proteínas del fluido folicular relacionados con la calidad del oocito.
Materiales y métodos
En este estudio se utilizaron ovarios, folículos, FF y oocitos de tractos uterinos de vacas Cebú comercial obtenidos en el frigorífíco-Friogan de Villavicencio, Meta. La recolección del FF, y la evaluación de folículos y oocitos y la cuantificación y separación electroforética de proteínas del fluido folicular se llevó a cabo en la Corporación Colombiana de Investigación Agropecuaria (AGROSAVIA), en el Laboratorio de Reproducción del centro de Investigación (CI) La Libertad, ubicado en el kilómetro 17 vía Puerto López, departamento del Meta a una altura de 467 mts sobre el nivel del mar y en el laboratorio de Proteómica del centro de Investigación (CI) Tibaitatá, ubicado en el kilómetro 14 vía Mosquera, del departamento de Cundinamarca.
Obtención de los Ovarios
Los ovarios fueron extraídos de tractos uterinos de 26 hembras bovinas cíclicas (presencia de cuerpo lúteo y folículos en el ovario), de la raza cebú comercial adultas. Una vez extraídos los tractos uterinos del animal, se depositaron en una bolsa de colecta, con solución de tampón fosfato salino estéril (PBS) (por sus siglas en inglés), o con solución salina 0.9 % estéril a 36 ± 1 °C %.
Evaluación del fluido folicular
El fluido folicular se obtuvo por aspiración directa del folículo ovárico con aguja calibre 16 acoplada a una jeringa de 10 mL, su contenido se colocó en viales de 2 mL; posteriormente se realizó la búsqueda de oocitos y separación del fluido folicular.
La muestra de fluido folicular se centrifugó a 13.000 rpm durante 30 minutos a 4°C, posteriormente se adicionó inhibidor de proteasas (fenilmetilsulfonil fluoruro) disuelto en dimetil sulfoxido (DMSO) (por sus siglas en inglés), 3 µl por cada 1 ml de muestra, y se almacenó a -20 °C para su sucesivo uso.
Las proteínas se cuantificaron mediante el método colorimétrico descrito por Bradford, 1976. La separación de las proteínas de fluido folicular se realizó mediante electroforesis 1D SDS-PAGE de tipo desnaturalizante y discontinuo, según protocolo de Laemmli (1970). Los geles se digitalizaron en el documentador de imágenes Molecular Imagen Gel Doc, de Bio-Rad®. El análisis de los geles se realizó con el software Quantity One ® de Bio-Rad.
Extracción de folículos y clasificación
Luego de la recuperación de los ovarios, se extrajeron los folículos, estos fueron puestos en una placa de petri con solución de tampón fosfato salino estéril (PBS) sobre una platina calentadora 36°C; siguiendo la técnica de Caixeta et al., 2008.
Posterior a la disección de los folículos, la medición del tamaño se realizó con ayuda de una lupa con ocular graduado. (Estereoscopio, Olympus®). Los folículos se categorizaron según su tamaño así: Folículos con un tamaño entre 1 a 3,0 mm (TI), folículos con un tamaño entre 3,1 a 6 mm (TII) y folículos con un tamaño 6,1 a 8 mm (TIII)
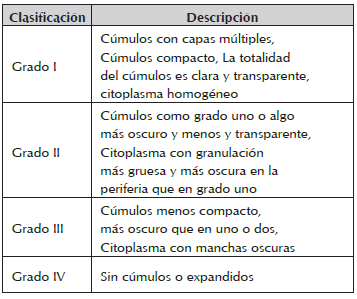
La evaluación de la calidad del oocito se realizó con base en el aspecto de su citoplasma y las características del cúmulo que lo rodea, para ello nos apoyamos en lo descrito por Solís et al., 2012 y la modificación que se consideró fue la integración del grado III y IV. Evaluando en este estudio los grados I (GI), II (GII) y III (GIII) (tabla 1).
Resultados
Proteínas totales del FF en folículos de ovarios de bovinos
La concentración promedio de proteína total del FF en folículos (<3mm) fue de 60,6±16,6 µg/dl; de 50,6±21,0 µg/dl en folículos (3-6mm) y de 53,4±16,3 µg/dl en folículos mayores de 6mm. Al análisis estadístico, estos valores no presentan diferencias (p>0,05) en función del tamaño del folículo.
En el fluido de los folículos de 3-6 mm la concentración de proteína total correlacionó positivamente (r=0,29, p<0,05) con oocitos de buena calidad, y en oocitos de mala calidad (r=0,27, p<0,05). En folículos >6 mm la concentración de proteína total correlacionó (r=0,39, p<0,05) con oocitos GII.
En estos resultados, se pudo detectar una correlación (r=0,43, p<0,05) para la concentración de proteína de fluido folicular de folículos >6mm y oocitos GII en el lado derecho del ovario.
En el ovario izquierdo la concentración de proteína del fluido folicular de folículos de 3-6 mm correlacionó (r=0,37, p<0,05) con oocitos GII y (r=0,39, p<0,05) con oocitos GIII. Mientras que en el fluido de los folículos >6 mm se encontró una correlación (r=0,40, p<0,05) con la calidad oocito GII.
Perfiles electroforéticos unidimensionales SDS- PAGE de proteínas del FF en folículos de diferentes tamaños
El análisis de las imágenes de los geles unidimensionales permitió establecer a nivel general, un número de 25 bandas de proteína expresadas en el FF de los diferentes folículos evaluados, con pesos moleculares entre 9 y 240 kDa (figura 1). En folículos de tamaño I se expresaron un total de 23 bandas de proteína con pesos moleculares entre 13 a 240 kDa, 19 bandas de proteína entre 9 a 240 kDa se expresaron en FF de folículos de tamaño II, y 20 bandas de proteína entre 9 y 240 kDa se expresaron en FF de folículos con tamaño III.
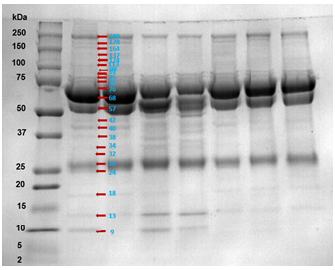
Figura 1 Perfil electroforético unidimensional de bandas de proteína de fluido folicular de ovarios de vacas Cebú comercial. El marcador de peso molecular, se ubicó al lado izquierdo de la imagen, el peso molecular de las bandas de proteínas se relacionaron en kilo Dalton (kDa). Con flechas café se señalan las bandas de proteínas presentes en este estudio.
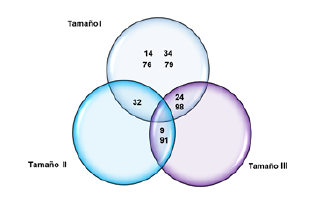
Las proteínas de 14 kDa, 34 kDa, 76 kDa y 79 kDa únicamente se expresaron en el fluido folicular de folículos de tamaño I (<3mm), de igual forma la banda de proteína de 32 kDa se presentó en los folículos de tamaños I y II y las bandas de proteína de 24 y 98 kDa en los folículos de tamaño I y III, por otra parte las bandas de proteína de 9 y 91 kDa no se presentaron en los folículos de tamaño I (figura 2).
Concentración de las bandas de proteína de fluido folicular en folículos de tamaño I, II y III
La banda de proteína con peso molecular de 68 kDa, representa el 24,45% del total de la cantidad relativa de proteína del FF, la banda de 57 kDa el 13,65%, y la banda de 26 kDa el 20,81%, estas bandas son las que identifican a un grupo de proteínas del FF con un promedio de concentración relativo mayor, que constituyen el 58,91% de la concentración total. En contraste las bandas de proteínas de 210,164,98,91,79,76,34,32,24,14 y 9 kDa, representan solo el 7,38 %. Sobresalen en los resultados, la banda de 68 kDa como la de mayor concentración en el FF de los tres tamaños de folículo, seguida de la banda de 26 kDa y de 57 kDa. Es notorio que a medida que aumenta el tamaño folicular, aumenta la concentración de las bandas de 68 y 57 kDa, mientras es estable la concentración para la banda de 26 kDa. Se evidenció diferencia estadística (p<0,05) en la concentración relativa de la banda de 164 kDa, entre el ovario derecho e izquierdo.
Frecuencia de presentación de las bandas de proteína de fluido folicular en folículos de tamaño I, II y III
Las bandas de proteínas con mayor frecuencia de presentación (80%) en folículos de tamaño I fueron las de 240 kDa, 68 kDa, 57 kDa,26 kDa, 40 y 42 kDa y las bandas de 34, 24 y 14 kDa fueron las de menor frecuencia (20%). En folículos de tamaño II, las bandas de 240 kDa, 57 kDa, 26 kDa, 68 kDa, 85 kDa, 40 kDa, 137 kDa, 178 kDa, 42 kDa fueron las de mayor frecuencia y las de menor presentación fueron las bandas de 32 kDa, 9 kDa, 210 kDa, 91 kDa, y finalmente en folículos de tamaño III, las bandas por encima del 80% de presentación son las de 240 kDa, 210 kDa, 68 kDa, 57 kDa , 26 kDa, 85 kDa ,137 kDa, 40 kDa, y con menor presentación las de 9 kDa, 42 kDa,91 kDa, 124 kDa,178 kDa, 24 kDa, 13 kDa, y 18 kDa.
Relación entre las bandas de proteínas del Fluido Folicular provenientes de folículos de diferentes tamaños y la calidad del oocito
Se observó correlación (r=0.66, p<0.001) entre la banda de 164 kDa y la calidad II del oocito, para el tamaño I del folículo. En este mismo tamaño de folículo se encontró que la proteína de 57 kDa se correlacionó inversamente (r=-0.36; p<0,05) con el oocito de calidad III. En el FF del folículo de tamaño II, la proteína de 38 kDa se correlacionó (r=0.68, p<0.003) con la calidad I del oocito, en tanto que la banda de 26 kDa correlacionó (r=-0.42, p<0.02) con oocitos de este mismo grado de calidad. En el tamaño III del folículo, la banda de 26 kDa correlacionó (r=-0.53, p<0.008) con oocitos de calidad GII.
Asociación entre las proteínas del FF y la calidad del oocito en folículos de diferente tamaño en el ovario derecho
En fluido de folículos de tamaño I, la banda de 164 kDa correlacionó (r=0.8, p<0,05 con oocitos calidad GI, mientras que oocitos de calidad GIII correlacionaron con las bandas de 68 KDa, 57KDa (r=-0.45 y -0.62 respectivamente, p<0.05). En fluido de folículos de tamaño II, las bandas de 38 KDa y 26 KDa correlacionaron (r=0.74 y -0.58 respectivamente, p<0.05) con oocitos calidad GI. La calidad GII del oocito correlacionó (r=0.72, p<0.05) con la banda de 13KDa. Las bandas de proteína de FF de folículos tamaño III, no presentaron correlaciones con la calidad del oocito del ovario derecho.
Asociación entre las proteínas del FF y la calidad del oocito en folículos de diferente tamaño en el ovario izquierdo
En fluido de folículos de tamaño I del folículo, la banda 164 kDa correlacionaron (r=0,62, p<0,05) con oocitos de buena calidad. La calidad GII del oocito, correlacionó (r=0.82, p<0.02) con la banda de 98 KDa, mientras que el oocito calidad GIII correlacionó (r=0.82, p<0.023) con la banda de 210 KDa. En el fluido del folículo de tamaño II, la banda de 124 kDa correlacionó (r=0.89, p<0.05) con el grado de calidad GIII del oocito, mientras que la banda de 68 KDa correlacionó (r=0.74, p<0.05). Finalmente, en el fluido del folículo tamaño III, las bandas de 68 kDa y 26 KDa se correlacionaron (r=0.71 y -0.63 respectivamente, p<0.05) con calidad del oocito grado II.
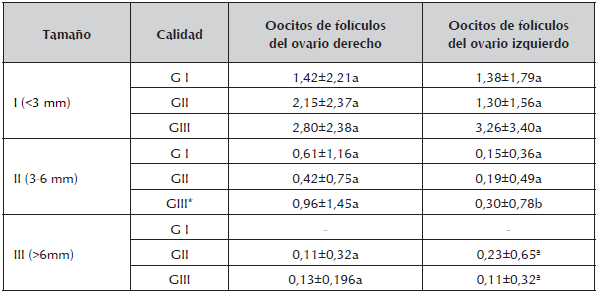
Los 403 oocitos evaluados en esta investigación fueron colectadas 321 en folículos tamaño I, 69 folículos tamaño II y 13 folículos tamaño III. Se clasificaron en calidad GI (93), GII (115) y GIII (195) oocitos. Para el tamaño de los folículos <3 mm los oocitos fueron de calidad GI: 73, GII:52 y GIII: 158, en el tamaño II en calidad GI:20, GII:54, y en GIII:33 y finalmente en folículos definidos como mayores de 6 mm en calidad GII: 9 y GIII:4. En la tabla 2, se observa los promedios de oocitos obtenidos de folículos aislados del ovario derecho e izquierdo colectados de estructuras de matadero por grado de calidad (G I, GII, GII) clasificados por la escala de Solís et al., 2012 , los resultados indican que para todos los tamaños determinados I, II, y III, en los grados de calidad (GI, GII,GIII) únicamente se encontró diferencia entre los oocitos de folículos de ovario derecho e izquierdo de tamaño II (3-6 mm) y clasificación de calidad GIII (Cúmulos como grado uno o algo más oscuro y menos y transparente, citoplasma con granulación más gruesa y más oscura en la periferia que en grado uno) en forma significativa (p<0.05).
Las concentraciones de proteínas de fluido folicular de esta investigación se encuentran dentro de los rangos promedio de concentración de proteínas totales en fluido folicular (Villa et al., 2009; Nandi et al., 2007; Leroy et al., 2004); sin embargo, nuestros resultados difieren de los de Aller et al., 2013; Shabankareh et al., 2013 en bovinos, que describen una disminución en la concentración total de proteínas a medida que aumentaba el tamaño del folículo. Aspectos como el diámetro folicular, crecimiento oocitario y folicular conllevan a fluctuaciones en la concentración de las proteínas y otros metabolitos por una mayor capacidad de filtración en la estructura folicular en folículos grandes (Fortune y Hansel, 1985; Nandi et al., 2007; Rahman et al., 2008; Tabatabaei et al., 2011); y también es mayor en folículos sanos (folículos irrigados) a diferencia de folículos atresicos según Clarke et al., 2006. Lo anterior respalda los resultados encontrados en esta investigación.
Para determinar la presencia de bandas de proteínas del fluido de folículos las muestras se sometieron a SDS-PAGE, evidenciándose un número de 25 bandas de proteínas similares a los descritos por Ribeiro et al., 2012 e inferiores a los encontrados por Mortarino et al.,1999 y Zachut et al.,2016; y a los encontrados por Petrucci et al., 2014 en folículos entre 15 y 40 mm; y en otros estudios de proteómica realizados en fluido folicular en búfalos (Fu et al., 2016). Las bandas de proteínas detectadas en fluido folicular bovino denotan la presencia de albuminas, cadenas pesadas de inmunoglobulinas, alfa-1-antitripsina, alfa-2-macroglobulinas, angiotensinas, apolipoproteinas, antitrombinas, fibrinógeno, haptoglobulinas, lactoferrinas, transferrinas entre otras (Sunderland et al., 1996; Driancourt, 2001; Fahiminiya et al., 2011; Ambekar et al., 2013).
Como se expresó anteriormente las bandas de proteínas con pesos moleculares de 14 y 34 kDa solo se detectaron en folículos menores 3 mm, su peso molecular sugiere que se trate de las haptoglobulinas α 1 chain; factores de crecimiento entre ellos IGFB2, caracterizados por aumentar la proliferación y diferenciación de células foliculares según Monget et al., 1996; inmunoglobulinas con acciones en el espermatozoide y la interacción de este con el oocito, y síntesis en respuesta a agentes infecciosos (Fahiminiya et al., 2011). Así mismo en este tamaño se encontraron las bandas de 76 y 79 kDa que pueden corresponder con la familia de las transferrinas (de Jong et al.,1990) involucradas en el transporte de hierro, la reducción de ROS y procesos de atresia folicular. La banda de proteína de 32 kDa se identificó en los folículos de tamaño I y II, que puede corresponder a los factores de complemento C3 (31,84 PM aprox.) según Bianchi et al., 2013; los genes de esta proteína tienen acción reguladora de hormonas tiroideas, glucocorticoides y de estrógenos entre otros (Fahiminiya et al., 2010; Yoo et al., 2013). Las bandas 98 y 24 kDa se encontraron en el fluido de folículos de tamaño I y III, la primera puede ser una proteína de la familia de las gelatinasas, y la segunda corresponder a factores de crecimiento insulínico (tipo 4) de importancia en procesos de crecimiento y desarrollo folicular. Las bandas de 9 y 91 kDa detectadas en los tamaños II y III, podrían ser: la de 9 kDa una proteína relacionada con el factor de crecimiento como el epidermal, este tipo de proteínas son exclusivas de la interacción de las células granulosa, de la teca y el metabolismo folicular (Schweigert et al., 2006, Hill 1989 y Jans et al., 1998). La banda de proteína de 91 kDa identificada podría ser una proteína relacionada con la gelsolina, participa en procesos contráctiles y morfogenéticos que ocurren durante el desarrollo folicular, ovulación modulando la actividad de la actomisina ATPasa (Teubner et al., 1994).
En este estudio se encontró que las bandas 68 kDa, 57 kDa, 26 kDa son las que representan mayor concentración en los tres tamaños foliculares. Ribeiro et al., 2012 y Gradela et al., 1998 reportaron como bandas de mayor concentración las de 68 y 26 kDa. La concentración de las bandas de proteína de 68 y 57 kDa aumenta en forma progresiva a medida que el tamaño folicular es mayor. La banda de 68 KDa podría corresponder a la albumina sérica bovina que fuera reportada por Ribeiro et al., 2012 como la de mayor frecuencia y concentración en fluido folicular, esta banda de proteína ha sido descrita igualmente en semen bovino (Oberst et al., 2002) y en fluido uterino (Alavi et al., 2006). Principal proteína del plasma, la cual es de fundamental importancia para la regulación de la presión oncótica, transporte de hormonas tiroideas, ácidos grasos, ácidos grasos libres, mantenimiento pH entre otras (Fahiminiya et al., 2011;Ambekar et al., 2013). Su concentración y presencia en los perfiles podría explicar su expresión en este estudio. La banda de 57 KDa identificada en nuestro estudio puede corresponder bien sea a la serpina o a la cadena pesada de la inmunoglobulina G (IgG) Ulbrich et al., 2009. La banda de 26 KDa posiblemente corresponda a la proteína ligante de IGF-4 (IGFBF-4) según Gradela et al., (1998) y ha sido detectada en células de la teca, especialmente aislada de folículos de menor tamaño, dicha proteína aumenta su concentración dependiendo de los niveles de LH (Amstrong et al.,1996).
De las 25 bandas detectadas solamente la banda de 164 kDa presentó diferencias significativas (p<0,05) en los diferentes tamaños del ovario derecho e izquierdo. Esta banda puede ser la descrita por Andersen et al., 1976, como una proteína del grupo de las inmunoglobulinas o de la inhibina subunidad α (Austin et al., 2001).
Como se describió anteriormente se encontraron correlaciones de las bandas de 164 kDa con oocitos de calidad regular y la banda 57 kDa con oocitos de mala calidad en los folículos < 3mm, al respecto Tao et al., 2014 reportaron una proteina de peso molecular aproximado 54,9 kDa como la vitamina D, la cual se asocia con atresia folicular durante la foliculogénesis (Tao et al., 2014), lo cual explicaria el resultado encontrado en la presente investigación. La banda de proteina 164 kDa se ha relacionado con inhibinas con acción principal en la secresión FSH y en otros factores producidos localmente en la gónada (IGF-I; TGF-β, activina) (Colazo y Mapletoft, 2014).
Las bandas de 26 y 38 kDa que correlacionaron con oocitos de buena calidad en folículos de 3-6 mm pueden corresponder a proteínas identificadas como factores de crecimiento producidos en los oocitos, células tecales y de la granulosa en las diferentes etapas de desarrollo folicular, estas están involucrados en la proliferación y diferenciación de células foliculares mediante la activación de acciones de las gonadotrofinas que ejercen funciones como la esteroidogénesis, maduración del oocito (Knight y Glister 2003). El anterior argumento explicaría los resultados de este trabajo. Llama la atención que en folículos > 6 mm la acción de la banda de 26 kDa tiene un efecto contrario al mencionado anteriormente con respecto a la calidad del oocito.
En el caso de la evaluación de calidad por cúmulos y citoplasma del oocito (Solís et al., 2012), los oocitos calidad tipo I evaluados en nuestros estudios presentan porcentajes inferiores a los reportados en vacas y novillas (Rizos et al., 2005); y en ovarios de hembras Bubalus bubalis utilizando la técnica de disección folicular (Quintana et al., 2012), pero fueron similares a los porcentajes descritos por Leal et al., 2010 en esta misma especie.
El número de oocitos calidad grado GII fue mayor en folículos con tamaños <3 y 6 mm, del ovario derecho. En este mismo tamaño de folículos, el porcentaje de oocitos clasificados como calidad GIII es mayor (p<0.05) en el ovario izquierdo. Los porcentajes reportados en el Grado II de calidad oocitaria son ligeramente inferiores a los obtenidos en búfalos en técnicas de aspiración y disección de folículos (Leal et al., 2010; Quintana et al., 2012) y en aspiración guiada por ultrasonido en vacas y novillas (Rizos et al., 2005).
Este resultado sugiere existen diferencias entre los ovarios, asociadas con los oocitos de calidad mala (GIII) y el tamaño folicular clasificado como II, debido al fase de crecimiento del folículo en el ciclo estral. Por otra parte, al considerar los valores obtenidos por tamaño de folículos I, II, III y calidad buena (GI) y regular GII de los oocitos, su porcentaje es de 51% oocitos similar a los que se seleccionan para procesos in vitro.
Conclusiones
La concentración de proteína total en el fluido folicular es un indicador de la calidad del oocito.
Este trabajo permitió establecer la presencia de determinadas bandas de proteínas en etapas específicas del desarrollo folicular.
Los resultados de esta investigación demostraron la importancia del análisis proteómico en la búsqueda de bandas de proteínas asociadas en la calidad del oocito.
La expresión, presentación y concentración de bandas de proteína varían con el tamaño del folículo, y la composición del fluido influye en la calidad del oocito.
Recomendaciones
Los resultados encontrados ameritan realizar nuevas investigaciones que permitan aclarar la función de estas proteínas en el crecimiento folicular.
Es conveniente adelantar procedimientos más sensibles que permitan obtener información de las diferentes etapas del ciclo estral en bovinos y realizar la secuenciación las proteínas detectadas.
A partir de esta investigación se pueden adelantar estudios en búsqueda de marcadores de calidad oocitaria que permitan seleccionar hembras de mayor fertilidad.