Introducción
En la actualidad se buscan nuevas biotecnologías para ser implementadas en el ámbito de salud y bienestar animal, el uso del plasma rico en plaquetas se ha convertido en un procedimiento común en la medicina veterinaria, siendo un sustrato autólogo y de fácil obtención. Este concentrado autólogo de plaquetas contiene 3 a 5 veces mayor de concentración basal de la sangre periférica, el cual es una fuente rica de factores de crecimiento (Akeda et al., 2019).
Es un gran desafío para la investigación el tratamiento de lesiones músculo esqueléticas por tener características de diferentes etiologías, magnitudes y localizaciones; por ende se ha incentivado la búsqueda y desarrollo de biomateriales como el PRP con contenido de fibrina y alta cantidad de factores de crecimiento; con ello estimulando, promoviendo y acelerando la curación de los tejidos, los cuales poseen una gran capacidad de contribución en la formación de hueso, ayudando a cumplir su función regenerativa en su mayor expresión. Además, es importante mencionar que actúan como un medio antiinflamatorio y control de infecciones en los procedimientos quirúrgicos (Cetinkaya et al., 2018).
Según Szponder et al., (2018) el PRP es usado en tratamientos de fracturas complicadas, teniendo en cuenta que éstas presentan cuadros de infección y pérdida de estructura ósea; en la actualidad se encuentran varias técnicas de reconstrucción con ayudas de bioestimulantes, todas ellas con el objetivo de tratar la infección, reestructurar la anatomía del hueso y obtener la consolidación ósea en el menor tiempo posible, generando una mayor posibilidad de éxito, con el mínimo riesgo y menor morbilidad para el paciente que se está tratando.
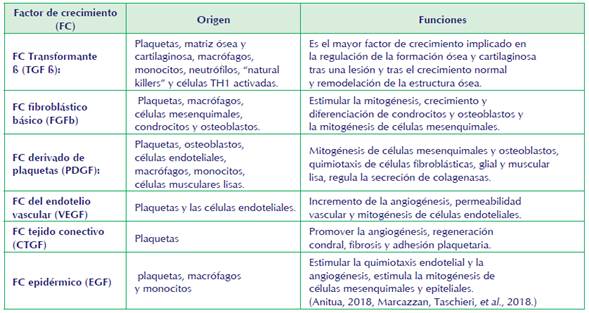
La importancia terapéutica del PRP está ligada con los factores de crecimiento (FC) liberados por sus gránulos poseedores de múltiples propiedades regeneradoras, osteoinductoras y antiinflamatorias (Bonilla-Gutiérrez et al., 2018).
El objetivo del artículo es la recolección de evidencias científicas presentadas en literatura médica con respecto al PRP como una alternativa de tratamiento en el manejo de fracturas y lesiones musculo esqueléticas, con ello se logra determinar la importancia de la estandarización del procedimiento (PRP) en uso, preparación, almacenamiento y administración.
Materiales y métodos
Estrategia de búsqueda
La búsqueda y recuperación de información es una etapa fundamental del quehacer científico. En éste artículo titulado “Uso de los factores de crecimiento presentes en el plasma rico en plaquetas como un tratamiento alternativo de lesiones músculo esqueléticas en animales”, las bases de datos bibliográficas usadas fueron Pubmed, Web of Science, Sciencedirect, Scielo, Medline, Embase y Scopus, obteniendo esta información es ciertamente difícil, porque existen múltiples fuentes con datos dispersos, parciales y faltos de exactitud. Por eso, se realizó una profunda investigación documental de información relevante publicada en inglés. Se usaron como términos de búsqueda; plasma rico en plaquetas, biotecnología, bioestimulante, cicatrización ósea, fracturas, osteoinductor, tratamientos en animales. También se exploraron los estudios relevantes de las listas de referencias de los estudios identificados y las revisiones sistemáticas anteriores, de igual manera se localizaron revistas, de alto impacto internacional donde se evaluaron con Scimago ranking para escoger solo las que se encontraban bien clasificadas.
Criterios de inclusión y exclusión
Los criterios de inclusión se dividieron en primarios y secundarios. Se manejaron los siguientes criterios de inclusión primarios: artículos en idioma inglés, estudios realizados en animales, artículos publicados en revistas indexadas, uso de PRP (como biotecnologías nuevas, lesiones óseas y condrales), uso de PRP solo o en asociación con injertos óseos y disponibilidad de texto completo. Los criterios de inclusión secundarios consideraron el protocolo y las características de velocidad de centrifugación, el recuento de plaquetas de PRP y / o dosis de PRP colocadas y protocolo del procedimiento para formar PRP.
Se excluyeron los estudios, de los artículos que no estaban en revistas ranking de instituciones (Scimago Journal y amp; Country Rank).
Desarrollo del tema
El uso del plasma rico en plaquetas en medicina veterinaria es un tema muy controvertido, ya que se encuentra una amplia información desde su preparación, aplicación y uso en los animales; en el siguiente artículo se relaciona, el uso por parte de los médicos en la práctica clínica, observándose a la vez el avance tecnológico y científico para tratar lesiones del sistema músculo esquelético, partiendo con la implementación de nuevos biomateriales. El aporte que se genera por parte de los biomateriales contiene propiedades mecánicas y a su vez funciona como un andamio, favoreciendo el hueso. Según Marcazzan et al., (2018), mencionan la importancia de la velocidad de centrifugación en el proceso de preparación del PRP, como también el coadyuvante (citrato de sodio) que tiene función de activador y anticoagulante, el método de aplicación, tiempo usado para concentrar las plaquetas hasta la misma administración del PRP. Los factores de crecimiento (FC) y otras citokinas deben estar presentes en concentración suficientes para estimular los mecanismos de reparación tisular (Oryan A., Alidadi S., Moshiri A. et al., 2016).
Importancia de los factores de crecimiento de las plaquetas
Las plaquetas con sus (FC) son importantes en el proceso de reparación de las heridas, llegando al sitio de la herida en el menor tiempo posible comenzando un proceso de coagulación y regeneración tisular e influyendo en procesos de angiogénesis, procesos inflamatorios y respuesta inmune. Dichas plaquetas son viables durante 7 días y continuarán liberando factores de crecimiento en el tejido durante este tiempo. (López; et al., 2019). La función principal es contribuir a la homeostasis a través de 3 procesos: adhesión, activación y agregación y estos se desencadenan durante una lesión. (Alves R., Grimalt R. et al., 2017.)
El PRP desempeña un potente papel osteoinductor, capaz de acelerar la consolidación de fracturas o de osteointegrar rápida y eficientemente distintos tipos de implantes óseos. A pesar de que la biología del hueso es capaz de reconstruir los defectos pequeños, en ocasiones donde la estructura natural del hueso se ve comprometida, es imprescindible recurrir al aporte de sustitutivos óseos para obtener la reparación que se quiere en el menor tiempo posible (Yin et al., 2020).
Según los autores Badr et al., (2016) observaron la presencia de 2 factores de crecimiento: PDGF, TGF-ß1 en los concentrados de plaquetas identificando que las células esponjosas tienen receptores para estos factores de crecimiento, y concluyeron que la adición de PRP aceleraba la velocidad de formación ósea y el grado de formación ósea durante 6 meses.
La importancia del PRP autólogo, es dada por la combinación de factores de crecimiento naturales dentro de un coágulo normal que actúa de portador, este coágulo se compone de fibrina, fibronectina, y vitronectina, que son moléculas de adhesión celular requeridas para la migración de las células como la que se aprecia en el proceso de osteoconducción y la epitelización de lesiones de manera fisiológica. Cabe destacar que los gránulos alfa de las plaquetas contienen más de 30 proteínas bioactivas, muchas de las cuales tienen un papel fundamental en la hemostasia y/o reparación de los tejidos lesionados principalmente en la estructura ósea afectada (Kazemi et al., 2014). Ver tabla 1.
Estudios de la activación del plasma rico en plaquetas
Las plaquetas participan en varios procesos relacionados con la hemostasia primaria y secundaria. La hemostasia primaria es un proceso caracterizado por la agregación plaquetaria a través de la unión de las plaquetas al fibrinógeno, que conduce a la formación de tapón de plaquetas, mientras que la hemostasia secundaria implica la escisión del fibrinógeno para fibrina insoluble a través de trombina generada por el sistema de coagulación proteolítica. En la hemostasia primaria, las plaquetas reaccionan en respuesta a la lesión ósea por la exposición de colágeno. La activación plaquetaria se caracteriza principalmente por el cambio de forma plaquetaria, adhesión, agregación y secreción de gránulos. (Córtese, Christopherson, Pelagalli. et al., 2020)
Se ha identificado que al iniciarse el proceso de cicatrización ósea, cuando se forma el coágulo y las plaquetas se degranulan, éstas y otros factores de crecimiento son liberados, es decir, que si existen más plaquetas en el sitio de la herida se liberará un número mayor de estos factores de crecimiento, por ello la gran importancia del PRP teniendo un volumen de plasma autólogo, que no es tóxico y no es inmunorreactivo. (Miron et al., 2017). Esto conlleva a analizar diferentes métodos de activación por parte de investigadores, buscando el mejor uso y técnica para implementar, se describen los siguientes estudios:
Antes de la infiltración, el PRFC de caninos se activó con el 5% de su volumen con el 10% cloruro de calcio. Este derivado de PRP obtenido se enriquece en plaquetas 2 veces sobre la sangre periférica y menos de 0.2 leucocitos 106/mL. (López et al., 2019). Este proceso de activación transforma la protrombina en trombina, que interviene en la agregación y en la adhesión a través de los receptores de la membrana de las plaquetas. (Anitua et al., 2018).
En el estudio realizado por Silva et al., 2013, se activó 1 ml de concentrado de plaquetas (PC) de caninos con 0,1 ml de gluconato de calcio al 10% o 0,1 ml de cloruro de calcio al 10%. Después de activarse, las muestras se mantuvieron en incubación con sales de calcio a temperatura ambiente (22-26 °C) durante dos horas. Los geles de plaquetas se liberaron de las paredes del tubo y se centrifugaron a 1500 g durante 10 minutos. No se encontraron diferencias estadísticamente significativas entre las concentraciones de TGF-β1 y PDGF-AB en los PC y plasma en función de la sal de calcio empleada para la activación de los PC.
Una vez que el PRP se mezcla con una sustancia activadora de plaquetas (es decir, sal de calcio ó trombina) o entran en contacto con colágeno tisular, cambian a una forma de gel, es decir, gel rico en plaquetas (PRG), que libera gradualmente los FC. En particular, la composición celular del PRP determinará el perfil de los FC y citocinas liberado de las plaquetas y leucocitos activados. (Gutiérrez et al., 2017).
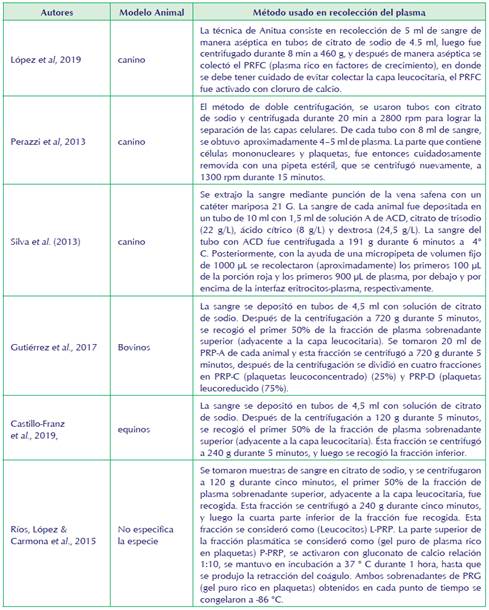
Cuando el PRP se destina a tratar lesiones de partes blandas, no se considera necesaria la activación previa, debido a que esta se produce in situ al contacto con el colágeno tendinoso o con el propio coágulo de la rotura fibrilar. Cuando el PRP se usa para el tratamiento de la osteoinducción para manejo de fracturas, suele preferirse la activación con trombina o cloruro cálcico, que además, le confiere una consistencia gelatinosa que facilita su uso en el ámbito quirúrgico. (Brendan, Wragg y Louise, 2019) (ver tabla 2).
Uso del plasma rico en plaquetas en fracturas y osteoartritis
El plasma rico en plaquetas (PRP) es un concentrado de plaquetas autólogo, administrado en el sitio de la fractura, libera factores de crecimiento y promueve la cascada de regeneración y consolidación ósea. Las plaquetas presentes contienen un conjunto de factores de crecimiento, que incluyen factor de crecimiento transformante- β (TGF-β), factor de crecimiento derivado de plaquetas (PDGF) y el factor de crecimiento endotelial vascular (VEGF), contenido principalmente en plaquetas alfa granuladas que se liberan después de la degranulación plaquetaria en el sitio del daño y mejorar la regeneración de tejidos estimulando la proliferación celular, aumentando el crecimiento extracelular y síntesis matricial, promoviendo el crecimiento vascular, además reduce las citocinas catabólicas de degradación de la matriz ósea como interleukinas y metaloproteinasas de matriz. (Giraldo, Álvarez y Carmona, 2015).
La aplicación de las proteínas liberadas a partir de las plaquetas es especialmente importante en condiciones patológicas, como la curación de fracturas comprometidas como consecuencia de un ambiente biológico inadecuado con concentraciones muy reducidas de factores de crecimiento TGF- ß, IGF e PDGF (Burska et al., 2020). Las lesiones osteoarticulares causan claudicación y disminución de la calidad de vida del paciente, la literatura de algunos autores describe la recuperación exitosa en casos de lesiones cartilaginosas y artritis mediante la aplicación de PRP intraarticular en humanos y animales de laboratorio (Szponder et al., 2018).
El plasma rico en plaquetas es una fuente importante de PDGF, TGF-β 1 y otras proteínas que inducen el anabolismo articular y disminuyen la inflamación y el dolor articular. En la actualidad, el PRP se usa como tratamiento de la osteoartritis en humanos, caballos y perros. El factor de crecimiento derivado de plaquetas (PDGF) induce anabolismo articular, proliferación de condrocitos y migración de células madre a los tejidos lesionados de la articulación, mientras que TGF-β1 aumenta la síntesis de la matriz extracelular del cartílago, disminuye la inflamación articular y promueve la diferenciación de las células madre de la membrana sinovial en los condrocitos. (Castillo et al., 2019).
Se manejan diferencias de criterios entre los autores teniendo en cuenta los trabajos realizados en fracturas articulares con el uso de PRP, en donde la mejora de la regeneración ósea sigue siendo objeto de debate por parte de (Ríos, López y Carmona et al., 2015), (Skwarcz et al., 2019), (Roffi, Di Matteo, Krishnakumar,et al., 2017), (Carmona et al., 2017), (Yin et al., 2020) y entre otros autores tratados en el presente artículo. Estos investigadores han demostraron que es un componente que ayuda a la formación de hueso de mayor calidad, de forma más temprana, en ocasiones en mayor cantidad existiendo una evolución clínica y radiológica favorable intraarticular con resolución completa de la línea de fractura. Yu et al., (2017) reportaron que los pacientes tratados mejoran su movilidad al cabo de unos 7 meses post aplicación, aunque algunos estudios no han observado ninguna mejora en formación y maduración ósea, se ha encontrado que el PRP es un medio óptimo para establecerlo como una ayuda en pacientes con problemas óseos.
Se debe tener como argumento importante la relación de la actividad biológica y sus beneficios clínicos (Marcazzan, Taschieri, et al., 2018), teniendo en cuenta que con ello se plantea un análisis crítico del uso del plasma rico en plaquetas para el empleo ortopédico en animales, estos son mencionados en la tabla 3.
Tabla 3 Principales actividades biológicas e indicaciones clínicas de concentrados de plaquetas tomada de Marcazzan, Taschieri, et al., 2018.
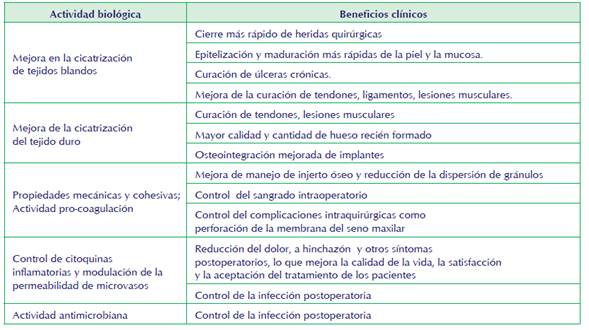
Sin embargo, algunos resultados controvertidos se pueden encontrar en la literatura citada; por lo tanto, la efectividad de esta técnica requiere más investigación. Según el conocimiento de los autores, los artículos que tratan sobre fracturas recientes y curación de fracturas retrasadas son muy escasos. López et al., 2019, realizaron un estudio, en donde los perros utilizados fueron pacientes clínicos, siendo su objetivo evaluar el uso de PRFC en el tratamiento de la ocurrencia natural de fracturas óseas en perros, encontrando que el uso de PRGF para la reparación ósea acelera la consolidación de fracturas y promueve simultáneamente la cicatrización, logrando tiempos de extracción de implantes claramente más cortos.
Estudios del uso de plasma rico en plaquetas en animales
En un estudio de 24 casos, una sola infiltración intraarticular de PRGF (plasma rico en factores de crecimiento) en pacientes caninos con displasia bilateral de cadera debido a osteoartritis, es efectiva para aliviar el dolor y mejorar la función de las extremidades. La combinación de un programa de fisioterapia junto con un tratamiento con PRGF, permite mantener el efecto máximo durante más de seis meses, lo que no sucede si los caninos son tratados solamente con PRGF (Cuervo, et al., 2019).
Se observó una alta incidencia de necrosis avascular de la cabeza femoral (ANFH) después de la fractura del cuello femoral y las dificultades en el tratamiento, por ende se realizó un estudio en treinta conejos blancos de raza Nueva Zelanda, los cuales se dividieron aleatoriamente en grupo control, grupo TCP (fosfato tricálcico beta) y grupo PRP + TCP, dando como resultado que el tratamiento con PRP combinado con TCP, puede promover la formación de hueso nuevo e inhibir la respuesta inflamatoria, lo cual demostró una mayor eficiencia en la regeneración de ANFH (Zhang et al., 2018).
Los conejos White Termond y cobayos Hartley son biomodelos con características específicas excelentes para la investigación del PRP; ya que poseen huesos grandes, tiempos cortos de cicatrización y fácil adquisición. En el presente artículo por Skwarcz et al., 2019. Se evidencia el uso del conejo White Termond como un modelo animal para los estudios experimentales; en donde se realizó un procedimiento quirúrgico, formando defectos cilíndricos, unicorticales del diámetro de 4 mm en el medio de los ejes de ambos fémures e implantando PRP en un grupo de animales y otro grupo control. Arrojando resultados significativos en las mediciones macroscópicas en los límites tomados en el área del defecto en donde se implantó el PRP en relación con el grupo control. Concluyeron que el Plasma rico en plaquetas (PRP) estimula la formación de hueso en el área de defectos óseos y puede acelerar la regeneración ósea (Skwarcz et al., 2019).
En animales de experimentación (ratas) se ha observado que el PRP participa en el desarrollo del proceso de angiogénesis reparadora, varios estudios avalan la posibilidad del uso del PRP para mitigar los efectos negativos, debidos a otras patologías como la diabetes mellitus. En este estudio el PRP corrige el impacto negativo de la hiperglucemia crónica en la osteogénesis reparadora, promoviendo una eliminación más rápida del infiltrado inflamatorio del sitio del defecto óseo y la formación de haces osteogénicos y la remodelación del hueso en tejido óseo membranoso lamelar. (Dudchenko et al., 2020).
Un experimento se realizó con seis ovejas merinas hembras adultas (Ovis aries), de aproximadamente tres años de edad, usando el copolímero de L-lactida / DL-lactida 80/20 (PLDLLA) y el plasma rico en plaquetas (PRP), se realizó dos craniectomías, creando 3 cm de diámetro en cada animal. Éste estudio demostró que la aplicación de implantes hechos de PLDLLA 80/20 combinados con plasma rico en plaquetas puede promover la cicatrización ósea en defectos de gran tamaño en las ovejas. Estos prometedores estudios de prueba de concepto deben verificarse en el futuro en una muestra de animales más grande, para sacar conclusiones definitivas (Błaszczyk et al., 2018).
En un estudio se eligieron, seis caballos de 5 a 11 años en los cuales, se emplearon muestras de membrana sinovial de las articulaciones metacarpofalángicas. En donde se concluyó que las preparaciones de Lc-PRP (leucoconcentrado) obtenido del cuarto inferior de la fracción) y Lr-PRP (leucorreducido) de la fracción plasmática superior a diferentes densidades, pueden generar respuestas mixtas antiinflamatorias y anabólicas en un sistema in vitro de sinovitis equina. Del mismo modo los sobrenadantes Lc-PRP generan efectos antiinflamatorios, pero no anulan los efectos catabólicos del LPS (lipopolisacárido) en explante de membrana sinovial (SMEs), por el contrario Lr-PRP mostraron intensos efectos antiinflamatorios y anabólicos (Carmona et al., 2017).
Un total de 37 animales (29 perros y ocho gatos), con fractura conminuta de hueso largo y complicaciones de la misma, donde el método terapéutico instaurado fue el uso de PRP y TCP (fosfato tricálcico β) para mejorar la unión ósea. Durante la aplicación clínica del tratamiento, se observó unión ósea en el 91% de los casos, lo que confirmó que el uso de PRP y TCP en el tratamiento quirúrgico de fracturas en animales pequeños, tiene efectos beneficiosos de los factores de crecimiento contenidos en PRP, no solo con respecto al proceso de unión ósea, particularmente en su inicio, sino también con respecto a los tejidos blandos que rodean el sitio de la fractura (Szponder et al., 2018).
El plasma rico en plaquetas es una fuente importante de PDGF, TGF-b1 y otras proteínas que inducen anabolismo articular y disminuyen inflamación y dolor articular. Actualmente, PRP se utiliza como tratamiento de la OA en humanos, caballos y perros. (Ríos, López y Carmona et al., 2015). Ver en la tabla 4 las características de los estudios del uso de PRP en animales
Tabla 4 Características de los estudios del uso de plasma rico en plaquetas en animales.
| Estudios | Tipo de estudio y revista | Autores | No. de animales en el estudio | Año publica ción | Tipo de preparación- Activación (PRP) | Velocidad de centrifugación | Resultados |
|---|---|---|---|---|---|---|---|
| Anti-inflammatory effects of two platelet-rich gel supernatants in an in vitro system of ligament desmitis. | Q1 Muscles, Ligaments and Tendons Journal. Artículo original de investigación | C. Castillo-Franz , C. López, M.E. Álvarez,C.E. Giraldo, J.U. Carmona | Seis caballos | 2019 | Método de centrifugación en tubo. La sangre fue depositada en tubos de 4,5 ml con solución anticoagulante de citrato de sodio | Centrifugación a 120 g durante cinco minutos, el primer 50% de la fracción superior de plasma sobrenadante, adyacente a la capa leucocitaria, fue recogido. Esta fracción se centrifugó adicionalmente a 240 g durante cinco minutos y luego la fracción inferior fue recogida. El PRP se activó con gluconato de calcio | Observaron correlaciones significativas entre algunos mediadores evaluados en este estudio, estos hallazgos deben ser considerados con precaución porque una correlación no necesariamente significa una relación causal. Por lo tanto, más estudios son necesarios para aclarar el valor de las correlaciones. En este estudio, concluyen que debería incluirse un estudio in vivo, que evalúe los efectos de Lc-PRP (plasma rico en plaquetas leucoconcentrado) y Lr-PRP (plasma rico en plaquetas leucoreducido) en modelos animales o en pacientes humanos. |
| Platelet Function and Therapeutic Applications in Dogs: Current Status and Future Prospects. | Q1 MDPI Artículo de revisión. | Laura Cortese, Pete W. Christopherson y Alessandra Pelagalli. | N.A | 2020 | No presento | No presento | El uso estandarizado de las formulaciones de PRP obtenidas por kits comerciales muestra algunas limitaciones debido a una disminución en las células rojas de la sangre y neutrófilos, que contribuyen a la eficacia clínica del producto plaquetario, jugando papeles principales en las respuestas inflamatorias después de la inyección de PRP. |
| Platelet-rich plasma, bone marrow and chitosan in minimally invasive plate osteosynthesis of canine tibia fractures - a randomized study | Q2 Veterinarni Medicina Artículo original | Fabricia Geovania Fernandes Filgueira, Bruno Watanabe Minto, Denise Granato Chung, Tiago Carmagni Prada, Natalie Massaro Rosa- Ballaben, Maria Gabriela Nogueira Campos. | 30 caninos | 2019 | Sangre de cada paciente (4,5 ml) se recogió en tubos que contenían citrato de sodio al 3.2% | Se hace doble centrifugado. Las muestras fueron centrifugadas a 1200 rpm durante 10 min, el plasma y capa leucocitaria aspirada y transferida a un tubo estéril sin aditivo y se realiza un centrifugado adicional a 1600 rpm durante 10 minutos. | Los biomateriales como el plasma enriquecido en plaquetas, el concentrado de médula ósea y el quitosano, contribuyeron a la consolidación ósea cuando se combina con MIPO (osteosíntesis mínimamente invasiva) de la tibia en perros, el concentrado de médula ósea resulta mejor obteniendo un menor tiempo de consolidación ósea. |
| Effects of sodium citrate and acid citrate dextrose solutions on cell counts and growth factor release from equine pure-platelet rich plasma and pure-platelet rich gel. | Q1 BMC Veterinary Research Artículo de investigación | Carlos E Giraldo , María E Álvarez y Jorge U Carmona | 18 caballos criollos argentinos | 2015 | Depositado al azar en tubos con citrato de sodio (SC) (12.35 mg de sodio citrato y 2.21 mg de ácido cítrico O citrato ácido dextrosa (ACD) solución A (ACD-A) (22.0 g / L de citrato trisódico, 8.0 g / L de ácido cítrico y 24.5 g / L de dextrosa, O solución ACDB (ACD-B) (13,2 g / L de citrato trisódico 4,8 g / L de ácido cítrico y 14.7g/L de dextrosa. | Después de centrifugar a 120 g durante 5 min, el primer 50% de la parte superior de la fracción de plasma sobrenadante, adyacente a la capa leucocitaria, fue recolectada y centrifugada a 240 g durante 5 minutos y la fracción del cuarto inferior fue recogido. Ésta fracción se consideró la fracción plasmática superior P-PRP (plasma rico en plaquetas puro). El plasma se obtuvo por centrifugación de cada sangre anticoagulada a 3500 g durante 8 min | Este estudio presenta nueva información sobre el efecto de los anticoagulantes: SC, ACD-A y ACD-B, para la elaboración de P-PRP equino. Los resultados obtenidos en el estudio confirman la hipótesis de trabajo, en donde los anticoagulantes evaluados no influyeron significativamente en el recuento celular o en concentraciones de factores de crecimiento (FC) en P-PRP equino. Sin embargo, ACD-B fue aparentemente el peor anticoagulante, porque produjo concentraciones de células y FC más bajas en comparación con los otros dos anticoagulantes. Es necesario realizar investigaciones adicionales, para determinar la cinética de dilución de FC a partir de P-PRG (gel rico en plaquetas puro) obtenido con los anticoagulantes evaluados en este estudio. |
| Short term storage stability at room temperature of two different platelet-rich plasma preparations from equine donors and potential impact on growth factor concentrations. | Q1 BMC Veterinary Research. Artículo de investigación | Gregor Hauschild ,Florian Geburek ,Georg Gosheger ,Maria Eveslage ,Daniela Serrano ,Arne Streitbürger ,SaraJohannlükens ,Dirk Menzel y Reinhard Mischke. | 15 caballos | 2017 | Las instrucciones proporcionadas por el fabricante incluyendo uso de ACD-A (solución de ácido-citratodextrosa) como anticoagulante y 8 ml de una solución patentada para Recuperación de las plaquetas. Ni ACP® ni E-PET prep- Las activaciones se realizaron después del procesamiento | Se realizó centrifugación a 1500 rpm (352 G) durante 5 minutos. | ( PRP rico en leucocitos) L-PRP ad modum E-PET y P-PRP (plasma rico en plaquetas puro) ad modum ACP® son aplicables durante al menos seis horas a temperatura ambiente sin pérdida de contenido de factor de crecimiento. Según los resultados de este estudio, los factores que influyen en las concentraciones resultantes del factor de crecimiento siguen siendo cuestionables. Se requieren estudios adicionales que implican una mayor estandarización de los protocolos de preparación y es necesario para identificar un impacto constante en el contenido de citocinas después del procesamiento de PRP. |
| Assessment of the Efficacy of Platelet- Rich Plasma in the Treatment of Traumatic Canine Fractures. | Q1 International journal of molecular sciences. Artículo deinvestigación | Sergio López, José M. Vilar, Joaquín J. Sopena, Elena Damià , Deborah Chicharro, José M. Carrillo, Belén Cuervo y Mónica Rubio. | 43 perros | 2019 | Se usaron 20 ml de sangre que fueros asépticamente recolectados en cuatro tubos de citrato de sodio 4.5 ml | Centrifugado durante 8 min a 460 G. Se debe tener cuidado de evitar la capa leucocitaria al extraer el PRGF (plasma rico en factores de crecimiento). Antes de la infiltración, el PRGF se activó con el 5% de su volumen con cloruro de calcio al 10% | El uso del PRGF para la reparación ósea acelera la consolidación de fracturas y promueve simultáneamente la cicatrización, logrando tiempos de extracción de implantes claramente más cortos. |
| Description of a double centrifugation tube method for concentrating canine platelets. | Q1 BMC Veterinary Research. Artículo metodológico | Anna Perazzi, Roberto Busetto, Tiziana Martinello, Michele Drigo, Daniela Pasotto, Francesco Cian, Marco Patruno & Ilaria Iacopetti. | 12 perros | 2013 | Método de doble centrifugación en tubo: 16ml de sangre citratada. Este procedimiento divide la sangre en tres componentes básicos: glóbulos rojos, plasma rico en plaquetas (PRP) y plasma pobre en plaquetas (PPP). | Fueron centrifugados 20 ml de sangre durante 20 min a 2800 rpm, para lograr la separación de las capas celulares. La solución obtenida se colocó en un tubo Falcon estéril de 15 ml y se centrifugó a 1300 rpm durante 15 minutos, para obtener el PRP. | El método del tubo de doble centrifugación puede representar un método relativamente simple y económico para obtener plasma rico en plaquetas caninas, potencialmente disponible para uso terapéutico. Nuestro método tiene que ser evaluado en un mayor número de muestras, pero los resultados preliminares fueron positivos. El procedimiento puede ser estandarizado y es fácil de adaptar en entornos clínicos con una infraestructura mínima, permitiendo así que un gran número de pacientes se beneficie de ésta terapia celular. |
| Platelet-rich plasma in bone regeneration: engineering the delivery for improved clinical efficacy | Q2 BioMed resear chinternational. Artículo de Revisión. | Isaac A. Rodriguez, Emily A. Growney Kalaf, Gary L. Bowlin, y Scott A. Sell | N.A | 2014 | En este estudio se analizó las diferentes formas de preparación del PRP, en forma líquida, gel, hidrogeles, esponjas, nanofibras y vidrio bioactivo. | Manejan andamios como matriz ósea desmineralizada, minerales óseos, proteínas morfogenéticas óseas, hidrogeles de alginato y esponjas de colágeno entre otras. | Si bien hasta la fecha no ha habido un método definitivo de entrega de PRP que se ha distanciado de los demás en términos de eficacia, el aumento en número y diversidad de los enfoques parecen indicar que el potencial clínico de PRP en el tratamiento de defectos óseos ha sido reconocido. Depende de la investigación en curso y la investigación futura, en áreas tales como hidrogeles PRP, esponjas y fabricación de andamios de nanofibras para realizar un complemento potencial y crear una formulación clínicamente exitosa y un método de entrega estandarizado. |
| Release of transforming growth factor beta 1 and platelet derived growth factor type AB from canine platelet gels obtained by the tube method and activated with calcium salts | Q3 Arch. med. vet. Artículo de investigación | R.F Silva, G.C Santana, F.O.P Leme, Carmona,C.M.F Rezende | 14 perros Fila brasileño | 2013 | Tubo de 8,5 ml con 1,5 ml de solución A de ACD (ACD-A) (citrato trisódico 22 g / L, ácido cítrico 8 g / L y dextrosa 24,5 g / L); un tubo de 4,5 ml con k 3EDTA (ácido etilendiaminotetraacético | El tubo de sangre ACD-A se centrifugó a 191 g durante 6 minutos a 4 ° C. Se utilizó una micropipeta de un volumen fijo de 1000 μ L para recolectar 100 μ L de la porción roja y los primeros 900 μ L de plasma, debajo y por encima de la interfaz plasma.La activación de 1ml de PC fue hecha con 0.1 ml de gluconato de calcio al 10% o 0.1 ml de cloruro de calcio 10%. Se mantuvieron en incubación a temperatura ambiente (22-26 oC) por 2horas. Geles de plaquetas fueron liberados de las paredes del tubo y centrifugados a 1500g por 10 minutos. | El estudio permitió concentrar un mayor número promedio de plaquetas (570.82 x 10 3 / μL), Es importante tener en cuenta que el ACP y nuestro PC (concentrado de plaquetas) podrían clasificarse técnicamente como (pure-platelet rich plasma) P-PRP, pero la concentración celular de ambas sustancias influye drásticamente en el perfil de factores de crecimiento Con ésta técnica se puede producir gel de plaquetas con capacidad terapéutica en medicina regenerativa. No se encontró diferencias significativas en los dos métodos de activación estudiados. |
| Platelet-rich plasma enhances the repair capacity of muscle-derived repair capacity of muscle-derived mesenchymal stem cells to large humeral bone defect in rabbits | Q1 Scientific Reports. Artículo de investigación | Nuo Yin, Yifei Wang, Liang Ding, Junjie Yuan, Li Du1, Zhongsheng Zhu, Mingmang Pan, Feng Xue, Haijun Xiao | 60 conejos Nueva Zelanda | 2020 | Tubos con citrato de sodio | La centrifugación inicial se realizó a 400 g durante 10 minutos y luego se centrifuga a 1700 g durante 10 minutos. | La aplicación de PRP mejoró significativamente la capacidad de regeneración de M-MSC (derivados musculares células madre mesenquimales) en defectos óseos grandes, mediante la promoción de la migración y proliferación de M-MSC, y también induciendo la diferenciación osteogénica. |
| Autologous platelet-rich plasma induces bone formation of tissueengineered bone with bone marrow mesenchymal stem cells on betatricalcium phosphate ceramics | Q2 Journal of Orthopaedic Surgery and Research.Articulo original | Tengbo Yu,Huazheng Pan, Yanling Hu, Hao Tao, Kai Wang, Chengdong Zhang | 6 conejos blancos de Nueva Zelanda | 2017 | Se colectó la sangre en tubos que contenían 4 ml de solución de citrato ácido dextrosa-A como anticoagulante y se separaron igualmente en 2 tubos estériles | Se centrifugó inicialmente durante 15 minutos a 800 rpm a 20 ° C para separar el plasma que contiene las plaquetas de los glóbulos rojos. El plasma se extrajo de la parte superior y se centrifugó nuevamente durante 15 minutos a 2000 rpm a 20 ° C para separar las plaquetas. Luego se extrajo el plasma pobre en plaquetas de la parte superior, dejando el PRP y la capa leucocitaria | El PRP produjo una concentración significativamente mayor de plaquetas, (el factor de crecimiento derivado de plaquetas AB) PDGFAB y TGF-β1. In vitro, se demostró que las células madre mesenquimatosas MSC en presencia de PRP autólogo exhibieron una excelente proliferación en cada punto de tiempo. Los resultados de la detección de capacidad osteogénica mostraron niveles significativamente más altos de síntesis de actividad de fosfatasa alcalina y de osteocalcina, por las MSC en combinación con PRP autólogo, después de 7 y 14 días de cultivo. |
| Efficacy of Platelet Concentrates in Bone Healing: A Systematic Review on Animal Studies - Part B: Large-size Animal Models | Q1 Platelets.Revisión sistemática | Sabrina Marcazzan; Silvio Taschieri; Roberto Lodovico Weinstein y Massimo Del Fabbr | Rata, conejo, perro, oveja, cabra, minicerdo | 2018 | N.A | N.A | No se obtuvieron conclusiones sólidas, hubo falta de la caracterización del contenido de concentrado autólogo de plaquetas APC y protocolos estandarizados que proporcionarán información útil para traducir los resultados a la aplicación clínica de APC en cirugía ósea |
| Proinflammatory and Anabolic Gene Expression Effects of Platelet-Rich Gel Supernatants on Equine Synovial Membrane Explants Challenged with Lipopolysaccharide | Q2 Veterinary Medicine International. Artículo de investigación | Jorge U. Carmona, Diana L. Ríos ,Catalina López ,María E. Álvarez y Jorge E. Pérez | 6 equinos | 2017 | Se depositó en tubos de 4,5 ml con solución de citrato de sodio (BD Vacutainer®, Becton Drive, Franklin Lakes, NJ, EE. UU. | Centrifugación a 120 g durante 5 minutos, se recogió el primer 50% de la fracción de plasma sobrenadante superior, adyacente al recubrimiento leucocitario. Esta fracción se centrifugó a 240g durante 5 minutos, y luego se recogió el cuarto inferior de la fracción | Este estudio demuestra que las preparaciones de (PRP leuco concentrado) Lc-PRP y (PRP leucorreducidas) Lr-PRP a diferentes concentraciones pueden inducir respuestas mixtas antiinflamatorias y anabólicas en un sistema in vitro de sinovitis equina. Los sobrenadantes de 25% y 50% de (gel rico en plaquetas leuco concentrado) Lc-PRG presentaron efectos antiinflamatorios de leves a moderados. Sin embargo, estas sustancias no revirtieron los efectos catabólicos del (lipopolisacáridos) LPS. Los sobrenadantes de 25% y 50% de Lr-PRG mostraron intensos efectos antiinflamatorios y anabólicos, que fueron mayores para el sobrenadante de 50% de (gel rico en plaquetas leucorreducidas) Lr-PRG. |
| Study of a Two-Step Centrifugation Protocol for Concentrating Cells and Growth Factors in Bovine Platelet-Rich Plasma Concentrating | Q2 Veterinary Medicine International Artículo de investigación | Claudia M. Gutiérrez, Catalina López, Carlos E. Giraldo, and Jorge U. Carmona | 19 vacas Holstein-Friesian lactantes | 2017 | 1. Los tubos de sangre con citrato de sodio se centrifugaron (Hettich Rotofix 32, Tuttlingen, Alemania). 2.Dos tubos de plástico estériles sin aditivo (Vacuette, Greiner BioOne, Kremsmünster,Austria) | Centrifugación a 720 g durante 5 minutos, se recogió el primer 50% de la fracción de plasma sobrenadante superior (adyacente a la capa leucocitaria), dividiéndose las fracciones en PRP-A (50%) y PRP-B (50%). Se tomaron 20 ml de PRP-A de cada animal y esta fracción se centrifugó a 720 g durante 5 minutos, después de la centrifugación, se dividió en PRP-C (25%) y PRP-D (75%). | En conclusión los recuentos de plaquetas y recuentos de leucocitos fueron significativamente mayores en PRP-C. Las concentraciones de TGF-β1 fueron significativamente mayores en los sobrenadantes (gel rico en plaquetas) PRG-C y su corresponsal lisado PRP-C cuando se compara con los demás sobrenadantes PRG y plasma. Los sobrenadantes de PRG-A, PRG-B, y PRG-D tenían concentraciones equivalentes de TGF- β 1 (se divide en cuatro fracciones la sangre A, B, C, D). Las concentraciones de factores de crecimiento: PDGF-BB no fueron estadísticamente diferentes entre los hemoderivados. Según su composición se dividieron en (concentrado en leucocitos) Lc-PRP (PRP-C), (reducido en leucocitos) Lr-PRP (PRP-B y PRP-D), y PRP de transición (T-PRP) (PRP-A). |
| Equine Suspensory Ligament and Tendon Explants Cultured With Platelet-Rich Gel Supernatants Release Different Anti-Inflammatory and Anabolic Mediators | Q1 Biomedicine and Pharmacotherapy. revisión | Andrés F Bonilla-Gutiérrez, Cristian Castillo-Franz, Catalina López, María E Álvarez, Carlos E Giraldo, Jorge T Carmona | 6 equinos | 2017 | La sangre se depositó en tubos de 4,5 ml con solución de citrato de sodio (BD Vacutainer®, Becton Drive, Franklin Lakes, NJ, EE. UU.) | La primera centrifugación fue a 120 g durante 5 minutos y segunda se centrifugó a 240 g durante 5 minutos | El 50% de (sobrenadante de gel rico en plaquetas reducido en leucocitos) Lr-PRGS indujo significativamente menos liberación de IL-1β que los otros hemoderivados en ambos tejidos. A las 48 h, tanto el Lr-PRGS como el 25% de (sobrenadante de plasma reducido en leucocitos) Lr-PL indujeron concentraciones de TNF-α significativamente más altas en los (explantes de ligamentos suspensorios equinos normales) LES en comparación con los (explantes de tendones) TE, mientras que ambas concentraciones de Lr-PRGS indujeron concentraciones significativamente más altas de IL-4 en los LES en comparación con los TE. La liberación de IL-1 no fue diferente entre los tejidos. Sin embargo, esta citocina fue significativamente mayor en los explantes de tejidos cultivados con ambas concentraciones de Lr-PRGS. La concentración de hematocrito fue menor en los explantes de tejido cultivados con todos los hemoderivados a dos concentraciones en comparación con el grupo control. |
| Platelet-rich plasma in the management of chronic low back pain: a critical review | Q1 Journal of Pain Research. Artículo de revisión | Koji Akeda, Junichi Yamada, Erikka T Linn, Akihiro Sudo, and Koichi Masuda | N.A | 2019 | Estudios in vivo adición de cloruro de calcio y / o trombina, congelación y descongelación. Estudios in vitro, un procedimiento de congelación y descongelación. | N.A | Varios estudios en animales han demostrado que la inyección de PRP en (Intervertebral disc) IVD degenerados es efectiva para restaurar los cambios estructurales (altura de IVD) y mejorar la integridad de la matriz de los IVD degenerados según lo evaluado por la resonancia magnética (MRI) y la histología. Los resultados de esta investigación básica han demostrado la gran posibilidad de que PRP tenga efectos biológicos significativos para la reparación de tejidos para contrarrestar la degeneración de IVD. |
| The Efficacy of Platelet-Rich Plasma Gel in MRSA-related Surgical Wound Infection Treatment: An Experimental Study in an Animal Model | Q2 Official publication of the European Trauma Society. Artículo de investigación | R.A. Cetinkaya S. Yilmaz, A.Ünlü, P. Petrone, C. Marini, E. Karabulut M. Urkan E. Kaya, K. Karabacak, M. Uyanik, I. Eker, A.Kilic, A. Gunal | 72 ratas macho Wistar | 2017 | Tubo con una dilución 1:10 con solución de dextrosa de citrato anticoagulante | Se centrifugó a 1500 rpm durante 10 minutos. Se volvió a centrifugar adicionalmente a 4000 rpm durante 10 minutos. | Los recuentos de (modelo animal de Staphylococcus aureus resistente a la meticilina) MRSA en los grupos MRSA, MRSA + PRP, MRSA + Vancomicina y MRSA + Vancomicina + PRP fueron 5,1 × 10 6 (DE ± 0,4) UFC / ml, 4,3 × 10 6 (DE ± 0,7) UFC / ml, 2,3 × 10 6 (DE ± 0.3) UFC / mL, 1.1 × 10 6 (DE ± 0.4) UFC / mL, respectivamente. Las puntuaciones de inflamación de los grupos MRSA + PRP, MRSA + Vancomicina y MRSA +Vancomicina + PRP fueron significativamente más bajas que el grupo MRSA. La puntuación de inflamación del grupo MRSA + Vancomicina + PRP fue significativamente menor que el grupo MRSA + PRP. |
| Application of Platelet-rich Plasma and Tricalcium Phosphate in the Treatment of Comminuted Fractures in Animals | Q2 In Vivo Artículo de investigación | Tomasz szponder; Joanna wesselyszponder; aleksasobczyńskarak; beata żylińska; radosław p. radzki; izabella polkowska | 16 conejos blancos de Nueva Zeland | 2018 | Se activa posteriormente con trombina bovina (Biomed Lublin) y se mezcla con (fosfato β-tricálcico) TCP granulado (Cerasorb ® M; Curasan) con diámetro de grano de 500-1000 micras y un diámetro de poro de 5 a 500M. | La sangre se centrifugó 150 g durante 10 min). Luego se centrifugó nuevamente (400 g por 15 min). | Se observó una unión ósea correcta en los grupos experimentales, el fosfato tricalcico permaneció visible en el sitio de la fractura después de 12 semanas. En la aplicación clínica en conejos, se observó unión ósea en más del 91% de los animales tratados. |
| Platelet-rich plasma for bone healing and regeneration | Q1 Expert Opinion on Biological Therapy. revisión | Ahmad Oryan | rata, conejo, perro, oveja, cabra, | 2014 | Anticoagulantes para la preparación de PRP incluyendo heparina, citrato, solución ácida de citrato-dextrosa A o citrato anticoagulante dextrosa-A (ACD-A), citrato-fosfato-dextrosa (CPD), citrato-teofilinaadenosina- dipirimadole (CTAD) y ácido etilendiaminotetraacético (EDTA) | La Centrifugación fue de 160- 3.000 g durante 3 a 20 min y la fuerza centrífuga del segundo giro aumentó de 300 g 2.000 g. | Como la eficacia de PRP depende de varios factores, el resultado de la terapia con PRP es variable e impredecible en pacientes ortopédicos. Por lo tanto, aún es demasiado pronto para sugerir el PRP como la opción de tratamiento de primera línea en lesiones óseas complicadas como curación exitosa de defectos óseos grandes. Sin embargo, la combinación de PRP con biomateriales naturales y sintéticos puede mejorar la efectividad de PRP. |
| Effect of Autologous Platelet Rich Fibrin on the Healing of Experimental Articular Cartilage Defects of the Knee in an Animal Model | Q2 BioMed Research International.Artículo de investigación | Davoud Kazemi ,Ashraf Fakhrjou, Vahid Mirzazadeh Dizaji , Majid Khanzadeh Alishahi | 12 perros | 2014 | Tubos de ensayo de vidrio estéril de 10 ml sin ningún anticoagulante | La muestra de sangre se centrifugó a 3000 rpm (400 g) durante 10 minutos | Los resultados de las evaluaciones macroscópicas e histológicas indicaron que había diferencias significativas entre los defectos tratados y no tratados con plasma rico en fibrina PRF, indicando que éste tratamiento favorece la cicatrización de los defectos articulares. |
| Efficacy of platelets in bone healing: A systematic review on animal study | Q1 Platelets. Revisión sistemática | Sabrina Marcazzan; Roberto Lodovico Weinstein ; Massimo Del Fabbro | ratas, conejos,perros, ovejas y mini cerdos | 2017 | N.A | N.A | Las especies animales, los modelos sanos, las plaquetas, los factores de crecimiento y la concentración de leucocitos y el tipo de defecto óseo parecieron influir en la eficacia de los concentrados de plaquetas en la curación ósea. |
| Objective Comparison between Platelet Rich Plasma Alone and in Combination with Physical Therapy in Dogs with Osteoarthritis Caused by Hip Dysplasia | Q1 MDPI ANIMALS Artículo de investigación | BelénCuervo Mónica Rubio; Debora Chicharro Elena Damiá Angel Santana; José Carrillo Ayla Romero; José Vilar; José Cerón; Joaquin Sopena | 24 perros | 2020 | Tubos Vacutainer de citrato de sodio al 3,8% tubos y el PRGF se activó agregando 5% de cloruro de calcio (CaCl 2 10%) | Los tubos se centrifugaron a 460 g durante 8 minutos | Se observaron diferencias significativas en cada punto de control con respecto al tiempo basal en ambos grupos. Sin embargo, después de 180 días, el grupo de plasma rico en factores de crecimiento PRGF, mostró una disminución en (fuerza vertical máxima) PVF y (impulso vertical) VI con respecto a los valores obtenidos a los 90 días. Sin embargo, el grupo de fisioterapia más PRGF mantuvo valores aumentados de PVF y VI durante el período de estudio de 180 días. |
| Effects of Polylactide Copolymer Implants and Platelet-Rich Plasma on Bone Regeneration Withina Large Calvarial Defect in Sheep | Q2 BioMed Research International.Revisión sistemática | Bartłomiej Błaszczyk; Wojciech Kaspera; Krzysztof Ficek; Maciej Kajor; Marcin Binkowski; Ewa Stodolak-Zych; Aniela Grajoszek; Jerzy Stojko;Henryk Bursig; Piotr Ładzińsk | 6 ovejas Merino | 2018 | Las muestras se recogieron en viales de silicona con 0,5 ml de citrato de sodio al 3,2% | Se centrifugaron a 2.400 rpm durante 10 minutos y por segunda vez se centrifugó a 5.000 rpm durante 10 minutos | El estudio demostró que la aplicación de implantes hechos de (copolimero de L-lactida / DL-lactida 80/20) PLDLLA 80/20 combinados con una sustancia PRP, puede promover la cicatrización ósea en defectos de gran tamaño en las ovejas. |
| The Application of PRP Combined With TCP in Repairing Avascular Necrosis of the Femoral Hea After Femoral Neck Fracture in Rabbit. | Q2 European review for medical and pharmacological sciences. Artículo de investigación. | X.-L. Zhang, Y.-M. Wang, K. Chu, Z.-H. Wang, Y.-H. Liu, L.-H. Jiang, X.Chen, Z.-Y. Zhou, G. Yin | 30 conejos nueva Zelanda. | 2018 | Una jeringa de 10ml precargada con 1ml de compuesto de anticoagulante citrato de sodio | La muestra de sangre fue mezclada y transferida a una centrífuga de 10 ml Metro (Corning, NY, EE. UU.), seguido de centrifugación (4 ° C, 3700 rpm) durante 10 min Todas las preparaciones se activaron de la siguiente forma: PRP (0.8 mL), coagulante (0.2 mL) (10% CaCl 2 , 1000 U trombina | PRP combinado con fosfato tricálcico, puede regular la expresión de factores relacionados con la formación ósea y regulan a la baja los factores relacionados con la inflamación.Afirman que el trabajo proporcionó una referencia para el tratamiento clínico de fractura de cuello femoral. |
| Autologous activated platelet-rich plasma (PRP in bone tissue healing - doesit work? Assessment of PRP effect on bone defect healing in animal models | Q2 Journal of Veterinary Sciences. Artículo de investigación | Skwarcz, S., Bryzek, I., Gregosiewicz, A., Warda, E., Gawęda, K., Tarczyńska, M.,Węgłowski,R., Skwarcz, J., Nadulski, R., Starek, A., & Sanford, J. | 12 conejos de raza White termond. | 2019 | 2 ml para realizar un recuento sanguíneo y evaluar el nivel de compactación plaquetaria en la preparación de PRP, en relación a su nivel en sangre total y 4 ml se colocaron en tubos de ensayo BD Vacutainer® CPT ™ (GE Healthcare) | Después de una centrifugación y activación estándar con la trombina obtenida previamente del suero de uno de los conejos, se obtuvo el PRP listo para usar. En el artículo no menciona la velocidad y tiempo de centrifugación | El plasma rico en plaquetas, como fuente de factores de crecimiento, puede agregar beneficios para la curación ósea al estimular la formación de hueso en el área de defectos óseos y puede acelerar la regeneración del hueso. Aumenta el volumen total del nuevo tejido formado en el área del defecto. |
| Morphological Characteristics and Correction of Long Tubular Bone Regeneration under Chronic Hyperglycemia Influence. | Q2 Analytical Cellular Pathology. Artículo de investigación. | Yevhenii S. Dudchenko , Olena S. Maksymova, Vasyl S. Pikaliuk, DmytroV. Muravskyi, Ludmila I. Kyptenko, and Gennadii F. Tkach | 70 ratas blancas de laboratorio | 2020 | 2 ml de sangre de la vena lateral de la cola,se recogió en recipientes de vacío de 4 ml que contienen 0,35 ml de solución de citrato de sodio al 10% | La muestra se centrifugó durante 20 minutos a una velocidad de 200 rpm. | Los resultados del efecto de hiperglucemia crónica en la regeneración ósea son el deterioro de la proliferación celular osteogénica y cambio de su diferenciación hacia la regeneración y formación del fibrocartílago. La hiperglucemia crónica contribuye en el retraso de la inflamación en el sitio del defecto óseo, lo que hace que cese la osteogénesis reparadora de forma más prolongada. El PRP corrige el impacto negativo de la hipertensión crónica y la glucemia, en la osteogénesis reparadora, promoviendo más rápido la respuesta inflamatoria y formación de haces osteogénicos y remodelación del hueso en tejido óseo membranoso lamelar. |
| Evaluation of the anti-inflammatory effects of two platelet-rich gel supernatants in an in vitro system of cartilage inflammation | Q1 Cytokine Artículo de investigación | Ríos DL, López C, Carmona J.U | 6 caballos | 2015 | Se depositó inmediatamente en tubos de 4,5 ml consolución decitrato de sodio(BD Vacutainer®, Becton Drive, Franklin Lakes, NJ, EE. UU.). Ambas preparaciones de PRP se activaron con gluconato de calcio (Ropsohn Therapeutics Ltda®, Bogotá, Colombia) | Esta fracción se centrifugó a 240 g durante cinco minutos. | Tanto los sobrenadantes de PRG al 25% como al 50% produjeron un perfil molecular diferente en los medios de cultivo, a diferencia del CE desafiado solo con LPS. El 50% de L-PRG produjo la liberación más sostenida de factores de crecimiento y citocinas antiinflamatorias, aunque produjo la mayor liberación de TNF-α. PDGFBB se correlacionó significativamente con las concentraciones de IL-1ra y TNF-α, mientras que TNF-α se correlacionó con IL-4. |
Consideraciones finales
Se recopiló información científica que permite concluir la efectividad o mejoría del paciente con lesiones óseas o articulares en función del tratamiento convencional con PRP, promoviendo la osteogénesis con factores de crecimiento derivados, el cual representa un tratamiento coadyuvante útil para promover la reparación de fracturas con periodos de recuperación más cortos y con menores complicaciones; se debe indagar de manera más extensa sobre la utilización del PRP en fracturas complicadas y no complicadas, así como determinar su efecto en pacientes jóvenes y gerontes, para poder realizar comparaciones con los tratamientos convencionales (Filgueira et al., 2019).
El plasma rico en plaquetas ha supuesto un avance decisivo en la estimulación y la aceleración de la consolidación de huesos y cicatrización de partes blandas. Es una biotecnología relativamente nueva que representa el interés creciente, que estudia actualmente la ingeniería de tejidos y terapia celular. Esta biotecnología, no está exenta del riesgo de que no se comprenda con exactitud su manipulación y se realice un uso incorrecto. A pesar del entusiasmo que ha despertado el desarrollo del producto entre algunos autores y la difusión que han realizado las empresas que comercializan los kits de obtención del PRP, siguen existiendo dudas sobre la verdadera eficacia del Plasma Rico en Plaquetas sobre la regeneración esquelética en nuestros pacientes. (Roffi, Di Matteo, Krishnakumar, et al., 2017).
Actualmente el mejor sustitutivo óseo es el hueso mismo, ya sea autólogo, como en el caso del autoinjerto óseo, o bien obtenido de un donante, aloinjerto óseo. El autoinjerto o injerto autólogo continúa siendo el único biomaterial que posee la capacidad osteogénica, osteoinductora y osteoconductora; pero este genera una gran comorbilidad de la zona donante y su disponibilidad es limitada, por ende, se busca nuevas alternativas como lo es el uso del PRP. (Yin et al., 2020).
La utilización de PRP en el sitio de la injuria confirma la importancia de la expresión y producción de factores de crecimiento a nivel de la línea de fractura, esta puede ser una causa para la disparidad de resultados clínicos entre varios autores y habría que realizar nuevos experimentos que los confirmen. Estos resultados tan dispares se deben a las diferencias entre las líneas celulares utilizadas, así como los diferentes procedimientos de producción del PRP, lo cual genera distintas liberaciones de factores de crecimiento (Hauschild; et al., 2017).
La falta de consenso sobre la composición y la producción de los concentrados plasmáticos hacen imposible el establecimiento de un estándar que integre a todos los trabajos de investigación. Es necesario realizar estudios experimentales en los que se incluya, la determinación y cuantificación de los factores de crecimiento in situ, en la aplicación del PRP, en la regeneración de las lesiones, que nos permita profundizar en el conocimiento del comportamiento biológico de los factores de crecimiento plaquetarios en la reparación ósea. Se debe determinar por qué los productos ricos en plaquetas son muy efectivos en unos determinados casos, pero ineficaces en otros (Dehghan et al., 2015¸ Perazzi et al., 2013). Pero se debe tener en cuenta que este tratamiento alternativo se trata de una opción de bajo costo e inocuidad, fácil manejo y con utilidad en procesos patológicos esquivos a los tratamientos convencionales (Perazzi; et al., 2013).
La mayoría de los estudios no informan aspectos clave que pueden influir en el resultado final y obstaculizar una interpretación correcta de los resultados, entre los cuales se encuentran la forma de preparación, las concentraciones de plaquetas utilizadas, los componentes de los leucocitos y la modalidad de activación, que a menudo se pasa por alto. Aunque varios productos con un amplio rango de concentración celular están incluidos en la familia PRP, el número y tipo de células aplicadas no es un aspecto secundario. Los efectos de PRP también pueden depender de la condición del tratamiento, es decir, la modalidad de aplicación, en particular en términos de administración de forma inyectada o quirúrgica (un estado más sólido con más fibrina), que puede implicar una liberación diferente de los FC de la red de fibrina, y aún más con los procedimientos combinados que van en aumento.
Si bien hasta la fecha no ha habido un método definitivo de entrega de PRP que se ha distanciado de los demás en términos de eficacia, el aumento en número y diversidad de los enfoques parecen indicar que el potencial clínico de PRP en el tratamiento de defectos óseos ha sido reconocido. Depende de la investigación en curso y la investigación futura, en áreas tales como hidrogeles de PRP, esponjas y fabricación de andamios de nanofibras, para realizar un complemento potencial y crear una formulación clínicamente exitosa y un método de entrega estandarizado. (Rodríguez, Growney Kalaf, Bowlin, y Sell et al., 2014.)
En los últimos estudios se demuestra que el uso de PRP en consolidaciones óseas ha dado resultados positivos, siendo indicado para defectos óseos grandes, sin la intervención de ningún tratamiento secundario. Es de recalcar que los defectos óseos amplios, incluso después de 90 días no pueden cerrarse naturalmente y el efecto de reparación natural es deficiente, por lo tanto, estos defectos óseos requieren de injertos para promover la regeneración ósea y la reparación total del defecto. Otros experimentos afirman que el mecanismo molecular de PRP es recomendado para mejorar la capacidad de regeneración del implante autólogo de células mesenquimatosas derivadas del músculo, contribuyendo como tratamiento para inducir la migración y la proliferación de células mesenquimatosas, como también promover la diferenciación osteogénica en experimentos in vitro (Yin et al., 2020).
Se debe tener en cuenta limitaciones importantes en el momento de un estudio en animales de compañía con fracturas óseas, primero, el uso de perros con un amplio rango de peso, un rango de peso estrecho podría proporcionar más confiabilidad y resultados precisos, al menos para un rango de peso específico. Segundo, un análisis biomecánico de la marcha podría proporcionar resultados objetivos completos con respecto a la función de las extremidades (López; et al., 2019).
Hace 16 años se pensaba que la más alta concentración de plaquetas en el PRP producirían mejores resultados clínicos, que una sustancia con una menor concentración de plaquetas (PLT). Este paradigma ha cambiado con el tiempo y actualmente es ampliamente aceptado que el PRP con una baja concentración de PLT (≥1.2 veces mayor que la concentración de PLT en sangre total) puede también producir buenos resultados clínicos en comparación con los PRP muy rico en PLT. (Gutiérrez et al., 2017).
La falta de indicaciones claras sobre la mejor manera de aplicar concentrados de plaquetas se refleja en una extrema heterogeneidad en términos de preparaciones de PRP, así como en objetivos y métodos de entrega. Además, la calidad de los estudios es limitada: en cuanto al campo preclínico, se omiten muchos parámetros clave, el diseño del estudio es deficiente e incluso para ensayos aleatorios, el bajo número de pacientes y la presencia de factores de confusión concomitantes dificultan la posibilidad de obtener resultados claros. Pero a pesar de lo anteriormente mencionado, el uso de este biomaterial, genera un gran avance médico en el cual la única manera de observar resultados es empezar a usarlo en nuestros pacientes, analizando la rapidez de cicatrización, el manejo del dolor e inflamación, procesos infecciosos secundarios, y relacionándolo con la gran oportunidad de estar disponible en nuestras manos ya que es un producto estéril y lo más importante a bajo costo, dando la oportunidad de implementarlo en todos los campos clínicos de la Medicina Veterinaria. (Marcazzan, Taschieri, et al., 2018)