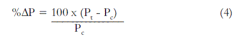Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.12 no.1 Medellín Jan./June 2005
BIOTECNOLOGÍA
PARÁMETROS CINÉTICOS DE CRECIMIENTO DE Saccharomyces cerevisiae EN PRESENCIA DE UN CAMPO MAGNÉTICO VARIABLE DE BAJA INTENSIDAD Y ALTA FRECUENCIA
KINETIC PARAMETERS OF GROWTH OF Saccharomyces cerevisiae AFFECTED BY A VARYING MAGNETIC FIELD OF LOW INTENSITY AND HIGH FREQUENCY
José E ZAPATA M.1*;Margarita HOYOS R.1; Lida A. QUINCHÍA B.2
1 Facultad de Química Farmacéutica. Departamento de Alimentos. Universidad de Antioquia. Apartado aéreo 1226, Medellín-Colombia.
2 Estudiante. Ingeniería de Alimentos. Facultad de Química Farmacéutica. Universidad de Antioquia. Apartado aéreo 1226, Medellín- Colombia.
RESUMEN
En el presente trabajo se evalúa el crecimiento de la levadura Saccharomyces cerevisiae en malaza (miel virgen), en presencia de un campo magnético (CM) variable de alta frecuencia y baja intensidad. Se evalúan los parámetros cinéticos: Velocidad específica máxima de crecimiento (μmax), constante de saturación (Ks) y coeficiente de rendimiento (Yxs). Se realizan ensayos en fermentadores de 400 ml, a temperatura de 25 ºC. El flujo de aire utilizado en cada fermentador es de aproximadamente 1 vvm. El campo aplicado posee una frecuencia de 100 kHz, el tiempo de exposición es de 200 s y la densidad de campo usada es de 250 mG. Se comparan los resultados obtenidos para cultivos bajo la acción del CM y cultivos creciendo en condiciones ambientales normales (control). Los resultados muestran que el campo magnético puede afectar los parámetros cinéticos de forma diferente dependiendo del número de aplicaciones que se utilicen, llegando a generar incrementos de hasta 20% en la velocidad específica de crecimiento y de hasta el 28% en el rendimiento, y descensos de hasta el 26% en el valor de la constante de saturación.
Palabras clave: campo magnético, saccharomyces cerevisiae, parámetro cinético.
ABSTRACT
In this work, the growth of the Saccharomyces cerevisiae yeast in molasses (virgin honey), is evaluated in the presence of a variable magnetic field (MF) of high frequency and low intensity. The kinetic parameters, such as the maximum specific speed of growth (μmax), the saturation constant (Ks) and the yield coefficient (Yxs), are evaluated. The tests are carried out in 400 ml fermentation vessels at 25 ºC (77 ºF) with an air flow of 1 vvm, approximately. A magnetic field having a frequency of 100 kHz and a field density of 250 mG is applied during 200 seconds. The results are obtained by comparing crops under the effect of the MF with those growing in normal environmental conditions (control). The results show that the magnetic field can affect the kinetic parameters of different form depending on the number of applications that are used, getting to generate increases of up to 20% in the specific speed of growth and until 28% in the yield, and reductions of until 26% in the value of the saturation constant.
Keywords: magnetic fields, saccharomyces cerevisiae, kinetic parameter.
INTRODUCCIÓN
A través de estudios con diferentes tipos de microorganismos, se ha encontrado que los campos magnéticos (CM) generan efectos de naturaleza variable sobre las células expuestas. Entre los efectos más importantes encontrados se cuentan: Cambios en la dirección de la migración de microorganismos (1,2,3,4,5) alteración del crecimiento y la reproducción (6,7,8), cambios en la síntesis de ADN (9), en la orientación de biomoléculas y biomembranas (10) y alteración del flujo de iones a través de la membrana plasmática (11,12). Estos efectos de manera individual o combinada generan como resultado neto, una modificación en la velocidad de reproducción celular (13,14,15,16).
Los efectos de los CM sobre la velocidad de crecimiento de los microorganismos, pueden ser para incrementarla o para disminuirla (17). En pocos estudios se ha evaluado la velocidad específica de crecimiento de microorganismos, en presencia de CM (18) o la velocidad de consumo de sustrato bajo la acción de CM (19).
Los parámetros cinéticos de crecimiento microbiano son las herramientas básicas para escalar los procesos biotecnológicos evaluados en de laboratorio, puesto que permiten predecir el desarrollo de la fermentación y evaluar los rendimientos y las productividades en los procesos (20). Los más importantes son: La velocidad específica máxima de crecimiento ((μmax), la constante de afinidad por el sustrato (Ks) y los coeficientes de rendimiento (Yxs, Yxp, etc).
Un efecto positivo sobre los parámetros cinéticos de crecimiento, permitiría disminuir los tiempos y aumentar los rendimientos y las productividades de procesos industriales como, la producción de cerveza, vino, lácteos fermentados y un sin número de procesos biotecnológicos tanto de la industria alimentaría como farmacéutica.
En el presente trabajo se evaluó el crecimiento de la levadura Saccharomyces cerevisiae creciendo en malaza (miel virgen), en presencia de un CM variable de alta frecuencia y extremadamente baja intensidad. Se evaluaron los parámetros cinéticos: Velocidad específica máxima de crecimiento (μmax), constante de saturación (Ks) y coeficiente de rendimiento de sustrato (Yxs). Se compararon los resultados obtenidos para cultivos bajo la acción de CM y cultivos creciendo en condiciones ambientales normales.
MATERIALES Y MÉTODOS
Microbiológicos
La cepa. Se utilizó una cepa comercial de Saccharomyces cerevisiae panaria, la cual se adquirió deshidratada en un supermercado local de la ciudad de Medellín. La cepa inicial fue reactivada inoculando la levadura al 3% p/v en un medio de cultivo líquido, durante 24 h a 30ºC. Este medio líquido previamente esterilizado a 121 ºC, contenía la siguiente concentración en % p/p: Miel virgen de caña 20; KH2PO4 0,2; (NH4)SO4 0,3; MgSO4 – 7H2O 0,1; extracto de levadura 0,4; peptona 0,36. Este además seria el medio de cultivo utilizado durante las fermentaciones. El cultivo por 24 h en medio líquido, se extendió sobre agar Saboureaud sólido y se dejó incubando a 30ºC, por 24 h como mínimo, para tener una provisión de la cepa, para los diferentes ensayos.
Condiciones de cultivo. Para las fermentaciones se partió de los microorganismos en los tubos en agar Saboureaud sólido. De estos tubos se tomaron las células por disolución en medio líquido, se llevaron a los recipientes de fermentación cada uno con 400 ml de medio líquido, buscando en cada caso que la absorbancia fuera entre 0,15 – 0,20 (0,6 g/l). El flujo de aire utilizado en cada fermentador fue de aproximadamente 1 vvm y la temperatura de 25ºC. Se tomaron dos fermentadores como controles (sin aplicación de CM) y a los otros dos se les aplicó el tratamiento con CM.
Determinaciones analíticas. Se tomaron muestras del caldo de fermentación a intervalos de tiempo. De estas muestras se hicieron análisis de azúcar y biomasa. Se adoptó el método de Peso seco para el análisis de biomasa (21) y para el análisis de azúcares se utilizó el método de antrona (22).
Magnéticos
Sistemas de aplicación de CM. El sistema para generación de CM se constituyó de dos componentes principales, el generador de señal y el sistema de bobinas. La medición del campo se realizó con un Gausimetro, marca F.W. Bell, modelo 9550, de efecto Hall. La señal eléctrica usada para alimentar las bobinas se basó en el sistema propuesto por Goldsworthy et al. (1999) (14), con algunas modificaciones. El generador entregó una onda cuadrada de amplitud pico – pico variable de 0 – 25 voltios, con frecuencia entre 10 – 120 kHz, la cual fue modulada en amplitud por otra onda cuadrada de frecuencia entre 0 – 3 kHz. La señal, la cual se monitoreó con un osciloscopio, se liberaba como una serie de pulsos con una relación marca - espacio 1:1 y con una frecuencia de repetición definido por la onda moduladora de 1 kHz. Esta señal se generó modulando una onda cuadrada de 100 kHz, con otra onda cuadrada de 1 kHz. La señal se entregaba a una bobina en el interior de la cual se colocaba un tubo de vidrio con el cultivo de levadura, por un tiempo de 200 s. La densidad de campo usada fue de 250 mG.
Diseño de las bobinas. Se diseñaron bobinas para una frecuencia de 100 kHz, las cuales se elaboraron en alambre trenzado, con un tubo de cartón como soporte interno, un diámetro interior de 8,2 cm, altura de 15 cm y núcleo de aire, en el interior del cual se colocaron los recipientes de fermentación durante el tratamiento con CM. Las dimensiones de las bobinas se definieron con base en las dimensiones de los recipientes usados para contener el cultivo durante la aplicación del campo, buscando que el cultivo se ubicara en la región donde el campo es más uniforme, es decir el centro geométrico del cilindro conformado por la bobina (23).
Modo de operación
Tipos de ensayos: Se aplicaron tratamientos con CM de la siguiente forma:
- Aplicación de un tratamiento antes de iniciar la fermentación sin aireación (Ensayo A).
- Aplicación de un tratamiento antes de iniciar la fermentación con aireación (Ensayo B).
- Aplicación de un tratamiento antes de iniciar la fermentación y otro a las 4 horas de iniciada, con aireación (Ensayo C).
- Aplicación de un tratamiento antes de iniciar la fermentación, otro a las 2 horas y otro a las 4 horas de iniciada, con aireación (Ensayo D).
Determinación de parámetros
El modelo cinético utilizado para ajustar los datos experimentales, fue el modelo de Monod. Las ecuaciones del modelo son las siguientes (24):
Se ajustaron los datos correspondientes a la fase de crecimiento logarítmico, es decir al tramo recto de la curva de crecimiento de biomasa y en el que se presenta la máxima velocidad específica de crecimiento. Para el ajuste de los datos y la determinación de los parámetros cinéticos, se utilizó el programa Berkeley Madona (Modelling and Analysis of Dynamic, versión 8.1 para windows, 2003).
Para observar el efecto de cada tratamiento se realizó un cultivo control de cada experimento y se comparó la diferencia porcentual (%ΔP) entre el tratamiento y el control. El %ΔP está definido como sigue:
Siendo Pt el valor de un parámetro P para el cultivo tratado y Pc el valor del parámetro para el control en un ensayo. Cada tratamiento y su control se hicieron por duplicado y se reporta el promedio, además del respectivo coeficiente de variación (c.v.).
RESULTADOS Y DISCUSIÓN
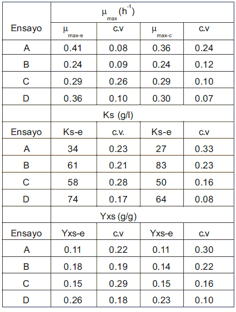
A partir del ajuste de los datos de crecimiento de biomasa y consumo de sustrato de cada cultivo y sus controles, se calcularon los parámetros cinéticos (μmax, Ks y Yxs) de cada uno. Estos resultados se presentan en la tabla No.1, con sus respectivos coeficientes de variación (c.v.).
Tabla 1. Parámetros cinéticos de S. cerevisiae creciendo en miel virgen bajo el efecto de diferentes tratamientos con CM.
Efectos del CM sobre la velocidad específica de crecimiento
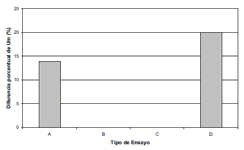
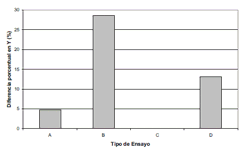
Con los datos de la tabla No. 1 se calculó el %ΔP de cada uno de los parámetros cinéticos. En la figura No. 1 se presenta la comparación del efecto de diferentes dosis de CM sobre el %Δμmax. En esta figura se observa que los tratamientos B y C, no generan diferencias apreciables con sus controles, en cuanto a la μmax. El ensayo A, presenta un %μmax de 13,89%, es decir al aplicar una dosis de CM al cultivo sin aireación, se genera un incremento en la velocidad específica máxima de crecimiento del 13,89%. De igual forma, el tratamiento D, presenta un %Δμmax de 20% con respecto al control. Estos resultados con inFcremento en μmax, se corresponden con los observados por Goldsworthy et al. en 1999 (14) y Zapata et al. en 2002 (13), quienes aplicaron CM de extremadamente baja intensidad y alta frecuencia, sobre S. cerevisiae, provocando estimulación en su crecimiento. La no existencia de diferencia en el μmax entre los tratamientos y los controles en el caso de los ensayos B y C, no se puede explicar con claridad, porque como se verá más adelante, en estos ensayos sí hay efectos sobre los otros parámetros cinéticos.
Figura 1. Efecto de diferentes dosis de CM sobre el %Δμmax en cultivos de Saccharomyces cerevisiae creciendo en malaza.
Efectos del CM sobre la constante de saturación
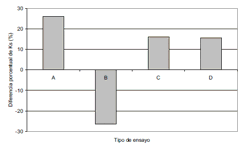
En la figura No. 2 se presenta la comparación del efecto de diferentes dosis de CM sobre el %ΔKs. En esta figura se observa que la aplicación de CM aumenta el valor de Ks, es decir hace que los cultivos de levadura disminuyan su afinidad por el sustrato, en todos los ensayos, excepto en el ensayo B (una dosis, con aireación). En este ensayo, la Ks del tratamiento es 26 % menor que la del control, es decir que en este caso, el microorganismo aprovecha el sustrato del medio mejor, cuando está siendo sometido en esta forma a la acción del CM. La posible explicación, es que bajo ciertas condiciones el CM genera un aumento de la permeabilidad de la pared celular del microorganismo, lo cual está asociado con la mayor entrada de algunos iones de importancia metabólica como Ca++ (17, 25, 11) y Na+ (12) y de esta forma se incrementa la actividad de las bombas de Na+/Ca++ o K+/Ca++, resultando en un mayor flujo de Ca++ a través de la membrana (26), manifestándose como una mayor afinidad por el sustrato.
Figura 2. Efecto de diferentes dosis de CM sobre el %ΔKs en cultivos de Saccharomyces cerevisiae creciendo en malaza.
Efectos del CM sobre el rendimiento
En la figura No. 3 se presenta la comparación del efecto de diferentes dosis de CM sobre el %ΔYxs. En esta figura se aprecia como el ensayo B, presenta un %ΔYxs del 28,57% respecto del control, lo que significa que el tratamiento B genera un rendimiento 28,57% mayor que el control. Esto está asociado con la mayor afinidad por el sustrato que se observó en la figura No. 2, puesto que al haber mayor afinidad por el sustrato, habrá un mejor aprovechamiento del mismo, manifestando mejores rendimientos. El mayor %ΔYxs con respecto al ensayo A, se explica en parte, a la turbulencia generada por la aireación, que provoca un mayor efecto del CM, porque combina el efecto entre el movimiento de las partículas en suspensión y la oscilación del campo (14,27). Además se ha observado que el CM puede afectar la adsorción-desorción del oxígeno en solución y de esta forma afectar la utilización del oxígeno por parte de los organismos vivos (28).
Figura 3. Efecto de diferentes dosis de CM sobre el %ΔYxs en cultivos de Saccharomyces cerevisiae creciendo en malaza.
CONCLUSIONES
Los CM afectan los parámetros cinéticos de crecimiento del microorganismo Saccharomyces cerevisiae. El efecto que se genera es de naturaleza compleja, puesto que las condiciones de tratamiento que son favorables para uno de los parámetros, no necesariamente los son para los otros. Esto se debe a que cada uno de los parámetros cinéticos está asociado con un aspecto metabólico diferente, y los CM no afectan de igual forma, todos los aspectos metabólicos.
Para las condiciones evaluadas en el presente estudio, las mejores para incrementar la producción de biomasa, las constituyen las utilizadas en el ensayo B (aplicación de una dosis de CM en un cultivo con aireación). Bajo estas condiciones se observa un incremento en el rendimiento (Yxs) y una disminución en la constante de saturación (Ks), mientras que la velocidad específica máxima de crecimiento (μmax) no presenta cambios apreciables.
Los CM interactúan con la presencia de oxígeno en el medio de cultivo, haciendo más marcado el efecto de los CM sobre los parámetros que dependen de la aireación, como es el caso del rendimiento de biomasa.
El conocer los efectos que tienen los CM sobre los diferentes parámetros cinéticos de crecimiento, permitirá en investigaciones futuras, evaluar sistemas que por medio de la aplicación de este tipo de efectos físicos, mejoren los rendimientos y las productividades de los procesos biotecnológicos.
AGRADECIMIENTOS
Los realizadores de este trabajo agradecen al CODI, de la Universidad de Antioquia, por la financiación del mismo. También a los estudiantes de la Facultad de Química Farmacéutica Hernán Restrepo, Jaime Cano, John Ramírez, Maryori Jiménez y Alex Giraldo.
REFERENCIAS BIBLIOGRÁFICAS
1. Adamkiewicz, V. W. Bassous, C., Morency, D., Lorranin, P. y Lepage, J. L. (1987) Magnetic response in cultures of Streptococcus mutans ATCC – 27607. Experimental Biology. 46: 127 – 132. [ Links ]
2. Mottas, D. y Lins, H. (1986) Motion of magnetotactic microorganims. J. exp. Biol. 121: 153 – 163. [ Links ]
3. Farina, M., Lins, H., Mottas, D. y Danon, J. (1983) Electron microscopy and ultrastructure of a magnetic microorganism. Rio de janeiro: Centro Brasilero de Pesquisas Físicas – CBPF – 022. 1 – 5. [ Links ]
4. Farina, M., Lins, H., Mottas, D. y Danon, J. (1982) Microorganismes magnetotactiques de la region de Rio de Janeiro. Rio de janeiro: Centro Brasilero de Pesquisas Físicas – CBPF – 039. 1 – 5. [ Links ]
5. Blakemore, R. y Frankel, R. (1981) Magnetic navigation in bacteria. Scientific American. 245: 58. [ Links ]
6. Jennison, M. (1937) The growth of bacteria, yeast and molds in a strong magnetic fields. Journal of Bacteriology. 33: 15 – 16. [ Links ]
7. Kimball, G. (1938) The growth of yeast in a magnetic fied. Journal of Bacteriology. 35 (2): 109 – 122. [ Links ]
8. Moore R (1.979) Biological effects of magnetic fields: studies with microorganisms. Can. J. Microbiol. 25: 1145 – 1151. [ Links ]
9. Liboff, A., Williams, T., Strong, D. y Wistair, R. (1.984) Time varying magnetic fields: Effect on DNA synthesis. Science. 223 (dic.): 818-820. [ Links ]
10. Maret, G. y Dransfeld, K. (1977) Macromolecules and membranes in high magnetic fields. Physica. (86 – 88B): 1077 – 1083. [ Links ]
11. Conti, P., Gigante, G. E., Alesse, E., Fieschi, C., Reale, M. y Angeletti, P. U. (1985) A role for Ca2+ in the effect of low frequency electromagnetic field on the blastogenesis of human lymphocytes. FEBS Letters. 181 (1): 28 – 32. [ Links ]
12. Collis, C. S. y Segal, M. B. (1988) Effects of pulsed electromagnetic fields on Na+ fluxes across stripped rabbit colon epithelium. Journal of applied physiology. 65: 124 – 130. [ Links ]
13. ZAPATA J. E., MORENO G. y MARQUEZ E. J. (2002) Efectos de los campos magnéticos sobre el crecimiento de Saccharomyces cerevisiae. Interciencia. 27 (10): 1 – 7. [ Links ]
14. Goldsworthy, A., Whitney, H. y Morris, E. (1.999) Biological effects of physically conditioned water. Water Research. 33 (7): 1618-1626. [ Links ]
15. Pothakamury, U., Barletta, B., Barbosa, G. y Swanson, B. (1993) Inactivación de microorganismos en alimentos usando campos magnéticos oscilantes. Revista española de ciencia y tecnología de alimentos. 33 (5): 479-489. [ Links ]
16. Gerencser, V., Barnothy, M. y Barnothy, J. (1.962) Inhibition of bacterial growth by magnetic fields. Nature. 539-541. [ Links ]
17. Pothakamury U., Barbosa G. y Swanson B. (1993b) Magnetic – Fields Inactivation of Microorganisms and Generation of Biological Changes. Food Technology. 47: 85- 93. [ Links ]
18. Hirano M., Ohta A. y Abe, K. (1.998) Magnetic fields effects on photosynthesis and growth of the cyanobacterium. Journal of fermentation & bioengineering. 86 (3): 313 - 316. [ Links ]
19. Jung, J. T. y Sofer, S. (1997) Enhancement of phenol biodegradation by south magnetic field exposure. Journal of Chemical Technology & Biotechnology. 70 (3): 299-303. [ Links ]
20. Duarte, A. (1998) Introducción a la Ingeniería Bioquímica. Ed. Universidad Nacional de Colombia: Bogotá. 198 p. [ Links ]
21. García, M. J., Zúñiga, M. y Uruburu, F. (1991) Métodos directos de medida del crecimiento microbiano. Alimentaria. 31 – 34. [ Links ]
22. Castaño, H. y Gómez, J. Determinación de la cinética de una fermentación alcohólica utilizando como sustrato miel. Medellín (1995). Trabajo de grado (Ingeniero químico). Universidad Nacional de Colombia. Facultad Nacional de Minas. [ Links ]
23. Kaufman, M. y Seidman, A. (1982) Manual para ingenieros y técnicas en electrónica. Mexico: McGrawhill. [ Links ]
24. Blanch, H. y Clark, D. (1996) Biochemical engineering. Marcel Dekker, inc: New York. 702 p. [ Links ]
25. Dihel, L., Smith, J. y Middaugh, R. (1985) Effects of extremely low frequency electromagnetic field on the cell division rate and plasma membrane of Paramecium tetraurelia. Bioelectromagnetics. 6: 61 – 71. [ Links ]
26. Liboff, A. (1985) Cyclotron resonance in membrane transport. Schawn serie A: Life sciences. 97: 281 – 296. [ Links ]
27. Higashitani, K., Okuhara, K. y Hatade, S. (1992) Effects of magnetics fields on stability of nonmagnetic ultra fine colloidal particles. Journal of colloid and interface science. 152 (1): 125 – 131. [ Links ]
28. Ueno, S. y Harada, K. (1982) Redistribution of dissolve oxygen concentration under strong DC magnetic fields. IEEE Transactions on magnetics. 18 (6): 1704 – 1706. [ Links ]
Recibido: Septiembre 30 de 2004; Aceptado: Febrero 8 de 2005
* Autor a quien debe dirigir la correspondencia: joseedgar_4@hotmail.com