Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.12 no.2 Medellín Jul./Dec. 2005
UTILIZACIÓN DE RESIDUOS DE PLÁTANO PARA LA PRODUCCIÓN DE METABOLITOS SECUNDARIOS POR FERMENTACIÓN EN ESTADO SÓLIDO CON EL HONGO Lentinus crinitus
UTILIZATION OF PLANTAIN WASTE FOR THE PRODUCTION OF SECONDARY METABOLITES BY SOLID SUBSTRATE FERMENTATION USING THE FUNGI Lentinus crinitus
GRANDA R. Diana M.1, MEJÍA G. Amanda I.1* y JIMÉNEZ T. Gloria A.2
1 Grupo Ciencia de los Materiales. Facultad de Ciencias Exactas. Universidad de Antioquia AA 1226 Medellín-Colombia
2 Laboratorio de Fisiología y Ecología Microbiana. Universidad Libre de Bruselas. 642 rue engeland 1180. Bruselas, Bélgica
* Autor a quien se debe dirigir la correspondencia: amejia@quimbaya.udea.edu.co
Recibido: mayo 17 de 2005 Aceptado: agosto 23 de 2005
RESUMEN
En este artículo se presenta la producción de metabolitos secundarios de interés farmacéutico y alimentario obtenidos de los residuos del cultivo de plátano al emplearse como sustrato en un proceso de fermentación en estado sólido con el hongo de la podredumbre de la madera Lentinus crinitus. La producción de metabolitos se determina durante el crecimiento del microorganismo por un periodo de 21 días, en un sistema de fermentación conformado por 7 combinaciones de sustrato: tallo-fruto, hojas-fruto, hojas-tallo, hojas, tallo, fruto y hojas-tallo-fruto. La mejor combinación para la producción de las enzimas ligninoperoxidasa (LiP) y manganesoperoxidasa (MnP) es la conformada por hojas-tallo de plátano Musa paradisiaca. Esto es importante para aprovechar el enorme potencial que tienen estos residuos para la producción de enzimas peroxidasas, las cuales tienen muchas aplicaciones. No existen reportes anteriores en la literatura acerca de la producción de la enzima ligninoperoxidasa por el hongo Lentinus crinitus. En los sistemas donde se obtiene actividad enzimática: (tallo-fruto, hojas-fruto, hojas-tallo y hojas-tallo-fruto) se evalúa la presencia de los compuestos aromáticos ácido ferúlico, vainilla, ácido vainillínico y eugenol en los días 11, 16 y 21. Los análisis químicos se realizan por cromatografía líquida de alta eficiencia (HPLC). En los sistemas de mayor actividad enzimática conformados por la mezcla de hojas-tallos, los productos aromáticos de interés se detectaron en muy baja concentración. En el sistema conformado por hojas-frutos donde solo se destaca la producción de la enzima LiP, se encuentra ácido ferúlico, vainilla, ácido vainillínico y eugenol en cantidades importantes durante el día 16.
Palabras clave: fermentación en estado sólido, vainilla, eugenol, desechos del cultivo de plátano, Lentinus crinitus
ABSTRACT
This paper presents the production of secondary metabolites with pharmaceutical and alimentary interest from plantain waste used as substrate in a solid state fermentation process with the white root fungi Lentinus crinitus. The production of metabolites is studied during the growth of the microorganism for a period of 21 days, in a system conformed by 7 substrate combinations: stem-fruit, leaves -fruit, leaves -stem, leaves, stem, fruit and leaves-stem-fruit. The best combination for the production of enzymes -lignin peroxidase (LiP) and -manganese peroxidase (MnP) is conformed by leaves-stem of plantain Musa paradisiaca. It is then important to take advantage of the huge potential that these residues have for the production of peroxidase enzymes, which have many applications. On the other hand, the use for the first time of the fungi Lentinus crinitus in such production constitutes a novel biotechnological approach. In the systems where there is enzymatic activity (stem-fruit, leaves-fruit, leaves-stem and leaves-stem-fruit) the aromatic compounds: ferulic acid, vanilla, vanillin acid and eugenol are determined at 11, 16 and 21 days by high performance liquid chromatographic (HPLC). For the systems with the best enzymatic activity (leaves-steam), the concentration of aromatic products is low. In the system conformed by leaves-fruit, where only the production of the LiP enzyme is important, significant concentrations of ferulic acid, vanilla, vanillin acid and eugenol are found during the sixteenth day.
Keywords: solid state fermentation, vanilla, eugenol, plantain waste, Lentinus crinitus
INTRODUCCIÓN
El plátano (Musa paradisiaca) es una fruta tropical de alto consumo especialmente en países de África, Latinoamérica y el Caribe (1-3). Colombia es el segundo productor mundial, después de Uganda, alcanzando en el 2003 una producción de 2.925.000 toneladas (1). Se estima que del área cultivada en plátano en Colombia, un 87%, se encuentra como cultivo tradicional asociado con café, cacao, yuca y frutales, y el restante 13% equivalente a 409.330 hectáreas es monocultivo tecnificado (3).
La práctica agronómica del corte de la planta de plátano para que crezca otra, genera día a día grandes cantidades de residuos que son descartados cerca de las orillas de los ríos o quebradas y en los caminos, causando un problema ambiental (1,2). 1,2En los últimos años ha surgido un fuerte interés por darle un manejo adecuado y eficiente a los residuos agroindustriales (3-6) y aprovecharlos para el desarrollo de bioprocesos en los que se involucran como sustratos para la producción de ácidos orgánicos, etanol, enzimas y otros metabolitos secundarios importantes para la industria farmacéutica y alimentaria (2-5,7-17)
La fermentación en estado sólido (FES) es una técnica aplicada para la transformación y bioconversión de residuos agroindustriales. Ofrece notables ventajas biotecnológicas, como la alta concentración de metabolitos obtenidos, estabilidad de los productos y adaptabilidad de los microorganismos - especialmente los hongos- al sistema, con bajo contenido de agua libre. (2,4-6,9,10,12-14,16,18,19)
Los residuos de las cosechas de plátano son en su mayoría hojas, pseudotallos y restos de fruto. Las hojas y los pseudotallos contienen niveles importantes de ligninocelulosa, mientras que los restos de fruto presentan en su composición gran cantidad de micronutrientes(1,2,8,12,20-22). Estas propiedades hacen de los residuos sustratos eficientes para algunos hongos basidiomicetos, especialmente hongos de la podredumbre blanca, los cuales producen enzimas ligninolíticas capaces de degradar completamente la lignina, polímero conformado por p-hidroxi-cinnamil alcohol, y metabolizar los monómeros fenólicos en compuestos aromáticos de interés tales como vainilla, ácido ferúlico y eugenol. Todos estos metabolitos son importantes para la industria alimentaria, farmacéutica y de colorantes. (2,4,5,8,9,12,20-28)
En este trabajo se evalúa la capacidad del hongo Lentinus crinitus para producir enzimas ligninolíticas como la ligninoperoxidasa (EC 1.11.1.14), la manganesoperoxidasa (EC1.11.1.13) y la producción de compuestos aromáticos, en un sistema de fermentación en estado sólido sobre los residuos de plátano Musa paradisiaca .
MATERIALES Y MÉTODOS
Cultivo y preparación del inóculo
La cepa THC 5 Lentinus crinitus pertenece al herbario Universidad de Antioquia –HUA- Hongos de Colombia, fue recolectada en Colombia Departamento de Antioquia, Municipio de Caldas, en predios del SENA el 12 de Diciembre de 2003 y clasificada por la experta Dra. Ana Esperanza Franco Molano. Se inocula una pequeña porción interna del carpóforo en caja de petri con agar malta para obtener el micelio. Los cultivos se incuban sobre agar malta por 7dias a 23°C +/- 1°C. Se almacena a 4°C y se realizan subcultivos cada 30 días.
Preparación del sistema de fermentación en estado sólido (FES), inoculación y condiciones del cultivo
Los residuos de plátano recolectados, se separan en hojas, pseudotallos y fruto, se cortan en trozos de +/-2 cm2, se secan a 80°C durante 24 horas. Se evalúan siete combinaciones de sustrato: tallo-fruto, hojas-fruto, hojas-tallo, hojas, tallo, fruto y hojastallo- fruto. En frascos de vidrio redondos de 180 ml se adicionan 5 gramos de sustrato y 28 ml de buffer tartrato de sodio a pH 5.0. Se esterilizan en autoclave a 15 libras de presión y 121°C. Cada uno de los frascos se inocula con un fragmento de agar impregnado con micelio de Lentinus crinitus, de tamaño 0.5 x 0.5 cm2. Los cultivos se incuban a 23°C durante 21 días en un sistema de agitación con rotación continua. La primera muestra para análisis se toma después del día 11 y se repite la operación cada 5 días.
Para cada combinación de sustrato se hacen controles sin inocular el hongo y se someten a las mismas condiciones experimentales. Todas las combinaciones se realizan por triplicado.
Métodos de análisis
Se toma un mililitro de medio líquido libre de cada uno de los sistemas de fermentación en estado sólido, se centrifuga a 6000 rpm por 30 min y se filtra por membrana de 0.45 µm. En el medio extracelular se analiza la actividad de la LiP y de la MnP y se determinan los compuestos aromáticos.
Determinación de la actividad de la MnP
Se realiza a 334 nm, por 5 minutos. Volumen total en la cubeta: 900 µL.
Buffer Tartrato de Sodio 0.3 mM, pH 5, 30ºC: se completa a 650µL de acuerdo con el volumen de medio extracelular tomado (varía entre 15–50µL).
Cofactor: MnSO4 1mM: 75 µL
Sustrato: vainillinacetona-butenona 1mM: 75 µL
Medio extracelular entre 15 – 50 µL
Solución de H2O2 (1%): 50 µL.
Determinación de la actividad de la LiP.
Se realiza a 310 nm, por 5 minutos.
Volumen total en la cubeta: 900 µL
Buffer tartrato de sodio 0.150 M, pH 3, 30ºC: 750 µL, varía según volumen de medio extracelular tomado.
Medio extracelular: entre 15 - 50 µL
Sustrato: alcohol veratrílico 10 mM: 50 µL
Medio extracelular entre 15 – 50 µL
Solución de H2O2 (1%): 50 µL.
Las unidades de actividad para la LiP se definen como la cantidad de enzima requerida para oxidar 1 µmol de alcohol veratrílico por minuto. Una unidad de MnP se define como la cantidad de enzima requerida para oxidar 1 µmol de Mn+2 a Mn+3 en un minuto y reportada sobre la base de gramos de sustrato seco (29).
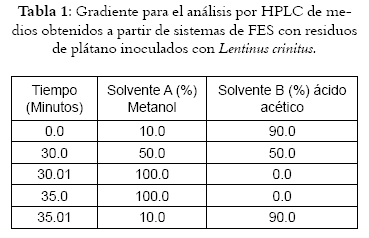
Los compuestos aromáticos se analizan por HPLC, en un equipo Waters 996 con arreglo de diodos, con una columna C18. Los componentes de la fase móvil son ácido acético al 0.05% en agua destilada y metanol grado HPLC. Para una óptima separación de las sustancias se emplearon gradientes de la fase móvil (Véase tabla 1) (30).
Para el análisis cualitativo de los compuestos aromáticos se utilizaron estándares de ácido ferúlico, vainilla, acido vainillínico, eugenol y guayacol, calidad grado reactivo. Los tiempos de retención y la longitud de onda para la detección de cada uno de los compuestos son los siguientes:
Acido ferúlico: 32.66 minutos a 320 nm
Vainilla: 27.32 minutos a 310 nm.
Ácido vainillinico: 24.23 minutos a 288 nm
Eugenol: 42.2 minutos a 230 nm
Guayacol: 30.56 minutos a 275 nm
RESULTADOS Y DISCUSIÓN
Producción de enzimas
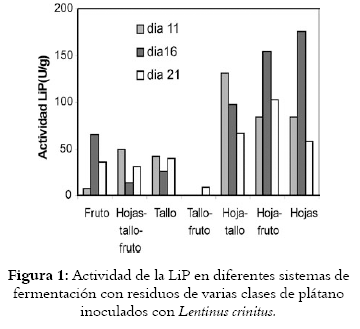
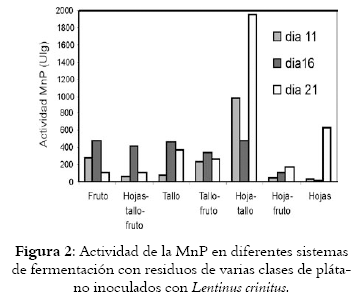
La actividad de las enzimas LiP y MnP se muestra en cada uno de los siete sistemas. (Véanse figuras 1 y 2 respectivamente).
Análisis de la actividad enzimática del Lentinus crinitus sobre:
Residuos de fruto: la producción de enzimas LiP y MnP sobre biomasa del fruto de plátano tiene máxima actividad para la LiP el día 16 (65,03 U/g), mientras que la producción de MnP es mucho mayor el mismo día (486,29 U/g).
Residuos de hoja-tallo-fruto: la actividad es 49,23 UI/g para la LiP el día 11 y la máxima actividad para la MnP es 413,90 UI/g el día 16 de fermentación.
Residuos de tallo: la actividad máxima para la LiP es 41,80 UI/g a 11 días de fermentación, disminuyendo a los días 16 y 21 días. La producción de MnP alcanza su máximo nivel el día 16 con 470,55 UI/g y disminuye a 373,2983 UI/g el día 21 de fermentación.
Residuos de tallo-fruto: la actividad para la LiP es baja, de solo 8,25 UI/g al día 21, mientras que la producción de MnP el día 16 es de 342,55 UI/g.
Residuos de hojas-tallos: las actividades de la LiP y MnP en éste sistema muestran un incremento importante. La LiP a los 11 días alcanza 130,68 UI/g, disminuye a 97.03 UI/g el día 16, y a los 21 días 66.27 UI/g. Este valor bajo para este sistema, es más alto que el obtenido con los anteriores sistemas. La producción de MnP alcanza una actividad enzimática alta, de 969.12 UI/g, el día 11, que disminuye el día 16 a 481.57 UI/g y finalmente alcanza su máximo valor a los 21 días de 1955.88 UI/g, superando la cantidad producida de esta enzima en los demás sistemas.
Residuos de hojas-fruto: la actividad de la LiP el día 16, es de 153.80 UI/g y el día 21 es de 102.81 UI/g, producciones altas comparadas con las actividades alcanzadas para esta enzima en los demás sistemas. Para la MnP se obtienen actividades muy bajas.
Residuos de hojas: se obtiene actividad importante de la LiP, alcanzando el valor más alto entre todos los sistemas evaluados de 175.48 UI/g el día 16 de fermentación. Después se observa una disminución a 58.21 UI/g. En la producción de la MnP, la concentración aumenta a 628.24 UI/g durante el último día de fermentación.
Los sistemas de mayor producción: de la enzima LiP son hoja-tallo, hoja-fruto, hojas y para la MnP el mejor en el sistema tallos-hojas.
Producción de compuestos aromáticos
La evaluación de compuestos aromáticos se realiza en los cuatro sistemas que se describen con la mayor producción de la LiP y de la MnP, formados por combinaciones de hojas, tallos o fruto. Lo anterior porque se espera que los productos obtenidos por la degradación de la lignina sean compuestos de interés por su composición aromática. La determinación se hace por cromatografía líquida de alta eficiencia -HPLC- los días 11, 16 y 21.
El día 11 sólo se encuentra eugenol en los sistemas. No se detecta la presencia de ninguno de los otros compuestos empleados como estándares. En el día 16 se encuentran 0.6 ppm de ácido ferúlico, 0.04 ppm de vainilla; 0.6 ppm de ácido vainillínico y 254 ppm de eugenol, en el sistema conformado por la combinación de hojas-fruto; los demás sistemas tienen mas baja proporción de ellos. El día 21 en todos los sistemas sigue encontrándose eugenol, que disminuye considerablemente a 30.6 ppm en el sistema conformado por la combinación de hojasfruto, así como el ácifo ferúlico que se detecta aún pero en muy baja concentración. La vainilla y el acido vainillínico ya no presentan pico característico indicando su ausencia en el sistema.
CONCLUSIONES
El Lentinus crinitus además de ser un basidiomiceto degradador de lignina, es un hongo comestible y con propiedades medicinales, sin embargo, es un hongo muy poco estudiado, lo que motivó su investigación con el fin de evaluar su capacidad para la producción de metabolitos secundarios de interés farmacéutico y alimentario.
Para evaluar el potencial de los residuos de plátano que se emplean como sustrato por fermentación en estado sólido en la producción de metabolitos secundarios con el hongo Lentinus crinitus, se determina la producción de enzimas ligninolíticas extracelulares Ligninoperoxidasa –LiP- y Manganesoperoxidasa –MnP- en tres días diferentes del proceso de fermentación. Se encuentra que en el sistema conformado por hojas-tallos sobresale una alta producción de ambas enzimas. En la combinación de hoja-fruto se destaca la producción de la enzima LiP. Los sistemas conformados por la combinación tallo-fruto y hojas-tallo-fruto muestran menor actividad.
Los residuos de plátano involucran la presencia de hojas, vástagos, frutos y tallos, todo esto genera una cantidad apreciable de biomasa que tiene la ventaja de ser susceptible de recogerse con la fruta en el momento de la cosecha. Es una práctica agronómica el corte de la planta para generar otra nuevamente (2)
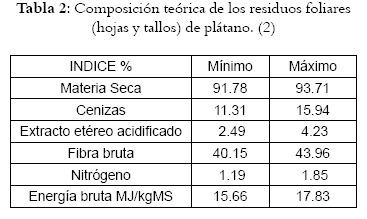
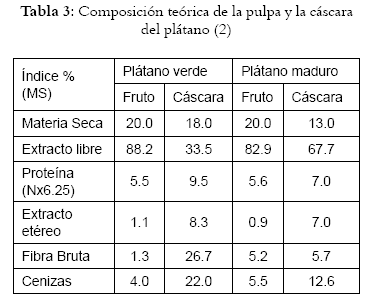
Estudios de estos residuos han arrojado la siguiente composición: (Véanse tabla 2 y 3)
Tanto la composición de los residuos de hojas y tallos como la de los frutos del plátano, presentan un porcentaje de fibra bruta alto, al igual que su porcentaje de proteína, lo que hace necesario que todo el potencial que presentan estos residuos sea aprovechado adecuadamente.
La mejor combinación para la producción de las enzimas ligninoperoxidasa y manganesoperoxidasa es la conformada por hojas-tallos de plátano Musa paradisiaca. Estas enzimas tienen muchas aplicaciones en el campo del tratamiento de aguas residuales, en el proceso de blanqueamiento durante la elaboración del papel, en la degradación de colorantes, etc. Este sustrato para la producción de estas enzimas resulta muy económico, se aprovechan residuos de poco valor comercial y no requiere la adición de medios enriquecidos para favorecer el desarrollo del microorganismo, haciendo muy viable económicamente la purificación de estas enzimas y su comercialización.
La investigación básica sobre los mecanismos de degradación de la lignina, la fisiología, enzimología y biología molecular han sido estudiadas principalmente con el hongo Phanerochaete chrysosporium, (35) y ha servido como modelo para hacer comparaciones cuando se evalúan las características de otras cepas menos estudiadas. El proceso de degradación de la lignina involucra un grupo de enzimas extracelulares denominadas ligninoperoxidasa, lacasa y manganesoperoxidasa. La estructura de la lignina es estereoirregular, muy heterogénea y no contiene uniones hidrosolubles, esto significa que las enzimas deben ser oxidativas y tener un mecanismo de ataque no especifico (35,36). Las enzimas ligninoperoxidasa (LiP) y la manganesoperoxidasa (MnP) son hemo glicoproteínas las cuales requieren peroxido como oxidante (31,32). La LiP oxida subestructuras fenólicas y no fenólicas de la lignina por la remoción de un electrón, generando un radical catión el cual descompone químicamente la estructura (31,32).31,32
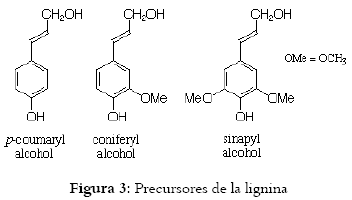
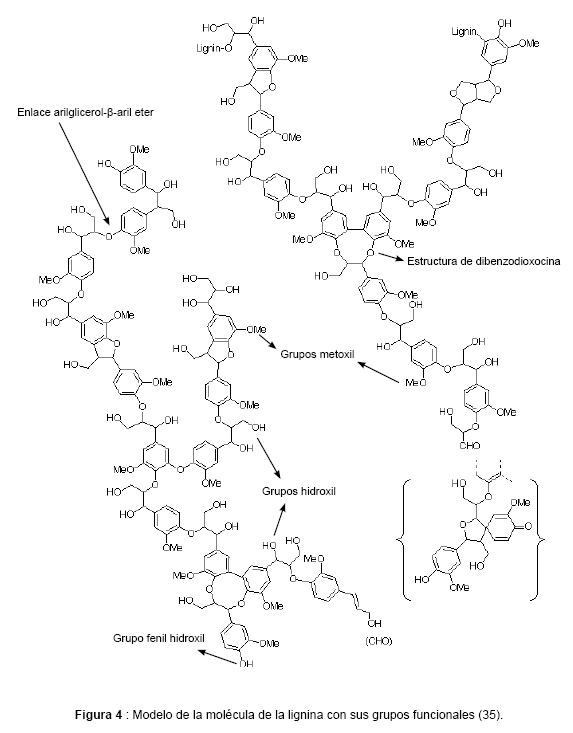
Los enlaces que predominan en la estructura de la lignina son del tipo éter principalmente arilglicerol- ß-aril éter, mientras que las unidades de fenil propano están unidas por enlaces carbono-carbono. Entre los grupos funcionales que le aportan diferentes propiedades a la lignina están: los grupos fenólicos libres, grupos hidroxil, metoxil, hidroxil benzilicos, alcohol benzilicos y grupos carbonilitos (33). (Véase figura 3 y 4)
Las anteriores características hacen de la molécula de la lignina una estructura muy compleja, de forma que no es sorprendente que solo relativamente pocos microorganismos, principalmente hongos, posean las enzimas necesarias para llevar a cabo su degradación (34). También es importante destacar que anteriormente no se tienen reportes en la literatura de la producción de la enzima ligninoperoxidasa por el hongo Lentinus crinitus.
Evaluando los compuestos encontrados en las muestras de hojas-fruto se puede sugerir que el Lentinus crinitus libera de la estructura de la lignina cantidades de eugenol que es bioconvertido a ácido vainillínico, produciendo en su ruta el acido ferúlico y la vainilla (30,36).
Los compuestos aromáticos son extremadamente importantes en las industrias de alimentos, farmacéuticas, de cosméticos y alimentos para animales, para obtener productos de sabor y olor característicos. La oferta de aromas naturales en el mundo es muy inferior a la demanda, por lo tanto el costo de los aromas naturales es elevado, lo que hace recurrir al uso de los sintéticos (9,37,38). Los aromas y fragancias naturales generalmente son extraídos a partir de animales o plantas por procedimientos físicos, obteniéndose una mezcla muy compleja. Los compuestos sintéticos imitan a los naturales y son similares desde el punto de vista de sus características fisicoquímicas y parcialmente en sus características sensoriales; pero las características sensoriales de la mezcla compleja es imposible de reproducir en las fragancias sintéticas (9,37-39)
Las leyes alimentarias, farmacéuticas y cosméticas discriminan entre aromas naturales y sintéticos. Por esta razón, se restringe menos la concentración que puede usarse en las aplicaciones mencionadas y comandan los más altos precios del mercado, compensando sus altos precios (9,39). Este favorecimiento por los aromas naturales en relación con sus similares sintéticos, también es a causa del incremento en un estilo de vida saludable y nutricionalmente conciente. El desarrollo y la innovación permanente de nuevos productos con éstas características, buscan también dar respuesta a las exigencias sensoriales del consumidor (olor, color, sabor, entre otras) (9).
El ácido ferúlico es un compuesto fenólicos, producto bien conocido de la degradación de la lignina por los basidiomicetos y algunas bacterias (21), éste se encuentra unido a las estructuras de arabinosa a través del carbono 1 y unido a la lignina a través del carbono 5 (21), esto hace que esté presente en las plantas y frutos que contienen un alto porcentaje de fibra y lignina en su composición. Algunos microorganismos tienen la capacidad de emplear el ácido ferúlico como fuente de carbono generando así vainilla y ácido vainillinico como productos (21,37); lo anterior convierte al ácido ferúlico en un compuesto aromático de alto interés, ya que a partir de él se puede llegar a compuestos como la vainillina natural.
La vainilla sintética obtenida a partir de desechos de la lignina (con un rendimiento del 10%), tiene un valor de U.S $15ºº/Kg, mientras que la vainilla natural (extraída de las vainas de vainilla) tiene un valor 300 veces mayor que la sintética: U.S $4500ºº/Kg (40).
En cuánto a los compuestos aromáticos que se pueden producir por rompimiento de las unidades fenil-propano de la lignina por las enzimas ligninolíticas, se supone que a mayor producción de enzimas más rápida es la degradación de la lignina hasta los compuestos más simples. En los sistemas de mayor actividad enzimática investigados como son los conformados por la mezcla de hojas-tallos, la detección de productos aromáticos de interés fue baja. En el sistema conformado por hojas-frutos donde solo se destaca la producción de la enzima LiP, el día 16 estos mismos sistemas muestran la presencia de ácido ferúlico, vainilla, ácido vainillínico y eugenol, que aparecen en cantidades apreciables.
La detección de los compuestos aromáticos de interés depende de un proceso de adaptación por parte del microorganismo al medio, y de una actividad específica que produzca una degradación gradual de la lignina y no conduzca además a la degradación de los mismos compuestos de interés. Esto es complejo de lograr, requiere un estudio de investigación de la cinética, y de caracterización molecular para explicar por qué posiblemente la combinación en la que se obtiene mejor actividad enzimática conformada por hojas-tallos, detecta menos compuestos aromáticos de interés, por poseer altas actividades de dos enzimas inespecíficas potentes como la LiP y la MnP. Mientras que la combinación que presenta la mayor cantidad de compuestos aromáticos es la conformada por hojas-frutos, la cual presenta una importante producción de LiP y baja actividad de MnP.
La biotecnología permite a través de una fermentación en estado sólido con hongos endémicos obtener eugenol como compuesto aromático natural, en concentraciones iinteresantes. La concentración de eugenol presente en los sistemas permite pensar en la posibilidad de que este compuesto sea empleado como materia prima en la producción de otros compuestos aromáticos como vainilla y acido ferúlico, siendo estos igualmente naturales. Con los resultados obtenidos en el presente estudio a nivel de laboratorio, se demuestra la importancia de continuar investigando sobre nuestra biodiversidad en hongos, ya que estos pueden representar un potencial importante para ser empleados en procesos de degradación de residuos agroindustriales y en la producción de metabolitos secundarios de interés para la industria farmacéutica y alimentaria.
AGRADECIMIENTOS
Agradecemos a la Universidad de Antioquia Programa de Gestión Tecnológica por financiar esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. A García, Instituto de investigaciones porcinas. Composición Quimica de la harina de residuos foliares del plátano (Musa paradisiaca). [Sitio en Internet] Disponible en: http://www.sian.info.ve/porcinos/publicaciones/ rccpn/REV32/ARISTIDE.htm. Consultado: 5 de marzo de 2005. [ Links ]
2. Shah MP, Reddy GV, Banerjee R, Ravindra Babu P, Kothari IL. Microbial degradation of banana waste under solid state bioprocessing using two lignocellulolytic fungi (Phylosticta spp. MPS-001 and Aspergillus spp. MPS -002). Process Biochem 2005; 40(1): 445-451 [ Links ]
3. Gunther L, Benno K, Marianne N. Transformation of vegetable waste into value added products: (A) the upgrading concep; (B) practical implementations. Bioresour Technol 2003; 87(2): 167-198. [ Links ]
4. Howart RL, Abotsi E, Jansen van Rensburg EL, and Howard S Lignocellulose biotechnology: issues of bioconversion and enzyme production. Afr J of Biotechnol 2003; 2(12): 602-619. [ Links ]
5. Pandey A, P Selvakumar, Carlos RS, Poonam N. Solid state fermentation for the production of industrial enzymes. J Basic Microbiol 2000; 40:187-197 [ Links ]
6. Pandey A. Solid-state fermentation. Biochem Engin J 2003; (13):81-84. [ Links ]
7. Arboleda C, Castrillón C, Newar A, Segura F, Mejía A. Evaluación del Capacho y la Tusa de Maíz como Soporte y Sustrato para la Fermentación en Estado Sólido -FES- del Phanerochaete Chrysosporium. Vitae 2003; 10(1):25-33 [ Links ]
8. Krishna C, Chandrasekaran M. Banana waste as substrate for alfa-amilasa production by Bacillus subtilis (CBTK 106) under solid-state fermetation. Appl Microbiol Biotechnol 1996; 46(2):106-111. [ Links ]
9. Lomascolo A, Stentelaire C, Asther M, Lesage-Meessen L. Basidiomycetes as new biotechnological tools to generate natural aromatic flavours for the food industry. Trends in Biotechnol 1999; 17(7): 282-289. [ Links ]
10. Nigam P, Singh D. Solidstate (substrate) fermentation systems and their applications in biotechnology. J Basic Microbiol 1994; 34(6): 405-423. [ Links ]
11. RJ Braddock. By-Products of Citrus Fruit. Food Technol. 1995; 49(9):74-77. [ Links ]
12. Reddy GV, Babu PR, Komaraih P, Roy KRRM and Kothari IL. Utilization of banana waste for the production of lignolytic and cellulolytic enzymes by solid substrate fermentation using two Pleurotus species (P. ostreatus and P. sajor-caju). Process Biochem 2003; 38(10):1457-1462. [ Links ]
13. Rodriguez S, Sanroman MA. Application of solidstate fermentation to ligninolytic enzyme production. Biochem Eng J 2005; 22(3): 211-219. [ Links ]
14. Sanchez A, Ysunza F, Beltran-García M and Esqueda M. Biodegradation of Viticulture wastes by Pleurotus: A Source of Microbial and Human food and its potential use in animal feeding. J of Agric and Food Chem 2002; 50(9):2537-2542. [ Links ]
15. Soler C, Martín VL Wichers H. International Astronautical Congress. En: IAF, editor. FOOD: Fungus on Orbit Demonstration. 50ª ed. Ámsterdam: International Astronautical Federation Christophe Lasseur. 1999. p.1-35. [ Links ]
16. Robinson T, Singh D, and Nigam P. Solid-state fermentation: a promising microbial technology for secondary metabolite production. Appl Microbiol Biotechnol 2001; 55(3): 284-289. [ Links ]
17. Krings U, Berger RG. Biotechnological production of flavours and fragrances. Appl Microbiol Biotechnol 1998; 49(1):1-8. [ Links ]
18. Barrios Gonzalez J, Mejía A. En: Biotechnol Annual Review ed. El-Gewely; 1998.p. 85-237. [ Links ]
19. Holker U, Hofer M, Lenz J. Biotechnological advantages of laboratory-scale solid-state fermentation with fungi. Appl Microbiol Biotechnol 2004; 64(2):175-186. [ Links ]
20. Bumpus JA, Aust S. Biodegradation of environmental pollutants by the rot fungus Phanerochaete chrysosporium involvement of the lignin-degrading system. Bioessays 1987; 6(4):166-170. [ Links ]
21. Oddou J, Stentelaire C, Lesage-Meessen L, Asther M, Colonna Ceccaldi B. Improvement of Ferulic acid bioconversion into vanillin by use of high-density cultures of Pycnoporus cinnabarinus. Appl Microbiol Biotechnol 1999; 53(1):1-6. [ Links ]
22. Jiménez GA, Mejía A, López B. Actividad de las enzimas ligninoliticas del Phanerochaete chrysosporium y su variación con la adición de Mn2+. Rev Acad Colomb Cienc 1999; 23(89):587-594. [ Links ]
23. Mejía A, López B, Mulet A. Biodegradation of poly (vinylalcohol) with enzymatic extracts of phanerochaete chrysosporium. Macromolecula Chem Phys Symposio. 1999; 148:131-148. [ Links ]
24. Mejía AL, López OB, Hess M. Bioconversion of poly (vinylalcohol) to vanillin in a Phanerochaete chrysosporium culture medium. Mater Res Innov 2003; 7(3): 144-148. [ Links ]
25. Paszczynski A, Crawford RL. Potential for bioremediation of xenobiotic compounds by the white-rot fungus Phanerochaete chrysosporium. Biotech Progress 1995; 11:368-379. [ Links ]
26. Cohen R, Persky L, Hadar Y. Biotechnological applications and potential of wood-degrading mushrooms of the genus Pleurotus. Appl Microbiol Biotechnol. 2002; 58(5):582-594. [ Links ]
27. Segura F, Mejía A, López B. Obtention of Secondary Metabolites by the Addition of Polymerics Substrates to Submerged Culture Mediums of Phanerochaete Chrysosporium. Bioprocess and Biosyst Eng. Sometida a publicación. 2003 [ Links ]
28. Tien M, Kirk T. Lignin degrading enzime from the hymenomycete Phanerochaete chrysosporium burds. Science 1983; 221(4611): 661-663. [ Links ]
29. Mejía AI. Determinación de la Biodegradabilidad del polivinilalcohol (PVOH) y del polietilvinilalcohol (EVOH) con las enzimas extracelulares del hongo Phanerochaete chrysosporium. Valencia (España): Universidad Politécnica de Valencia; 1999. [ Links ]
30. Rabenhorst J. Production of methoxyphenol-type natural aroma chemicals by biotransformationof eugenol with a new Pseudomonas sp. Appl Microbiol Biotechnol. 1996; 46(5-6): 470-474. [ Links ]
31. Dr. Hatakka A. In Biopolymers, Volume 1. En: Hofrichter M, Steinbuchel A, editores. Lignin, Humic Substances and Coal, Ed. Wiley. Finland; 2001.p. 129-67. [ Links ]
32. Kent Kirk T and Cullen D. Enzymology and Molecular Genetics of Wood Degradation by White-Rot fungi. En: Young AR, Akhtar M, editores. Environmentally friendly technologies for the pulp and paper industry. Toronto: John Wiley & Sons, Inc.; 1998. p. 273-307. [ Links ]
33. Martinez AT, Camarero S, Gutiérrez A, Bocchini P, and Galleti GC. Studies on Wheat lignin degradation by Pleurotus species using analytical pyrolysis. J Anal Appl pyrolysis 2001; 58-59: 401-411. [ Links ]
34. Wainwright M. Introducción a la Biotecnología de los Hongos. Zaragoza: Acribia S.A; 1995. [ Links ]
35. Palonen H. Role of Lignin in the enzymatic hydrolysis of Lignocellulose. 2004;11-16. [ Links ]
36. Walton NJ, Mayer MJ, and Narbad Arjan. Molecules of interest Vanillin. Phytochesmistry. 2003; 63(5):505-515. [ Links ]
37. Vanderhaegen B, Neven H, Coghe S, Verstrepen KJ, Derdelinckx G and Verachtert H. Bioflavoring and beer refermentation. Appl Microbiol Biotechnol. 2003; 62(2-3):140-150. [ Links ]
38. Walton NJ, Narbad A, Faulds CB and Williamson G. Novel approaches to the biosynthesis of vanillin. Curr Opin Biotechnol. 2000; 11(5): 490-496. [ Links ]
39. Bauer K, Garbe D and Surburg H. Common Flavours and Fragance Materials. Preparations, properties and uses. 5ª ed. Nueva York: Wiley - VCH. Fourt; 2001. [ Links ]
40. Muheim A and Lerch K. Towards a high-yield bioconversion of ferulic acid to vanillin. Biotech.Progress. 2001; 51(4): 456-461. [ Links ]