Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.12 no.2 Medellín Jul./Dec. 2005
RECOLECCIÓN SEMINAL INTRACAPSULAR, UNA VARIABLE A CONSIDERAR EN LA GERMINACIÓN IN VITRO DE SEMILLAS DE ACHIOTE (Bixa orellana L), PLANTA CON ACTIVIDAD ANTIOFÍDICA
INTRACAPSULAR SEED COLLECTION, AN IMPORTANT VARIABLE IN IN VITRO ANNATTO (Bixa orellana L) GERMINATION, PLANT TO TREAT SNAKEBITES
ALARCÓN P. Juan C. 1*, QUINCHIA B. Lida A. 2, CIRO G. Gelmy L.2, JIMÉNEZ R. Silvia L. 1 y DÍAZ C. Abel1
1 Grupo de Ofidismo y Escorpionismo. Universidad de Antioquia. AA 1226. Medellín, Colombia.
2 Estudiante Ingeniería de Alimentos. Facultad de Química Farmacéutica. Universidad de Antioquia. AA 1226. Medellín, Colombia.
* Autor a quien se debe dirigir la correspondencia: jalarcon@farmacia.udea.edu.co
Recibido: junio 01 de 2005 Aceptado: agosto 23 de 2005
RESUMEN
Para establecer la incidencia del momento de la colección y de algunos tratamientos de desinfección e imbibición sobre la germinación seminal in vitro de Bixa orellana L, se colectan intracapsularmente o postextrusión semillas maduras, con escasa variación en peso (25.57± 0.01 mg,). Una vez desinfectadas y en algunos casos expuestos a procesos adicionales de imbibición, las semillas se transfieren a cajas de cultivo en las que se mantienen en completa oscuridad a 25 ± 1°C, por espacio de siete semanas. La germinación resulta influenciada por el tratamiento de imbibición, por las semanas de cultivo empleadas y por el momento de la colección, pues las semillas extracapsulares germinan en muy bajo porcentaje mientras que en las colectadas previamente a la ruptura de la cápsula, la germinación se manifiesta desde la primera semana de cultivo y con incrementos estadísticamente significativos en la extrusión. Asimismo, y dependiendo del tratamiento de imbibición y desinfección que se emplee, se logran aumentar los porcentajes de germinación, hasta un 78%, evitando la escasa o caprichosa tasa de germinación evidenciada por algunos autores para esta promisoria especie vegetal.
Palabras clave: Bixa orellana, germinación seminal, achiote
ABSTRACT
To establish the incidence of the time of collection and some disinfections and imbibition treatment on the seed germination in vitro of Bixa orellana L, mature seeds are collected via intracapsule or postextrusion, with a little weight variation (25.57 ± 0.01 mg,). Once the seeds are disinfected and in some case exposed to imbibition process, they are transfered to culture medium and are kept in complete darkness to 25 ± 1 ºC, for seven weeks. The germination is influenced by the imbibition treatment, the growing time and the collection moment. On the other hand, the extracapsular seeds have a lower germination percent than those collected prior to rupture since in this the germination manifests during the first week of growing with significant statistical increases in the extrusion. Likewise, depending on the imbibition and disinfections treatment that is used, the germination percents can increase up to 78%, avoiding the poor germination rate showed by some authors from this promising vegetable species.
Keywords: Bixa orellana, seed germination, annatto
INTRODUCCIÓN
La Bixa orellana, arbusto americano conocido generalmente como achiote(1), es una planta multipropósito por su adaptabilidad a diferentes sistemas agroforestales, el enorme potencial reforestador de tierras pobres o ácidas y el notable crecimiento en diferentes pisos térmicos que le proporcionan variedades en el color de las cápsulas (negro, colorado y amarillo) e incluso, en el contenido del colorante natural característico, que es considerando el segundo tinte natural más importante del mundo, y con amplias aplicaciones en las industrias relacionadas con alimentos, bebidas, cosméticos, textiles y diversos productos químicos (2). Esta planta de corteza parda, presenta pecíolos delgados, hojas simples que se acompañan de flores hermafroditas agrupadas en panículas de diferentes colores con numerosos estambres y frutos capsulares globosos u ovoides con tonalidad roja, púrpura o carmelita y en cuyo interior se destacan hasta 50 semillas triangulares, comprimidas y recubiertas de un arilo de color amarillo rojizo o anaranjado (1).
A la planta completa, propagada rutinariamente por semillas, estacas o injertos (3), o a algunas de sus partes, se le atribuyen efectos en la medicina tradicional, de hecho, la infusión de flores se utiliza como purgante, el macerado de la corteza contra la ictericia (4), mientras que las decocciones de algunos de sus órganos son consideradas diuréticas, antidisentéricas, antivenéreas, abortivas, antiinflamatorias, antimaláricas, antimicrobianas, digestivas, laxantes suaves, antieméticas, hipoglucemiantes, repelentes de insectos, afrodisíacas, digestivas, expectorantes, antipiréticas, antigonorréicas e incluso contra las quemaduras y la lepra (1,4,6). Adicionalmente, el achiote se constituye en una gran alternativa para nuestro medio y comunidad, pues además de las actividades farmacológicas referenciadas, se ha hecho evidente que sus componentes metabólicos resultan útiles como antiedematizantes, antiihemorrágicos y neutralizantes del veneno de Bothrops atrox asper (mapaná), serpiente causante del 50% al 70% de las mordeduras en nuestro país (7,8,9,10). Con esta consideración, la producción in vitro de los metabolitos con actividad neutralizante y demás efectos adicionales, se hace necesaria, pues estos compuestos aislados pueden constituirse en una alternativa de atención primaria en accidentes ofídicos o en una fuente generadora de moléculas con importancia farmacéutica, ya que seguramente las actividades neutralizantes están mediadas por el efecto que alguno(s) de ellos tienen sobre las enzimas fosfolipasas A2 (PLA2), que son responsables de algunos eventos farmacológicos adicionales tales como, el neurotóxico, el miotóxico, el cardiotóxico y el agregante plaquetario (11).
Lamentablemente, la producción metabólica -colorante y todos los demás secundarios- no se obtiene de manera temprana, pues la producción de semillas se inicia después del primero o segundo año de la plantación; pero solo hasta el tercero, e incluso el cuarto año del cultivo, se alcanzan unos rendimientos adecuados de producción (12,13). Esta tardanza en producción metabólica, sumada a diversos factores como variación en el número cromosómico de la especie (2n= 14, 16), la disminución en porcentaje de germinación cuando las semillas pierden humedad (14), la necesidad de escarificación mecánica como mecanismo de recuperación del porcentaje de germinación (15), la alta exigencia de suelos ricos en manganeso y la escasa viabilidad seminal (16), son razones suficientemente poderosas para considerar que las alternativas de propagación, como promoción in vitro de la germinación y las técnicas de manipulación que incluyen desdiferenciación tisular, optimización y masificación de suspensiones celulares son las principales estrategias a desarrollar en la masificación y producción metabólica de esta planta con enorme potencial farmacológico (17). Por lo anterior, este trabajo intenta optimizar las condiciones necesarias para facilitar y promover la germinación seminal de Bixa orellana L., como insumo mínimo para obtener plántulas libres de patógenos, tejidos indiferenciados con origen en diferentes explantos y suspensiones celulares potencialmente generadoras de metabolitos.
MATERIALES Y MÉTODOS
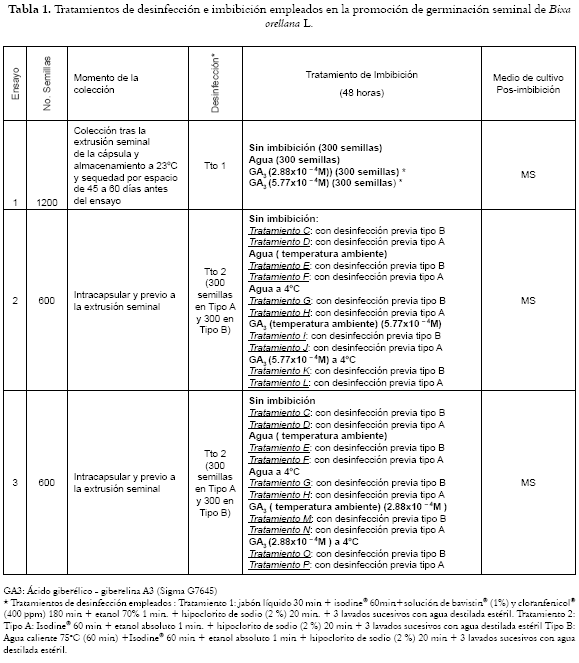
Dos mil cuatrocientas semillas (2400) maduras de Bixa orellana L, variedad roja, provenientes del municipios de San Luis (1050 m.s.n.m., Departamento de Antioquia), con alta homogeneidad en el peso (25.57± 0.01 mg) e identificadas por personal del Herbario de la Universidad de Antioquia sirven como material de partida para los protocolos de germinación seminal en los que se incluyen modificaciones en el momento de la colección (postextrusión seminal (ensayo 1) o intracapsularmente (ensayos 2 y 3)), y en los tratamientos de desinfección e imbibición (véase tabla 1). Las semillas desinfectadas y sometidas o no, al proceso de imbibición, se transfieren a cajas de cultivo (50 mm F) dispuestas con un medio nutritivo (pH: 5.7) preparado con las sales y vitaminas propuestas por Murashige y Skoog (1962; MS) (18), un suplemento de sacarosa (30 gl-1), agar (7 gl-1)(Oxoid®) y previamente esterilizado con calor húmedo (121°C/15min/1atm). Una vez transferidas a las cajas de cultivo, las semillas (10 por caja) se mantienen en completa obscuridad a 25 ± 1°C, por espacio de siete semanas en las que se incluye un subcultivo rutinario en la cuarta de ellas.
Una vez germinadas, las plántulas en formación se transfieren a tubos de vidrio dispuestos con el medio de cultivo descrito e incubadas a 25 ± 1°C con fotoperiodicidad larga (16h luz/ 8h oscuridad, 50 µmol m-2 s-1) y subcultivos rutinarios cada cuatro semanas.
Los diferentes tratamientos se comparan mediante un análisis de varianza de medidas repetidas en el tiempo. Tanto las pruebas estadísticas (error α = 0.05) como los cálculos de las medidas descriptivas se realizan con el paquete STATISTICA98 ( Statsoft Inc., Tulsa, OK ).
RESULTADOS Y DISCUSIÓN
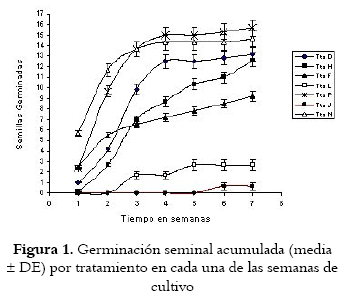
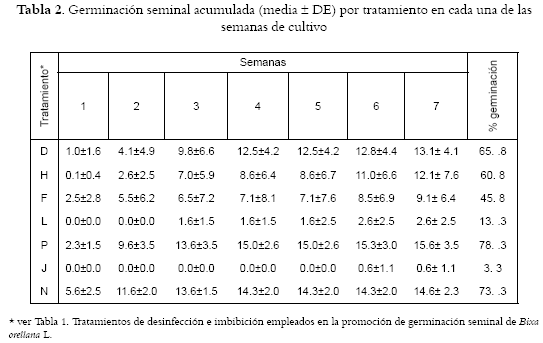
La germinación seminal in vitro de Bixa orellana L., resulta influenciada por el tratamiento de imbibición (p = 0.007), y por las semanas de cultivo empleadas (p = 0.000) (Véanse figura 1, tablas 2 y 3), sin ser éste último, un factor per se para la extrusión, simplemente es una consecuencia directa del primero de ellos. Estos, sumados a la colección seminal (intracapsular o postextrusión), se convierten en los factores determinantes del proceso, pues de las semillas colectadas tras la extrusión de la cápsula (ensayo 1) y almacenadas bajo condiciones controladas de temperatura y humedad, sólo germinaron una cantidad inferior al 3% de ellas, lo cual sugiere en concordancia con Belfort et al. (14) y Yogeesha et al.. (15), que en esta especie vegetal la germinación se ve disminuida, considerablemente, por la pérdida de humedad y por ello se hace necesaria una escarificación mecánica como protocolo alterno de recuperación del porcentaje de germinación (15,16).
En las semillas colectadas intracapsularmente (ensayos 2 y 3) la germinación se hace manifiesta desde la primera semana de cultivo con la mayoría de los tratamientos imbibitorios utilizados (Véase figura 1), con incrementos estadísticamente significativos en el porcentaje de germinación durante el período de tiempo comprendido entre la segunda y cuarta semana de cultivo, a pesar de presentar alta variabilidad en estos porcentajes, como consecuencia de lo caprichosa que es la germinación en esta especie vegetal (14,16,17).
Además, dependiendo del tratamiento de imbibición y desinfección empleados (Véanse tablas 2 y 3) se alcanzan porcentajes de germinación que superan el 70% y son totalmente contrarios a la baja viabilidad y tasa de germinación propuesta por Eira y Mello (17).
El empleo de agua caliente dentro de los protocolos de desinfección no resulta benéfico y, contrario a lo propuesto por D`Souza y Sharon (20), en este estudio se evidencia una disminución considerable en la capacidad de germinación, pues en ninguno de los casos se supera el 10 % de germinación en aquellas semillas sometidas a este tratamiento. En estos resultados, como en los de Yogeesha et al. (15), los tratamientos que incluyen imbibición a 4oC presentan un leve incremento en los porcentajes de germinación (sin significancia estadística), pero a diferencia de lo observado por ellos, en este estudio el aumento en ningún caso representa una ventaja con relación a la utilización de temperaturas diferentes a la ambiental (22-23°C), y probablemente, en concordancia con lo propuesto por Yogeesha et al.. (15), no se constituya en un factor con importancia para evitar la dormancia seminal que se presenta en las estructuras colectadas posextrusión.
Las semillas correspondientes a los ensayos 2 y 3 (semillas colectadas intracapsularmente) con esquema de desinfección tipo A (no incluye agua caliente), muestran tasas germinatorias hasta del 78% (Véase tabla 2), cuando no se someten a imbibición, o cuando ésta se realiza a una concentración baja de ácido giberélico (2.88x10 – 4M). A una concentración más alta (5.77x10 – 4M), los porcentajes de germinación descienden incluso a niveles mas bajos que los observados en las semillas colectadas postextrusión (ensayo 1), probablemente como consecuencia directa del regulador, pues es bien conocido que las concentraciones exógenas bajas, generalmente inferiores a 10-4 M, causan un mayor desprendimiento de etileno (21). Sin embargo, la inhibición manifiesta al utilizar una concentración de 5.77x10 – 4M, permite suponer que con esta adición, sumada a los niveles endógenos seminales, se podrían alcanzar los niveles inhibitorios o la pérdida de la capacidad de las células para responder al efecto de esta hormona (22,23), pues es conocido su efecto sobre algunos genes relacionados con expresiones enzimáticas involucradas en la germinación seminal (24,25,26,27,28).
CONCLUSIONES
La germinación in vitro de Bixa orellana L., se encuentra influenciada por el momento de la colección seminal, pues si la semilla pierde humedad tras su salida de la cápsula, esta disminuye progresivamente la capacidad de germinar. Asimismo, si la colección se realiza posextrusión, los organismos contaminantes oportunistas dificultan considerablemente los protocolos de desinfección necesarios para implementar los procesos in vitro.
Las semillas colectadas intracapsularmente no requieren protocolos exigentes de desinfección, y su germinación alcanza porcentajes muy elevados, sin que en ello importe proceso alguno de imbibición, pues aquellas semillas que no la tuvieron, germinaron en proporciones estadísticamente similares a las que la tuvieron con ácido giberélico a una concentración de 2.88x10 – 4M.
En caso de imbibición, no se recomienda utilizar ácido giberélico a una concentración de 5.77x10– 4M, pues los niveles de extrusión se reducen a tasas inferiores a todos los demás tratamientos empleados y solo comparadas con las que disminuyen progresivamente su capacidad germinativa como consecuencia de la pérdida de humedad. Sin embargo, aunque en ninguno de los casos es significativa la diferencia, vale la pena mencionar que en este tratamiento, y en los demás, los porcentajes de germinación tuvieron un leve incremento cuando la imbibición se realizó a baja temperatura (4°C).
No se deben incluir procesos de desinfección o imbibición que involucren el uso de temperaturas superiores a la ambiental, pues en este estudio se hizo evidente que el agua caliente como parte del protocolo de desinfección no mejora el proceso y por el contrario, incide desfavorablemente en el porcentaje de germinación. Asimismo, la utilización de temperaturas bajas en la imbibición no muestra efectos favorecedores que permitan considerar este como un factor promotor de germinación en Bixa orellana L.
La germinación de semillas en esta especie vegetal resulta estadísticamente influenciada por las semanas de cultivo, pero no porque este constituya un factor determinante per se, sino porque, en la medida en que el tiempo de cultivo avanza se obtiene un mayor porcentaje de germinación; de hecho, la extrusión seminal durante las primeras dos semanas es significativamente inferior a las restantes y por tanto, en ensayos posteriores relacionados se deberán considerar un mínimo de dos, o incluso tres semanas, para evaluar cualquier efecto progerminativo.
Ensayos adicionales (datos no presentados), muestran que el efecto continuado de estos reguladores en los medios de cultivo, no mejoran el porcentaje de germinación presentado en este estudio.
AGRADECIMIENTOS
Al Comité para el Desarrollo de la Investigación (CODI) y a la Universidad de Antioquia por la financiación del proyecto CIQF-066.
REFERENCIAS BIBLIOGRÁFICAS
1. Fonnegra R, Jiménez SL. Plantas medicinales aprobadas en Colombia serie Yuluka. Medellín: Universidad de Antioquia; 1999. [ Links ]
2. Mercadante AZ, Pfander H. Carotenoids from annato: a review. Recent Research Developments in Agriculture and Food Chemistry. 1998; 2(1): 79-91. [ Links ]
3. Cáceres A. Plantas de uso medicinal en Guatemala. Guatemala: Universidad de San Carlos de Guatemala; 1996. [ Links ]
4. Rodríguez PM. Plantas de la medicina popular Venezolana de venta en herbolarios. Sociedad Venezolana de Ciencias Naturales. Caracas: Sucre Caracas; 1983. [ Links ]
5. Bernal HY, Correa JE. Especies vegetales promisorias de los países del convenio Andrés Bello. Tomo II. Bogotá: Secretaría ejecutiva del convenio Andrés Bello, Ministerio de Educación y Ciencia de España y la Junta del Acuerdo de Cartagena; 1989. [ Links ]
6. Parrotta JA. Healing plants of peninsular India. Wallingford, U.K.: CABI Publishing; 2001 [ Links ]
7. Otero R, Fonnegra R, Jiménez S. Plantas utilizadas contra mordedura de serpientes en Antioquia y Chocó, Colombia. Medellín, Colombia: Universidad de Antioquia; 2000a. [ Links ]
8. Otero R, Núñez V, Jiménez SL, Fonnegra R, Osorio RG, García M, et al. Snakebites and ethnobotany in the northwest region of Colombia, Part II: Neutralization of letal and enzymatic effects of Bothrops atrox venom. J Ethnopharmacology. 2000b; 71(3):505-511 [ Links ]
9. Otero R, Núñez V, Barona J, Fonnegra R, Jiménez SL, Osorio RG, et al. Snakebites and ethnobotany in the northwest region of Colombia, Part III: Neutralization of the haemorrhagic effect of Bothrops atrox venom. J Ethnopharmacology. 2000; 73(1-2): 233-241 [ Links ]
10. Otero R, Núñez V, Barona J, Saldarriaga M, Fonnegra R, Osorio R, et al. Neutralization of edema-forming and defibrinating effects of Bothrops atrox asper venom by extracts of plants used by healers in Antioquia and Chocó, Colombia, En: Cordovez, J.M. Abstracts XV International Congress for Tropical Medicine and Malaria. Bogotá: Corcas; 2000d. 186. [ Links ]
11. Gowda TV. Interaction of snake venom phospholipases A2 with plant isolates. En: Kini RM, Editor. Venom phospholipase A2 enzymes. Nueva York: John Wiley and Sons, Chichester; 1997. p. 124-27 [ Links ]
12. Nepstad DC, Uhl C, Serrao EAS. Recuperation of a degraded amazonian landscape: forest recovery and agricultural restoration. Ambio.1991; 20(6):248-255 [ Links ]
13. Kanjilal PB, Singh RS. Agronomic evaluation of annatto (Bixa orellana L.) by five grafting methods. Ceres. 1995; 38(218): 340-344 [ Links ]
14. Belfort AJL, Kato OR, Kato M do SA. Practical method of drying annatto seeds for seedling production, Circular Técnica 67. Belem, Brazil: Centro de Pesquisa Agropecuaria do Tropico Umido, EMBRAPA-CPATU; 1992. [ Links ]
15. Yogeesha HS, Shivananda TN, Bhanuprakash K. Effect of seed maturity, seed moisture and various pre-treatments on seed germination of annatto (Bixa orellana L.). Seed Science and technol. 2005; 33(1): 97-104. [ Links ]
16. Amaral LIV, Pereira de FA, Cortelazzo AL. Dormancy breaking in seeds of Bixa orellana. Revista Brasileira de Fisiología Vegetal. 1995 7(2): 151-157 [ Links ]
17. Eira MTS, Mello CMC. Bixa orellana L., Seed germination and conservation. Seed Sci. Tech.1997; 25: 373-380. [ Links ]
18. Liogier HA. Plantas medicinales de Puerto Rico y del Caribe, Iberoamericana de Ediciones, Inc. San Juan P.R. 563. 1990. [ Links ]
19. Murashige T, Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant.1962; 15: 473-497. [ Links ]
20. DSouza MC, Sharon M. In vitro clonal propagation of Annatto (Bixa orellana L.). In Vitro Cell Dev. Biol. Plant. 2001; 37(2):168-172. [ Links ]
21. Ketring DL, Morgan PW. Physiology of oil seeds. I. Regulation of dormancy in Virginia-type peanut seeds. Plant Physiol. 1970; 45(3):268-273 [ Links ]
22. Richards DE, King KE, Ait-ali T, Harberd NP. How gibberellin regulates plant growth and development: A molecular genetic analysis of gibberellin signaling. Annu. Rev. Plant Physiol. Plant Mol. Biol. 2001; 52:67–88. [ Links ]
23. Kepczynski J. Ethylene-dependent action of gibberellin in seed germination of Amaranthus caudatus. Physiol. Plant.1986; 67(4):584–587. [ Links ]
24. Nonogaki H, Gee OH, Bradford KJ. A germinationspecific endo-ß-mannanase gene is expressed in the micropylar endosperm cap of tomato seeds. Plant Physiol. 2000; 123: 1235–1245. [ Links ]
25. Chen F, Nonogaki H, Bradford KJ. A gibberellinregulated xyloglucan endotransglycosylase gene is expressed in the endosperm cap during tomato seed germination. J. Exp. Bot. 2002; 53(367): 215–223. [ Links ]
26. Chen F, Bradford KJ. Expression of an expansin is associated with endosperm weakening during tomato seed germination. Plant Physiol. 2000; 124(3):1265–1274. [ Links ]
27. Chen F, Dahal P, Bradford KJ. Two tomato expansin genes show divergent expression and localization in embryos during seed development and germination. Plant Physiol. 2001; 127: 928–936. [ Links ]
28. Wu C-T, Leubner-Metzger G, Meins FJr, Bradford KJ. Class I ß-1,3-glucanase and chitinase are expressed in the micropylar endosperm of tomato seeds prior to radicle emergence. Plant Physiol. 2001; 126: 1299–1313. [ Links ]