Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.13 no.1 Medellín Jan./Jun. 2006
Juan C. ALARCÓN P.1*, Hader I. CASTAÑO P.1, Ligia L. CORRALES G.1, Silvia L. JIMÉNEZ R.1 y Abel DÍAZ C.1,
1 Grupo de Ofidismo y Escorpionismo. Profesores Facutlad de Química Farmacéutica. Universidad de Antioquia. A.A. 1226. Medellín-Colombia
* Autor a quien se debe dirigir correspondencia: jalarcon@farmacia.udea.edu.co
Recibido: Diciembre 12 de 2005 Aceptado: Marzo 02 de 2006
RESUMEN
Recientes evidencias sugieren que el achiote puede constituirse en una alternativa terapéutica por sus efectos directos e indirectos contra el veneno de Bothrops asper, serpiente causante de la mayoría de mordeduras en nuestro país. Considerando que la producción metabólica ex vitro de esta planta no se obtiene de manera temprana y que eventualmente puede lograrse con ayuda de cultivos celulares, el trabajo evalúa algunas combinaciones inductoras de callos en segmentos de hojas, raíces y tallos de plantas de Bixa orellana L. con el fin de inducir y masificar tejidos precursores de suspensiones celulares potencialmente productores de los metabolitos activos. Estos explantes, dispuestos en medios nutritivos sin reguladores de crecimiento, o con suplementos de algunas combinaciones de ellos, se almacenan por ocho semanas a 25± 1º C y oscuridad, verificando los porcentajes de formación de callo en las semanas dos, cinco y ocho del cultivo. La generación de callo en explantes provenientes de raíces no resulta masiva, mientras que en tallos y hojas se favorece con el tratamiento empleado y con el tiempo de exposición a los reguladores de crecimiento. Sin importar el explante utilizado, la inducción de callo se aumenta con la exposición al tratamiento que involucra NAA (5 µM) y kinetina (4,64 µM), alcanzando valores de 17.0 % (raíces), 58.9 % (tallos) y 77.5 % (hojas)
Palabras clave: callos, Bixa orellana, achiote
EVALUATION OF SOME GROWTH REGULATORS COMBINATION FOR CALLUS INDUCTION IN ANNATTO (Bixa orellana L.) ACTIVE PLANT AGAINST SNAKE BITES.
ABSTRACT
Recent evidences suggest annatto can be constituted in a therapeutic alternative by its direct and indirect influences against the poison of Bothrops asper, cause of most of snake bite in our country. The ex- vitro metabolic production of this plant is not obtained in early growth stages but it is possible to obtain it by means of cell cultures. This research evaluates some inductive calli combinations of plant segments of Bixa orellana L., like leaves, roots and stems grown in vitro, in order to get high induction rates and bigger amounts of tissue precursors of cellular suspensions, potentially producers of active metabolites. These explants, located in nutritious means without growth regulators, or with supplements of some combinations of them, are stored for eight weeks (25± 1º C and darkness) and the calli formation percentage tested in second, fifth and eighth week of growing. The calli generation in explants from roots is low, whereas in those from stems and leaves is favored with the treatment and with exposition time to the growth regulators. Regardless of the kind of explant used, the calli formation percentage is increased by the treatment that uses NAA (5 µM) and kinetine (4.64 µM), and showing values of 17,0 %, 58,9 % and 77,5 % for roots, stems and leaves respectively.
Keywords: calli, Bixa orellana, annatto.
INTRODUCCIÓN
La Bixa orellana, arbusto americano con amplia distribución geográfica y conocido generalmente como achiote (1), es una planta de gran adaptabilidad a diferentes sistemas agroforestales y con numerosas aplicaciones en las industrias relacionadas con alimentos, bebidas, cosméticos, textiles y diversos productos químicos (2).
A la planta completa, o a algunas de sus partes, se les atribuyen múltiples efectos en la medicina tradicional (1,3,4,5), pero recientes evidencias constituyen el achiote en una gran alternativa para nuestro medio y comunidad, pues además de las actividades farmacológicas referenciadas, sus componentes metabólicos resultan útiles como antiedematizantes, antiihemorrágicos y neutralizantes del veneno de Bothrops asper (mapaná equis), serpiente causante del 50% al 70% de las mordeduras en nuestro país (6,7,8,9). Con esta consideración y teniendo en cuenta que: 1. La producción metabólica no se obtiene de manera temprana, 2. En algunos casos se pueden presentar variaciones en el número cromosómico de la especie (2n= 14, 16), 3. El porcentaje de germinación disminuye por pérdida de humedad en las semillas (10) con necesidad de escarificación mecánica para recuperarlo (11), 4. La planta es exigente en la cantidad de manganeso en el suelo, y 5. En algunos casos presenta escasa viabilidad seminal (12), se hace cada vez mas necesaria la producción in vitro de los metabolitos con actividad neutralizante del veneno de la serpiente o los de los otros efectos adicionales comprobados, pues estos compuestos aislados pueden constituirse en una alternativa de atención primaria en accidentes ofídicos o en una fuente generadora de moléculas con importancia farmacéutica, ya que seguramente las actividades neutralizantes están mediadas por el efecto que alguno(s) de ellos tienen sobre las enzimas fosfolipasas A2 (PLA2), que son responsables de eventos farmacológicos adicionales tales como, el neurotóxico, el miotóxico, el cardiotóxico y el agregante plaquetario (13). Así pues, las alternativas de propagación in vitro, la desdiferenciación tisular y la masificación de suspensiones celulares se constituyen en estrategias de desarrollo para aumentar la producción metabólica de esta planta con enorme potencial farmacológico (14). Para lograr este objetivo, se han mencionado algunos protocolos inductores de callos en esta especie vegetal (15,16,17), y sus resultados muestran diferencias, tanto en las combinaciones hormonales como en los porcentajes de desdiferenciación logrados. Para ampliar las alternativas y optimizar las condiciones mínimas necesarias, este trabajo compara unos protocolos conocidos y ensaya la combinación entre ellos para generar desdiferenciación tisular en explantes provenientes de diferentes estructuras organogénicas de Bixa orellana L., como requisito inicial de suspensiones celulares, potencialmente generadoras de metabolitos secundarios con los intereses farmacéuticos mencionados.
MATERIALES Y METODOS
Segmentos pequeños (5 x 5 mm), provenientes de hojas, raíces y tallos de plantas de B. orellana L. crecidas in vitro, e identificadas por personal del Herbario de la Universidad de Antioquia (HUA No. 6485), sirven como explantes en cajas de cultivo (55 mm Ø) dispuestas con medios nutritivos (Véase tabla 1) ajustados a pH: 5,7 antes de su esterilización con condiciones de calor húmedo (121º C/15min/1 atm).
Los medios de cultivo (control y tratamientos), incluyendo cinco explantes por caja en cada una de las tres réplicas (cajas independientes por cada tratamiento para cada una de las estructuras) y con tres repeticiones de todos los ensayos, se almacenan durante ocho semanas (con subcultivo rutinario en la cuarta de ellas) a 25± 1º C, en condiciones de completa oscuridad y se verifican los porcentajes de formación de callo en las semanas dos, cinco y ocho del cultivo.
Los diferentes tratamientos se comparan mediante un análisis de varianza de medidas repetidas en el tiempo. Tanto las pruebas estadísticas (error a= 0,05) como los cálculos de las medidas descriptivas se realizan con el paquete STATISTICA98 (Statsoft Inc., Tulsa, OK).
RESULTADOS Y DISCUSION
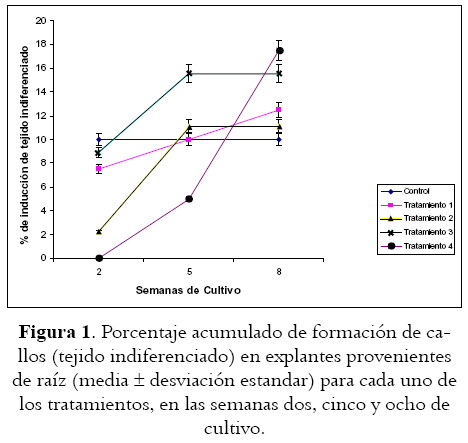
La generación de callos en los explantes provenientes de las raíces no resulta masiva, pues los porcentajes de inducción son muy bajos (difícilmente superiores al 15%) y sin diferencias estadísticamente significativas con relación a los controles (véase figura 1), en los que incluso, en algunos se logra detectar una escasa desdiferenciación que probablemente se deba a la presencia de pequeñas zonas meristemáticas. Estos resultados se encuentran en concordancia con Cuartas Chacón (15), pero difieren de lo reportado por Castello y colaboradores (16), quienes muestran que los explantes provenientes de esta estructura poseen una altísima capacidad productora de callos en muy poco tiempo de cultivo. En ensayos adicionales realizados con los reguladores de crecimiento y a las concentraciones propuestas por estos últimos autores (resultados no publicados), no se logran los porcentajes de inducción, ni la cantidad reportada por ellos. Considerando que la exposición de las raíces a cualquiera de los tratamientos inductores de nuestro estudio no ha arrojado resultados significativamente superiores a los observados en los controles (p = 0,.92), se hace necesario realizar nuevos ensayos para verificar la utilidad de estos explantes en los protocolos encaminados a la formación de callos en esta especie vegetal.
Aunque los explantes provenientes de raíz no parecen ser la mejor materia prima para lograr la formación de callos, en aquellos en los que se logra (véase figura 1), el tiempo de cultivo se constituye en un factor estadísticamente influyente (p < 0,001), pero no porque esté directamente relacionado con la inducción de los callos, sino porque puede ser una consecuencia indirecta del efecto de los tratamientos aplicados.
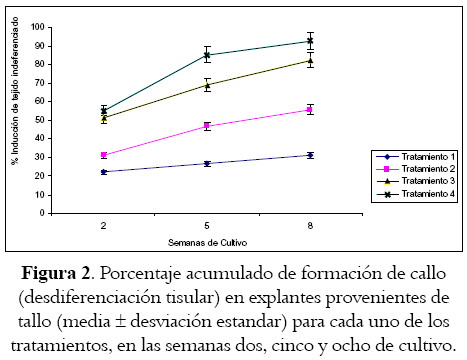
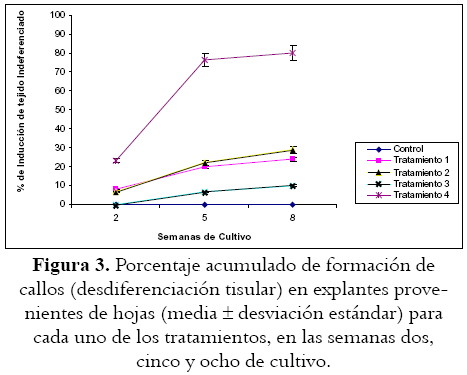
La formación de callos en tallos y hojas se ve favorecida por el tiempo de exposición a los reguladores de crecimiento (p = 0,01 y p < 0,001 respectivamente), y en ningún caso se obtienen callos en los medios de cultivo empleados como control, pero sí resulta evidente y notoria la incidencia del tratamiento empleado (véase tablas 2 y 3; figuras 2 y 3) en la inducción del tejido mencionado.
La alta variación con relación a las medias en los porcentajes de formación de callos en los segmentos provenientes de tallo y hojas, podrían, ser consecuentes, con los tipos de reguladores de crecimiento empleados en cada uno de los tratamientos, pues en los que se incluye la combinación de ácido 2,4-diclorofenoxiacético (2,4-D, 4,52µM), 6-furfuril-aminopurina (kinetina 4,64µM) y adenina (100 mg/l) (Tratamiento 1) la respuesta es baja, y consecuente con la poca asociación manifiesta entre inducción de callo y 2,4-D para esta especie vegetal (19), pero muy contraria a la establecida por Cuartas Chacón (15), quien con esta combinación logra buenos resultados utilizando hipocótilos como explantes.
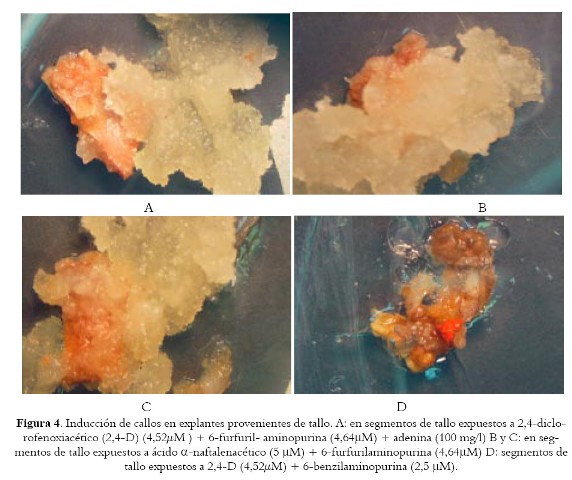
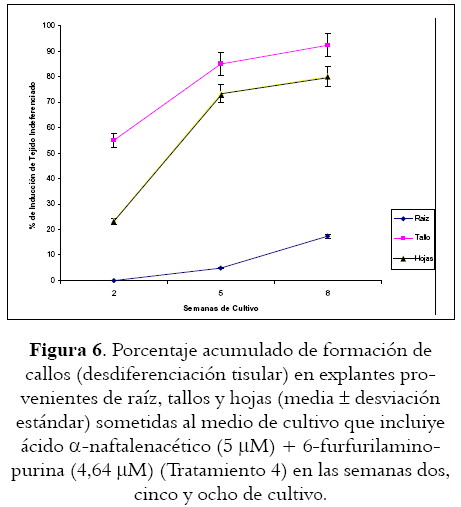
Es bien conocido el efecto promotor de la 6-benzilaminopurina en la generación de callo en B. orellana (17,19), pero existen algunas evidencias que muestran el enorme potencial de la 2-isopentenyladenina y la kinetina a altas concentraciones (16,19) en la inducción de callos en esta especie vegetal, y quizá por ello, en los segmentos provenientes de tallos, la poca desdiferenciación parece revertir cuando en esta combinación de reguladores se reemplaza la kinetina por 6-benzilaminopurina (2,5 µM) (véase tabla 2, tratamiento 3), pues se alcanzan niveles significativamente equiparables a los observados como respuesta en otros tratamientos. De hecho, los porcentajes de inducción en los explantes dispuestos en ácido a-naftalenacético (5 µM) + 6-benzilaminopurina (2,5 µM) + ácido ascórbico (200 mg l –1) + myo-inositol (200 mg l –1) (Tratamiento 2) son superiores a los encontrados en el tratamiento 1, pero un poco mas bajos que los establecidos para semillas en completa oscuridad (17), y muy parecidos a los observados por estos últimos bajo condiciones de fotoperiodicidad de día largo. Sin embargo, la presencia de 6-furfurilaminopurina (4,64µM) en reemplazo de 6-benzilaminopurina (2,5 µM) (Tratamiento 4), mejora considerablemente la desdiferenciación, pues genera callos amarillentos y friables (véase figura 4) con porcentajes de formación superiores a los observados por Sha Valli Khan et al (17), y en concordancia con quienes destacan la incidencia de este regulador tipo citoquinina en la formación de callos en achiote (19).
En hojas, la generación de callos (véase tabla 3, figura 5) presenta porcentajes inductores un poco mas bajos, pero con patrones similares a lo observado en tallos; de hecho, el mejor inductor resulta ser el tratamiento que incluye ácido a-naftalenacético (5 µM) y 6-furfurilaminopurina (4,64 µM) (Tratamiento 4). Este comportamiento repetido en los diferentes explantes sugiere que el ácido a-naftalenacético es un regulador auxínico que se debe considerar en los protocolos relacionados con inducción de callos en B. orellana L.; de hecho, ensayos preliminares adicionales (datos no publicados) que incluyen este regulador auxínico en combinación con una citoquinina diferente (2-isopentenyladenina), muestran en concordancia con algunos autores (16,17), la tendencia a incrementar los porcentajes inductores, quizá como consecuencia de su condición fisiológica natural o de la facilidad de esta para oxidarse a zeatina (20).
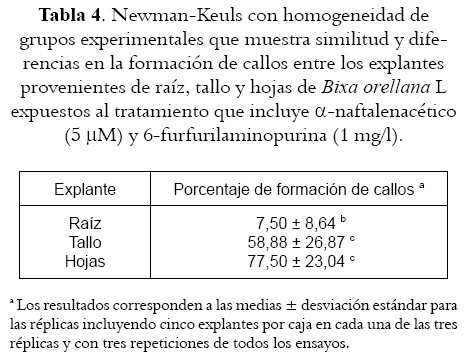
Sin importar el explante utilizado, la desdiferenciación tisular se ve muy favorecida por la exposición al tratamiento que involucra ácido a-naftalenacético (5 µM) y 6-furfurilaminopurina (4,64 µM) (Tratamiento 4) (véase figura 6 y tabla 4), al punto que en las raíces en las que los porcentajes de inducción resultan tan bajos, los sometidos a este tratamiento alcanzan cifras superiores al 17%, mientras que en tallos y hojas se logran porcentajes de 58,88 y 77,50 respectivamente, siendo este último valor un poco mas alto que el observado por Sha Valli Khan et al (17) con semillas expuestas al medio de cultivo denominado en este trabajo como Tratamiento dos, aunque con diferencia poco significativa y probablemente como consecuencia de la cantidad de myo-inositol empleado pues, al parecer, la concentración empleada tiene un efecto promotor en la inducción de tejido indiferenciado en otras especies vegetales (21).
CONCLUSIONES
En este trabajo, la generación de tejido indiferenciado en explantes provenientes de raíces de B. orellana L., no resulta masiva, y los porcentajes de inducción son bajos, difícilmente superiores al 15% y notorios a partir de la quinta semana de cultivo. Por el contrario, la inducción de callos en segmentos de tallos y hojas se ve favorecida por el tiempo de exposición a los reguladores de crecimiento y por el tratamiento empleado para ella.
La alta variación con relación a las medias, en los porcentajes de formación de callos en los segmentos provenientes de tallo y hojas, podría ser consecuente con los tipos de reguladores de crecimiento empleados en cada uno de los tratamientos, pues en este trabajo, y dependiendo de su combinación y explante, se ve disminuida o revertida la aparición de estos tejidos poco diferenciados.
En este trabajo, y sin importar el explante utilizado (incluso raíces), la formación de callos se ve favorecida por la exposición al tratamiento que involucra ácido a-naftalenacético (5 µM) y 6-furfurilaminopurina (4,64 µM), aunque en hojas, los porcentajes de generación de este tejido indiferenciado son un poco más bajos. En consecuencia, la utilización de esa combinación hormonal, y de explantes provenientes de tallos y hojas, se constituye en una alternativa adicional para la inducción de callos en B. orellana L. y en posteriores suspensiones celulares potencialmente productoras de los metabolitos de interés.
AGRADECIMIENTOS
Al Comité para el Desarrollo de la Investigación (CODI) y a la Universidad de Antioquia por la financiación del proyecto CIQF-066.
REFERENCIAS
1. Fonnegra, R., Jiménez, S. L. (1999) Plantas medicinales aprobadas en Colombia. Ed. Universidad de Antioquia, serie Yuluka, 1.Ed, pp. 15-17. [ Links ]
2. Mercadante, A.Z., Pfander, H. (1998) Carotenoids from annato: a review. Recent Research Developments in Agriculture and Food Chemistry, 2(1): 79-91[ [ Links ]STANDARDIZEDENDPARAG]
3. Rodríguez, P.M. (1983) Plantas de la medicina popular Venezolana de venta en herbolarios. Sociedad Venezolana de Ciencias Naturales. Editorial Sucre, Caracas. pp. 25-27[ [ Links ]STANDARDIZEDENDPARAG]
4. Bernal, H., Bernal, Y., Correa, J.E. (1989) Especies vegetales promisorias de los países del convenio Andrés Bello, Tomo II. Ed. Secretaría ejecutiva del convenio Andrés Bello, Ministerio de Educación y Ciencia de España y la Junta del Acuerdo de Cartagena. pp. 260-289[ [ Links ]STANDARDIZEDENDPARAG]
5. Parrotta, J.A. (2001) Healing plants of peninsular India. CAB International, Wallingford, U.K. 944 p[ [ Links ]STANDARDIZEDENDPARAG]
6. Otero, R., Fonnegra, R., Jiménez, S. (2000) Plantas utilizadas contra mordedura de serpientes en Antioquia y Choco, Colombia. Otero, Fonnegra y Jiménez Editores, 1 Ed. Medellín, Colombia. 402 p [ Links ]
7. Otero, R., Núñez, V., Jiménez, S., Fonnegra, R., Osorio, R., García, M., et al. (2000b). Snakebites and ethnobotany in the northwest region of Colombia. Part II: Neutralization of letal and enzymatic effects of Bothrops atrox venom. J. Ethnopharmacology, 71: 505-511[ [ Links ]STANDARDIZEDENDPARAG]
8. Otero, R., Núñez, V., Barona, J., Fonnegra, R., Jiménez, S., Osorio, R. G., et al. (2000c) Snakebites and ethnobotany in the northwest region of Colombia. Part III: Neutralization of the haemorrhagic effect of Bothrops atrox venom. J. Ethnopharmacology, 73: 233-241[ [ Links ]STANDARDIZEDENDPARAG]
9. Otero, R., Núñez, V., Barona, J., Saldarriaga, M., Fonnegra, R., Osorio, R., et al. (2000d) Neutralization of edema-forming and defibrinating effects of Bothrops atrox asper venom by extracts of plants used by healers in Antioquia and Chocó, Colombia. In: Cordovez J.M., Abstracts XV International Congress for Tropical Medicine and Malaria. Corcas editores Ltda, Bogotá. pp. 186[ [ Links ]STANDARDIZEDENDPARAG]
10. Belfort, A.J.L., Kato, O.R., Kato, M. do S.A. (1992) Practical method of drying annatto seeds for seedling production. Circular Técnica 67, Centro de Pesquisa Agropecuaria do Tropico Umido, EMBRAPA-CPATU, Belem, Brazil, 14 pp[ [ Links ]STANDARDIZEDENDPARAG]
11. Amaral, L.I.V., Pereira de, F.A., Cortelazzo, A.L. (1995) Dormancy breaking in seeds of Bixa orellana. Revista Brasiliera de Fisiología Vegetal. 7(2): 151-157[ [ Links ]STANDARDIZEDENDPARAG]
12. Eira, M.T.S., Mello, C.M.C. (1997) Bixa orellana L., Seed germination and conservation. Seed Sci., Tech. 25: 373-380. [ Links ]
13. Gowda, T.V. (1997) Interaction of snake venom phospholipases A2 with plant isolates. In: Kini R.M., (Ed.), Venom phospholipase A2 enzymes, John Wiley&Sons, Chichester. Pp. 124-127[ [ Links ]STANDARDIZEDENDPARAG]
14. Liogier, H.A. (1990) Plantas medicinales de Puerto Rico y del Caribe. Iberoamericana de Ediciones, Inc. San Juan. P.R. 563[ [ Links ]STANDARDIZEDENDPARAG]
15. Cuartas, Ch., S. (2003) Estudio preliminar para la obtención in vitro de células de Bixa orellana L. (achiote). Trabajo de grado para optar al título de magíster en Microbiología, Instituto de Biotecnología, Facultad de Ciencias, Universidad Nacional de Colombia. Bogotá Colombia. 106 p. [ Links ]
16. Castello, M.C., Phatak, A., Chandra, N., Sharon, M. (2002) Antimicrobial activity of crude extracts from plant parts and corresponding calli of Bixa orellana L. Indian Journal of Experimental Biology. 40: 1378-1381. [ Links ]
17. Sha Valli Khan, P., Prakash, E., Rao, K. (2002) Callus induction and plantlet regeneration in Bixa orellana L. an annatto-yielding tree. In Vitro Cell Dev. Biol. Plant, 38: 186-190. [ Links ]
18. Murashige, T., Skoog, F. (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15: 473-497[ [ Links ]STANDARDIZEDENDPARAG]
19. D' Souza, M.C., Sharon, M. (2001) In vitro clonal propagation of Annatto (Bixa orellana L.) In Vitro Cell Dev. Biol. Plant. 37: 168-172. [ Links ]
20. Salisbury, F.B., Ross, C.W. (1992) Plant Physiology 4 Ed. Wadsworth Publishing Company. Belmont, California. pag. 384-386 [ Links ]
21. Staudt, G. (1984) The effect of myo-inositol on the growth of callus tissue in Vitis. Journal Plant Physiology. 116: 161-166 [ Links ]