Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.13 no.1 Medellín Jan./Jun. 2006
Karina E. MOTATO R.1, Amanda I. MEJÍA G.1* y Ángela LEÓN P.2
1 Grupo de Ciencias de los Materiales. Facultad de Química Farmacéutica y el Instituto de Química de la Facultad de Ciencias Exactas y Naturales . Universidad de Antioquia. A.A. 1226. Medellín-Colombia
2 Grupo BIOALLI. Departamento de Alimentos. Facultad de Química Farmacéutica. Universidad de Antquia. A.A 1226. Medellín - Colombia.
* Autor a quien se debe dirigir la correspondencia: amejia@quimbaya.udea.edu.co
Recibido: Diciembre 12 de 2005 Aceptado: Marzo 23 de 2006
RESUMEN
Se estudia el desarrollo del cuerpo fructífero del hongo Pleurotus djamor en residuos de plátano (Musa Paradisíaca) y aserrín de abarco (Cariniana pyriformis) en diferentes mezclas así: Aserrín (100%), Hojas (100%), Tallo (100%), Aserrín-Hoja (50/50%), Aserrín-Tallo (50/50%), Aserrín-Fruto (50/50%), y una mezcla final de Aserrín-Hojas-Tallo y Fruto (25/25/25/25). De acuerdo con el diámetro micelial máximo alcanzado sobre los sustratos sometidos a diferentes temperaturas, y a las mayores actividades de las enzimas manganeso peroxidasa y lacasa, se escogen los sustratos Aserrín-Hojas (50/50) y Hojas (100) para el desarrollo del cuerpo fructífero. El sustrato Hojas (100%) resultó ser mas adecuado para la obtención de cuerpos fructíferos con una eficiencia biológica promedio del 24.1% ±-7.0 después de dos cosechas. Se hace la caracterización bromatológica de los hongos cosechados, así como de las hojas del plátano antes y después del cultivo de los hongos, para determinar su composición nutritiva y la factibilidad de esta especie para ser cultivada sobre residuos de hojas de plátano, residuos agroindustriales que se obtienen en alta cantidad en el país.
Palabras clave: Pleurotus djamor, residuos agroindustriales del plátano (Musa Paradisíaca), aserrín de abarco (Cariniana pyriformis), lacasa, manganesoperoxidasa.
EVALUATION OF THE AGROINDUSTRIAL WASTES OF BANANA (Musa paradisiaca) AND SAWDUST OF ABARCO (Cariniana pyriformis) AS SUBSTRATES FOR THE CULTURE OF THE FUNGUS Pleurotus djamor
ABSTRACT
The development of the Pleurotus djamor fungi fruit body on banana (Musa Paradisíaca) and sawdust (Cariniana pyriformis) remainders is studied for seven different mixtures: sawdust (100%), leaves (100%), stem (100%), sawdust-leaves (50/50%), sawdust-stem(50/50%), sawdust-fruit (50/50%) and a final mixture of sawdust-leaves-stem-fruit(25/25/25/25%). The micelial growth is analyzed at different temperatures. A according to the maximum micelial diameter and the larger activities of the manganese peroxidasa and lacase enzymes that were obtained , the sawdust-leaves (50/50%) and leaves (100%) remainders were chosen as substrates for the culture of the Pleurotus djamor fungus. The leaves substrate (100%), is successful for development of P. djamor fruit body with an average biology efficiency of 24.1% ±-7.0 after two fungi growths . Bromatology characterization of the mushrooms and the substrate of leaves before and after of the fungi cultivation is done in order to determine the nutritional composition and possibilities of cultivation of this fungi on agroindustrial remainers , which are obtained in large amount in Colombia.
Keywords: Pleurotus djamor, agroindustrial banana (Musa paradisiaca) remainers, sawdust (Cariniana pyriformis), lacase, manganesoperoxidase.
INTRODUCCIÓN
Una de las principales problemáticas ambientales en nuestro medio es la alta producción de residuos agroindustriales, los cuales, en la mayoría de los casos, son quemados o arrojados a los basureros, quebradas y ríos sin ningún tratamiento previo y contribuyen de esta manera a la degradación del ecosistema (1). La composición química de estos materiales es variada e incluye compuestos como la lignina, biopolímero aromático, recalcitrante y difícil de biodegradar (2). Dentro de las alternativas para el aprovechamiento de esta materia prima, está su uso como sustrato en el cultivo de los hongos basidiomicetos (3). Entre las ventajas que ofrece el cultivo de basidiomicetos, específicamente el Pleurotas, se destaca la posibilidad de cultivarlo en zonas tropicales y de utilizar una amplia gama de sustratos. Pero debido a esta diversidad de sustratos, la selección de cepas que se adapten a dichos sustratos proporciona información acerca de la adaptabilidad saprófita de los hongos a ellos. La capacidad de invadir diferentes sustratos se debe en gran medida a la producción de enzimas peroxidasas (4,5). La biodegradación por basidiomicetos se considera un proceso no-específico, oxidativo, el cual se lleva a cabo principalmente por la acción de tres tipos diferentes de enzimas: manganeso peroxidasas (MnPs), lignino peroxidasas (LiPs), y lacasa, conjunto de enzimas con alto poder degradativo.
La fructificación de este tipo de hongos sobre residuos agroindustriales altamente ligninocelulósicos conlleva un conjunto de transformaciones biológicas complejas, en las cuales las condiciones ambientales, nutritivas y genéticas de cada especie requiere investigación. En el cultivo de los hongos, el micelio vegetativo se induce a fructificar mediante estímulos externos como luz, disminución de la temperatura y aumento de la humedad relativa. Sin embargo, aún no está claramente establecido qué factores activan la diferenciación de la iniciación de la diferenciación al interior del basidiocarpo.
Para determinar las condiciones nutricionales apropiadas que favorecen las altas eficiencias biológicas y altos índices de proteína de los hongos cosechados, es indispensable encontrar diversos residuos agroindustriales, así como las diferentes temperaturas de crecimiento, que proporcionen información con respecto a la adaptación de las especies a distintos climas.
El objetivo general del presente trabajo es evaluar la capacidad de crecimiento del basidiomiceto Pleurotus djamor sobre residuos agroindustriales de Musa paradisíaca y Cariniana pyriformis a diferentes temperaturas de crecimiento micelial, lo cual es comprobado mediante la evaluación de la producción de las enzimas del complejo lignolítico y la caracterización bromatológica de los hongos y del sustrato antes y después del cultivo.
MATERIALES Y MÉTODOS
Pretratamiento de los sustratos
Los residuos de plátano se obtienen en el Urabá antioqueño. Las diferentes partes de los sustratos de plátano (Musa paradisiaca) (hojas, pseudotallos, fruto) se cortan a un tamaño de 1 cm2, y se someten a secado en estufa a 70ºC durante 48 Horas. El aserrín de abarco (Cariniana pyriformis) se obtiene en un aserradero en la ciudad de Medellín.
Microorganismo y condiciones de cultivo
Se utiliza la cepa Pleurotus djamor, recolectada en la vereda La Salada, en el municipio de Caldas, la cual es clasificada por la experta micóloga Ana Esperanza Franco Molano. Se toma un poco de tejido del basidiocarpo, se dispone en agar extracto de malta, se incuba a 25ºC durante 10 días. El aislado es llamado G0 (generación cero) y partir de este se emplean máximo dos repiques del aislado original.
Preparación del inóculo
Se utilizan cajas de petri de 100 x 15 mm, en las que se depositan 6 g de las diferentes mezclas. Aserrín (100%) –A-, Hojas (100%) -H-, Tallo (100%) -T-, Aserrín-Hoja (50/50%) -AH- , Aserrín-Tallo (50/50%) -AT-, Aserrín-Fruto (50/50%) -AF-, y una mezcla final de Aserrín-Hojas-Tallo y Fruto (25/25/25/25) -AHTF-. Se ajustan a una humedad del 75% y se someten a esterilización a 121°C durante 15 minutos. Se deja enfriar a temperatura ambiente. El pH en todas las mezclas está entre 6.0 y 6.5. Se inoculan con un cuadro de 0.5 cm2 de agar con el micelio crecido durante 10 días, dispuesto invertidamente en el centro de las cajas de petri con el sustrato. Las siete mezclas se incuban a tres diferentes temperaturas de crecimiento: 20, 26, y 15ºC. Todos los ensayos se efectúan por triplicado y se aplica el análisis multifactorial ANOVA con un nivel de confianza del 95%.
Crecimiento micelial
Se mide cada 48 horas, en 4 puntos equidistantes del centro de crecimiento. Luego de 9 días se determina la velocidad de crecimiento micelial en milímetros por día.
Obtención de extractos enzimáticos: Por cada sustrato se realiza la extracción de las enzimas producidas a distintos tiempos de crecimiento, adicionando al sustrato suficiente cantidad de agua para la extracción enzimática. Se someten a agitación por 1 hora a 450 rpm. El fluido extracelular se obtiene al exprimir con ayuda de un tamiz el sustrato, y centrifugado a 6000 rpm durante 30 minutos a temperatura ambiente. Se determinan la actividad de la MnP con el método descrito por Paszcynski 1986 (6), y de la lacasa, como lo describen por Bourbonnais et al 1990 (7).
Las actividades enzimáticas son reportadas como u/g de medio sólido. Los ensayos de la enzima fueron llevados a cabo por triplicado.
Para la selección del mejor sustrato se tuvo en cuenta el parámetro cinético de actividad específica para cada enzima medida (U/g sustrato seco), así como el crecimiento micelial.
Seguimiento de las actividades enzimáticas durante el cultivo y fructificación
Una vez escogidos los posibles sustratos y la temperatura más apropiada para el desarrollo de los hongos, se preparan sistemas de minicultivo, consistentes en 5 g de sustrato, se esterilizan e inoculan como se mencionó anteriormente. Las actividades enzimáticas se evalúan en estos sistemas de minicultivo de acuerdo a las diferentes etapas de crecimiento de los hongos así: Micelio, agregación de hifas, (nódulos hifales primarios), fructificación (pinhead 2-3 cm), cosecha (cuerpo fructífero) y poscosecha. Durante el crecimiento micelial de los hongos se mantiene el sustrato en completa oscuridad y a una temperatura de 25ºC. La fructificación es estimulada por aumento de la humedad relativa (88-90%) y sometiendo los sustratos a fotoperíodos de luz natural de 24 horas. El sustrato más favorable para el crecimiento de los hongos se escala a 100 g de sustrato seco y se cultiva en bolsas de polipropileno inoculados con suficientes cuadros de agar. El cultivo se lleva a cabo en dos grupos de experimentación por triplicado y los resultados de eficiencia biológica y bioconversión se reportan como la media +/- S.D.
Tanto los hongos obtenidos luego de dos cosechas, como el sustrato favorable para su crecimiento de los mismos, se analizan en su contenido de humedad, cenizas, grasa, proteína, fibra cruda, de acuerdo con métodos especificados según el AOAC (24).
RESULTADOS Y DISCUSIÓN
Crecimiento micelial
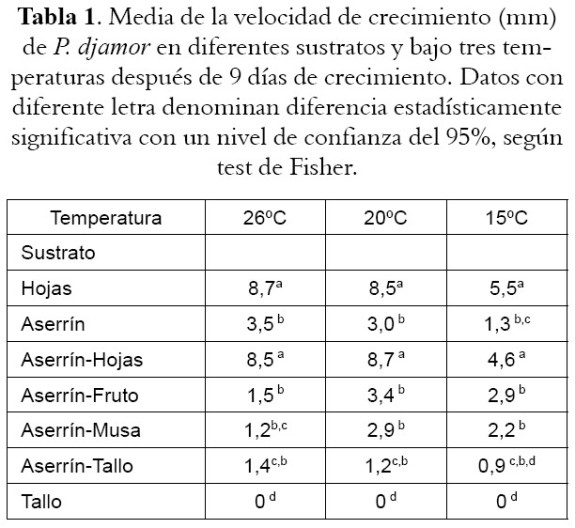
Los resultados del diámetro alcanzado por los diferentes sustratos bajo tres diferentes temperaturas se presentan en la tabla 1. Se observa una clara influencia de la temperatura sobre el crecimiento micelial, donde los diferentes sustratos muestran una menor velocidad de crecimiento bajo una temperatura de 15ºC. Las temperaturas de 20 y 26 ºC favorecieron el crecimiento del hongo, y aunque a 26ºC se obtuvieron los mejores resultados, no se encontró diferencia estadísticamente significativa entre los resultados de las dos temperaturas. En cuanto a la densidad y vigor del micelio sobre las diferentes mezclas en todas las temperaturas, se halló que los micelios crecidos sobre la mezcla AH y H fueron más densos que los demás sustratos. El aserrín, por su parte, mostró un micelio muy débil, y el crecimiento sobre los sustratos que contenían tallo dentro de su composición fue incipiente o inexistente.
Determinación de lacasa y manganesoperoxidasa (MnP) en el crecimiento micelial bajo tres temperaturas diferentes
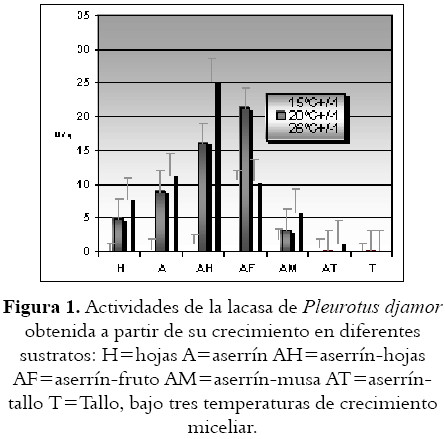
Los resultados de la actividad de la lacasa y la MnP en los diferentes sustratos a tres temperaturas diferentes se muestran en la figura 1 y 2 respectivamente. En ellas, se ilustran los valores de actividad específica (U/g) de lacasa y MnP obtenidos después de 9 días de crecimiento para las diferentes mezclas. Al igual que para el crecimiento micelial, las actividades enzimáticas fueron desfavorables para todos los sustratos que crecieon a una temperatura de 15ºC.
Sin embargo aun a 26°C no se obtuvo prácticamente actividad en los experimentos con tallo -T- y la actividad enzimática fue muy baja en las mezclas de sustratos que contenían el tallo de plátano con aserrín -AT-, lo cual indica que el tallo de plátano solo o aún mezclado con aserrín no es un sustrato adecuado para el cultivo de éste hongo. Para los otros sustratos, y específicamente para los experimentos con hojas -H-, aserrín solo -A-, la mezcla de aserrín y hojas -AH-, de aserrín y musa -AM- (mezcla de diferentes partes de la planta), la actividad de la lacasa fue mayor a 26 °C (véase figura 1).
Para los experimentos con H, A, AF, la actividad de la MnP fue mayor a 26°C (véase figura 2).
Dadas entonces las condiciones de velocidad de crecimiento y capacidad degradativa de los sustratos, se escogieron los sustratos H y AH para evaluarlos en el crecimiento y fructificación de los hongos.
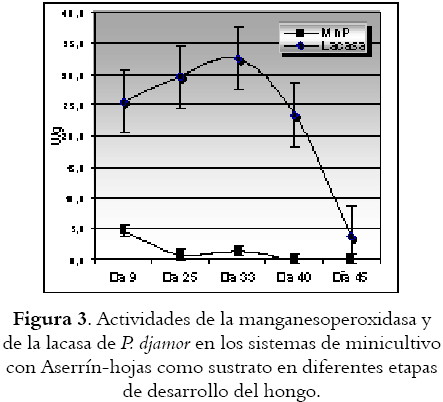
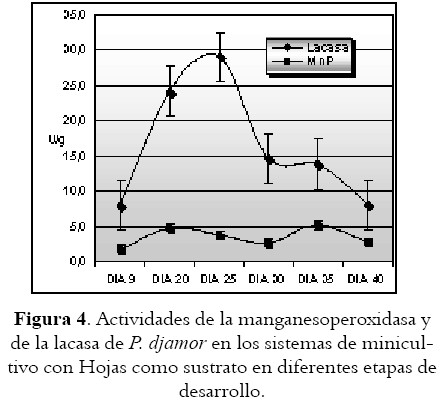
Determinación de lacasa y manganesoperoxidasa (MnP) en las diferentes etapas de crecimiento de los hongos
Las figuras 3 y 4 ilustran las actividades enzimáticas de acuerdo a la fase de desarrollo del hongo. Al igual que en los resultados anteriores, se obtiene mayor actividad de la enzima lacasa que de la manganesoperoxidasa en ambos sustratos de estudio. Las cinéticas de las enzimas MnP y lacasa muestran cómo esta última incrementa su producción justo en la etapa de fructificación de los hongos sobre ambos sustratos. Por su parte, la MnP se encuentra en mucha menor proporción en los sustratos de estudio y su actividad no se incrementó significativamente en ninguna de las etapas del proceso de fructificación.
Luego del proceso de minicultivo de los hongos sobre los sustratos, sobre la mezcla AH, la fructificación fue mucho más prolongada y los basidiocarpos obtenidos no lograron toda su elongación.
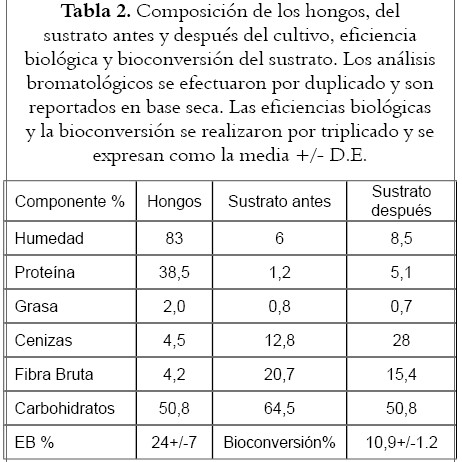
Composición bromatológica de los hongos y del sustrato antes y después del cultivo Eficiencia Biológica, Bioconversión del sustrato
Los análisis Bromatológicos antes y después del cultivo de los hongos, la Eficiencia Biológica expresada como:
EB = ((Peso Hongos Frescos)/(Peso Sustrato seco))*100
y la bioconversión es expresada como pérdida de peso del sustrato seco luego de la cosecha de los hongos, se presentan en la tabla 2.
Se observa que el contenido de proteína del sustrato, en relación con el de fibra bruta tiene un cambio considerable, lo que indica que el proceso causa una biotransformación de la última en proteína, de la cual habrá que determinar su valor biológico; en su composición proximal ya demuestra la importancia de partir de un residuo para obtener los alimentos proteicos que tanto requiere la humanidad.
CONCLUSIONES
Las hojas de plátano presentaron características apropiadas como sustrato para el desarrollo de los basidiocarpos de P. djamor, lo que se confirma con la eficiencia biológica obtenida, similar a la obtenida en especies de Pleurotus (9). Las cinéticas de las enzimas MnP y lacasa, muestran cómo esta última incrementa su producción justo en la etapa de fructificación de los hongos sobre ambos sustratos, evidenciando el rol fisiológico de esta enzima dentro del metabolismo y crecimiento del hongo, lo cual ya ha sido reportado por otros autores. Múltiples investigaciones han asociado el rol fisiológico de la enzima lacasa dentro del proceso de fructificación de los hongos (5,6,10). Otros estudios (4,11,12,13), que han evaluado en especial el papel de la enzima lacasa en la fructificación de los basidiomicetos, reportan actividades de 3.147 U/g empleando alcohol veratrílico (14, 15,16,17) como precursor de la actividad, y en este estudio se obtuvieron actividades de hasta 25.44 U/g. De acuerdo a los anteriores resultados, se encuentra un importante valor nutritivo en P. djamor, con alto contenido de proteínas y baja cantidad de grasa.
Los resultados obtenidos también muestran cómo a partir de una materia prima económica como son las hojas de Musa paradisíaca, se puede obtener hongos comestibles como el Pleorotus djamor, con alto porcentaje de proteína: 38,5 %, y bajo costo de producción bajo las condiciones climáticas propias de nuestra región, y similares a los obtenidos en otros estudios (17,18,19,21,22,23,24). Esto es importante y se debe continuar optimizando el proceso con el objetivo de cultivarlos a escala adecuada para convertirlos en una opción nutricional y de sutentabilidad, sobre todo para los pobladores del Urabá antioqueño, que producen grandes cantidades de hojas de plátano. Obtener productos de alto valor nutricional y comercial como los hongos ayudaría a mejorar su nivel de vida.
Estudios mercadotécnicos realizados por el DANE revelan cómo la producción, y consecuentemente las exportaciones de hongos comestibles, procesados o no, sólo manifiestan reactivación y unos primeros pasos hacia el desarrollo y comercialización en nuestro país en el año 2003; inclusive se muestra cómo en los últimos años los hongos procesados no fueron exportados. Casi la totalidad de la producción en el país está concentrada en el departamento de Antioquia (www.proexport.gov.co, 2003). Así, el panorama de cultivo de hongos en Colombia es un campo por explotar y con futuro, cuyo desarrollo dependerá en gran medida de los avances que se puedan lograr en el ámbito científico y tecnológico para su optimización.
AGRADECIMIENTOS
A la Vicerrectoría de Extensión, Gestión Tecnológica por la financiación de la investigación. Al Grupo Ciencia de los Materiales y al Laboratorio de Microbiología de Alimentos, laboratorios donde se realizó la investigación. A Diana Maria Granda Restrepo, Freimar Segura y Rosario Echeverri por su valiosa colaboración.
REFERENCIAS BIBLIOGRÁFICAS
1. Rodríguez, S., Fernández, M., Bermúdez, R., et al. (2003) Tratamiento de efluentes industriales coloreados con Pleurotus spp. Rev Iberoam Micol. 20: 164-168. [ Links ]
2. Kües, U., Liu, Y. (2000). Fruiting Body Production in Basidiomicetes. Appl Microbiol Biotechnol. 54:141-152. [ Links ]
3. García, A., Torres, R. (2003) Producción de enzimas lignolíticas por Basidomycetes mediante la técnica de fermentación en sustrato sólido. Revista colombiana de biotecnología. 4 (1): 56-64. [ Links ]
4. Sanchez, A., et al. (2002) Biodegradation of Viticulture Wastes by Pleurotus: A Source of Microbial and Human Food and Its Potential Use in Animal Feeding. Journ of Agricul and Food Chem. 50, 2537-2542. [ Links ]
5. Leonowicz, A.; Matuszewka, A.; Luterek, J.; Ziegenhagen, D.;Wojta´s-Wasilewska, M.; Cho, N.; Hofrichter, M.( 1999) Biodegradation of lignin by white rot fungi. Fungal Gen. Biol., 27, 175-185. [ Links ]
6. Paszcynski, A., Huynh, Van-Ba., Crawford, R. (1986) Comparision of ligninase-1 and peroxidase M-2 from the white-rot fungus Phanerochaete chrysosporium. Archives of Biochem. and Biophis. 244 (2), 755. [ Links ]
7. Bourbonnais, R., Paice, M. G. (1990) oxidation of non-phenolic sustrates an expanded role for laccase in lignin biodegradation. FEMS lett. 267: 99-102. [ Links ]
8. Han, y. H; shin, k.s., youn h.d., hah, y. C., kang, s. (1996) Mode of action and active site of an extracellular peroxidase from Pleurotus ostreatus. Journal Biochemistry 314: 421-426. [ Links ]
9. Papinutti, V.L., Diorio, L.A., Forchiassin, F. (2003) Degradación de madera de álamo por Fomes sclerodermeus: producción de enzimas ligninolíticas en aserrín de álamo y cedro. Rev Iberoam Micol. 20: 16-20. [ Links ]
10. Peláez, F., Martínez, M.J., Martínez, A.T. (1995) Screening of 68 species of basidiomycetes for enzymes involved in lignin degradation. Mycol Res. 99: 37-42. [ Links ]
11. Thurston, C.F. (1994) The structure and function of fungal laccases. Microbiology-UK. 140: 19-26. [ Links ]
12. García, A. (2001) Producción de enzimas lignolíticas por basidiomycetes mediante la técnica de fermentación en sustrato sólido. Tesis. Universidad industrial de Santander, Escuela de Química, Bucaramanga. [ Links ]
13. Hatakka, A., (1994) Lignin Modifying Enzimes From Selected White Rot Fungi: Production And Role In Lignin Degradation. FEMS Microb. Rev. 13:125-135. [ Links ]
14. Papinutti, V.L., Diorio, L.A., Forchiassin, F. (2003) Efecto combinado del cobre y pH inicial del medio de cultivo sobre la producción de lacasa y manganeso peroxidasa por Stereum hirsutum (Willd) Pers. Rev Iberoam Micol. 20: 176-178. [ Links ]
15. Rupak, M.,Bishnu, P.,Chatterjee,Arun., Guha, K., (2002) Biochemical changes during fermentation of edible mushroom Pleurotus sajor-caju in whey. Process Biochem., 38, 723-725. [ Links ]
16. Suguimoto, H.H., Barbosa, A.M., R.F.H. Dekker, R.F.H., Castro, R.J.H., (2000) Veratryl alcohol stimulates fruiting body formation in the oyster mushroom, Pleurotus ostreatus. FEMS lett., 194,235-238. [ Links ]
17. Wang, D., Sakoda, A., Suzuki, M., (2001) Biological efficiency and nutritional value of Pleurotus ostreatus cultivated on spent beer grain. Biore Tech., 78 (3), 293-300. [ Links ]
18. Cohen, R., Persky, L., Hadar, Y., (2002) Biotechnological applications and potential of wood-degrading mushrooms of the genus Pleurotus. Appl and Env Micro., 58, 582-594. [ Links ]
19. Programa STATGRAPHICS Plus for Windows Version 4 (1999).
20. Silva, E.M., Machuca, A., Milagres, A.M.F., (2004) Evaluating the growth and enzyme production from Lentinula edodes strains. Process Biochem., 95,167-172. [ Links ]
21. Laufenberg, G., Kunz, B., Nystroem, M., (2003) Transformation of vegetable waste into value added products: (A) the upgrading concept; (B) practical implementations. Bior Tech., 87,167-198. [ Links ]
22. Manzi, P., Aguzzi, A., Pizzoferrato, L., (2001) Nutritional value of mushrooms widely consumed in Italy. Food Chem., 73 (3), 321-325. [ Links ]
23. Stephen, J., Mdachi, M., Mayunga, H., et al (2004) Amino acid composition of some Tanzanian wild mushrooms. Food Chem., 86, 179-182[ [ Links ]STANDARDIZEDENDPARAG]
24. Ramirez, G.y col. Manual de Laboratorio de Bromatología QFF-137. (1999) Universidad de Antioquia, Facultad de Química Farmacéutica., 27-46. [ Links ]