Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Vitae
versión impresa ISSN 0121-4004
Vitae v.13 n.1 Medellín ene./jun. 2006
Edison J. OSORIO D1. , Guillermo L. MONTOYA P.1, Katalina MUÑOZ D.1 y Gabriel J. ARANGO A.1*
1 Grupo de Investigación en Sustancias Bioactivas (GISB). Facultad de Química Farmacéutica. Corporación de Patologías Tropicales. Universidad de Antioquia. A.A. 1226. Medellín-Colombia.
* Autor a quien se debe dirigir la correspondencia: gjarango@quimbaya.udea.edu.co
Recibido: Enero 26 de 2006 Aceptado: Marzo 30 de 2006
RESUMEN
En el desarrollo de estudios etnobotánicos o quimiotaxonómicos en búsqueda de sustancias biológicamente activas con efectos antiparasitarios a partir de plantas colombianas de la familia Annonaceae, fue observada la actividad antiplasmodial sustancial para los extractos de acetato de etilo de tallos de Rollinia pittieri y Pseudomalmea boyacana (Annonaceae), los alcaloides aislados a partir de éstas fueron estudiados. De los compuestos, liriodenina presentó la mayor actividad contra las cepas de Plasmodium falciparum sensible y resistente a cloroquina (CI50 = 8.0-10,0 µg/ml). Igualmente fue evaluada la capacidad de inhibición de la formación de la ß-hematina (Ifß-h) a los metabolitos aislados. O-metilmoschatolina y melosmina presentaron porcentajes de inhibición mayor del 96% cuando fueron evaluados a una concentración de 2 mg/ml. Algún grado de actividad citotóxica fue observada en todos los alcaloides oxoaporfínicos aislados contra células U-937.
Palabras clave: actividad antiplasmodial, Annonaceae, plantas colombianas y alcaloides aporfínicos.
ANTIPLASMODIAL ACTIVITY OF APORPHINE ALKALOIDS FROM Rollinia pittieri AND Pseudomalmea boyacana (ANNONACEAE)
ABSTRACT
In the course of from ethnobotanical or chemotaxonomical studies on biologically active substances with antiparasitic effects from Anonaceae colombian plants, substantial antiplasmodial activity was observed from the ethyl acetate extract of the stem of Rollinia pittieri and Pseudomalmea boyacana (Annonaceae), the alkaloids isolated from these were studied. Of the alkaloids, liriodenine exhibited the highest activity against chloroquine sensitive and chloroquine resistant strains of Plasmodium falciparum (CI50 = 8.0-10.0 µg/ml). In addition, inhibition of ß-hematin formation (Ifß-h) by isolated compounds was evaluated (Ifß-h). O-methylmoschatoline and melosmine showed inhibition percentage >96% at 2 mg/ml. Some degree of cytotoxic to U-937 cells activity was observed by oxoporphine alkaloids.
Keywords: antiplasmodial activity, Annonaceae, colombian plants and aporphine alkaloids.
INTRODUCCIÓN
La malaria es una enfermedad producida por parásitos del género Plasmodium. Según cálculos de la Organización Mundial de la Salud (OMS), anualmente ocurren entre 300 y 500 millones de casos clínicos de la enfermedad, de los cuales 1,5 a 2,7 millones son mortales; además; 2.400 millones de personas viven en regiones de alto riesgo para su transmisión, lo que hace de esta enfermedad la principal causa de morbilidad y mortalidad en 90 países ubicados en las regiones tropicales y subtropicales del mundo, especialmente al sur del Sahara en África, el sudeste de Asia y Latinoamérica (1).
El tratamiento de la malaria se ha realizado con diversos medicamentos que actúan sobre estadios eritrocíticos del parásito, entre los que se encuentran la quinina, un alcaloide aislado a partir de especies del género Cinchona (Rubiaceae) y otros derivados sintéticos desarrollados posteriormente como mefloquina y cloroquina (2). El descubrimiento reciente más importante es la artemisinina, una sesquiterpen lactona obtenida de Artemisia annua (Asteraceae) y el desarrollo de sus derivados, el artemether y el artesunato, medicamentos de rápida acción y efectivos contra cepas de P. falciparum resistentes a múltiples medicamentos (3). Sin embargo, la actividad de la artemisinina y sus derivados se ve afectada por su baja solubilidad y pobre biodisponibilidad. Además, aunque los derivados presentan una mejor absorción, rápida acción y mayor efectividad contra P. falciparum multirresistente, ocasionan citotoxicidad y acarrean efectos adversos importantes (4,5). No obstante, el tratamiento de la malaria continúa como uno de los mayores retos para los programas de control debido al fenómeno de resistencia del parásito contra los medicamentos, que ha llevado a la necesidad de desarrollar nuevos compuestos antimaláricos que permitan mejorar el control de la enfermedad.
En un tamizaje preliminar (6), los extractos de acetato de etilo de tallos de Rollinia pittieri Saff. y Pseudomalmea boyacana (J.F. Macbr.) Chatrou., presentaron actividad antiplasmodial in vitro a concentraciones de 8 µg/ml contra cepas de Plasmodium falciparum sensibles (F32) y resistentes (W2) a la cloroquina. Además, ambas especies de plantas presentaron el mayor índice de selectividad cuando fue comparada la actividad antiparasitaria contra la actividad citotóxica sobre células U-937.
El propósito del presente trabajo fue profundizar en el estudio de estas plantas y dirigir la búsqueda hacia las moléculas responsables de la actividad biológica. En el trabajo se describe el aislamiento biodirigido por actividad de cinco alcaloides a partir de tallos de R. pittieri y P. boyacana y la actividad biológica in vitro de estos compuestos contra dos cepas de P. falciparum. Igualmente fue evaluada la capacidad de inhibición de la formación de la ß-hematina, sustancia sintética e idéntica a la hemozoína (pigmento malárico). Una de las hipótesis mayormente aceptadas es que la cloroquina y otros antimaláricos quinolínicos actúan inhibiendo la formación de la hemozoína; por lo tanto, este proceso permanece como blanco atractivo para la búsqueda de nuevos compuestos antimaláricos (7). También es reportada la actividad citotóxica de los cinco compuestos contra células U-937.
MATERIALES Y MÉTODOS
Material vegetal
Las especies R. pittieri y P. boyacana fueron colectadas desde su hábitat natural en el corregimiento de Lomas Aisladas, Municipio de Turbo (Antioquia, Colombia). Las muestras de herbario fueron determinadas por M.Sc. Fernando Alzate (A 1072 y A 1039, respectivamente) y depositadas en el Herbario de la Universidad de Antioquia (HUA), Medellín-Colombia.
Extracción y aislamiento
El material vegetal seco y molido de R. pittieri (2,7 kg) y P. boyacana (3,1 kg) fue desengrasado con n-hexano durante un período de 2,5 días. Una vez comprobada la actividad antiparasitaria de la fracción alcaloidal de R. pittieri (2,8 g) se aislaron dos compuestos, O-metilmoschatolina [1] y melosmina [2]. La fracción alcaloidal de P. boyacana (3,1 g) se sometió a fraccionamiento por cromatografía en gel (Sephadex LH-20). El proceso dio como resultado el aislamiento de liriodenina [3], atherospermidina [4] e isomoschatolina [5]. La caracterización estructural de los diferentes compuestos se realizó por RMN (mono – H1 y C13–y bidimensional – COSY, NOESY, HMQC, HMBC-), EM, UV e IR, junto a diversas determinaciones físicas.
Actividad antiplasmodial in vitro
La actividad antiplasmodial se realizó por el método de cultivo continuo in vitro desarrollado por Trager y Jensen (8). De acuerdo con esta técnica, las formas parasitarias de P. falciparum cepa F32 sensible a la cloroquina y cepa W2 resistente a la cloroquina, fueron cultivadas en medio RPMI 1640, suplementado con suero humano al 10 % y un hematocrito del 4 % (Grupo sanguíneo O, Rh+) a 37ºC en atmósfera modificada. Los extractos fueron disueltos en DMSO y la cloroquina en agua destilada estéril para luego ser diluidos con el mismo medio obteniéndose las concentraciones requeridas (0,10; 1,0 y 10,0 µg/ml). Los cultivos fueron sincronizados con una parasitemia y un hematocrito del 1 y 2 % respectivamente, estos fueron dispensados en un volumen de 100 µl en placas de 96 pozos por duplicado, se adicionaron 100 µl de los extractos, y finalmente fueron incubados a 37ºC durante 48 horas. Pasado este tiempo de incubación se eliminó completamente la fase superior del cultivo, para realizar un frotis del sedimento de cada pozo, fijando luego con metanol y realizando la tinción con Giemsa. Estas placas fueron observadas en el microscopio con lente de inmersión 100x, contando glóbulos rojos no infectados (GRL) y glóbulos rojos infectados (GRI), para obtener el porcentaje (%) de Inhibición calculado mediante la fórmula 1:
%Inhibicion=((GRL-GRI)/GRL)*100
El cálculo para hallar la Concentración Inhibitoria del 50 % en la maduración de los esquizontes (CI50), se realizó con un método gráfico mediante el programa Cricket Graph 1.3, considerándose como activos aquellos que presentaron una CI50 menor a 10 µg/ml.
Inhibición de la formación de la ß-hematina
Para el ensayo de inhibición de la formación de la ß-hematina se utilizó el método de Baelmans y colaboradores (9) con algunas modificaciones. En resumen, la síntesis de la ß-hematina fue realizada con una mezcla de 100 µl de hemina 6,5 mM recién preparada disuelta en una solución de NaOH 0,2 N, 50 µl de ácido acético glacial 17,4 M, 50 µl de agua destilada y 200 µl de tampón acetato de sodio trihidratado 3 M, pH, final aproximadamente 4,0. Se incubó por 1h a 60ºC. Posteriormente fue centrifugada a 12.000 rpm durante 10 min; luego de descartar el sobrenadante, el precipitado se lavó 3 veces con 200 µl de DMSO para remover la hemina no reaccionante. El sólido ß-hematina obtenido fue disuelto en una solución de NaOH 0,1N, de la cual se tomó una alícuota para la lectura espectrofotométrica a 386 nm y correspondió al 100% de ß-hematina sintetizada. La formación de ß-hematina se monitoreó por espectroscopia IR-TF. Para la evaluación de la actividad inhibitoria de los extractos, los 50 µl de agua destilada fueron remplazados por una solución del extracto correspondiente a una concentración final de 2,5 mg/ml y con la lectura espectrofotométrica fue calculado el porcentaje de inhibición mediante la fórmula 2:
%Inhibición=100*(1-(Abmuestra/Abcontrol))
donde Abmuestra y Abcontrol son la absorbancia de la ß-hematina con y sin el uso de extractos, respectivamente. El difosfato de cloroquina (CQ) fue utilizado como control positivo y su actividad inhibitoria fue expresada en términos de CI50, es decir, la concentración de CQ necesaria para la inhibición del 50% de la formación de ß-hematina, y se calculó mediante el paquete estadístico GraphPad Prism® demo, Versión 4,00 para Windows, (GraphPad software, Inc, San Diego CA 2003). Los ensayos fueron realizados por triplicado.
Ensayo de citotoxicidad
La actividad citotóxica de los compuestos fue evaluada en células promonocíticas humanas U-937. Para estimar la concentración letal 50 (LC50), fue utilizado el micrométodo enzimático 3-(4,5-dimethyithiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) (10). Fueron usadas como controles células cultivadas en ausencia de tratamiento pero mantenidas bajo las mismas condiciones. Dos experimentos independientes, por triplicado, fueron desarrollados para la determinación de la citotoxicidad de cada compuesto. Los resultados son expresados como CL50 y calculados mediante el programa de análisis Probit.
RESULTADOS Y DISCUSIÓN
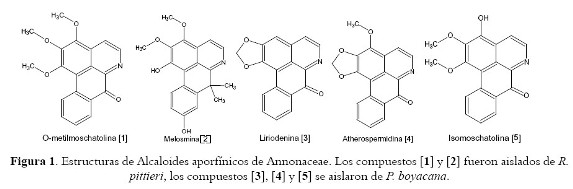
El aislamiento biodirigido por actividad de los extractos de acetato de etilo de tallos de R. pittieri y P. bayacana permitió la caracterización de cuatro alcaloides oxoaporfínicos O-metilmoschatolina [1] (11-14), liriodenina [3] (11-13,15-17) atherospermidina [4] (18-19) e isomoschatolina [5] (17) y un alcaloide de núcleo 7,7-dimetilaporfínico, melosmina [2] (11,20). La identificación estructural de los compuestos 1-5 (véase figura 1) fue realizada comparando los datos espectroscópicos (UV, IR, EM, RMN H-1 y C13) y físicos con los reportados en la literatura. Copias de los espectros originales se pueden obtener del autor.
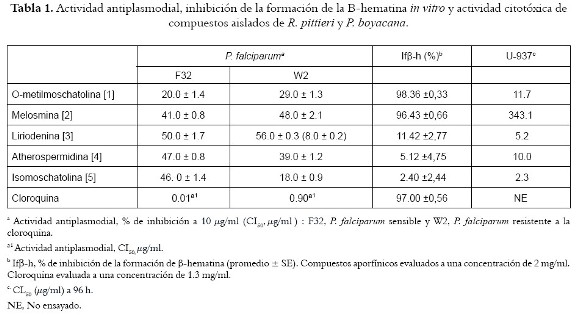
La actividad antiplasmodial in vitro (valores de % de inhibición y CI50) de los compuestos aislados a partir de R. pittieri y P. boyacana puede verse en la tabla 1. A partir de los resultados obtenidos en este estudio, no fue posible determinar relaciones de estructura- actividad para los compuestos ensayados. No obstante, es interesante observar que liriodenina presentó la mayor actividad contra las cepas de P. falciparum tanto sensible como resistente a cloroquina (CI50 = 8,0-10,0 µg/ml). La actividad antiparasitaria de [3] estuvo en concordancia con previos reportes (21-23). Sin embargo, el compuesto y todos los alcaloides oxoaporfínicos ensayados presentaron algún grado de citotoxicidad. Liriodenina ha sido reportado como responsable de la actividad acaricida, antimicrobiana y antimicótica de un número importante de plantas (24-27) y presenta propiedades anticancerígenas, citotóxicas y antivirales por inhibición de la topoisomerasa II (28-31). Según nuestro conocimiento, éste es el primer reporte de actividad antiplasmodial para los compuestos [2] y [4].
Igualmente fue evaluada la capacidad de inhibición de la formación de ß-hematina (Ifß-h) (véase tabla 1). La relevancia de evaluar dicha actividad se basa en la siguiente observación: durante su ciclo intraeritrocítico, el parásito de la malaria degrada una gran cantidad de hemoglobina presente en el citoplasma de la célula hospedera (entre 60-80%) (32). Durante el proceso de proteolisis de hemoglobina en su vacuola digestiva ácida, se produce heme (Ferriprotoporfirina IX), un compuesto potencialmente tóxico para el parásito (33). El parásito carece de heme oxigenasa, enzima que dispone del compuesto en otras especies, entonces lo detoxifica, en parte por su incorporación en una sustancia cristalina, inerte e insoluble denominada hemozoína (o pigmento malárico) (34), y el resto por procesos de degradación peroxidativos (33). Esta función especializada hace de la vacuola digestiva un blanco atractivo para la búsqueda de nuevos compuestos antimaláricos; un compuesto capaz de inhibir la formación de hemozoína podría ser potencialmente letal para el parásito. Para muchas sustancias, la habilidad de inhibir está formación esta directamente relacionada con su potencia antimalárica (35,36).
Una sustancia similar a la hemozoína, la ß-hematina, puede ser formada in vitro a partir de una solución de hemina (hidroxi-ferriprotoporfirina IX) bajo ciertas condiciones de pH, temperatura y concentración de sales, que simulan el ambiente de la vacuola digestiva (37,38). La ß-hematina sintética es espectrofotométrica y químicamente idéntica a la hemozoína; además, conserva las propiedades de solubilidad de la sustancia nativa (39), siendo útil en el estudio y diseño de nuevos agentes terapéuticos. La metodología aplicada para la formación de ß-hematina se monitoreó por espectroscopía de IR-TF, en donde se distingue inequívocamente hemina de ß-hematina. El espectro IR de ß-hematina mostró bandas a 1.662 y 1.209 cm-1, características de la unión hierro-carboxilato (40), las cuales no están presentes en el espectro IR de la hemina (datos no mostrados).
Los compuestos [1] y [2] presentaron la mayor actividad Ifß-h cuando fueron evaluados a una concentración de 2 mg/ml. A pesar de ello, no se observó una correlación importante con la actividad antiplasmodial. Esto puede explicarse por factores relacionados con la incapacidad de los principios activos de alcanzar el sitio de formación de la hemozoína y de acumularse en la vacuola digestiva ácida del parásito a concentraciones efectivas durante el ensayo in vitro. Por su parte, liriodenina no presentó actividad Ifß-h, estableciendo que la actividad antiplasmodial observada no obedece a la inhibición de la formación de hemozoína; sin embargo, ésta fue la más alta alcanzada para aquellos compuestos aislados de P. boyacana.
Ninguno de los compuestos evaluados presentó actividad antiplasmodial comparable con la droga estándar (cloroquina); no obstante; la baja toxicidad mostrada por algunos de ellos, particularmente compuestos no oxoaporfínicos, ofrece estructuras promisorias. Es razonable concluir que los alcaloides aporfínicos, aislados a partir de los tallos de R. pittieri y P. boyacana son responsables de su actividad antiplasmodial, en especial, compuestos como melosmina y liriodenina; sin embargo, es posible también pensar en procesos de sinergismo debido a la potente actividad de los extractos. Finalmente, es importante mencionar que otros alcaloides aporfínicos han mostrado potente actividad antiprotozoaria in vitro (41) e in vivo (42): de esta forma, algunos de los alcaloides aislados en este trabajo podrían ser considerados como moléculas bases para el desarrollo de fármacos antiparasitarios.
Desde el punto de vista quimiotaxonómico, se establece que liriodenina, atherospermidina e isomoschatolina son reportados por primera vez en tallos de P. boyacana. Es la primera vez que se reporta un metabolito aislado a partir del género Pseudomalmea. Por su parte, los compuestos O-metilmoschatolina y melosmina, son reportados por primera vez en tallos de R. pittieri; además, es la primera vez que se reporta un alcaloide de núcleo 7,7-dimetilaporfinoide en el género Rollinia.
AGRADECIMIENTOS
Este trabajo fue financiado por COLCIENCIAS (Contrato No. RC 108-2003) y CODI-Universidad de Antioquia (Acta No. CPT 0313). Igualmente agradecemos a la Dra. Grace Ruiz, del Instituto de Investigaciones Fármaco Bioquímicas de la Universidad Mayor de San Andrés (La Paz-Bolivia) por la realización de los ensayos antiparasitarios.
REFERENCIAS BIBLIOGRÁFICAS
1. WHO Expert Committee on Malaria (2000) “Technical Report Series, Twentieth Report”. World Health Organization, Geneva. [ Links ]
2. Marshall, E. (2000) Drugs. Reinventing an ancient cure for malaria. Science. 290 (5491) : 437-439. [ Links ]
3. Wright, C.W. (2004) Trease and Evans Pharmacognosy. WC Evans and WB Saunders (Ed) Edinburgh. pp. 407–413. [ Links ]
4. Beekman, A., Barentsen, A., Woerdenbag, H. (1997) Stereochemistry dependent cytotoxicity of some artemisinin derivates. J Nat Prod. 60 (4) : 325-330. [ Links ]
5. Galal, A., Ahmad, M., El-Feraly, F., et al. (1996) Preparation and characterization of a new artemisinin-derived dimer. J Nat Prod. 59 (10) : 917-920. [ Links ]
6. Osorio, E., Arango, G., García, E., et al. (2005) Actividad antiplasmódica in vitro e inhibición de la formación de la ß-Hematina de plantas colombianas de la familia Annonaceae. Acta Farm Bonaerense. 24 (4) : 527-532. [ Links ]
7. Egan, T.J. (2004) Haemozoin formation as a target for the rational design of new antimalarials. Drug Des Review. 1 (1) : 93-110. [ Links ]
8. Trager, W., Jensen, J.B. (1976) Human malaria in continuous culture. Science. 193 (4254) : 673-675. [ Links ]
9. Baelmans, R., Deharo, E., Bourdy, G., et al. (2000) A search for natural bioactive compounds in Bolivia through a multidisciplinary approach. Part IV. Is a new haem polymerisation inhibition test pertinent for the detection of antimalarial natural products?. J Ethnopharmacol. 73 (1-2) : 271-275. [ Links ]
10. Weniger, B., Robledo, S., Arango, G.J., et al. (2001) Antiprotozoal activities of Colombian plants. J Ethnopharmacol. 78 (2-3) : 193–200. [ Links ]
11. Guinaudeau, H., Leboeuf, M., Cavé, A. (1983) Aporphinoid alkaloids, III. J Nat Prod. 46 (6) : 761-835. [ Links ]
12. Harrigan, G.G., Leslie, A.A., Kingston, D.G.I. (1994) Isolation of bioactive and other oxoaporphine alkaloids from two annonaceous plants, Xylopia aethiopica and Miliusa CF. banacea. J Nat Prod. 57 (1) : 68-73. [ Links ]
13. Kithsiri, E.M., Hatanaka, Y., Kikuchi, T., et al. (1996) A dioxoaporphine and other alkaloids of two annonaceous plants of Sri Lanka. Phytochemistry. 42 (6) : 1703-1706. [ Links ]
14. Mahmood, K., Chan, K.C., Park, M.H., et al. (1986) An aporphinoid alkaloid from Pseuduvaria macrophylla. Phytochemistry. 25 (6) : 1509-1510. [ Links ]
15. Brash, R.M., Sneden, A.T. (1983) Oxoaporphine alkaloids from Rollinia sericea. J Nat Prod. 46 (3) : 437-437. [ Links ]
16. Dabrah, T.T., Sneden, A.T. (1983) Oxoaporphine alkaloids from Rollinia papilionella. J Nat Prod. 46 (3) : 436-436. [ Links ]
17. Guinaudeau, H., Leboeuf, M., Cavé, A. (1975) Aporphinoid alkaloids. Lloydia. 38 (4) : 275-338. [ Links ]
18. Cortes, D., Torrero, M.Y., D’ocon M.P., et al. (1990) Norstephalagine et atherospermidine, deux aporphines D’ Artabotrys mazngayz relaxantes du muscle lisse. J Nat Prod. 53 (2) : 503-508. [ Links ]
19. Kithsiri, E.M., Leslie, A.A., Kingston, D.G., et al. (1995) Artabotrine: a novel bioactive alkaloid from Arttiotrys zeylanicus. Tetrahedron. 51 (29) : 7877-7882. [ Links ]
20. Zabel, V., Watson, H. (1982) Melosmine and melosmidine, 7,7-dimethyltetrahydroaporphine alkaloids from Guatteria melosma. J Nat Prod. 45 (1) : 94-101. [ Links ]
21. Camacho, M.R., Kirby, G.C., Warhurst, D.C., et al. (2000) Oxoaporphine alkaloids and quinones from Stephania dinklagei and evaluation of their antiprotozoal activities. Planta Med. 66 (5) : 478-480. [ Links ]
22. Mbah, J.A., Tane, P., Ngadjui, B.T., et al. (2004) Antiplasmodial agents from the leaves of Glossocalyx brevipes. Planta Med. 70 (5) : 437-440. [ Links ]
23. Waechter, A.I., Cavé, A., Hocquemiller, R., et al. (1999) Antiprotozoal activity of aporphine alkaloids isolated from Unonopsis buchtienii (Annonaceae). Phytother Res. 13 (2) : 175–177. [ Links ]
24. Akendengue, B., Ngou-Milama, E., Bourobou, H.B., et al. (2003) Acaricidal activity of Uvaria versicolor and Uvaria klaineana (Annonaceae). Phytother Res. 17 (4) : 364-367. [ Links ]
25. Khan, M.R., Kihara, M., Omoloso, A.D. (2002) Antimicrobial activity of Michelia champaca. Fitoterapia. 73 (7-8) : 744–748. [ Links ]
26. Nissanka, A.P., Karunaratne, V., Ratnayake, B.M., et al. (2001) Antimicrobial alkaloids from Zanthoxylum tetraspermum and caudatum. Phytochemistry. 56 (8) : 857-861. [ Links ]
27. Zhang, Z., ElSohly, H.N., Jacob, M.R., et al. (2002) New sesquiterpenoids from the Root of Guatteria multivenia. J Nat Prod. 65 (6) : 856-859. [ Links ]
28. Goren, A.C., Zhou, B.N., Kingston, D.G. (2003) Cytotoxic and DNA damaging activity of some aporphine alkaloids from Stephania dinklagei. Planta Med. 69 (9) : 867-868. [ Links ]
29. Hsieh, T.J., Liu, T.Z., Chern, C.L., et al. (2005) Liriodenine inhibits the proliferation of human hepatoma cell lines by blocking cell cycle progression and nitric oxide-mediated activation of p53 expression. Food Chem Toxicol. 43 (7) : 1117–1126. [ Links ]
30. Woo, S.H., Reynolds, M.C., Sun, N.J., et al. (1997) Inhibition of topoisomerase II by liriodenine. Biochem Pharmacol. 54 (4) : 467-473. [ Links ]
31. Woo, S.H., Sun, N.J., Cassady, J.M., et al. (1999) Topoisomerase II inhibition by aporphine alkaloids. Biochem Pharmacol. 57 (10) : 1141–1145. [ Links ]
32. Francis, S., Sullivan, D., Goldberg, D. (1997) Hemoglobin metabolism in the malaria parasite Plasmodium falciparum. Annu Rev Microbiol. 51 (1) : 97-123. [ Links ]
33. Loria, P., Miller, S., Foley, M., et al. (1999) Inhibition of the peroxidative degradation of haem as the basis of action of chloroquine and other quinoline antimalarials. Biochem J. 339 (pt2) : 363-370. [ Links ]
34. Goldberg, D., Slater, A (1992) The pathway of hemoglobin degradation in malaria parasites. Parasitol Today. 8 (8) : 280–283. [ Links ]
35. Dorn, A., Vippagunta, S.R, Matile, H, et al. (1998) An assessment of drug-haematin binding as a mechanism for inhibition of haematin polymerisation by quinoline antimalarials. Biochem Pharmacol. 55 (6) : 727-736. [ Links ]
36. Egan, T.J., Marques, H.M. (1999) The role of haem in the activity of chloroquine and related antimalarial drugs. Coordination Chemistry Reviews. 192 (1) : 493–517. [ Links ]
37. Adams, P., Egan, T., Ross, D., et al. (1996) The chemical mechanism of beta-haematin formation studied by Mossbauer spectroscopy. Biochem J. 318 (1) : 25-27. [ Links ]
38. Basilico, N., Pagani, E., Monti, D., et al. (1998) A microtitre-based method for measuring the haem polymerization inhibitory activity (HPIA) of antimalarial drugs. J Antimicrob Chemoter. 42 (1) : 55-60. [ Links ]
39. Pagola, S., Stephens, P., Bohle, D., et al. (2000) The structure of malaria pigment beta-haematin. Nature. 404 (6775) : 307-310. [ Links ]
40. Slater, A., Swiggard, W., Orton, B., et al. (1991) An iron carboxylate bond links the heme units of malaria pigment. Proc Natl Acad Sci USA. 88 (2) : 325-329. [ Links ]
41. Likhitwitayawuid, K., Dej-adisai, S., Jongbunprasert, V., et al. (1999). Antimalarials from Stephania venosa, Prismatomeris sessilifora, Diospyros montana and Murraya siamensis. Planta Med. 65 (8) : 754-758. [ Links ]
42. Muñoz, V., Sauvain, M., Mellinedo, P., et al. (1999) Antimalarial activity and cytotoxicity of (-)-roemrefidine isolated from the stem bark of Sparattanthelium amazonum. Planta Med. 65 (5) : 448-449. [ Links ]