Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.13 no.1 Medellín Jan./Jun. 2006
Liliana ÁVILA1, Eduard BAQUERO1, Amparo VIÑA2 y Elizabeth MURILLO2*
1 Departamento de Biología. Universidad del Tolima. Barrio Sta. Elena, Ibagué.
2 Departamento de Química. Universidad del Tolima. Barrio Sta. Elena, Ibagué.
* Autor a quien se debe dirigir la correspondencia: emurillo8@hotmail.com
Recibido: Enero 17 de 2006 Aceptado: Marzo 30 de 2006
RESUMEN
Se presenta el estudio de la actividad antibacteriana de la especie vegetal Diplostephium tolimense Cuatrec. (Asteraceae), colectada en el páramo del nevado del Tolima, la cual cuenta con pocos estudios químicos y farmacológicos, al igual que muchas otras especies de este ecosistema. A partir de un extracto etanólico crudo y mediante partición biodirigida se obtiene la fracción más simple de mayor actividad frente a Staphylococcus aureus (ATCC 25923). Paralelamente se realizan análisis fitoquímicos a las porciones de mayor bioactividad obtenidas durante todo el proceso. Se observa que la acción antibacteriana se incrementa al aumentar la simplicidad química del extracto y que terpenos y flavonoides parecen estar relacionados con la acción revelada. Se trata del primer reporte, hasta la fecha conocido, de actividad antibacteriana in vitro para D. tolimense.
Palabras clave: actividad antibaceriana, Diplostephium, fraccionamiento biodirigido, terpenos, flavonoides.
ANTIBACTERIAL ACTIVITY OF Diplostephium tolimense Cuatrec. (ASTERACEAE) AGAINST Staphylococcus aures
ABSTRACT
A study of antibacterial activity of the Diplostephium tolimense Cuatrec (Asteraceae) vegetal species, which was collected in the paramo of Tolima, is presented. This species, as many others of this ecosystem, has had few chemical and pharmacological studies. The simplest fraction with the largest activity against Staphylococcus aureus (ATCC 25923), is obtained starting from a raw ethanol extract and by means of bioassay guided partition. Parallelly, phytochemical analyses to the portions of greater bioactivity, obtained during the whole process, are carried out. It is observed that antibacterial action increases as the chemical simplicity increases and that the presence of terpenes and flavonoids seems to be related with this action. This is the first report, so far well-known, of in vitro antibacterial activity for D. tolimense.
Keywords: Antibacterial activity, Diplostephium, bioassay guided fractionation, terpenoids, flavonoids.
INTRODUCCIÓN
El aumento de microorganismos resistentes a los agentes antimicrobianos es el principal problema al que se enfrenta la ciencia médica en el tratamiento de las enfermedades infecciosas (1,2); su efecto es mayor en los países en vías de desarrollo, en donde por cada habitante se gasta menos de US $7 en salud, cifra insignificante frente a los US $1.500 a US $4.000 que puede costar el tratamiento de una persona que presente alguna enfermedad ocasionada por un agente patógeno resistente (3,4). Esta problemática tiene mayor incidencia en alteraciones orgánicas como tuberculosis, malaria, cólera, neumonías, etc., que en conjunto constituyen la causa de muerte de más de 10 millones de individuos anualmente en el mundo (5,6).
Lo anterior deja ver la necesidad de ampliar el arsenal terapéutico mediante el descubrimiento de moléculas bioactivas novedosas, las cuales pueden ser halladas a partir de fuentes naturales; sin embargo, los ambientes donde se las puede encontrar son agredidos por toda una serie de dinámicas sociales que amenazan con su destrucción y, por tanto, con la supresión de especies promisorias que habitan en estos ecosistemas (7,8). Merecen especial atención los páramos, ecosistemas frágiles y en alto riesgo de desaparición, reconocidos, entre otros cosas, por ser depositarios de una gran diversidad florística ampliamente estudiada desde el punto de vista ecológico (9-17) pero poco química o farmacológicamente.
El género Diplostephium pertenece a la tribu Asteridae, una de las más grandes de la familia Asteraceae; alberga cerca de 110 especies repartidas a lo largo de las zonas más altas de los Andes, desde Venezuela hasta el norte de Chile; generalmente son arbustos o pequeños árboles, de hojas alternas e inflorescencia de escasas a numerosas flores; algunas de estas plantas encuentran aplicación en la recuperación de focos de erosión severa, areneras y canteras (18). Pese a su vasta distribución, las especies de este género han sido poco estudiadas desde el punto de vista químico y/o biológico.
A partir de un estudio previo en el cual se seleccionan al azar plantas de la familia Asteraceae del páramo del Nevado del Tolima para evaluar su potencial antibacteriano, se encuentra que Diplostephium tolimense Cuatrec., presenta una mayor actividad y gran abundancia en este ecosistema, razón por la cual se decide obtener la fracción química más simple del extracto etanólico total, monitorear el fraccionamiento mediante la evaluación de la actividad antibacteriana de las porciones separadas frente a Staphylococcus aureus y asociar su composición química con la acción biológica revelada; todo esto en un intento de hacer una contribución al conocimiento científico de las especies vegetales de páramo y de la región tolimense en general.
MATERIALES Y MÉTODOS
Material vegetal
Las ramas terminales del vegetal en estudio se recolectaron en “La Cueva”, en el páramo del nevado del Tolima (3850 m.s.n.m.); la muestra se tomó en óptimo estado fitosanitario y de desarrollo vegetativo, el material fue secado a la sombra y se trituró en un molino eléctrico (tamiz 0.3 cm). Un ejemplar del vegetal fue depositado en el Herbario Nacional y referenciado con el número 505950.
Microorganismos
Las pruebas biológicas se realizaron con las bacterias Staphylococcus aureus (Gram positiva, ATCC 25923) y Escherichia coli (Gram negativa, ATCC 25922).
Preparación de extractos vegetales y fraccionamiento
Los extractos fluídos se prepararon por los procesos de maceración y soxhlet (50º C) con el fin de evaluar el rendimiento del método extractivo. En ambos procesos se empleó una relación 1:4, material vegetal-etanol del 96%; la extracción se realizó hasta el agotamiento de la muestra. El producto se llevó a sequedad y luego se particionó líquido-líquido con éter de petróleo (E. petrol) y acetato de etilo (AcOEt), obteniéndose así los subextractos E. petrol, AcOEt e hidroalcohólico (H2O-OH).
Los fraccionamientos posteriores se realizaron mediante cromatografía en columna abierta (CC), con sílica gel 60 como fase estacionaria (1:30, muestra-fase estacionaria). Para la primera columna se utilizó como muestra el subextracto de mayor bioactividad, el eluente fue una mezcla de diclorometano-metanol (9.5:0.5). La fracción con mayor actividad antibacteriana resultante de esta columna constituyó la muestra de la subsecuente cromatografía, aplicando en este caso como fase móvil diclorometano-metanol-éter de petróleo (8.0:0.8:1.2). Las fracciones de esta columna se denominaron subfracciones, aquellas con mayor potencial antibacteriano se refraccionaron por cromatografía preparativa, el solvente fue diclorometano-metanol-éter de petróleo (7.5:0.5:2.0).
La simplificación química de los extractos se monitoreó en todos los casos a través de un tamizaje fitoquímico, siguiendo la metodología propuesta por Sanabria (19) y modificada en algunas de sus partes en el Laboratorio de Fitoquímica de la Universidad del Tolima (20). La figura 1 ilustra el procedimiento de partición aplicado.
Actividad antibacteriana
La actividad de los extractos y subfracciones frente a las bacterias se realizó, con algunas modificaciones, de acuerdo al método de difusión en pozo descrito por Dobner et al. (21). 20 ml de agar Mueller Hinton se colocaron en cajas de Petri (Ø 10 cm); utilizando un sacabocados se hicieron tres pozos (Ø 0.5 cm) sobre el agar sólido, se inoculó el medio con una suspensión bacteriana en caldo tripticasa de soya, ajustada turbidimétricamente a Mc Farland 0.5. En cada pozo se aplicó 50 µl del extracto o fracción (80 mg/ml) disuelto en dimetilsulfóxido (DMSO), 50 µl de gentamicina (control positivo, 100 µg/ml) y DMSO (control negativo, 50 µl), respectivamente. Las cajas se incubaron (37º C, 24 h) y se determinó el diámetro y la presencia o no de zonas de inhibición. Cada ensayo se realizó por triplicado.
La bioactividad de las fracciones obtenidas por cromatografía preparativa se monitoreó siguiendo el método de bioautografía descrito por el CYTED (22), en el cual se colocó el cromatograma resultante de la cromatografía de capa delgada (CCD) sobre una capa de 10 mililitros de agar Mueller Hinton solidificado. A continuación se cubrió con 10 mililitros del medio de cultivo, se dejó enfriar y solidificar. Posteriormente se sembró la suspensión bacteriana ajustada a Mc Farland 0.5 y se incubó a 37°C por 24 horas. Al cabo de este tiempo se determinaron las zonas de inhibición. Cada ensayo se realizó por triplicado.
La existencia o no de diferencias significativas entre los diámetros de los halos de inhibición en cada proceso se evaluó por medio de un análisis de varianza (ANOVA).
RESULTADOS Y DISCUSIÓN
El método escogido para la preparación del extracto etanólico crudo fue el de sohxlet, dado que mostró el mejor rendimiento (9%), comparado con el obtenido cuando se aplicó maceración (3.5%), lo que a su vez permitió el manejo de mayor cantidad de biomasa en los procesos subsecuentes.
Por otra parte, se encontró que ninguno de los productos de la extracción inhibió el crecimiento de E. coli, lo que determino la escogencia de S. aureus, para la determinación de la actividad antibacteriana. Es conocido que bacterias gram negativas como E. coli, poseen una membrana adicional denominada “Estructura OM” la cual les confiere un mayor grado de resistencia a los agentes antimicrobianos (23, 24).
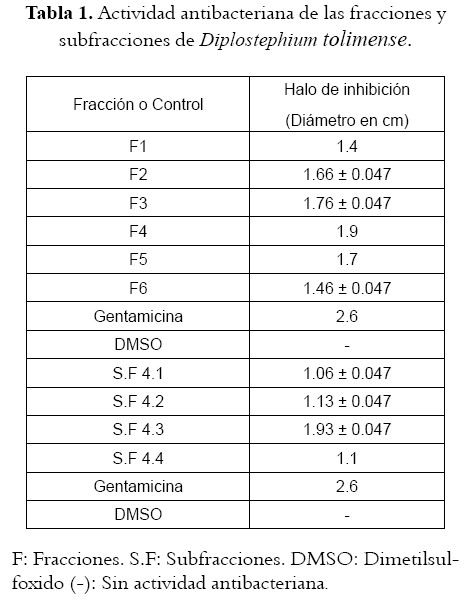
De los tres subextractos solo el de AcOEt presentó actividad; su fraccionamiento por C.C. permitió obtener seis fracciones de las cuales la número cuatro fue la que mostró mayor acción antibacteriana, una subsecuente partición de esta fracción generó cuatro subfracciones, siendo la 4.3 la más activa (véase tabla 1).
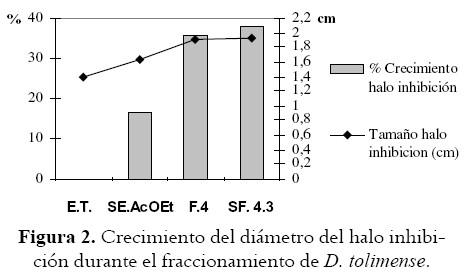
En la figura 2 se observa una relación directa entre la actividad antibacteriana y el grado de simplificación del extracto evidenciándose un incremento del halo de inhibición entre el extracto completo y la fracción AcOEt del 16%, entre esta ultima y la fracción cuatro del 19%, logrando la fracción 4.3 inhibir el crecimiento de la bacteria un 36% mas que el extracto etanólico. Esto sugiere tal vez la acción antagónica de una buena parte de los metabolitos secundarios frente a los compuestos responsables directos de la actividad biológica en el vegetal o que posiblemente estos se encuentran en muy baja proporción en relación a aquellos. Por otra parte el análisis de variancia reveló que existen diferencias significativas entre los halos de inhibición mostrados por el extracto total, las fracciones y subfracciones (P>0.05).
La posterior simplificación de la subfracción 4.3, mediante C.P., dio como producto 15 fracciones simples. La bioautografía de estas últimas mostró a las fracciones 6 a 13 (Rf 0.1-0.64) con acción inhibitoria del crecimiento de S. aureus (véase figura 3).
Al comparar la bioactividad de las fracciones y la gentamicina, utilizada como control positivo, se encontró diferencias significativas (P>0.05); lo que podría atribuirse a la baja concentración de los constituyentes químicos presentes en el vegetal con actividad antimicrobiana o quizá a la acción antagónica que ejercen sobre ellos otro grupo de compuestos.
Análisis fitoquímico
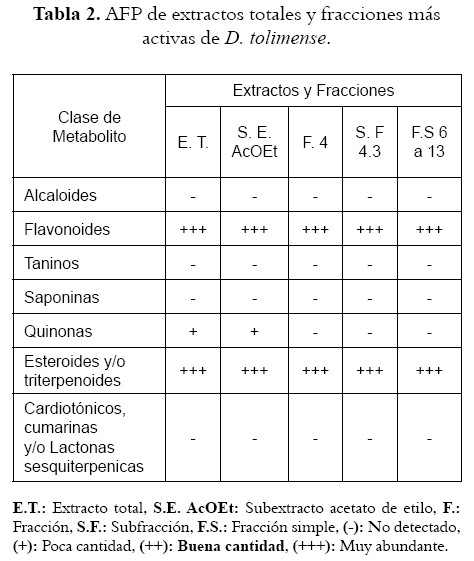
Los metabolitos secundarios que se identificaron en gran abundancia fueron los flavonoides y triterpenos y/o esteroides, tanto en el extracto total (E.T.) como en el subextracto de AcOEt, fracción (F.3), subfracción (S.F.3.4) y en las fracciones simples (F.S.6-13) que mostraron mayor actividad antibacterial. En el E.T. y en el subextracto de AcOEt se detectaron quinonas en escasa cantidad (véase tabla 2).
El tamizaje fitoquímico no permitió revelar la presencia de compuestos como alcaloides, taninos, saponinas o algún constituyente de tipo lactona (terpénicas, cumarinas, cardiotónicos). Podría inferirse que estos metabolitos no se encuentran en la parte aérea de D. tolimense o que quizá estén pero en baja concentración.
Tanto los resultados positivos como los negativos se corroboraron a través de cromatografía de capa delgada, según el tipo de metabolito buscado.
En el caso particular de los flavonoides se confirmó su presencia al observar en la placa con luz UV a 365 nm una serie de manchas características de este tipo de constituyente químico (verde y azul fluorescente). Sin embargo cuando se cromatografiaron las fracciones simples que inhibieron el crecimiento de S.aureus en la bioautografía (Rf entre 0.1 a 0.6, Ver figura 3), estos metabolitos se dejaron ver como manchas anaranjadas luego de revelar con el reactivo de Shinoda (7, 8)
Por su parte triterpenos y/o esteroides fueron observados como manchas de color violeta, amarillo y café después de revelar con el reactivo de vainillina-ácido o-fosfórico (7,8).
Hasta el momento no se han reportado quinonas en el género Diplostephium y en general en la familia Asteraceae. La presencia de estos compuestos podría explicarse si se tiene en cuenta que pueden resultar provenientes del metabolismo primario o secundario a partir de compuestos que poseen esta estructura. Para el caso que nos ocupa serían tal vez artefactos producto del método de extracción aplicado (soxhlet).
Teniendo en cuenta que flavonoides y triterpenos y/o esteroides se detectaron a lo largo del fraccionamiento biodirigido, y que tal vez son ellos los únicos constituyentes presentes, se podría afirmar que son los directos implicados en la actividad de D. tolimense manifestada frente a S.aureus. Estos resultados son concordantes con muchas investigaciones en donde se ha comprobado la acción antibacteriana de estos metabolitos (25 - 28). No obstante, no fue posible establecer clara relación entre el halo de inhibición y un tipo de constituyente en particular.
A través de este estudio se encontró que Diplostephium tolimense presenta actividad antibacteriana in vitro frente a Staphylococcus aureus, así como también que dicha actividad se incrementó a medida que se simplificó químicamente el extracto total. La identificación de compuestos del tipo flavonoide y triterpenos y/o esteroides en el vegetal, revelan la conexión entre la actividad determinada y su composición química.
Son muy pocos los estudios químicos realizados con plantas del género que nos ocupa (29 - 31) y casi ninguno relacionado con actividad biológica. Este parece ser el primer reporte, hasta la fecha conocido, de actividad antibacteriana in vitro para Diplostephium tolimense.
La bioactividad del vegetal objeto de interés en este estudio podría verificarse frente a otros microorganismos tales como hongos y bacterias Gram negativas y Gram positivas, a fin de establecer la especificidad de su acción.
AGRADECIMIENTOS
Los autores agradecen el apoyo logístico brindado por el Departamento de Química de la Universidad del Tolima.
REFERENCIAS BIBLIOGRAFICAS
1. Kümmerer K. (2004) Resistance in the environment. The Journal of Antimicrobial Chemotherapy. 54 (2) : 311. [ Links ]
2. Russell, G. (2000) Antibiotic-resistant organism infection. The American Surgeon. 66 (2) : 112. [ Links ]
3. Organización Mundial de la Salud (1999) Informe sobre las enfermedades infecciosas. [En línea]. “Actualizada 12 de Junio 2004”. [citado 10 de agosto de 2004, 16:25]. Idioma español, formato html. Disponible en internet: http://www.who.int/infectious-disease-report/idr99-spanish/pages/. [ Links ]
4. Smith, R. and Coast, J. (2002) Antimicrobial resistance: A global response. Bulletin of the World Health Organization. 80 (2) : 126. [ Links ]
5. Homer J., Ritchie J., Rabbino H., et al. (2000). Toward a dynamic theory of antibiotic resistance. System Dynamics Review. 16 (4) : 287. [ Links ]
6. Heath, P. and Breathnach, S. (2002) Treatment of infections due to resistant organisms. British Medical Bulletin. 61 (1) : 231. [ Links ]
7. Pinzon, R., Arteaga, L. y Reguero, M. (1996) Búsqueda de principios bioactivos en plantas. Colombia Ciencia y Tecnología. 14 (2) : 12. [ Links ]
8. Sarmiento, F. (2002) Anthropogenic change in the landscapes of highland Ecuador. Geographical Review. 92 (2) : 213. [ Links ]
9. Jorgensen, P. y Yánez, S. (1999). Catálogo de las plantas vasculares del Ecuador. (Ed) Botanical Garden Press. pp. 1169. [ Links ]
10. Díaz, S. y Pedraza, L. (2001) Dos nuevas especies de Espeletia (Asteraceae - Heliantheae) de Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales. 25 (94) : 11. [ Links ]
11. Pedraza, L. (2000) Plantas con flores de los alrededores de la Laguna de Chisacá, Sumapaz, Colombia. Trabajo de grado (Biólogo). Universidad Nacional de Colombia-Facultad de Ciencias-Departamento de Biología. Bogota D.C. pp. 236. [ Links ]
12. Cleef, A. (1983) Fitogeografía y composición de la flora vascular de los páramos de la Cordillera Oriental, Colombia: una comparación con otras montañas tropicales. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales. 15 (58) : 23-31. [ Links ]
13. Llambi, L., Law, R. and Hodge, A. (2004) Temporal changes in local spatial structure of late-successional species: establishment of an andean caulescent rosette plant. The Journal of Ecology. 92 (1) : 122. [ Links ]
14. Cuatrecasas, J. (1967) Estudio sobre plantas andinas. Caldasia. 10 (46) : 3-26. [ Links ]
15. Veloza, C. (2000) Contribución al estudio taxonómico de los hidrófitos de la Laguna Negra de la región de Taquecitos, Páramo de Sumapaz (Colombia). Actualidades Biológicas. 22 (73) : 177-194. [ Links ]
16. Rada, F., Azócar, A., González, J., et al (1998) Leaf gas exchange in Espeletia schultzii Wedd., a giant caulescent rosette species, along an altitudinal gradient in the venezuelan Andes. Acta Oecologica. 19 (1) : 73-80. [ Links ]
17. Terneus, E. (2002) Comunidades de plantas acuáticas en lagunas de los páramos del norte y sur del Ecuador. Caldasia. 24 (2) : 379-391. [ Links ]
18. Ulloa, C. y Moller, P. (2003) Árboles y arbustos de los andes de Ecuador. [En linea]. Quito (Ecuador). “Actualizada 20 de Noviembre de 2003”. [Citado 15 de septiembre de 2004, 14:30]. Idioma español, formato html. Disponible en internet: <http://www.efloras.org/florataxon.aspx?flora_id=201&taxon [ Links ]>
19. Sanabria, A. (1983) Análisis fitoquímico preliminar: Metodología y su aplicación en la evaluación de 40 plantas de la familia Compositae. (Ed) Universidad Nacional de Colombia. pp. 95. [ Links ]
20. MURILLO, E. (2004) Guía metodológica para la investigación preliminar de plantas medicinales. Universidad del Tolima. pp.28. [ Links ]
21. Dobner, M., Schwaiger, S., Jenewein, I., et al (2003) Antibacterial activity of Leontopodium alpinum. Journal of Ethnopharmacology. 89 (23) : 301–303. [ Links ]
22. Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo (CYTED) (1995) Manual de técnicas de investigación. (Ed) CYTED. pp. 226. [ Links ]
23. Brehm-Stecher, B. and Johnson, E. (2003) Sensitization off Staphylococcus aureus and Escherichia coli to antibiotics by the sesquiterpenoids nerodiol, farnesol, bisabolol and apritone. Antimicrobial agents and chemotherapy. 47 (10) : 3357–3360. [ Links ]
24. Urzua, A., Caroli, M., Vasquez, L., et al (1998) Antimicrobial study of the resinous exudate and of diterpenoids isolated from Eupatorium salvia (Asteraceae). Journal of ethnopharmacology. 62 : 251-254. [ Links ]
25. Fraga, B. (2001) Natural sesquiterpenoids. Natural products report. 18 : 650–673. [ Links ]
26. Hanson, J. (2001) Diterpenoids. Natural products report. 18 : 88–94. [ Links ]
27. Cowan, M. (1999) Plant products as antimicrobial agents. Clinical microbiology reviews. 12 (4) : 564–582. [ Links ]
28. Bruneton, J. (2001) Farmacognosia : Fitoquímica : Plantas medicinales. (Ed) Acribia, pp. 245. [ Links ]
29. Urzua, A., Torres, R., Andrade, L., et al (1997) Flavonoids in the trichome tesinous exudate from Diplostephium cinereum. Biochemical systematics and ecology. 25 (7) : 681-682. [ Links ]
30. Bittner, M., Schuster, A. and Jakupovic, J. (1991) Diterpenes from Diplostephium meyenii. Phytochemistry. 30 (4) : 1329–1330. [ Links ]
31. Zdero, C., Bohlmann, F. and King, R. (1992) Clerodane derivates from Diplostephium. Phytochemistry. 31 (1) : 213–216. [ Links ]