Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.13 no.1 Medellín Jan./Jun. 2006
Edison J. OSORIO D.1, Guillermo L. MONTOYA P.1 y Gabriel J. ARANGO A.1
1 Grupo de Investigación en Sustancias Bioactivas (GISB). Facultad de Química Farmacéutica. Corporación Académica para el Estudio de
Patologías Tropicales, Universidad de Antioquia. A.A. 1226. Medellín- Colombia
* Autor a quien se debe dirigir la correspondencia: gjarango@quimbaya.udea.edu.co
Recibido: Enero 26 de 2006 Aceptao: Marzo 23 de 2006
RESUMEN
La morbilidad y mortalidad asociada con las enfermedades causada por parásitos protozoarios, ha motivado la investigación de nuevos agentes mas potentes y selectivos. Los productos naturales como parte de esta investigación, juegan un papel crucial en el desarrollo de una nueva generación de fármacos antiparasitarios. Este trabajo cubre los compuestos de tipo alcaloide aislados a partir de fuentes naturales con actividad antiparasitaria, principalmente contra Leishmania spp, Tripanosoma cruzi y Plasmodium falciparum. Los compuestos están organizados acorde con su estructura química y se discuten temas como mecanismos de acción (en donde hay disponibilidad de trabajos), desarrollos recientes en el campo y nuevas estrategias experimentales.
Palabras clave: alcaloides, productos naturales, actividad antiprotozoaria.
ALKALOIDAL NATURAL PRODUCTS WITH ANTIPROTOZOAL ACTIVITY.
ABSTRACT
The morbidity and mortality associated with protozoan parasites diseases have motivated the investigation of new powerful and selective agents. The natural products as part of this investigation, play a crucial role in the development of a new generation of antiparasitic drugs. This review covers alkaloid compounds with mainly antiparasitic activity against Leishmania ssp, Tripanosoma cruzi and Plasmodium falciparum, isolated from natural sources. The compounds are organized according to the metabolites structure and subjects such as mechanisms of action (for which there is availability of works), recent developments in the field and new experimental strategies are discussed
Keywords: alkaloids, natural products, antiprotozoal activity.
INTRODUCCIÓN
Las enfermedades infecciosas tropicales constituyen un problema para un gran porcentaje de seres humanos que habitan las zonas tropicales de nuestro planeta. Dentro de estas enfermedades encontramos en nuestra región la leishmaniosis, producida por parásitos protozoarios del género Leishmania, la enfermedad de Chagas, causada por el parásito Tripanosoma cruzi, y la malaria causada por diferentes especies de Plasmodium. La leishmaniosis presentaba una prevalencia en promedio de 5.400 casos nuevos por año, principalmente en las costas Atlántica y Pacífica y los valles de los ríos Magdalena y Cauca, en donde existe el ambiente propicio para el desarrollo de la enfermedad (1), sin embargo, por diversos factores, el número anual de casos de leishmaniosis diagnosticados en Colombia ha incrementado en los últimos años cerca de 6.500 (2). Por otro lado, en nuestro país hay infectados por T. cruzi entre 1.200.000 y 1.700.000 individuos y alrededor de 40.000 nuevos casos se reportan cada año, principalmente en regiones ubicadas a 2.000 metros sobre el nivel del mar; se detecta frecuentemente a todo lo largo del valle del Río Magdalena, en la región del Catatumbo, la Sierra Nevada de Santa Marta, el piedemonte de los Llanos Orientales y la Serranía de la Macarena (3,4). Se estima que entre el 3.3 y 5% de la población colombiana está infectada y cerca del 20% se encuentra bajo riesgo de adquirir la infección, dependiendo de la distribución geográfica de los vectores (4,5). Igualmente la enfermedad de la malaria es un verdadero problema de salud pública en el 85% del territorio rural colombiano situado por debajo de los 1.600 metros sobre el nivel del mar, principalmente en las costas Atlántica y Pacífica, en donde en los últimos años se han registrado focos urbanos y periurbanos de la enfermedad (6). El 65% del territorio colombiano presenta condiciones eco-epidemiológicas favorables para mantener la transmisión y alrededor de 4.7 millones de personas viven en áreas endémicas (7,8). En los últimos años se han registrado en promedio 160.000 casos anuales, de los cuales, el 75% son causados por P. vivax y el 24% por P. falciparum (6,7).
En relación a la quimioterapia, las drogas actualmente recomendadas para el tratamiento de la leishmaniosis incluyen los antimonios pentavalentes (SbV), stibogluconato de sodio (Pentostame®, GlaxoSmithKline) y antimoniato de meglumina (Glucantime®, Aventis), amfotericina B (Bristol-Myers Squibb) y su formulación lipídica AmBisomew® (Gilead), y pentamidina (Aventis) (9). Los SbV fueron introducidos en 1945 y siguieron siendo efectivos para algunas formas de leishmaniosis; sin embargo, los requerimientos de administración parenteral por lo menos 28 días, la eficacia variable contra las diferentes formas de la enfermedad, los efectos adversos que generalmente producen y la aparición de parásitos resistentes, son factores que hacen estos medicamentos poco atractivos (9-12). El uso de la diamina pentamidina y el antibiótico amfotericina B como agentes leishmanicidas ha sido limitado por su toxicidad; sin embargo desde su introducción en 1952, la pentamidina ha sido valorada como una segunda línea de drogas cuando los agentes antimoniales han mostrado ser inefectivos. De igual forma, la quimioterapia anti-leishmania mejoró con el desarrollo de la formulación lipídica de amfotericina B, la cual es menos tóxica y presenta un período mayor de vida media, pero su alto costo limita su uso masivo (9). Otros medicamentos potencialmente efectivos son el alopurinol, la mefloquina y la miltefosina (13-16). Aunque éstos pueden presentar eficacias similares a las obtenidas con los SbV, los resultados varían en función de la forma clínica de la enfermedad y de la especie de Leishmania involucrada. Así por ejemplo, el alopurinol y la mefloquina que son medicamentos potencialmente efectivos contra L. (L) mexicana (17), no lo son para el tratamiento de la leishmaniasis cutánea causada por L. (Viannia) panamensis y L. (V) braziliensis en Colombia y Brasil (18-20). Actualmente se tiene como candidato la miltefosina, la cual ha mostrado buenas tasas de curación en la India y recientemente en Colombia (15,21,22) y que por ser un medicamento oral representa una buena opción; sin embargo, dadas las variaciones en cuanto a eficacia dependiendo de las especies implicadas y la variedad de especies circulantes en Colombia, se necesitan muchos más estudios. Mientras ello ocurre, el medicamento ampliamente utilizado es a base de SbV. Desafortunadamente, el valor clínico de la terapia con los SbV está amenazado por la aparición cada vez más frecuente de fallas, principalmente en la India donde fracasaron aproximadamente el 50% de los tratamientos para leishmaniasis visceral con las dosis estándares de SbV (23). Estas fallas terapéuticas pueden deberse a variaciones no sólo en el contenido de SbV en los lotes del medicamento, como se ha evidenciado previamente (24), sino también a la aparición de parásitos resistentes al SbV (25,26).
La terapia de la enfermedad de Chagas ha dependido de dos drogas nitro-heterocíclicas: el nifurtimox y el benznidazol (27). El nitrofurano nifurtimox fue introducido en la década de 1960, mientras que el nitroimidazol benznidazol fue lanzado en 1970. Estos dos compuestos son agentes tripanocidas, principalmente contra los tripomastigotes circulantes; a pesar de ello el nifurtimox no ha sido ampliamente utilizado para el tratamiento de la enfermedad ya que su fabricante detuvo la producción en vista de que el benzidazol le lleva una clara ventaja en el mercado (28). Durante el 2001, el Ministerio de Salud (hoy Ministerio de la Protección Social) adelantó las gestiones requeridas para obtener el registro del medicamento benzonidazol (Rochagán®) por parte del laboratorio farmacéutico que lo produce. Desde el 2002, el Laboratorio de Parasitología del Instituto Nacional de Salud dispone de una cantidad limitada del medicamento para su distribución gratuita a los servicios de salud que lo requieran (29). Sin embargo cabe recordar que, en estudios previos, se han reportado reacciones adversas al medicamento con una frecuencia de entre el 4% y el 30%; éstas pueden ser dérmicas, gastrointestinales, neurológicas y osteomusculares (29,30), y están directamente relacionadas con la dosis y la edad; Los niños tienen mejor tolerancia al fármaco (31).
Por su parte el tratamiento de la malaria se ha efectuado con diversos medicamentos que actúan sobre estadios eritrocíticos del parásito, entre los que se encuentran la quinina, un alcaloide aislado de Cinchona succiruba (Rubiaceae) que se ha utilizado desde comienzos del siglo XIX, y sus derivados sintéticos mefloquina y cloroquina, desarrollados posteriormente y que mostraron ser más efectivos, menos tóxicos y de bajo costo (32). La mefloquina se utilizó por más de 10 años; sin embargo, se han registrado casos de resistencia en el sudeste de Asia, con tendencia a expandirse a otras regiones (33). A su vez la cloroquina, todavía se utiliza en algunas áreas de África y Suramérica donde la tasa de resistencia es baja, mientras que la quinina se utiliza en los casos de malaria cerebral. El descubrimiento reciente más importante es la identificación de la artemisinina, una sesquiterpen lactona obtenida de Artemisia annua (Asteraceae) y sus derivados, el artemether y el artesunato, que son medicamentos de rápida acción, efectivos contra cepas de P. falciparum resistentes a múltiples medicamentos (34). Sin embargo, la actividad de la artemisinina se ve afectada por su baja solubilidad y pobre biodisponibilidad. A su vez, los derivados artemether y artesunato, aunque presentan una mejor absorción, rápida acción y mayor efectividad contra P. falciparum multirresistente, poseen una mayor citotoxicidad y traen efectos adversos (35,36). No obstante, el tratamiento de la malaria continúa siendo uno de los mayores retos para los programas de control debido al fenómeno de resistencia del parásito contra los medicamentos. Esta resistencia se debe a la capacidad del parásito para mutar genes específicos (37), a la alta frecuencia de recombinación genética que da origen a poblaciones de parásitos con nuevos determinantes antigénicos y con modificaciones en los sitios blanco para la acción de medicamentos (38), a los sistemas de transporte activo específicos para compuestos antimaláricos y a las prácticas clínicas inadecuadas como el uso de antimaláricos profilácticos, tratamientos inconclusos o con dosis subterapéuticas (39). Durante muchos años, la cloroquina fue el tratamiento de elección para la malaria, sin embargo, en 1957 se reportaron los primeros casos de resistencia en Suramérica y desde entonces el fenómeno se expandió hacia toda América, África y Asia. En algunas regiones se ha informado de resistencia a todos los antimaláricos disponibles con excepción de los derivados de la artemisinina, los cuales aún se reservan para los casos que no responden a los demás medicamentos (39).
El problema es más grave si se tiene en cuenta que estas enfermedades se encuentran en países tropicales y subdesarrollados y no constituyen un interés para los países avanzados económicamente (40,41). Se evidencia pues, una urgente necesidad en la búsqueda de alternativas terapéuticas de nuevas moléculas seguras, efectivas, económicas y fáciles de administrar, contra la leishmaniasis, la enfermedad de Chagas y la malaria. Además del conocimiento de su mecanismo de acción. La naturaleza, con sus numerosas plantas, microorganismos y organismos marinos, es una fuente potencial de tales sustancias, ya que contiene una sorprendente cantidad de moléculas con gran variedad de estructuras químicas y actividades farmacológicas (42). A través de la historia, los productos animales, vegetales y minerales han sido la principal fuente de medicamentos para el hombre. Se estima que dos terceras partes de la población mundial aún cuenta con los remedios de la medicina tradicional, principalmente plantas, debido a la disponibilidad o accesibilidad limitada de la medicina moderna (43). Algunos principios activos antiprotozoarios, han tenido su origen en la naturaleza con la evaluación científica de plantas medicinales; por ejemplo, es importante recordar que el primer producto farmacéutico desarrollado para el tratamiento de la malaria y la amibiasis fueron los alcaloides quinina y emetina, obtenidos de diferentes especies del género Chinchona y Cephaëlis ipecacuanha (Rubiaceae), respectivamente (44). Recientemente, el uso clínico de la artemisinina, una sesquiterpen lactona producida por Artemisia annua para el tratamiento de la malaria, ha despertado una vez más el interés en la investigación de nuevos productos farmacéuticos de origen vegetal con actividad antiprotozoaria (45). Adicionalmente, esos productos naturales han sido usados para desarrollar compuestos sintéticos o semisintéticos con mejor eficacia, seguridad y/o perfil farmacocinético (43).
En algunas publicaciones se ha mostrado la diversidad de productos naturales con actividad antiprotozoaria, los cuales incluyen moléculas activas contra los agentes etiológicos de la malaria, leishmaniosis, la enfermedad de Chagas y tripanosomiasis africana (44,46-51). Esta reseña muestra exclusiva y exhaustivamente los productos naturales de tipo alcaloidal reportados desde 1990, que son particularmente activos contra P. falciparum, diferentes especies de Leishmania y T. cruzi, así como las nuevas estrategias experimentales ye agrupan de acuerdo a su estructura en 4 categorías: 1) quinolinas, isoquinolinas y derivados, 2) análogos indólicos y derivados, 3) alcaloides esteroidales y 4) otros alcaloides, incluyendo algunos provenientes de organismos marinos. Igualmente se discute sobre los mecanismos de acción. Ciertas actividades antiparasitarias o citotóxicas, reportadas en la literatura, son transformadas en concentración molar (mM, µM o nM) para permitir una mejor comparación, independientemente del peso molecular de la molécula. Sin embargo, la comparación puede ser muy compleja debido a los diferentes procedimientos usados en los laboratorios de investigación, lo cual se evidencia en las diferencias de los valores obtenidos para los medicamentos de referencia.
PRODUCTOS NATURALES ALCALOIDALES CON ACTIVIDAD ANTIPARASITARIA
Quinolinas, Isoquinolinas y derivados.
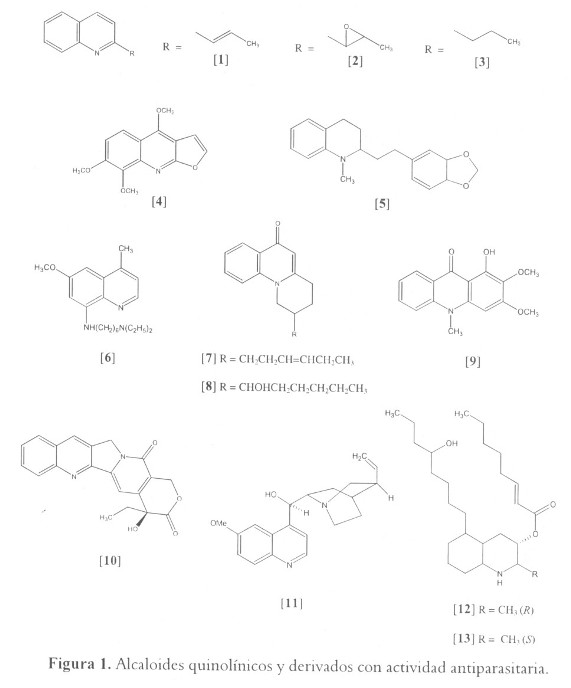
Quinolinas. Los alcaloides 2-alquilquinolina: chimanina B [1] y chimanina D [2], epóxido de la chimanina B, aislados desde las hojas de Galipea longiflora (Rutaceae), planta usada en el norte de Bolivia para el tratamiento de la leishmaniosis cutánea, mostraron actividad con una IC90 alrededor de 0.10 mM contra promastigotes de L. braziliensis, mientras que el compuesto 2-n-propilquinolina [3] mostró actividad a una IC90 de 0.20 mM. Igualmente, estos compuestos presentaron una actividad similar al nifurtimox contra T. Cruzi (IC50 = 0.1 – 0.2 mM o 25-50 µg/ml). En ensayos in vivo en lesiones cutáneas causadas por L. amazonensis y L. venezuelensis, [3] presentó una actividad a concentraciones de 100 mg/kg por día. Este metabolito, administrado oralmente (0.54 mmol/kg), suprimió alrededor del 99.9% la presencia de parásitos de L. donovani en el hígado de ratones BALB/c después de 10 días de tratamiento. De la misma manera, [2] presenta actividad in vivo contra parásitos de L. amazonensis y L. donovani (52-54). Otras quinolinas, como la furanoquinolina skimmianina [4], mostraron también una interesante actividad pero a concentraciones 2 a 4 veces más altas (52). El alcaloide tetrahidro-quinolina 2-sustituido galipinina [5], aislado de Galipea officinalis (Rutaceae), planta nativa de Venezuela, demostró una potente actividad in vitro cuando fue evaluado contra P. falciparum. Su IC50 estuvo entre 0.24 y 6.12 µM (55). Actualmente, sitamaquina [6], un compuesto derivado 8-aminoquinolina, se encuentra en fase tres de desarrollo en fármacos antileishmania (56). A pesar de no ser un producto natural, este compuesto verifica la importancia de los alcaloides quinolínicos como potenciales fármacos antiprotozoarios (véase figura 1).
Dictyolomida A [7] y dictyolomida B [8], dos alcaloides quinolin-4-ona aislados a partir de la corteza de Dictyoloma peruviana (Rutaceae), planta utilizada tradicionalmente para el tratamiento de la leishmaniosis, causaron una lisis total de promastigotes de L. amazonensis a 0.27 mM y mostraron una menor actividad en promastigotes de L. braziliensis a la misma concentración (57). A partir de las hojas de Teclea trichocarpa (Rutaceae), aisladas de alcaloides de a pesar de la buena actividad antiplasmodial del compuesto más activo, arborinina [9] con una IC50 de 3.5 µM, ninguno de los alcaloides presentó mayor eficacia que la cloroquina (58). Camptothecina [10], un alcaloide derivado quinolínico monoterpénico aislado a partir de las hojas de Camptotheca acuminata (Nyssaceae), mostró resultados promisorios contra los parásitos de Trypanosoma y Leishmania cuando fue evaluado a 1.5-3.2 µM (59). Y entre los alcaloides derivados quinolínicos, se debe mencionar el clásico antimalárico quinina [11], el cual inhibió completamente la replicación de T. cruzi in vitro a concentraciones de 14 µM (5 µg/ml) (50).
Existe una clase de alcaloides derivados quinolínicos, los decahidroquinolínicos (DHQs), cuyas fuentes naturales no corresponden a las plantas superiores. Los DHQs fueron reportados inicialmente a partir de la piel de ranas, y a la fecha, han sido aislados, aproximadamente 30 alcaloides de este tipo a partir de fuentes anfibias. También se han aislado a partir de hormigas y diferentes organismos marinos (60). Investigaciones realizadas en organismos marinos del género Didemnum permitieron el aislamiento y caracterización de alcaloides DHQs; los más activos corresponden a lepadina E [12] y F [13], con IC50 entre 0.4 – 2.0 µM (0.2 – 0.9 µg/ml) contra diferentes especies de P. falciparum y 4.6 – 5.6 µM (2.2 – 2.6 µg/ml) para T. Cruzi (61).
Poco se sabe en relación al mecanismo de acción de los alcaloides quinolínicos, para las diferentes especies de Leishmania y Tripanosoma; sin embargo, para el caso de Plasmodium, este tipo de compuestos parecen prevenir los procesos de detoxificación del heme liberado por el consumo de la hemoglobina por parte del parásito. (62-64). Durante su ciclo intraeritrocítico, el parásito de la malaria degrada una gran cantidad de hemoglobina presente en el citoplasma de la célula hospedera (entre el 60–80%) (65). Durante este proceso de proteolisis, se produce heme (Ferriprotoporfirina IX), compuesto potencialmente tóxico para el parásito (66,67). El parásito lo detoxifica, en parte por su incorporación en una sustancia cristalina, inerte e insoluble denominada hemozoína (o pigmento malárico) (68,69), y el resto por procesos de degradación peroxidativos (67). Las quinolinas y otros compuestos antimaláricos tienen la habilidad de interaccionar con el heme inhibiendo la formación de hemozoína (70-71).
Aporfínicos y oxoaporfínicos
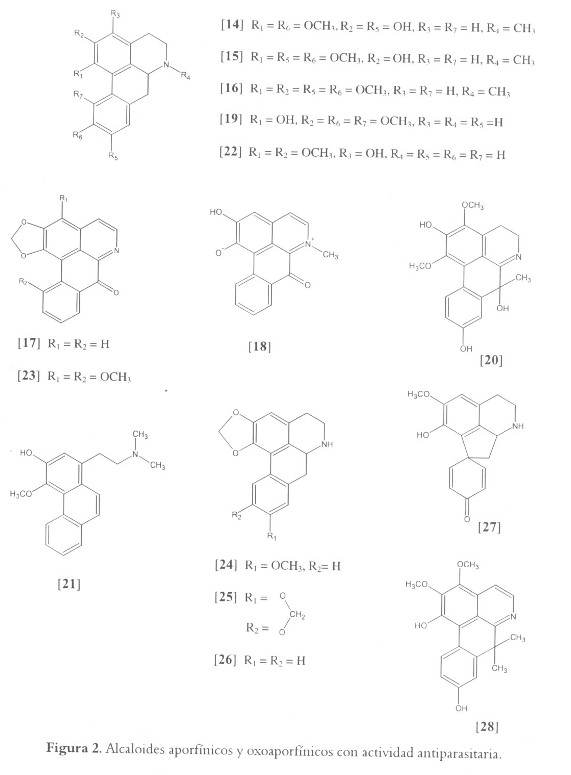
Entre los alcaloides isoquinolínicos con actividad antiparasitaria encontramos los aporfínicos y los oxoaporfínicos. Es el caso de boldina [14], predicentrina [15] y glaucina [16], los cuales mostraron inhibición del crecimiento in vitro de epimastigotes de T. cruzi con una IC50 menor de 0.10 mM (30 µg/ml) (72). A partir del fraccionamiento biodirigido del extracto metanólico activo de Stephania dinklaguei (Menispermaceae), se aislaron los compuestos liriodenina [17] y el alcaloide oxoaporfínico zwitterionico N-metilliriodendronina [18]. Este último registró la mayor actividad contra amastigotes de L. donovani con una IC50 igual a 36.1 µM, mientras que [17] mostró alta actividad contra L. donovani y P. falciparum con valores de IC50 de 26.16 y 15.0 µM, respectivamente (73). Por su parte, el alcaloide norcoridina [19] resultó ser el compuesto más activo (IC50 = 3.08 µM) entre 8 alcaloides aporfínicos evaluados contra cepas de P. falciparum (74). Su actividad según los autores, estuvo relacionada con la función amino secundaria y una sustitución fenólica (véase figura 2).
Algunas especies de la familia Annonaceae son fuente importante de alcaloides isoquinolínicos bioactivos y diversos reportes establecen la actividad antiparasitaria de los mismos. Por ejemplo: alcaloides isoquinolínicos, aislados por medio de ensayos biodirigidos contra Leishmania y T. cruzi, fueron obtenidos a partir de extractos de Guatteria foliosa. Isoguattouregidina [20], argentinina [21], 3-hidroxinornuciferina [22] y 3-metoxyoxoputerina [23] causaron lisis del 92%, 81%, 68% y 47% respectivamente, en tripomastigotes de T. cruzi cuando fueron evaluados a concentraciones de 250 µg/ml (cerca de concentración milimolar) (75). El compuesto [20] resultó ser aún más activo cuando fue evaluado contra diferentes especies de Leishmania y causó lisis total de los parásitos de L. donovani y L. amazonensis a concentraciones de 0.29 mM (75). A partir de otras especies del mismo género se aislaron los compuestos xylopina [24] (G. Amplifolia) y cryptodorina [25] (G. dumetorum) con actividad antileishmania; ambos compuestos presentaron una IC50 de 3 y 6 µM contra promastigotes de L. mexicana y L. panamensis, respectivamente (76). Anonaina [26] y nuevamente liriodenina [17], obtenidas a partir del tronco, la corteza y las raíces de Annona spinescens, han sido reportadas por mostrar actividad contra promastigotes de L. braziliensis, L. amazonensis y L. donovani (77). Sin embargo, mientras en este reporte el compuesto [17] mostró actividad leishmanicida con una IC100 de 0.25 mM, el mismo metabolito, reportado de la corteza de Rollinia emarginata (78) y Unonopsis buchtienii (79), exhibió una IC100 de 10 - 15 µM en promastigotes de la misma especie del parásito. A partir del extracto activo CH2Cl2 de Uvaria klaineana (IC50 = 3.55 µg/ml) y utilizando un fraccionamiento biodirigido, se obtuvo el alcaloide crostparina (tipo norproaporfina) [27] el cual presentó una actividad entre 7.0 – 11.3 µM contra diferentes cepas de P. falciparum sensibles y resistentes a la cloroquina. Alcaloides minoritarios fueron igualmente aislados pero con actividad menor (80).
La actividad antiparasitaria de los alcaloides aporfínicos parece estar relacionada con el intercalamiento al ADN y con la inhibición de la actividad catalítica de la topoisomerasa I (81). Igualmente se ha propuesto que en parásitos de T. cruzi, los alcaloides aporfínicos con grupos fenólicos podrían participar como antioxidantes inhibiendo los procesos de respiración, rompiendo la reacción en cadena de los radicales libres (50). Nuestra investigación en la búsqueda de compuestos bioactivos a partir de la flora colombiana es congruente con esta ultima hipótesis. A partir de los tallos de Rollinia pittieri (Annonaceae), obtuvimos una serie de alcaloides aporfínicos con potente actividad antiparasitaria (datos no publicados), el alcaloide más activo: melosmina [28], resultó ser el compuesto con mayor actividad captadora de radicales libres (82).
Bencilisoquinolinas
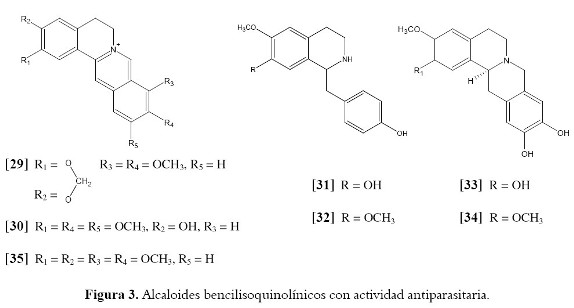
Algunos alcaloides bencilisoquinolínicos han sido estudiados en relación a su actividad antiparasitaria. Berberina [29], un alcaloide bencilisoquinolínico cuaternario hallado en un número de plantas de las familias Annonaceae, Berberidaceae y Menispermaceae, es uno de los alcaloides con mayor actividad leishmanicida. Este metabolito es el constituyente principal de varias plantas tradicionales usadas en el tratamiento de la leishmaniosis cutánea, la malaria y la amibiasis (83). [29] ha sido utilizado clínicamente para el tratamiento de la leishmaniosis durante más de 50 años y se ha demostrado que posee tanto actividad in vitro como in vivo contra varias especies de Leishmania. A concentraciones de 30 µM elimina efectivamente los parásitos de L. major en macrófagos peritoneales de ratones; sin embargo, muestra una actividad mínima cuando es aplicado tópicamente en lesiones cutáneas causadas por la misma especie de parásito. Similarmente, y aunque [29] es efectivo contra úlceras cutáneas en ratones, causadas por L. panamensis, se ha observado una reaparición de la lesión en los casos en los cuales los amastigotes viables persisten en la piel (84). Berberina también muestra actividad antiplasmodial en compañía de dehidrodiscretina [30], otro alcaloide aislado a partir de especies de la familia Menispermaceae. Ambas sustancias presentan una IC50 menor de 1 µM contra parásitos de P. falciparum (74). Otros ejemplos nos llevan a los alcaloides coclaurina [31] y norarmepavina [32], los cuales mostraron inhibición del crecimiento de epimastigotes de T. cruzi in vitro con una IC50 alrededor de 0.30 mM (72). Diez alcaloides derivados quinolínicos se obtuvieron de Annona spinescens (Annonaceae) y se evaluó su actividad contra tripomastigotes de T. cruzi y promastigotes de diferentes especies de Leishmania (77). Dos reportados por primera vez, pessoina [33] y spinosina [34], produjeron un 55% de lisis celular a concentraciones de 0.79 mM (77) (véase figura 3).
La intercalación con el DNA en combinación con la inhibición de la síntesis de proteínas, podría explicar la actividad antiparasitaria observada en estos compuestos (85). En un intento por comprender el mecanismo de acción de alcaloides bencilisoquinolínicos, fue utilizado el alcaloide burasaina [35], análogo estructural de [29], el cual es aislado a partir de la raíz de varias especies del género Burasaia (Menispermaceae). El estudio identificó efectivamente el DNA como un potencial biorreceptor para esta clase de compuestos (86).
Bisbencilisoquinolinas
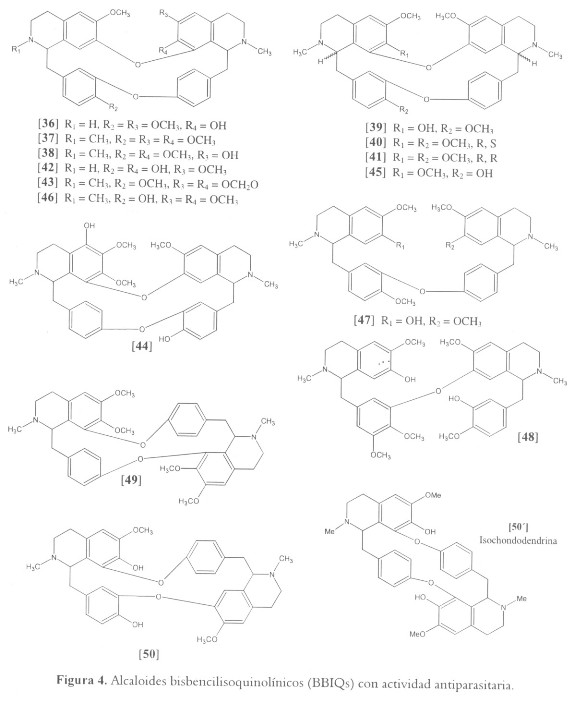
Los alcaloides bisbencilisoquinolínicos (BBIQ) están ampliamente distribuidos en la naturaleza (especies de las familias Annonaceae, Berberidaceae, Hernandiaceae, Menispermaceae, Monimiaceae y Ranunculaceae) y han sido aislados de diferentes plantas comúnmente utilizadas en medicina tradicional para el tratamiento de enfermedades parasitarias. En una evaluación de 14 alcaloides BBIQs se halló potente actividad contra promastigotes de L. braziliensis, L. amazonensis y L. donovani para cuatro de ello: Daphnandrina [36], aislado de Albertisia papuana (Menispermaceae), obaberina [37], obtenido de Pseudoxandra sclerocarpa (Annonaceae), gyrocarpina [38] producido por Gyrocarpus americanus (Hernandiaceae), y limacina [39] separado desde Caryomene olivascens (Menispermaceae), todos mostraron actividad leishmanicida con una IC100 cercana a 90 µM (47). El compuesto [38] mostró actividad in vitro a 8.50 µM, contra la forma promastigote de L. braziliensis, L. amazonensis y L. donovani. Sin embargo, en ensayos in vivo contra L. amazonensis, este metabolito no fue tan activo como el Glucantime® (100 mg/kg por día vs 56 mg SbV/kg por día) (47). Otro alcaloide que muestra actividad leishmanicida a 16.0 µM contra las formas promastigotes de L. braziliensis, L. amazonensis, y L. donovani, es isotetrandrina [40], un metabolito separado de Limaciopsis loangensis (Menispermaceae). La actividad in vivo de este producto a 100 mg/kg día en ratones BALB/c, es comparable con la del Glucantime® (56 mg SbV/kg) cuando se ensaya contra L. amazonensis, y es ligeramente menos efectivo contra L. venezuelensis (47). El isómero de [40], paeanthina [41] mostró ser tres veces más activo (IC50 = 2.41 µM; 1.5 µg/ml) que la droga estándar pentostam contra amastigotes de L. donovani; sin embargo, a esta concentración resultó ser igualmente tóxico (87). Por su parte, alcaloides BBIQs separados a partir de la corteza de Guatteria boliviana (Annonaceae) han sido reportados también por presentar moderada actividad cuando fueron ensayados contra Leishmania spp., T. cruzi y P. falciparum (88) (véase figura 4).
En 1988, A. Fournet, y col. reportaron la actividad tripanocida in vitro de alcaloides BBIQs contra las formas epimastigotes de T. cruzi; posteriormente, en 1994, confirman la actividad tripanocida contra las formas sanguíneas y entre 1997 y 2000, reportan estudios in vivo de los alcaloides más activos (82,90). Los efectos del tratamiento oral con daphnolina [42] aislada a partir de Albertisia papuana (Menispermaceae), de cepharanthina [43], obtenida de Stephania cepharantha (Menispermaceae) y de benznidazol fueron examinados en ratones Balb/c infectados con T. cruzi. En la infección aguda, la parasitemia fue significativamente reducida en el tratamiento con [42] (en comparación con el benznidazol) y además se observó la más alta velocidad de respuesta serológica negativa en comparación con los demás tratamientos. La misma actividad no fue observada para [43], un excelente inhibidor de la tripanotion reductasa (90).
Fueron evaluados 24 alcaloides BBIQs por su actividad antiplasmodial; de estos, 8 registraron actividad con IC50 menor de 1 µM contra cepas de P. falciparum resistentes a varios fármacos (la cloroquina presentó una IC50 de 0.2 µM) (91). Los más activos fueron isotetrandrina [40], thalisopidina [44] y bermamina [45] (aislado a partir de especies del género Berberis, Berberidaceae). Cuando este último compuesto es usado en combinación con cloroquina y artemisinina, se observa un efecto potenciador del medicamento contra las cepas resistentes a la cloroquina (46).
Otro estudio que evaluaba la actividad antimalárica de 53 alcaloides BBIQs naturales sobre cepas sensibles y resistentes a la cloroquina, identificó tres compuestos con baja toxicidad y potente actividad antiplasmodial (IC50 < 165 nM), malekulatina [46], neothalibrina [47], y el alcaloide repandina [48] (92). Estos dos últimos alcaloides, a diferencia de sus análogos BBIQs, tienen una sola unión tipo éter en su estructura básica; sin embargo, siguen conservando las propiedades de rigidez quizás necesarias para su actividad farmacológica. Finalmente, algunos alcaloides BBIQs con unión tipo éter inusual han sido reportados por poseer actividad antimalárica. Por ejemplo, en un intento por explicar el uso tradicional de Albertisia villosa (Menispermaceae), en el tratamiento de la malaria y otras enfermedades infecciosas se aislaron tres alcaloides, cycleanina [49], el más abundante (85%) parece ser el responsable de la potente actividad de la droga (93), igualmente a partir de la corteza de Isolona guesquierena (Annonaceae) se obtuvo el alcaloide curina [50], el compuesto presentó potente actividad antiplasmodial tanto in vitro (IC50 = 0.35 µM) como in vivo (dosis de 10 mg/kg inhiben la parasitemia en un 51.1%) (94). La isochondodendrina [50´] fue aislada de Epinetrum villosum (Menispermaceae), y tuvo una potente actividad antiplasmodial con una IC50 0.168µM sobre la cepa FcB1 resistente a la cloroquina de Plasmodium falciparum. (95).
Naftilisoquinolinas
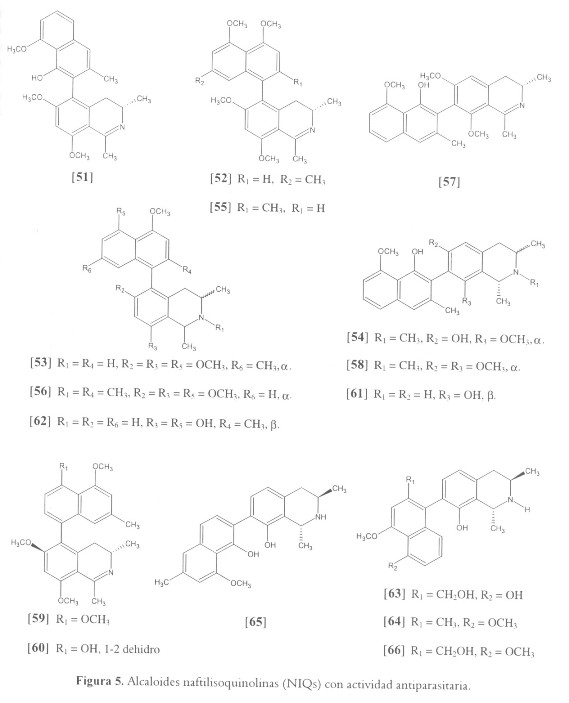
Las naftilisoquinolinas (NIQ) son biaril alcaloides quirales aislados a partir de plantas pertenecientes a las familias Ancistrocladaceae (un solo género, Ancistrocladus con 23 especies) y Dioncophyllaceae (tres géneros, Triphyophyllum, Habropetalum y Dioncophyllum), los cuales han mostrado actividades antiprotozoarias promisorias, en particular actividad antiplasmodial (44,96-98). La primera investigación fitoquímica realizada en la planta recién descubierta Ancistrocladus tanzaniensi, reportó el aislamiento de compuestos derivados isoquinolínicos con actividad antiprotozoaria, entre estos los dos nuevos alcaloides NIQ ancistrotanzanina A [51] y B [52], y el compuesto conocido ancistrotectorilina A [53] (101). Los compuestos [51] y [52] mostraron buena actividad contra los parásitos L. donovani y T. cruzi (IC50 entre 3.70 a 4.45 µM, 1.5 a 1.8 µg/ml), mientras que los tres exhibieron una potente actividad contra P. falciparum (IC50 entre 0.74 a 1.23 µM, 0.3 a 0.5 µg/ml) (99). Posteriormente se reportaron, con similares actividades antiprotozoarias los nuevos alcaloides ancistrotanzanina C [54], O-metillancistrocladinina [55] y O,N-dimetillancistrocladina [56] y los conocidos ancistrocladidina [57] y ancistrotectorina [58] (100). Similares NIQs con potente actividad antiplasmodial han sido aisladas a partir de A. ealaensis (98), A. congolensis (101), y A. griffithii (102). De la primera especie se obtuvieron 2 compuestos denominados ancistroealaina A [59] y B [60], el primero de ellos demostró mayor actividad contra los parásitos L. donovani y T. cruzi (IC50 de 9.78 y 5.60 µM, respectivamente), mientras que [60] mostró mayor actividad contra diferentes cepas de P. falciparum (IC50 entre 1.27 y 1.94 µM) (97) (véase figura 5).
Al parecer los compuestos aislados a partir de Dioncophyllaceae, son más potentes que los obtenidos a partir de Ancistrocladaceae. Entre los compuestos antiplasmodiales más activos de Dioncophyllum thollonii tenemos la dioncofilina E [61] (IC50 de 57.7 nM) (103) y de Triphyophyllum peltatum tenemos la, dioncofilina C [62] (IC50 de 38.5 nM), dioncopeltina A [63] (IC50 de 55.3 nM), 7-epidioncophyllina A [64] (IC50 de 0.50 µM) y dioncofilina B [65] (IC50 de 0.61 µM), los cuales se pueden comparar con el estándar de cloroquina actualmente en uso (IC50 de 15.63 nM) (46,97). La buena actividad in vitro de [62] y [63], permitió los estudios a nivel in vivo; al parecer dichos compuestos presentan una buena actividad sin ninguna señal de toxicidad (96,104). Recientemente se reportó habropetaline A [66] con valores de IC50 de hasta 5.08 nM. El compuesto [66] fue casi tan potente como el estándar de artemisinina (IC50 de 4.27 nM), uno de los productos naturales más potentes contra esta enfermedad (105). Está claro que los alcaloides NIQs pueden ser considerados como compuestos base para el desarrollo de nuevas moléculas antimaláricas; sin embargo, se requieren estudios adicionales para conocer la forma en que ejercen su acción.
Alcaloides de Amaryllidaceae
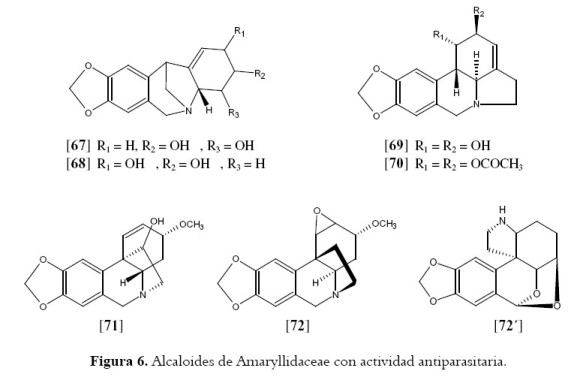
Las plantas de la familia Amaryllidaceae contienen una clase especial de alcaloides isoquinolínicos, especialmente en los bulbos que reciben el nombre de alcaloides de Amaryllidaceae. A este grupo de compuestos se les atribuyen propiedades medicinales potentes como antivirales, funguicidas, antimaláricos, citotóxicas y antitumorales (106). A partir de los bulbos frescos de Narcissus angustifolius subsp. transcarpathicus, fueron aislados los compuestos nangustina [67] y pancracina [68]. El segundo compuesto mostró mayor actividad contra los parásitos T. cruzi (IC50 de 24.88 µM) y P. falciparum (IC50 de 2.45 µM) y no se observó actividad citotóxica para ninguno de los dos (107). Otras especies de la familia Amaryllidaceae que han sido investigadas por su actividad antimalárica son Brunsvigia littoralis (108) B. radulosa (109) y Crinum amabile (110). Todas ellas contienen alcaloides característicos de Amaryllidaceae que además necesitan actividad antimalárica, también muestran algún grado de citotoxicidad. Campbell y col. aislaron 4 alcaloides de B. littoralis, 2 de los cuales mostraban actividad antimalárica y citotóxica, lycorina [69] y 1,2-di-O-acetyllycorina [70] (108). Los compuestos más activos de B. radulosa fueron identificados como lycorina [69] y crinamina [71] (109) y de los 5 alcaloides aislados a partir de C. amabile, 3 mostraban actividad contra las cepas de P. falciparum, nuevamente lycorina, crinamina y augustina [72] (110). Recientemente fue aislado un nuevo alcaloide por Machocho et al. La noraugustamina [72´] presentó moderada actividad con una IC50 65µM sobre tripomastigotes de T. brucei (111) (véase figura 6).
Análogos Indólicos y derivados ß-carbolinas
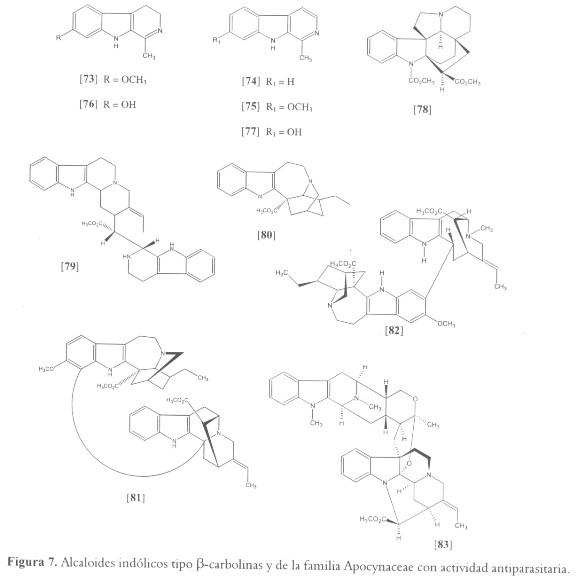
Entre los alcaloides indólicos reportados por presentar actividad antiprotozoaria está la harmalina [73], el constituyente principal de un núimero de plantas utilizadas en medicina tradicional para curar la leishmaniasis, que incluyen Peganum harmala (Zygophyllaceae) y Pasiflora incarnata (Passifloraceae) (47). Recientemente, [73] y otras ß-carbolinas como harmana [74] y harmina [75] fueron reportadas como potentes inhibidores de L. infantum (IC50 entre 0.2 y 1.1 µM) (112); igualmente estos compuestos y análogos ß-carbolinas como harmalol [76] y harmol [77] fueron reportados por inhibir el crecimiento de epimastigotes de T. cruzi in vitro entre 50-90% a concentraciones alrededor de 0.25 mM (50 µg/ml) (50). El posible mecanismo antiprotozoario de acción de estos compuestos parece estar relacionado con su capacidad de intercalación con el DNA o por interferir con el metabolismo de aminoácidos aromáticos en el parásito (47,112); sin embargo, debido a su actividad como inhibidor de la monoaminooxidasa A, producen efectos sicopáticos que impiden su uso como agentes terapéuticos (47) (véanse figuras 7 y 8).
Alcaloides indólicos de Apocynaceae
Por su parte, la familia Apocynaceae es una fuente importante de alcaloides mono y bis-indólicos con potente actividad antiparasitaria. Por ejemplo, a partir de la corteza y las hojas de Kopsia griffithii, se aislaron igualmente a [75] y otros alcaloides indólicos como pleiocarpina [78] y buchtienina [79]. Tales compuestos reportaron actividad contra promastigotes de L. donovani con IC50 entre 15.76 - 63.06 µM para [75] y [78] y entre 0.76 – 3.12 µM para [79] (111,112). Este resultado identifica la buchtienina como el principal compuesto responsable de la actividad leishmanicida, y esta de acuerdo con el aislamiento del mismo compuesto a partir de la planta boliviana Peschiera buchtieni (Syn. Tabernaemontana buchtieni), la cual también es utilizada localmente para el tratamiento de la leishmaniosis (115). Otras especies de este último género nativo de Suramérica, han sido estudiadas; a partir del extracto de Peschiera australis, el cual registró una potente actividad contra las formas amastigote y promastigote de L. amazonensis, se realizó un separamiento biodirigido que permitió obtener el compuesto responsable de la actividad biológica. El análisis químico identificó la coronaridina [80] (IC97 de 35.46 µM) y algunos análogos como principales constituyentes (116,117). Igualmente los alcaloides bis-indólicos gabunina [81] y voacamina [82], aislados a partir de Peschiera van heurkii (Syn. Tabernaemontana van heurkii) y Peschiera fuchsiaefolia respectivamente, mostraron actividad antiparasitaria. El compuesto [81] presentó una potente actividad in vitro contra L. amazonensis a 36.93 µM (118), mientras que [82] mostró una IC50 de 0.28 µM contra cepas sensibles y resistentes de P. falciparum (119). Otros géneros de Apocynaceae que han sido estudiados en relación con su actividad antiparasitaria y de los cuales se han aislado compuestos indólicos bioactivos son Aspidosperma (A. pirifolium y A. megalocarpon) (120), Alstonia (A. scholaris, A. macrophylla, A. glaucescens y A. angustifolia) (121,122) y Geissospermum (G. Sericeum) (123). Este último es un pequeño género de árboles amazónicos, nativos del norte de Suramérica, al cual pertenecen algunas especies reconocidas localmente por poseer propiedades antimaláricas, incluyendo G. laeve, G. sericeum y G. vellosii (124). Quizás el metabolito con mayor actividad aislado a partir de estos géneros, específicamente de A. macrophylla, corresponde a villalstonine [83], CI50 de 0.27 µM, cuya actividad biológica se compara con la del medicamento estándar cloroquina (CI50 de 0.20 µM) (122).
Alcaloides indólicos de Loganiaceae y Rubiaceae.
El género Strychnos, de la familia Loganiaceae, es una fuente de alcaloides indólicos bioactivos y abarca alrededor de 200 especies (125). La actividad antimalárica de 69 alcaloides de varias especies de este género fue evaluada contra líneas de P. falciparum resistentes y sensibles a cloroquina (126). Alcaloides que contenían el esqueleto tipo bis-indol presentaron una actividad selectiva y potente contra Plasmodium. Dentro de este tipo, se hallaron isostrychnopentamina [84] y ochrolifuanina A [85], activos contra cepas sensibles y resistentes a cloroquina (valores de IC50 de 100-150 y 100-500 nM, respectivamente), mientras que dihydrousambarensina [86] exhibió una actividad 30 veces más alta contra las cepas resistentes a la cloroquina (IC50 de 32 nM) en comparación con la cepa sensible (126). Los compuestos [84] y [86] han sido previamente ensayados in vivo contra P. berghei y P. vinckei (127,128), sin embargo [86] fue inactivo a una dosis de 30 mg/kg/ día (127). Este compuesto fue esencialmente activo contra cepas de P. falciparum resistentes a la cloroquina y la cepa P. berghei utilizada en este estudio era sensible a la cloroquina. Además de las diferencias entre la biología de las dos especies esto podría explicar su inactividad in vivo. Otros interesantes alcaloides indólicos activos contra P. falciparum son strychnogucina B [87] y 18-hidroxyisosungucina [88], aislados a partir de S. icaja. Los metabolitos presentaron una IC50 de 80 nM y al parecer registran una selectiva actividad antiplasmodial al ser comparados con diferentes líneas celulares humanas (129-142).
Por su parte, 5 alcaloides indólicos, a partir de la corteza de Corynanthe pachyceras (Rubiaceae), registran marcada actividad contra promastigotes de Leishmania major. Entre estos alcaloides están dihidrocorynantheina [89], corynantheina [90] y corynantheidina [91], los cuales presentaron valores de IC50 por debajo de 3 µM. Estos metabolitos no demostraron una actividad citotóxica significativa contra las líneas celulares KB-3-1 sensible y KBV1 resistente a medicamentos, lo que indica una importante selectividad en su actividad antiprotozoaria. Los alcaloides de C. pachyceras tienen una estructura planar tetracíclica y se ha propuesto que su mecanismo de acción está basado en la inhibición de la cadena respiratoria del parásito (132).
Al igual que las ß-carbolinas, se ha sugerido que el mecanismo de acción antiprotozoario de otros alcaloides indólicos podría estar relacionado con la intercalación al DNA en regiones ricas en GC (133); además, estabilizan el complejo covalente topoisomerasa II – DNA y estimulan los cortes del DNA por la topoisomerasa, causando así la muerte del parásito por necrosis (134).
Alcaloides esteroidales
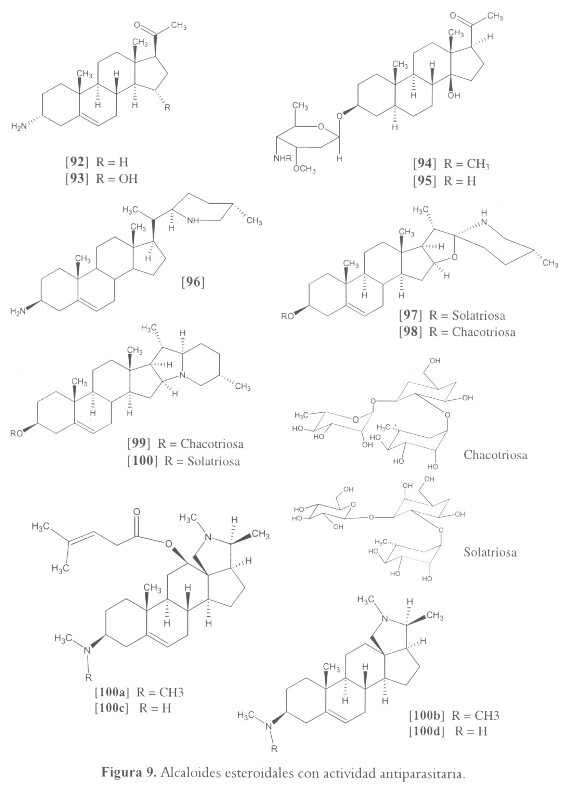
Ocho alcaloides esteroidales obtenidos a partir de hojas de Holarrhena curtisii (Apocynaceae) mostraron actividad leishmanicida contra promastigotes de L. donovani y una actividad citotóxica significativa contra la línea celular HL-60. Los más activos corresponden a holamina [92], 15-a-hidroxiholamina [93], y los glicoalcaloides holacurtina [94] y N-desmetilholacurtina [95] (13.53 > IC50 > 0.84 µM) (135). Recientemente, y a partir de otra especie de la familia, Funtumia elastica, fueron aislados 4 alcaloides esteroidales con potente actividad sobre la cepa resitente a la cloroquina FcB1 de P. falciparum. Holarrhetina [100a], conessina [100b], holarrhesina [100c] e isoconessimina [100d] con IC50 de 1.13 ± 0.32, 1.04 ± 0.14, 0.97 ± 0.11 y 3.39 ± 0.79 µM respectivamente (138) (véase figura 9).
Por su parte, sarachina [96], aminoesteroide aislado a partir de las hojas de la planta boliviana Saracha punctata (Solanaceae), inhibió totalmente el crecimiento de las formas promastigotes de L. brazilienis, L. donovani y L. amazonensis, a una concentración de 25.08 µM; sin embargo a esta misma concentración registró una fuerte actividad tóxica contra macrófagos peritoneales de ratones (136). Igualmente [96] fue activo in vivo contra P. vinckei con un 83% de inhibición de la parasitemia a una dosis de 100 mg/kg durante dos días (136). Otros alcaloides del género Solanum (Solanaceae) fueron ensayados contra diferentes formas del parásito T. cruzi. A una concentración de 5.7 µM se observó una disminución en la rata de crecimiento del 100% para los spirosolanos solasonina [97] y solamargina [98] y para los solanidanos chaconina [99] y solanina [100], un poco mayor a la inhibición producida por ketoconazol, medicamento control. Se presume que estas moléculas actúan en la membrana, causando cambios en la morfología del parásito (137).
Otros alcaloides
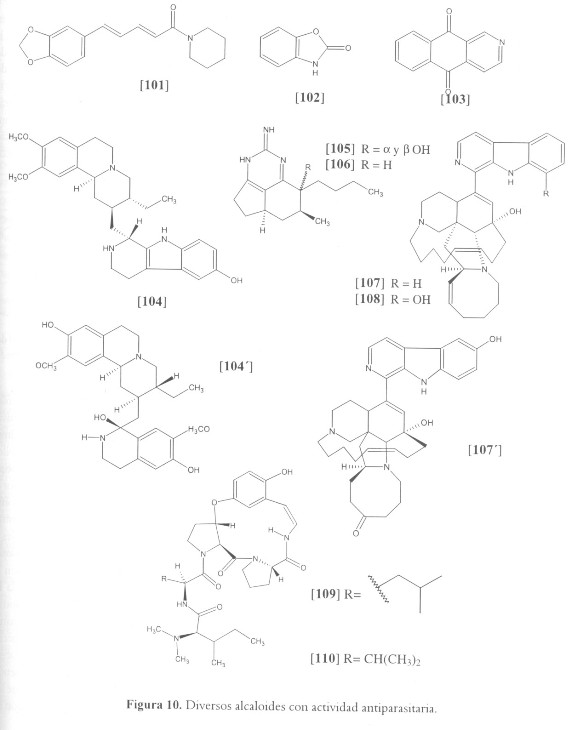
El conocido componente principal de especies del género Piper (Piperaceae), el alcaloide piperina [101] y el benzoxazol-2(3H)-ona [102], obtenido a partir de las hojas de Acanthus illicifolius (Acanthaceae), mostraron actividad contra promastigotes de L. donovani y sus actividades son completamente similares a las de la pentamidina (139,140). Por su parte, miembros de la familia Rubiaceae de Centro y Suramérica, han sido investigados en relación a su actividad antimalárica. Psychotria camponutans, la cual crece en Panamá y Costa Rica, contiene dos compuestos activos, [103] es el de mayor bioactividad, sin embargo muestra igualmente cierta citotoxicidad (141). Pogonopus tubulosus, planta boliviana utilizada por curanderos en el tratamiento de la malaria, tres alcaloides activos, entre ellos tubulosina [104], el más activo de los compuestos presentaba una IC50 entre 12.61 y 23.12 nM (0.006 y 0.011 µg/ml) contra cepas de P. falciparum sensibles y resistes a la cloroquina. Tubulosina fue también ensayado in vivo contra P. vinckei petteri y P. berghei y en ambos casos se obtuvieron buenos resultados a bajas concentraciones. Estos hallazgos demuestran sólidas bases para el uso tradicional de esta planta en el tratamiento de la malaria (142). El compuesto klugina [104´], aislado de Psychotria klugii mostró potente actividad antileishmania con una IC50 de 0.98 µM y actividad antimalárica de IC50 113.8µM sobre la cepa W2 resistente a la cloroquina.(144). Recientemente se aislaron alcaloides ciclopéptidicos de 13 miembros de la raíz de Ziziphus oenoplia var. brunoniana, las zizipinas N, O, P y Q. De estos, los compuestos N [109] y Q [110] mostraron actividad antiplasmodial con valores de IC50 de 6.4 y 5.8 µM respectivamente sobre la cepa resistente a múltiples medicamentos K1, con aparentes bajas toxicidades evaluadas sobre algunas líneas celulares humanas (151) (véase figura 10).
Los productos naturales de origen marino son una fuente potencial de agentes antiparasitarios que, en términos generales, permanecen aún inexplorados; sin embargo, poco a poco son más las investigaciones realizadas en el área que demuestran claramente la importancia de tales metabolitos (60,143). Entre los compuestos de origen marino tenemos los alcaloides guanídicos tricíclicos, una clase única de metabolitos derivados de esponjas, que muestran un gran rango de actividades biológicas (145), por ejemplo, los derivados de a y ß-hydroxyptilocaulina [105] y mirabilina [106], aislados a partir de la esponja marina Monanchora unguifera. La mezcla [105] fue activa contra P. falciparum con una IC50 de 14.53 µM, mientras que [106] registró actividad antiprotozoaria contra L. donovani con una IC50 de 68.74 µM (146). Otra clase única de alcaloides, aislados a partir de esponjas marinas, corresponde a las manzaminas, caracterizadas por poseer un complejo sistema policíclico que contiene nitrógeno. Entre ellas tenemos la manzamina A [107] y 8-hidroximanzamina A [108] con potentes actividades antiprotozarias. Ambas presentaron actividad contra P. falciparum con IC50 entre 4.5 - 6.0 ng/ml, [107] registró mayor actividad contra L. donovani (IC50 de 1.63 µM) que su análogo hidroxilado (147). De otros alcaloides tipo manzaminas, recientemente aislados, la 6-hydroxymanzamina E [107´] demostró buena actividad antiplasmodial, la cual fue evaluada sobre el clon D6 de Plasmodium falciparum con IC50 1.34 µM, y sobre el clon W2 resistente a la cloroquina con una IC50 1.49 µM. Esta misma molécula fue evaluada sobre promastigotes de Leishmania donovani con IC50 4.25 µM y una IC90 7.31 µM. (148).
Nótese que compuestos como [104], [104´], [107] y [107´] podrían estar incluidos en las clasificaciones anteriores; sin embargo, debido a su dualidad (isoquinolínico e indólico), preferimos incluirlos en este apartado.
DESARROLLOS RECIENTES Y NUEVAS ESTRATEGIAS.
En años recientes se han llevado a cabo tamizajes de plantas medicinales usadas para el tratamiento de enfermedades protozoarias en regiones tales como Colombia, Bolivia y El Salvador (149-152). Estos estudios han confirmado la importancia de muchas especies vegetales como una fuente importante de nuevos metabolitos con actividad antiparasitaria. Sin embargo, y aunque existe un número importante de productos naturales que han demostrado potencial como posibles agentes antiparasitarios, la mayoría de ellos no llenan todos los requerimientos considerados esenciales para su comercialización: ser administrados tópica u oralmente, ser efectivos a dosis moderadas y no causar efectos adversos (47). A la fecha y entre compuestos tipo alcaloide, solamente berberina [29] por vía parenteral, es usada clínicamente para el tratamiento de la leishmaniosis cutánea (84), mientras la 2-n-propilquinolina [3] se encuentra en fase de evaluación clínica para el tratamiento de la leishmaniosis (9). En relación a la enfermedad de Chagas, ningún compuesto se encuentra en experimentación clínica en la actualidad; sin embargo, se evalúa la actividad de ciertos funguicidas (28). Por su parte las quinolinas con su principal representante, la quinina [11], son históricamente reconocidas por su importante papel en la quimioterapia contra la malaria. Una de las principales razones por las cuales los metabolitos de origen vegetal con potente actividad antiparasitaria no han llegado a evaluación clínica es su toxicidad, merece anotarse que los agentes antiprotozoarios son básicamente agentes citotóxicos, que en algunos casos actúan selectivamente contra los parásitos. Igualmente, muchos metabolitos, que carecen de citotoxicidad tales como gabunina [81], registran una estrecha actividad leishmanicida in vivo. Quizás transformaciones químicas en estos metabolitos podrían mejorar su actividad antiprotozoaria y al mismo tiempo conservar su baja toxicidad. Actualmente, los reportes sobre nuevos agentes antiparasitarios incluyen la actividad contra líneas celulares mamíferas / humanas.
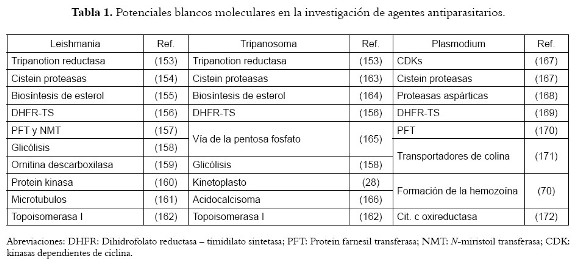
Por otro lado, como resultado de la investigación de nuevos agentes terapéuticos contra las enfermedades parasitarias, y teniendo en cuenta que en la mayoría de los casos el mecanismos, de acción de los productos naturales con actividad antiprotozoaria no se conoce, se ha propuesto la detección de blancos moleculares en donde estos productos sean activos (47,50). Debe anotarse que en los compuestos con buena actividad antiparasitaria existe una gran diversidad estructural, lo cual puede reflejar la variedad de blancos putativos en Leishmania, Tripanosoma y Plasmodium. En la tabla 1 se pueden observar algunos blancos terapéuticos utilizados actualmente en la investigación de nuevos agentes antiparasitarios. Nosotros estamos interesados específicamente en la Dihidrofolato reductasa–Timidilato sintetasa (DHFR-TS), recombinante de tripanosomátidos (Leishmania y Tripanosoma), por tratarse de una enzima esencial para la supervivencia del parásito involucrada en la biosíntesis de nucleótidos (173) y para el caso de P. falciparum, en la inhibición de la formación de hemozoina (datos no publicados). En un futuro la investigación en productos naturales podría quizás estar confinada a una línea de investigación en un departamento de química médica, dedicada a buscar moléculas bioactivas frente a determinados blancos moleculares.
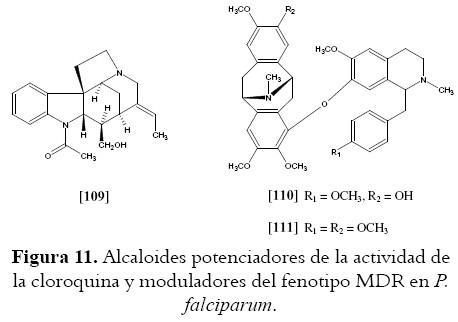
Finalmente, otra área de interés es el desarrollo de moduladores que puedan incrementar la actividad de un agente antiparasitario cuando son administrados conjuntamente, en especial en aquellos casos de resistencia al medicamento. El fenotipo MDR (de Multidrug Resístance) producido por la Glicoproteína-P (P-gp), ha sido establecido como un mecanismo para reducir la acumulación intracelular del medicamento en células tumorales y en parásitos, incluyendo Leishmania, Tripanosoma y Plasmodium (174). Los moduladores tienen la capacidad de contrarrestar las funciones de la P-gp y de esta forma evitar la resistencia. Nosotros hemos descrito la utilización de productos naturales como potenciales moduladores, en especial sesquiterpenos y flavonoides (174); sin embargo, algunos alcaloides han sido reportados por presentar actividad moduladora (véase Figura 11). Aunque los alcaloides no se han implicado en la modulación de resistencia a medicamentos en Leishmania, sí se sabe que alcaloides de tipo indólico como kopsoflorina muestran un incremento en la citotoxicidad de drogas contra células tumorales resistentes (175), igualmente alcaloides del tipo monoindólico como isoretulina [109] y del tipo bisbencilisoquinolina como fangchinolina (similar estructura a limacina [39]) se han utilizado para revertir la resistencia a cloroquina y mefloquina en P. falciparum (170,171); a su vez compuestos como la hervelina B [110] y C [111], los cuales presentan una moderada actividad antiplasmodial, actúan potenciando la actividad de la cloroquina cuando son administrados en forma conjunta (46). Estudios de relación estructura actividad de la interacción entre moduladores con P-gp, han definido farmacóforos y propiedades fisicoquímicas para dichos moduladores, entre ellas están estructuras con anillos aromáticos, alta lipofilicidad y presencia de átomos de nitrógeno básico (178,179). Esto sugiere que los alcaloides aromáticos son promisorios como modulares activos del fenotipo MDR en parásitos protozoos.
CONCLUSIONES
Durante miles de años las plantas han sido la base de sofisticados sistemas de medicina tradicional, y ahora los productos naturales aislados a partir de ellas, son investigados como compuestos bioactivos, especialmente contra enfermedades infecciosas. La mayoría de los estudios que se han preocupado en obtener productos naturales con actividad biológica contra parásitos protozoarios, se han centrado principalmente en la investigación de metabolitos con actividad antimalárica y amebicida (Entamoeba histolytica), y en una menor proporción, contra especies de Leishmania y Tripanosoma. Estas investigaciones han dado como resultadoo una gran cantidad de compuestos antiprotozoarios con inmensa variedad estructural; sin embargo, y a pesar de los grandes avances en las últimas décadas, muchos de ellos solamente han sido estudiados in vitro. Además, algunos de los alcaloides identificados como antiprotozoarios son también tóxicos y quizás no servirán como medicamentos. No obstante, y aun teniendo en cuenta estos problemas, los metabolitos naturales, incluyendo los alcaloides, jugarán un papel importante en el desarrollo de una nueva generación de fármacos antiparasitarios.
Otros grupos de alcaloides, tales como tropanos, piperidínicos, piridíicos y purínicos entre otros, han sido ensayados contra diferentes formas de parásitos; sin embargo, no han mostrado ser activos (85). Los reportados en este trabajo son los grupos de alcaloides que han presentado una l actividad antiprotozoaria sustancia in vitro y en algunas ocasiones in vivo.
REFERENCIAS BIBLIOGRÁFICAS
1. Vélez, I. D., Agudelo, S. M. (1995) Leishmaniosis. (Ed) Universidad de Antioquia. 10 ed. pp. 35. [ Links ]
2. Agudelo, L. A., Uribe, J., Sierra, D., Ruíz, R., Vélez, I. D. (2002) Presence of american cutaneous leishmaniasis vectors surrounding the city of Medellín, Colombia. Mem Inst Oswaldo Cruz. 97 (5) : 641-42. [ Links ]
3. Arjona, A., Alvarez, C., Agudelo, A. (1999) Prevalence of Trypanosoma and Leishmania chagasi infection and risk factors in a colombian indigenous population. Rev Inst Med Trop S Paulo. 41 (4) : 229-34. [ Links ]
4. Guhl, F. (2000) Enfermedad de Chagas o tripanosomiasis americana. Situación actual en Colombia. Medicina. 22 (2). Consultada en marzo de 2005, pagina web: http://www.encolombia.com/medicina/academedicina/220253.htm. [ Links ]
5. Leon-Sarmiento, F. E., Mendoza, E., Torres-Hillera, M., et al. (2004) Trypanosoma cruzi-associated cerebrovascular disease: a case-control study in Eastern Colombia. J Neurol Sci. 217 (1) : 61–4. [ Links ]
6. Instituto Nacional de Salud. (2002) Comportamiento por regiones de la malaria en el 2001. Sivigila ¬ Boletín Epidemiológico Semanal. Semana Epidemiológica No.1. Dic 30 a Ene 5 de 2002. [ Links ]
7. González, A. (2000) Epidemia de malaria en la Guajira: Una muestra lamentable de la situación de salud pública en el país. Informe Quincenal Epidemiológico Nacional. 5 (2) : 17-8. [ Links ]
8. Kroeger, A., Ordonñez-Gonzalez, J., Aviña, A. I. (2002) Malaria control reinvented: health sector reform and strategy development in Colombia. Trop Med Int Health. 7 (5) : 450–58. [ Links ]
9. Croft, S. L., Coombs, G. H. (2003) Leishmaniasis– current chemotherapy and recent advances in the search for novel drugs. Trends Parasitol. 19 (11) : 502-8. [ Links ]
10. Hardman, J., Limbird, L., Molinoff, P. (1996) Las Bases farmacológicas de la Terapéutica. Vol. II. (Ed) McGraw Hill. México. 9 ed. pp. 1033-1034, 1050, 1126-1130, 1321-2. [ Links ]
11. Singh, S., Sivakumar, R. (2004) Challenges and new discoveries in the treatment of leishmaniasis. J Infect Chemother. 10 (6) : 307–15[ [ Links ]STANDARDIZEDENDPARAG]
12. Borst, P., Ouellette, M. (1995) New mechanisms of drug resistance in parasitic protozoa. Annu Rev Microbiol. 49 (1) : 427-60. [ Links ]
13. Batista, P., Arribas, A., Ferreira, E. (2000) Leishmaniasis. What do we know about its chemotherapy. Brazilian J Pharm Sci. 36 (1) : 69-96. [ Links ]
14. Berman, J. (2001) Leishmaniasis. Curr Treat Options Infec Diseases. 3 (4) : 333-6. [ Links ]
15. Sundar, S. J., Thakur, C. P., Engel, J., Sindermann, H., Fischer, C., Junge, K., Bryceson, A., Berman, J. (2002) Oral miltefosine for indian visceral leishmaniasis. New Eng J Med. 347 (22) : 1739-46. [ Links ]
16. Davies, C. R., Kaye, P., Croft, S. L., Sundar, S. (2003) Leishmaniasis: new approaches to disease control. BMJ. 326 (7385) : 377-82. [ Links ]
17. Baum, K. F., Berens, R. L. (1994) Successful treatment of cutaneous leishmaniasis with allopurinol after failure of treatment with ketoconazole. Clin Infect Dis. 18 (5) : 813-15. [ Links ]
18. Vélez, I., Agudelo, S., Hendrickx, E., et al. (1997) Inefficacy of allopurinol as monotherapy for Colombian cutaneous leishmaniasis. A randomized controlled trial. Ann Intern Med. 126 (3) : 232-36. [ Links ]
19. Hendrikcx, E., Agudelo, S., Muñoz, D., Puerta, J., Vélez, I. (1998) Lack of efficacy of mefloquine in the treatment of new world cutaneous leishmaniasis in Colombia. Am J Trop Med Hyg. 59 (6) : 889-92. [ Links ]
20. Laguna-Torres, V. A., Silva, C. A., Correia, D., et al. (1999) Efficacy of mefloquine in the treatment of skin leishmaniasis in an endemic area of Leishmania (Viannia) braziliensis. Rev Soc Bras Med Trop. 32 (5) :529-32. [ Links ]
21. Soto, J., Toledo, J., Gutiérrez, P., et al. (2001). Treatment of American cutaneous leishmaniasis with miltefosine, an oral agent. Clin Infect Dis. 33 (7) : E57-61. [ Links ]
22. Soto, J., Arana, B. A., Toledo, J., et al. (2004) Miltefosine for new world cutaneous leishmaniasis. Clin Infect Dis. 38 (9) :1266-72. [ Links ]
23. Berhe, N., Ali, A., Hailu, A., Yeneneh, H. (1994) Relapse in Ethiopian visceral leishmaniasis (VL) patients after therapy with pentavalent antimonials: a ten year observation. Acta Trop. 57 (1) : 83-90. [ Links ]
24. Jackson, J. E., Tally, J. D., Ellis, W, Y. (1990) Quantitative in vitro drug potency and drug susceptibility evaluation of Leishmania sp. from patients unresponsive to pentavalent antimony therapy. Am. J. Trop. Med. Hyg. 90 (3) : 464-80. [ Links ]
25. Farault-Gambarelli, F., Piarroux, R., Deniau, M., et al. (1997) In vitro and in vivo resistance of Leishmania infantum to meglumine antimoniate: a study of 37 strains collected from patients with visceral leishmaniasis. Antimicrob Agents Chemother. 41 (4) : 827-830. [ Links ]
26. Bhattacharyya, A., Mukherjee, M., Duttagupta, S. (2002) Studies on stibanate unresponsive isolates of Leishmania donovani. J Biosci. 27 (5) : 503-508. [ Links ]
27. Cancado, J. R. (2001) Etiological treatment of chronic Chagas disease. Rev Inst Med Trop S Paulo. 43 (3) : 173-181. [ Links ]
28. Barrett, M. P., Burchmore, R. J., Stich, A., et al. (2003) The trypanosomiases. The Lancet. 362 (9394) : 1469-1480. [ Links ]
29. Nicholls, S., Guhl, F., Montoya, R., Rosas F., Zipa J. (2003) El tratamiento etiológico de la enfermedad de Chagas. Biomédica. 23 (suppl. 1) : 44-46. [ Links ]
30. Castro, S. L. (1993) The challenge of Chagas' disease chemotherapy: an update of drugs assayed against Trypanosoma cruzi. Acta Trop. 53 (2) : 83-98. [ Links ]
31. World Health Organization. (2002) Control of Chagas disease. Second Report of the WHO Expert Committee. Geneva, Switzerland: World Health Organization. [ Links ]
32. Marshall, E. (2000) Reinventing an ancient cure for malaria. Science. 290 (5491) : 437-439. [ Links ]
33. Fontanet, A. L., Johnston, D. B., Walker, A. M., et et al. (1993) High prevalence of mefloquine-resistant falciparum malaria in eastern Thailand. Bull World Health Org 71 (3-4) : 377–783. [ Links ]
34. Meshnick, S. (1998) Artemisin antimalarials: mechanisms of action and resistance. Med Trop. 58 (suppl 3) : 13-17. [ Links ]
35. Galal, A., Ahmad, M., El-Feraly, F., McPhail, A. (1996) Preparation and characterization of a new artemisinin-derived dimer. J Nat Prod. 59 (10) : 917-920. [ Links ]
36. Beekman, A., Barentsen, A., Woerdenbag, H. (1997) Stereochemistry dependent cytotoxicity of some artemisinin derivates. J Nat Prod. 60 (4) : 325-330. [ Links ]
37. Marsh, K. (1999) Genetic approaches to the determinations of drugs pathogenesis and infectivity in Plasmodium falciparum malaria. In: Malaria molecular and clinical aspects. (Ed) Harwood Academic Publishers. The Netherlands. pp. 217-248. [ Links ]
38. Walliker, D., Babiker, H., Cartwright, L. (1998) Malaria: Parasite biology, pathogenesis, and protection. (Ed) ASM Press. Washington, D.C. pp. 235-252. [ Links ]
39. Phillips, R. S. (2001) Current status of malaria and potential for control. Clin Microbiol Rev. 14 (1) : 208-226. [ Links ]
40. Enserink, M. (2000) Malaria researchers wait for industry to join fight. Science. 287 (5460) : 1956-1958. [ Links ]
41. Mckee, T. C., Bokesch, H. R., McCormick, J. L., et al. (1997) Isolation and characterization of new anti-HIV and cytotoxic leads from plants, marine, and microbial organism. J Nat Prod. 60 (5) : 431-438. [ Links ]
42. Newman, D. J., Cragg, G. M., Snader, K. M. (2003) Natural products as sources of new drugs over the period 1981-2002. J Nat Prod. 66 (7) : 1022-1037. [ Links ]
43. Tagboto, S., Townson, S. (2001) Antiparasitic properties of medicinal plants and other naturally occurring products. Adv Parasitol. 50 (1) : 199-295. [ Links ]
44. Hoet, S., Opperdoes, F., Brun, R., Quetin-Leclercq, J. (2004) Natural products active against African trypanosomes: a step towards new drugs. Nat Prod Rep. 21 (3) : 353-364. [ Links ]
45. Phillipson, J. D., Wright, C. W. (1991) Antiprotozoal agents from plant sources. Planta Med. 57 (7) : S53-59. [ Links ]
46. Schwikkard, S., Heerden, F. R. (2002) Antimalarial activity of plant metabolites. Nat Prod Rep. 19 (6) : 675-692. [ Links ]
47. Chan, M. J., Peña-Rodriguez, L. M. (2001) Plant natural products with leishmanicidal activity. Nat Prod Rep. 18 (6) : 674-688. [ Links ]
48. Fournet, A., Muñoz, V. (2002) Natural products as trypanocidal, antileishmanial and antimalarial drugs. Curr Top Med Chem. 2 (11) : 1215-1237. [ Links ]
49. Kayser, O., Kiderlen, A.F., Croft, S. L. (2003) Natural products as antiparasitic drugs. Parasitol Res. 90 (suppl 2) : S55-62. [ Links ]
50. Sepulveda-Boza, S., Cassels, B. K. (1996) Plant metabolites active against Trypanosoma cruzi. Planta Med. 62 (2) : 98-105. [ Links ]
51. Wright, C. W. (2002) Antiprotozoal natural products. In Evans, W. C., Saunders, W. B. Trease and Evans Pharmacognosy. (Ed) Saunders. Edinburgh. pp. 407–413. [ Links ]
52. Fournet, A., Hocquemiller, R., Roblot, F., Cavé, A., Richomme, P., Bruneton, J. (1993) Les Chimanines, Nouvelles Quinoleines Substituees en 2, Isolees d'Une Plante Bolivienne Antiparasitaire: Galipea longiflora. J Nat Prod. 56 (9) : 1547-1452. [ Links ]
53. Fournet, A., Angelo, A., Muñoz, V., Hocquemiller, R., Cavé, A., Bruneton, J. (1993) 2-substituted quinoline alkaloids as potential antileishmanial drugs. Antimicrob Agents Chemother. 37 (4) : 859-863. [ Links ]
54. Fournet, A., Gantier, J. C., Gautheret, A., et al. (1994) The activity of 2-substituted quinoline alkaloids in BALB/c mice infected with Leishmania donovani. J Antimicrob Chemother. 33 (3) : 537-544. [ Links ]
55. Jacquemond-Collet, I., Benoit-Vical, F., Mustofa, et al. (2002) Antiplasmodial and cytotoxic activity of Galipinine and other tetrahydroquinolines from Galipea officinalis. Planta Med. 68 (1) : 68-69. [ Links ]
56. Yeates, C. (2002) Sitamaquine (GlaxoSmithKline / Walter Reed Army Institute). Curr Opin Investig Drugs. 3 (10) : 1446–1452. [ Links ]
57. Lavaud, C., Massiot, G., Vasquez, C., Moretti, C., Sauvain, M., Balderrama, L. (1995) 4-quinoline alkaloids from Dictyoloma peruviana. Phytochemistry. 40 (1) : 317-320. [ Links ]
58. Muriithi, M. W., Abraham, W. R., Addae-Kyereme, J., et al. (2002) Isolation and in vitro antiplasmodial activities of alkaloids from Teclea trichocarpa: In vivo antimalarial activity and X-ray crystal structure of normelicopicine. J Nat Prod. 65 (7) : 956-959. [ Links ]
59. Bodley, A. L., Shapiro, T. A. (1995) Molecular and cytotoxic effects of camptothecin, a topoisomerase I inhibitor, on trypanosomes and Leishmania. Proc Natl Acad Sci USA. 92 (9) : 3726-3730. [ Links ]
60. Davis, R. A., Carroll, A. R., Quinn, R. J. (2002) Lepadins F-H, new cis-decahydroquinoline alkaloids from the Australian Ascidian Aplidium tabascum. J Nat Prod. 65 (4) : 454-457. [ Links ]
61. Wright, A. D., Goclik, E., Konig, G. M., Kaminsky, R. (2002) Lepadins D-F: Antiplasmodial and antitrypanosomal decahydroquinoline derivatives from the tropical marine Tunicate Didemnum sp. J Med Chem. 45 (14) : 3067-3072. [ Links ]
62. Egan, T. J., Ross, D. C., Adams, P. A. (1994) Quinoline antimalarial drugs inhibit spontaneous formation of ß-haematin (malaria pigment). FEBS Lett. 352 (1) : 54-57. [ Links ]
63. Zhang, J., Krugliak, M., Ginsburg, H. (1999) The fate of ferriprotoporphyrin IX in malaria infected erythrocytes in conjunction with the mode of action of antimalarial drugs. Mol Biochem Parasitol. 99 (1) : 129-141. [ Links ]
64. Vennerstrom, J. L., Nuzum, E. O., Miller, R. E., et al. (1999) 8-aminoquinolines active against blood stage Plasmodium falciparum in vitro inhibit hematin polymerization. Antimicrob Agents Chemother. 43 (3) : 598-602. [ Links ]
65. Francis, S., Sullivan, D., Goldberg, D. (1997) Hemoglobin metabolism in the malaria parasite Plasmodium falciparum. Annu Rev Microbiol. 51 (1) : 97-123. [ Links ]
66. Goldberg, D., Slater, A., Cerami, A., Henderson, G. (1990) Hemoglobin degradation in the malaria parasite Plasmodium falciparum: An ordered process in a unique organelle. Proc Natl Acad Sci USA. 87 (8) : 2931-2935. [ Links ]
67. Loria, P., Miller, S., Foley, M., Tilley, L. (1999) Inhibition of the peroxidative degradation of haem as the basis of action of chloroquine and other quinoline antimalarials. Biochem J. 339 (2) : 363-370. [ Links ]
68. Slater, A., Swiggard, W., Orton, B., et al. (1991) An iron carboxylate bond links the heme units of malaria pigment. Proc Natl Acad Sci USA. 88 (2) : 325-329. [ Links ]
69. Goldberg, D., Slater, A. (1992) The pathway of hemoglobin degradation in malaria. Parasitol Today. 8 (8) : 280–283. [ Links ]
70. Dorn, A., Vippagunta, S. R., Matile, H., Jacquet, C., Vennerstrom, J. L., Ridley, R. G. (1998) An assessment of drug-haematin binding as a mechanism for inhibition of haematin polymerisation by quinoline antimalarials. Biochem Pharmacol. 55 (6) : 727–736. [ Links ]
71. Egan, T. J., Marques, H. M. (1999) The role of haem in the activity of chloroquine and related antimalarial drugs. Coordination Chemistry Reviews. 192 (1) : 493–517. [ Links ]
72. Morello, A., Lipchenca, I., Cassels, B. K., Speisky, H., Aldunate, J., Repetto, Y. (1994) Trypanocidal effect of boldine and related alkaloids upon several strains of Trypanosoma cruzi. Comp Biochem Physiol Pharmacol Toxicol Endocrinol. 107 (3) : 367-371. [ Links ]
73. Camacho, M. R., Kirby, G. C., Warhurst, D. C., Croft, S. L., Phillipson, J. D. (2000) Oxoaporphine alkaloids and quinones from Stephania dinklagei and evaluation of their antiprotozoal activities. Planta Med. 66 (5) : 478-480. [ Links ]
74. Wright, C. W., Marshall, S. J., Russell, P. F., et al. (2000) In Vitro antiplasmodial, antiamoebic, and cytotoxic activities of some monomeric isoquinoline alkaloids. J Nat Prod. 63 (12) : 1638-1640. [ Links ]
75. Mahiou, V., Roblot, F., Hocquemiller, R., Cavé, A. (1994) New aporphine alkaloids from Guatteria foliosa. J Nat Prod. 57 (7) : 890-895. [ Links ]
76. Montenegro, H., Gutiérrez, M., Romero, L. I., Ortega-Barría, E., Capson, T. L., Rios, L. C. (2003) Aporphine alkaloids from Guatteria spp. with leishmanicidal activity. Planta Med. 69 (7): 677-679. [ Links ]
77. Queiroz, E. F., Roblot, F., Cavé, A., Paulo, M. Q., Fournet, A. (1996) Pessoine and Spinosine, Two Catecholic Berbines from Annona spinescens. J Nat Prod. 59 (4) : 438-440. [ Links ]
78. Février, A., Ferreira, M. E., Fournet, A., et al. (1999) Acetogenins and other compounds from Rollinia emarginata and their antiprotozoal activities. Planta Med. 65 (1) : 47-49. [ Links ]
79. Waechter, A. I., Cavé, A., Hocquemiller, R., Bories, C., Muñoz, V., Fournet, A. (1999) Antiprotozoal activity of aporphine alkaloids isolated from Unonopsis buchtienii (Annonaceae). Phytother Res. 13 (3) : 175–177. [ Links ]
80. Akendengue, B., Ngou-Milama, E., Roblot, F., et al. (2002) Antiplasmodial activity of Uvaria klaineana. Planta Med. 68 (2) : 167-169. [ Links ]
81. Hoet, S., Stévigny, C., Block, S., et al. (1994) Alkaloids from Cassytha filiformis and related aporphines: antitrypanosomal activity, cytotoxicity, and interaction with DNA and topoisomerases. Planta Med. 70 (5) : 407-413. [ Links ]
82. Montoya, G. L., Osorio, E. J., Jiménez, N., Arango, G. J. (2004) Actividad captadora de radicales libres de alcaloides de Rollinia pittieri (Annonaceae) por el método del DPPH. Vitae. 11 (2) : 51-57. [ Links ]
83. Phillipson, J. D., Wright, C. W. (1991) Medicinal plants in tropical medicine. 1. Medicinal plants against protozoal diseases. Trans Roy Soc Trop Med Hyg. 85 (1) : 18-21. [ Links ]
84. Iwu, M. M., Jackson, J. E., Schuster, B. G. (1994) Medicinal plants in the fight against leishmaniasis. Parasitol Today. 10 (2) : 65-68. [ Links ]
85. Merschjohann, K., Sporer, F., Steverding, D., Wink, M. (2001) In vitro effect of alkaloids on bloodstream forms of Trypanosoma brucei and T. congolense. Planta Med. 67 (7) : 623-627. [ Links ]
86. Kluza, J., Baldeyrou, B., Colson, P., et al. (2003) Cytotoxicity and DNA binding properties of the plant alkaloid burasaine. Eur J Pharm Sci. 20 (4-5) : 383-391. [ Links ]
87. Camacho, M. R., Phillipson, J. D., Croft, S. L., Rock, P., Marshall, S. J., Schiff, P. L. (2002) In vitro activity of Triclisia patens and some Bisbenzylisoquinoline Alkaloids against Leishmania donovani and Trypanosoma brucei brucei. Phytother Res. 16 (5) : 432–436. [ Links ]
88. Mahiou, V., Roblot, F., Fournet, A., Hocquemiller, R. (2000) Bisbenzylisoquinoline alkaloids from Guatteria boliviana (Annonaceae). Phytochemistry. 54 (7) : 709-716. [ Links ]
89. Foumet, A., Ferreira, M. E., Rojas, A., et al. (1997) The effect of bisbenzylisoquinoline alkaloids on Trypanosoma cruzi infections in mice. Int J Antimicrob Agents. 8 (3) : 163–170. [ Links ]
90. Fournet, A., Rojas, A., Ferreira, M. E., et al. (2000) Efficacy of the bisbenzylisoquinoline alkaloids in acute and chronic Trypanosoma cruzi murine model. Int J Antimicrob Agents. 13 (3) : 189–195. [ Links ]
91. Marshall, S. J., Russell, P. F., Wright, C. W., et al. (1994) In vitro antiplasmodial, antiamoebic, and cytotoxic activities of a series of bisbenzylisoquinoline alkaloids. Antimicro Agents Chemother. 38 (1) : 96-103. [ Links ]
92. Angerhofer, C. K., Guinaudeau, H., Wongpanich, V., Pezzuto, J. M., Cordell, G. A. (1999) Antiplasmodial and cytotoxic activity of natural bisbenzylisoquinoline alkaloids. J Nat Prod. 62 (1) : 59-66. [ Links ]
93. Lohombo-Ekomba, M. L., Okusa, P. N., Penge, O., Kabongo, C., Choudhary, M. I., Kasende, O. E. (2004) Antibacterial, antifungal, antiplasmodial, and cytotoxic activities of Albertisia villosa. J Ethnopharmacol. 93 (2-3) : 331–335. [ Links ]
94. Mambu, L., Martin, M. T., Razafimahefa, D., et al. (2000) Spectral characterisation and antilaplasmodial activity of bisbenzilisoqinolines from Isolona ghesquiereina. Planta Med. 66 (6) : 537-540. [ Links ]
95. Longanga, O., Apers, S., Pieters, L., et al. (2005) Biologically active bisbenzylisoquinoline alkaloids from the root bark of Epinetrum villosum. J Ethnopharmacol. 102: 89–94. [ Links ]
96. Francois, G., Timperman, G., Eling, W., et al. (1997) Naphthylisoquinoline alkaloids against malaria: evaluation of the curative potentials of dioncophylline C and dioncopeltine A against Plasmodium berghei in vivo. Antimicrob Agents Chemother. 41 (11) : 2533-2539. [ Links ]
97. Francois, G., Chimanuka, B., Timperman, G., et al. (1999) Defferential sensitivity of erythrocytic stages of the rodent malaria parasite Plasmodium chabaudi chabaudi to dioncophylline B, a highly active naphthylisoquinoline alkaloid. Parasitol Res. 85 (11) : 935-941. [ Links ]
98. Bringmann, G., Hamm, A., Gunther, C., Michel, M., Brun, R., Mudogo, V. (2000) Ancistroealaines A and B, two new bioactive naphthylisoquinolines, and related naphthoic acids from Ancistrocladus ealaensis. J Nat Prod. 63 (11) : 1465-1470. [ Links ]
99. Bringmann, G., Dreyer, M., Faber, J. H., et al. (2003) Ancistrotanzanine A, the first 5,3’-coupled naphthylisoquinoline alkaloid, and two further, 5,8’-linked related compounds from the newly described species Ancistrocladus tanzaniensis. J Nat Prod. 66 (9) : 1159-1165. [ Links ]
100. Bringmann, G., Dreyer, M., Faber, J. H., et al. (2004) Ancistrotanzanine C and Related 5,1’- and 7,3’-coupled naphthylisoquinoline alkaloids from Ancistrocladus tanzaniensis. J Nat Prod. 67 (5) : 743-748. [ Links ]
101. Bringmann, G., Messer, K., Brun, R., Mudogo, V. (2002) Ancistrocongolines A-D, new naphthylisoquinoline alkaloids from Ancistrocladus congolensis. J Nat Prod. 65 (8) : 1096-1101. [ Links ]
102. Bringmann, G., Wohlfarth, M., Rischer, H., Schlauer, J., Brun, R. (2002) Extract screening by HPLC coupled to MS–MS, NMR, and CD: a dimeric and three monomeric naphthylisoquinoline alkaloids from Ancistrocladus griffithii. Phytochemistry 61 (2) : 195–204. [ Links ]
103. Bringmann, G., Messer, K., Wolf, C., et al. (2002) Dioncophylline E from Dioncophyllum thollonii, the first 7,3’-coupled dioncophyllaceous naphthylisoquinoline alkaloid. Phytochemistry. 60 (4) : 389–397. [ Links ]
104. François, G., Timperman, G., Holenz, J., et al. (1996) Naphthylisoquinoline alkaloids exhibit strong growth-inhibiting activities against Plasmodium falciparum and P. berghei in vitro-structure-activity relationships of dioncophylline C. Ann Trop Med Parasitol. 90 (2) : 115-123. [ Links ]
105. Bringmann, G., Messer, K., Schwobel, B., Brun, R., Aké Assi, L. (2003). Habropetaline A, an antimalarial naphthylisoquinoline alkaloid from Triphyophyllum peltatum. Phytochemistry 62 (3) : 345–349. [ Links ]
106. Viladomat, F., Bastida, J., Codina, C., Nair, J. J., Campbell, W. (1997) Alkaloids of the south african Amaryllidaceae. Recent Res Devel in Phytochem. 1 (1) : 131-171. [ Links ]
107. Labraña, J., Machocho, A. K., Kricsfalusy, V., et al. (2002) Alkaloids from Narcissus angustifolius subsp. Transcarpathicus (Amaryllidaceae). Phytochemistry 60 (8) : 847–852. [ Links ]
108. Campbell, W. E., Nair, J. J., Gammon, D. W., et al. (1998) Cytotoxic and antimalarial alkaloids from Brunsvigia littoralis. Planta Med. 64 (1) : 91-93. [ Links ]
109. Campbell, W. E., Nair, J. J., Gammon, D. W., et al. (2000). Bioactive alkaloids from Brunsvigia radulosa. Phytochemistry. 53 (5) : 587-591. [ Links ]
110. Likhitwitayawuid, K., Angerhofer, C. K., Chai, H., Pezzuto, J. M., Cordell, G. A. (1993) Cytotoxic and antimalarial alkaloids from the bulbs of Crinum amabile. J Nat Prod. 56 (8) : 1331-1338. [ Links ]
111. Machucho, A., Bastida, J., Codina, C., et al. (2004) Augustamine type alkaloids from Crinum kirkii. Phytochemistry 65: 3143–3149. [ Links ]
112. Giorgio, C. D., Delmas, F., Ollivier, E., Elias, R., Balansard, G., Timon-David, P. (2004) In vitro activity of the b-carboline alkaloids harmane, harmine, and harmaline toward parasites of the species Leishmania infantum. Exp Parasitol. 106 (3-4) : 67–74. [ Links ]
113. Kam, T. S., Sim, K. M. (1998). Alkaloids from Kopsia griffithii. Phytochemistry. 47 (1) : 145-147. [ Links ]
114. Kam, T. S., Sim, K. M., Koyano, T., Komiyama, K. (1999). Leishmanicidal alkaloids from Kopsia griffithii. Phytochemistry. 50 (1) : 75-79. [ Links ]
115. Azoug, M., Loukaci, A., Richard, B., (1995). Alkaloids from stem bark and leaves of Peschiera buchtieni. Phytochemistry. 39 (5) : 1223-1228. [ Links ]
116. Delorenzi, J. D., Attias, M., Gattass, C. R., et al. (2001) Antileishmanial activity of an indole alkaloid from Peschiera australis. Antimicrob Agents Chemother. 45 (5) : 1349–1354. [ Links ]
117. Delorenzi, J. D., Freire, L., Gattass, C. R., (2002) In Vitro activities of Iboga alkaloid congeners coronaridine and 18-methoxycoronaridine against Leishmania amazonensis. Antimicrob Agents Chemother. 46 (7) : 2111–2115. [ Links ]
118. Muñoz, V., Morretti, C., Sauvain, M., et al. (1994) Isolation of bis-indole alkaloids with antileishmanial and antibacterial activities from Peschiera van heurkii (syn. Tabernaemontana van heurkii). Planta Med. 60 (5) : 455-459. [ Links ]
119. Federici, E., Palazzino, G., Nicoletti, M., Galeffi, C. (2000) Antiplasmodial activity of the alkaloids of Peschiera fuchsiaefolia. Planta Med. 66 (1) : 93-95. [ Links ]
120. Mitaine-Offer, A. C., Sauvain, M., Valentin, A., Callapa, J., Mallié, M., Zèches-Hanrot, M. (2002) Antiplasmodial activity of Aspidosperma indole alkaloids. Phytomedicine. 9 (2) : 142–145. [ Links ]
121. Wright, C.W., Allen, D., Cai, Y., Phillipson, J.D., et al. (1992) In vitro antiamoebic and antiplasmodial activities of alkaloids isolated from Alstonia angustifolia roots. Phytother Res. 6 (2) : 121-124. [ Links ]
122. Keawpradub, N., Kirby, G. C., Steele, J. C., Houghton, P. J. (1999) Antiplasmodial activity of extracts and alkaloids of three Alstonia species from Thailand. Planta Med. 65 (8) : 690-694. [ Links ]
123. Steele, J. C., Veitch, N. C., Kite, G. C., Simmonds, M. S., Warhurst, D. C. (2002) Indole and ß-carboline alkaloids from Geissospermum sericeum. J Nat Prod. 65 (1) : 85-88. [ Links ]
124. Milliken, W. (1997) Traditional anti-malarial medicine in Roraima, Brazil. Econ Bot. 51 (3) : 212-237. [ Links ]
125. Thongphasuk, P., Suttisri, R., Bavovada, R., Verpoorte, R. (2003) Alkaloids and a pimarane diterpenoid from Strychnos vanprukii. Phytochemistry. 64 (4) : 897–901. [ Links ]
126. Frédérich, M., Jacquier, M. J., Thépenier, P., et al. (2002) Antiplasmodial activity of alkaloids from various Strychnos species. J Nat Prod. 65 (10) : 1381-1386. [ Links ]
127. Wright, C. W., Bray, D. H., O’Neill, M. J., et al. (1991) Antiamoebic and antiplasmodial activities of alkaloids isolated from Strychnos usambarensis. Planta Med. 57 (4) : 337-340. [ Links ]
128. Frédérich, M., Tits, M., Goffin, E., et al. (2004) In vitro and in vivo antimalarial properties of isostrychnopentamine, an indolomonoterpenic alkaloid from Strychnos usambarensis. Planta Med. 70 (6) : 520-525. [ Links ]
129. Frédérich, M., De Pauw, M. C., Prosperi, C., et al. (2001) Strychnogucines A and B, two new antiplasmodial bisindole alkaloids from Strychnos icaja. J Nat Prod. 64 (1) : 12-16. [ Links ]
130. Philippe, G., De Mol, P., Zeches-Hanrot, M., et al. (2003) Indolomonoterpenic alkaloids from Strychnos icaja roots. Phytochemistry. 62 (4) : 623–629. [ Links ]
131. Frédérich, M., De Pauw, M. C., Llabrés, G., et al. (2000) New antimalarial and cytotoxic sungucine derivates from Strychnos icaja roots. Planta Med. 66 (3) : 262-269. [ Links ]
132. Stærk, D., Lemmich, E., Christensen, J., Kharazmi, A., Olsen, C. E., Jaroszewski, J. W. (2000) Leishmanicidal, antiplasmodial and cytotoxic activity of indole alkaloids from Corynanthe pachiceras. Planta Med. 66 (4) : 531-536. [ Links ]
133. Lisgartent, J. N., Coll, M., Portugal, J., Wright, C. W., Ayamamil, J. (2002) The antimalarial and cytotoxic drug cryptolepine intercalates into DNA at cytosine-cytosine sites. Nat Struct Biol. 9 (1) : 57–60. [ Links ]
134. Dassonneville, L., Bonjean, K., De-Pauw, M. C., et al. (1999) Stimulation of topoisomerase II-mediated DNA cleavage by 3 DNA-intercalating plant alkaloids: cryptolepine, matadine and serpentine. Biochemistry. 38 (9) : 7719–7726. [ Links ]
135. Kam, T., Sim, K., Koyano, T., Toyoshima, M., Hayashi, M., Komiyama, K. (1998) Cytotoxic and leishmanicidal aminoglycosteroids and aminosteroids from Holarrhena curtisii. J Nat Prod. 61 (11) : 1332-1336. [ Links ]
136. Moretti, C., Sauvain, M., Lavaud, C., Massiot, G., Bravo, J. A., Muñoz, V. (1998) A Novel Antiprotozoal Aminosteroid from Saracha punctata. J Nat Prod. 61 (11) : 1390-1393. [ Links ]
137. Chataing, B., Concepción, J. L., Lobatón, R., Usubillaga, A. (1998). Inhibition of Trypanosoma cruzi growth in vitro by Solanum Alkaloids: A comparison with ketoconazole. Planta Med. 64 (1) : 31-36. [ Links ]
138. Zirihi, G., Grellier, P., Gue-de-Guina, F., et al. (2005) Isolation, characterization and antiplasmodial activity of steroidal alkaloids from Funtumia elastica (Preuss) Stapf. Bioorg Med Chem Lett. 15: 2637–2640. [ Links ]
139. Kapil, A. (1993) Piperine: a potent inhibitor of Leishmania donovani promastigotes in vitro. Planta Med. 59 (5) : 474. [ Links ]
140. Kapil, A., Sharma, S., Wahidulla, S. (1994) Leishmanicidal activity of 2-benzoxazolinone from Acanthus illicifolius in vitro. Planta Med. 60 (2) : 187-188. [ Links ]
141. Solis, P. N., Lang’at, C., Gupta, M. P., Kirby, G. C., Warhurst, D. C., Phillipson, J. D. (1995) Bio-active compounds from Psychotria camponutans. Planta Med. 61 (1) : 62-65. [ Links ]
142. Sauvain, M., Moretti, C., Bravo, J. A., et al. (1996) Antimalarial Activity of Alkaloids from Pogonopus tubulosus. Phytother Res. 10 (3) : 198-201. [ Links ]
143. El Sayed, K. A., Dunbar, D. C., Goins, D. K., et al. (1996) The marine environment: a resource for prototype antimalarial agents. J Nat Toxins. 5 (1) : 261-285. [ Links ]
144. Muhammad, I., Dunbar, C., Khan, S., et al.(2003) Antiparasitic Alkaloids from Psychotria klugii. J. Nat. Prod., 66: 962-967. [ Links ]
145. Heys, L., Moore, C. G., Murphy, P. (2000) The guanidine metabolites of Ptilocaulis spiculifer and related compounds; isolation and synthesis. J Chem Soc Rev. 29 (1) : 57–67. [ Links ]
146. Hua, H., Peng, J., Fronczek, F. R., Kelly, M., Hamann, M. T. (2004) Crystallographic and NMR studies of antiinfective tricyclic guanidine alkaloids from the sponge Monanchora unguifera. Bioorg Med Chem. 12 (24) : 6461–6464. [ Links ]
147. Rao, K. V., Santarsiero, B. D., Mesecar, A. D., Schinazi, R. F., Tekwani, B. L., Hamann, M. T. (2003) New manzamine alkaloids with activity against infectious and tropical parasitic diseases from an Indonesian sponge. J Nat Prod. 66 (6) : 823-828. [ Links ]
148. Rao, K., Kasanah, N., Wahyuono S., et al. (2004) Three New Manzamine Alkaloids from a Common Indonesian Sponge and Their Activity against Infectious and Tropical Parasitic Diseases. J. Nat. Prod., 67: 1314-1318. [ Links ]
149. Muñoz V., Sauvain, M., Bourdy, G., (2000) A search for natural bioactive compounds in Bolivia through a multidisciplinary approach. Part I. Evaluation of the antimalarial activity of plants used by the Chacobo Indians. J Ethnopharmacol. 69 (2) : 127–137. [ Links ]
150. Weniger, B., Robledo, S., Arango, G. J., et al. (2001) Antiprotozoal activities of Colombian plants. J Ethnopharmacol. 78 (2-3) : 193-200. [ Links ]
151. Suksamrarn, S., Suwannapoch, N., Aunchai, N., et al. (2005) Ziziphine N, O, P and Q, new antiplasmodial cyclopeptide alkaloids from Ziziphus oenoplia var. brunoniana. Tetrahedron 61: 1175–1180[ [ Links ]STANDARDIZEDENDPARAG]
152. Kohler, I., Jenett-Siems, K., Siems, K., et al. (2002) In vitro antiplasmodial investigation of medicinal plants from El Salvador. Z Naturforsch. 57 (3-4) : 277-81. [ Links ]
153. Schmidt, A., Krauth-Siegel, R. L. (2002) Enzymes of the trypanothione metabolism as targets for antitrypanosomal drug development. Curr Top Med Chem. 2 (11) : 1239-1259. [ Links ]
154. Sajid, M., McKerrow, J.R. (2002) Cysteine proteases of parasitic organisms. Mol Biochem Parasitol. 120 (1) : 1–21. [ Links ]
155. Roberts, C.W., McLeod, R., Rice, D. W., Ginger, M., Chance, M. L., Goad, L. J. (2003) Fatty acid and sterol metabolism: potential antimicrobial targets in apicomplexan and trypanosomatid parasitic protozoa. Mol Biochem Parasitol. 126 (2) : 129–142. [ Links ]
156. Gilbert, I.H. (2002) Inhibitors of dihydrofolate reductase in Leishmania and trypanosomes. Biochim Biophys Acta. 1587 (2-3) : 249–257. [ Links ]
157. Gelb, M. H., Van Voorhis, W. C., Buckner, F. S., et al. (2003) Protein farnesyl and N-myristoyl transferases: piggy-back medicinal chemistry targets for the development of antitrypanosomatid and antimalarial therapeutics. Mol Biochem Parasitol. 126 (2) : 155–163. [ Links ]
158. Verlinde, C.L., Hannaert, V., Blonski, C., et al. (2001) Glycolysis as a target for the design of new anti-trypanosome drugs. Drug Resist Updat. 4 (1) : 50–65. [ Links ]
159. Müller, S., Coombs, G. H., Walter, R. D. (2001) Targeting polyamines of parasitic protozoa in chemotherapy. Trends Parasitol. 17 (5) : 242–249. [ Links ]
160. Doerig, C. (2004) Protein kinases as drug targets in parasitic protozoa. Biochim Biophys Acta. 1697 (1-2) : 155-168. [ Links ]
161. Jayanarayan, K. G., Dey, C. S. (2002) Microtubules: dynamics, drug interaction and drug resistance in Leishmania. J Clin Pharm Ther. 27 (5) : 313–320. [ Links ]
162. Shapiro, T. A., Englud, P. T. (1990). Selective cleavage of kinetoplast DNA minicircles promoted by antitrypanosomal drugs. Proc Natl Acad Sci USA. 87 (3) : 950-954. [ Links ]
163. Caffrey, C. R., Scory, S., Steverding, D. (2000) Cysteine proteinases of trypanosome parasites: novel targets for chemotherapy. Curr Drug Targets. 1 (2) : 155–162. [ Links ]
164. Urbina, J. A. (1997) Lipid biosynthesis pathways as chemotherapeutic targets in kinetoplastid parasites. Parasitology. 114 (suppl) : S91–99.
165. Barrett, M. P., Gilbert, I. H. (2002) Perspectives for new drugs against trypanosomiasis and leishmaniasis. Curr Top Med Chem. 2 (5) : 471–482. [ Links ]
166. Docampo, R., Moreno, S. N. (2001) The acidocalcisome. Mol Biochem Parasitol. 114 (2) : 151–159. [ Links ]
167. Go, M. L. (2003) Novel Antiplasmodial Agents. Med Res Rev. 23 (4) : 456-487. [ Links ]
168. Silva, A. M., Lee, A. Y., Gulnik, S. V., et al. (1996) Structure and inhibition of plasmepsin II, a hemoglobin-degrading enzyme from Plasmodium falciparum. Proc Natl Acad Sci USA. 93 (19) : 10034–10039. [ Links ]
169. Yuthavong, Y., Yuvaniyama, J., Chitnumsub, P., et al. (2005) Malarial (Plasmodium falciparum) dihydrofolate reductase-thymidylate synthase: structural basis for antifolate resistance and development of effective inhibitors. Parasitology. 130 (Pt 3) : 249-259. [ Links ]
170. Chakrabarti, D., Azam, T., DelVecchio, C., Qiu, L., Park, Y., Allen, C. M. (1998) Protein prenyl transferase activities of Plasmodium falciparum. Mol Biochem Parasitol. 94 (2) : 175–184. [ Links ]
171. Wengelnik, K., Vidal, V., Ancelin, M. L., et al. (2002) A class of potent antimalarials and their specific accumulation in infected erythrocytes. Science. 295 (5558) : 1311-1314. [ Links ]
172. Rosenthal, P. J. (2003) Antimalarial drug discovery: old and new approaches. J Exp Biol. 206 (21) : 3735-3744. [ Links ]
173. Naranjo, N., Osorio, E., Arango, G. J., Aguilar, Y., Muskus, C. (2004) Caracterización molecular del gen que codifica para la enzima bifuncional Dihidrofolato reductasa – Timidilato sintetasa (DHFR-TS) de Leishmania braziliensis. Revista de la Asociación Colombiana de Ciencias Biológicas. 16 (2) : 190. [ Links ]
174. Osorio, E., Muskus, C. E., Robledo, S. M. (2005) Leishmania. Glicoproteína P en resistencia a medicamentos y estrategias de reversión. Biomédica. En publicación. [ Links ]
175. Rho, M., Totoshima, M., Hayashi, M., Subramaniam, G., Kam, T., Komiyama, K. (1999) Reversal of multidrug resistance by kopsiflorine isolated from Kopsia dasyrachis. Planta Med. 65 (4) : 307-310. [ Links ]
176. Frédérich, M,. Hayette, M., Tits, M., Mol, P., Angenot, L. (2001) Reversal of chloroquine and mefloquine resistance in Plasmodium falciparum by the two monoindole alkaloids, Icajine and Isoretuline. Planta Med. 67 (6) : 523-527. [ Links ]
177. Frappier, F., Jossang, A., Soudon, J., et al. (1996) Bisbenzylisoquinolines as modulators of chloroquine resistance in Plasmodium falciparum and multidrug resistance in tumor cells. Antimicrob Agents Chemother. 40 (6) : 1476-1481. [ Links ]
178. Pajeva, I., Wiese, M. (1998) Molecular modeling of phenothiazines and related drugs as multidrug resistance modifiers: A comparative molecular field analysis study. J Med Chem. 41 (11) : 1815-1826. [ Links ]
179. Ecker, G., Hubber, M., Schmid, D., Chiba, P. (1999) The importance of a nitrogen atom in modulators of multidrug resistance. Mol Pharmacol. 56 (4) : 791-796. [ Links ]