Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.13 no.2 Medellín July/Dec. 2006
EFECTO DE HIDRAZONAS SOBRE AMASTIGOTES INTRACELULARES DE Leishmania panamensis Y UNA PROTEASA DE CISTEÍNA PARASITARIA
EFFECT OF HYDRAZONES AGAINST INTRACELLULAR AMASTIGOTES OF Leishmania panamensis AND A PARASITIC CYSTEIN PROTEASE
Diana L. MUÑOZ1, Diana P. CARDONA2,3, Alvaro CARDONA2, Lina M. CARRILLO1, Winston QUIÑONES2, Fernando ECHEVERRI2, Iván D. VÉLEZ1 y Sara M. ROBLEDO1*
1 Programa de Estudio y Control de Enfermedades Tropicales-PECET, Universidad de Antioquia, AA 1226, Medellín-Colombia.
2 Química Orgánica de Productos Naturales-SIU, Universidad de Antioquia, AA 1226, Medellín-Colombia.
3 Facultad de Química Farmacéutica, Universidad de Antioquia, Calle 67 No 53-108, Bloque 2, Medellín, Colombia.
* Autor a quien se debe dirigir la correspondencia: srobledo@guajiros.udea.edu.co
Recibido: Marzo 17 de 2006 Aceptado: Agosto 29 de 2006
RESUMEN
En este trabajo se describe la síntesis de hidrazonas derivadas de cromano, tiocromano, alquil y aril hidrazonas, su actividad leishmanicida y su efecto sobre proteasas de cisteína de L. (V) panamensis. Se sintetizan feniltiocromanos y bencil y naftil derivados; solamente las fenilhidrazonas muestran alguna actividad sobre amastigotes de Leishmnia (V) panamensis. No se observa ningún efecto sobre una proteasa de cisteína del parásito lo que sugiere un mecanismo de acción diferente a la inhibición de esta enzima.
Palabras Clave: síntesis, hidrazonas, efecto leishmanicida, proteasas de cisteína, Leishmania (V) panamensis
ABSTRACT
In this paper, the synthesis of hydrazones derived from cromano, thiocroman, alkyl and aril hydrazones is described, as well as their leishmanicidal activity and their effect on cysteine proteases from L. (V) panamensis. A series of novel phenylthiochromane and benzyl and naphtyl derivatives are synthesized and evaluated for their cytotoxic and antileishmanial activities. Their effect on parasite cysteine protease is also evaluated. Only phenylthiochromane derivatives display some activity against Leishmania (V) panamensis but all compounds are inactive against parasitic cystein protease. These results may suggest a different mechanism of action for these compounds.
Keywords: synthesis, hydrazones, leishmanicidal effect, cystein proteases, Leishmania (V) panamensis
INTRODUCCIÓN
La leishmaniosis es una de las enfermedades parasitarias más prevalentes en el mundo. Está presente en 88 países de las regiones tropicales y subtropicales de América, Europa, Asia y Africa y afecta principalmente la población de las áreas rurales y semiurbanas donde prevalece la pobreza y donde los sistemas de salud son poco eficientes. Se calcula que aproximadamente 350 millones de personas están en riesgo de adquirir la infección, 15 millones de personas sufren la enfermedad y la incidencia anual es de 2 a 3 millones de casos nuevos (1). Sin embargo, es muy probable que estas cifras sean una subestimación puesto que la enfermedad es de notificación obligatoria sólo en 32 de los países afectados, lo que hace que muchos casos permanezcan sin registrarse (2). Desde el año 2002 ha sido clasificada por la Organización Mundial de la Salud como enfermedad emergente o no controlada para la cual no se dispone de vacuna.
La quimioterapia es poco satisfactoria debido a que son muy pocos los medicamentos disponibles y su eficacia se ve afectada por la diferente sensibilidad (o resistencia) de los parásitos a los medicamentos, la toxicidad asociada a tratamientos prolongados con medicamentos empíricos y a su precio, relativamente alto si se tienen en cuenta las condiciones de pobreza de las personas afectadas. Por esta razón se hace necesaria la búsqueda de nuevas sustancias que conduzcan al desarrollo de nuevos medicamentos, estrategia que se vislumbra como elemento clave para la prevención y el control de la enfermedad (3).
Las proteasas de cisteína (PC) son enzimas que participan en funciones importantes del ciclo de vida de muchos parásitos, entre ellas el tráfico de proteínas necesarias para el metabolismo y las funciones reproductivas (4,5). Algunas de las PC identificadas y caracterizadas incluyen la catepsina tipo L (cpL) y la catepsina tipo B (cpB), encontradas en algunas especies de Leishmania, falcipaina-2 y falcipaina-3 de Plasmodium falciparum y la cruzipaina de T. cruzi. En Leishmania, específicamente, se ha encontrado que estas PC son de gran relevancia en varios aspectos importantes para el parásito como son el crecimiento, la infectividad y la supervivencia al interior de la célula huésped, por lo que se le ha considerado un buen blanco para el diseño de nuevos medicamentos.
Recientemente, en la búsqueda de sustancias antiparasitarias, se han sintetizado diferentes hidrazonas, ya que algunas tienen la capacidad de inhibir una PC del parásito; esta enzima hidroliza el enlace amídico mediante el ataque nucleofílico al carbonilo por parte del residuo de cisteína (6) y desempeña un papel muy importante en el tráfico citoplasmático de proteínas y péptidos. Algunos inhibidores peptidomiméticos reaccionan en ambos lados del sitio activo de la enzima (7), formando un aducto que puede ser reversible. La importancia de inhibir esta enzima radica en el hecho de que en el hombre existen formas isoenzimáticas de PC resistentes a las hidrazonas activas sobre las respectivas enzimas parasitarias. Por medio de la química combinatoria y mediante síntesis en fase sólida (8) y tamizaje virtual (6) se ha preparado una amplia serie de hidrazonas. Así, en ratones infectados con L. (L) major se han obtenido buenos resultados con derivados de la hidrazida de oxálico bis[(2-hidroxi-1-naftil)-metilen], que actúan como inhibidores enzimáticos reversibles (9). En este trabajo se describe la síntesis de hidrazonas derivadas de cromano, tiocromano, alquil y aril hidrazonas, su actividad leishmanicida y su efecto sobre PC de L. (V) panamensis.
MATERIALES Y MÉTODOS
Síntesis de hidrazonas
Los compuestos identificados por 1H y 13C RMN (10,11), se sintetizaron de acuerdo a metodologías descritas en la literatura. El procedimiento general se describe a continuación: la hidrazida (1 mmol) se adicionó a una disolución de aldehído y/o cetona (1.3 mmol) en metanol y posteriormente ácido acético glacial (4 gotas). La mezcla de reacción se sometió a reflujo durante 2-3 horas con agitación constante. Una vez se ha dado la conversión total de los reactivos, determinada por cromatografía de capa delgada o por precipitación del producto de reacción, las acil hidrazonas se recristalizaron con metanol. La síntesis de acil hidrazonas derivadas del furaldehído requieren una purificación adicional, en una columna de sílica gel, empacada en hexano y utilizando como fase móvil un gradiente de hexano: acetato. Las estructuras de los compuestos fueron asignadas principalmente por 1H y 13C RMN, y eventualmente por difracción de rayos X y serán objeto de otra publicación.
Parásitos
Se utilizaron promastigotes y amastigotes axénicos de L. (V) panamensis, cepa MHOM/CO/87/ UA140 aislada de un paciente colombiano con leishmaniosis cutánea, y amastigotes de L. (L) mexicana cepa MHOM/MX/95/NAN1, que se utilizó como control ya que en esta especie de Leishmania se ha demostrado la presencia y la actividad de PC (12). Para la obtención de promastigotes, los parásitos se cultivaron en medio NNN modificado a 26°C, y para la obtención de amastigotes axénicos los parásitos se cultivaron en medio Drosophila de Schneider suplementado con 20% de Suero Bovino Fetal (SBF) a un pH 5.4 y 32°C (13).
Evaluación de la citotoxicidad sobre células humanas
La actividad citotóxica de los productos de síntesis se evaluó sobre la línea celular promonocítica humana U-937 siguiendo la metodología descrita (14). Las células se cultivaron a una concentración de 100.000 células/mL en medio RPMI 1640 con 10% de SBF y la correspondiente concentración de los productos (usando como concentración mayor 250 μg/ml) en platos de 96 pozos para cultivo celular. Las células se incubaron a 37°C con 5% CO2 durante 96 horas con los productos respectivos y luego de 48 horas se renovó el medio de cultivo. Finalmente, el efecto de los productos se determinó a las 96 horas de incubación midiendo la actividad de la deshidrogenasa mitocondrial, adicionando 10 µl/pozo de MTT e incubando a 37°C durante 3 horas. Para parar la reacción se adicionó 100 µl/pozo de una solución al 50% de isopropanol y 10% de SDS.
La producción de Formazán se midió a 570 nm en un lector de ELISA. Se utilizaron como control de viabilidad células cultivadas en ausencia de los productos pero mantenidas en las mismas condiciones El Glucantime® se utilizó como medicamento control. Cada concentración de los productos y el Glucantime®, así como el control sin “medicamento” se evaluó por triplicado en tres experimentos diferentes. Los resultados se expresan como la Concentración Letal 50 (CL50) calculada por el método Probit, que corresponde a la concentración a la cual ocurre el 50% de muerte celular (15).
Actividad leishmanicida in vitro
La efectividad de los productos se evaluó sobre amastigotes intracelulares de L. (V) panamensis (MHOM/CO/87/UA/UA140). Para asegurar una buena infección in vitro los parásitos fueron aislados a partir de lesiones en hámsters infectados experimentalmente según lo descrito previamente (16). Las células U-937 con 48 horas de crecimiento se lavaron con PBS y se ajustaron a una concentración de 1x105 células/mL de medio RPMI 1640 y 100ng/ mL de Forbol 12-miristato 13-acetato (PMA). En cada pozo de un plato para cultivo celular de 24 pozos se dispensó 1 ml de la suspensión de células; los platos se incubaron a 37ºC con 5% CO2. Luego de 48 horas, las células adheridas se infectaron con promastigotes de L. (V) panamensis en fase estacionaria de crecimiento en una proporción 25:1 parásito: célula, suspendidos en medio RPMI sin suero.
Las células con los parásitos se incubaron durante 2 horas con 5% CO2 a 34°C. Luego de dos lavados con PBS para eliminar los parásitos libres, se adicionó medio RPMI y se incubó de nuevo. Después de 24 horas de incubación se reemplazó el RPMI por un medio que contenía las diferentes concentraciones de los productos (en un rango no superior a 50 µg/mL). Las células infectadas se expusieron a cada producto durante 96 horas, cambiando el medio con los productos a las 48 horas. Las células se lavaron, se fijaron con metanol y se colorearon con Giemsa. Células infectadas y cultivadas en ausencia de los diferentes productos sirvieron como control de la infección. El Glucantime ® se utilizó como medicamento control. Cada concentración de los productos y el Glucantime®, así como el control sin medicamento, se evaluó por triplicado en dos experimentos diferentes. Los resultados se expresan como la Concentración Efectiva 50 (CE50) calculada por el método Probit (15), que corresponde a la concentración en la cual la carga parasitaria disminuye en un 50%. El índice de selectividad (IS) se calculó dividiendo la actividad citotóxica para la actividad leishmanicida (IS = CL50 / CE50).
Capacidad inhibitoria de los productos sobre la actividad de PC de L. (V) panamensis
El efecto de los productos en la actividad de las PC de L. (V) panamensis se evaluó en el estadío de amastigotes axénicos. Para ello, los parásitos se incubaron con diferentes concentraciones de los productos (200, 100, 50 y 25 µg/mL) diluidos en medio Schneider al 20%, a un pH de 5.4 de SFB y 32°C. Parásitos incubados en ausencia de compuestos se evaluaron como control de actividad de PC; adicionalmente se incluyeron como control de inhibición de la actividad, parásitos incubados en presencia de E-64. Luego de 2 horas de incubación los parásitos se lavaron con PBS por centrifugación a 2500 rpm durante 10 minutos y se resuspendieron en tampón de muestra reductor que contiene Tris-HCL 0.5M (pH 6.8) SDS al 4%, Glicerol, 2-β-Mercaptoetanol y azul de bromofenol. El lisado total de los parásitos se analizó por separación electroforética bajo condiciones no desnaturalizantes en geles de poliacrilamida al 12% que contenían gelatina al 0.1%. Después de la electroforesis los geles se lavaron durante 10 minutos en PBS a un pH de 7.2 con Triton X100 al 2.5%, a temperatura ambiente, y luego se incubaron con DTT a 2 mM en PBS pH 5.5 a 37°C, finalmente se tiñeron con azul de Coomassie para visualizar la degradación de la gelatina debida a la actividad de estas proteasas.
RESULTADOS Y DISCUSIÓN
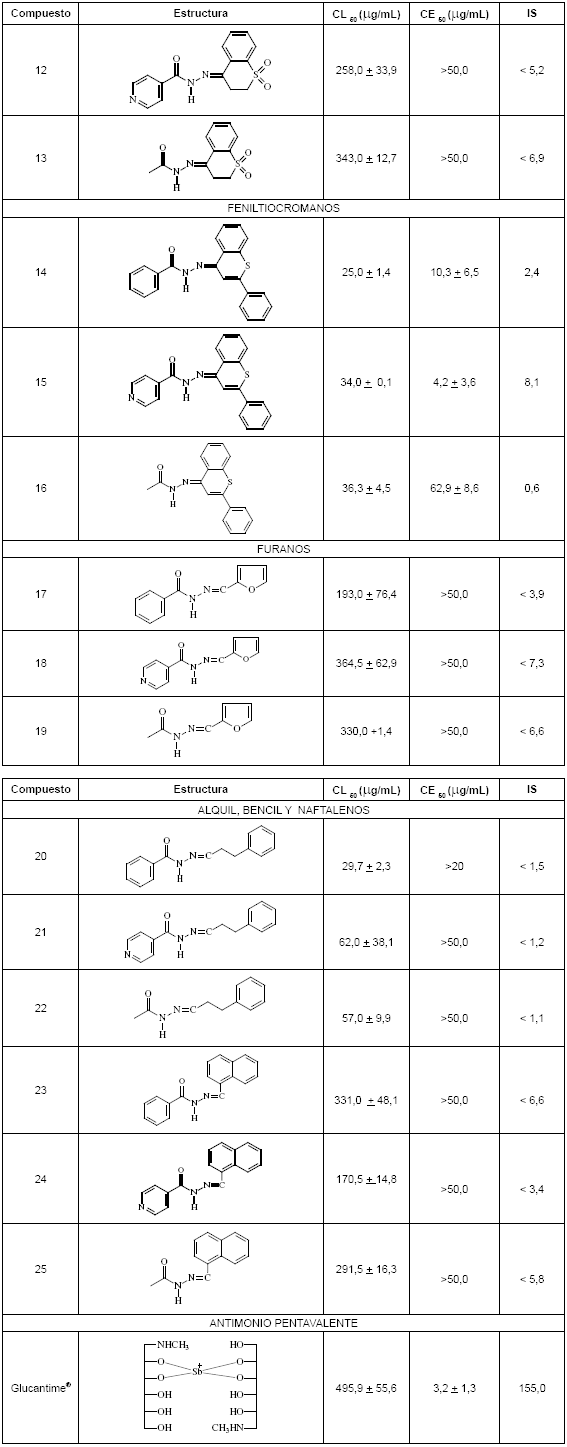
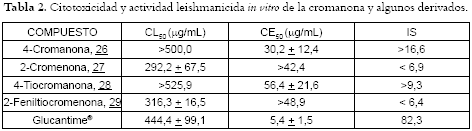
Como productos inhibidores potenciales de PC de Leishmania se obtuvieron 25 derivados de acil hidrazonas. Los compuestos se sintetizaron siguiendo metodologías previamente descritas en la literatura y los resultados se dividieron en cinco grupos, de acuerdo a la parte de la molécula que contribuye con el grupo carbonilo, feniltiocromanos y bencil y naftil derivados. La toxicidad y actividad leishmanicida obtenida para los compuestos derivados de acil hidrazonas se resumen en la tabla 1. Por su parte, la bioactividad de los compuestos originales 4-cromanona (26), 2-cromenona (27), tiocromanona (28) y feniltiocromenona (29) se muestra en la tabla 2. La actividad de una molécula para que sea promisoria en estudios más avanzados se ha definido de acuerdo a los parámetros de citotoxicidad y efectividad: CL50 >100.0 µg/mL y CE50 <50.0 µg/mL. Los compuestos originales tienen una citotoxicidad reducida y una efectividad que los sitúa en el umbral de sustancias promisorias. No obstante, la formación de la hidrazona implica una pérdida casi total de la actividad para casi todos los compuestos (véase tabla 2), excepto los derivados del 2- feniltiocromenona 14, 15 y 16 que tienen una CE50 de 10.3, 4.2 y 62.9 µg/mL, una actividad superior o similar a la molécula original. Se aprecia además que existe un incremento en la citotoxicidad, el cual se observa también para los productos 20, 21 y 22. Al parecer, tanto para la efectividad como para la citotoxicidad se requiere la presencia de sistemas aromáticos a cada lado de la hidrazona, en especial un grupo fenilo lateral. Por su parte las naftilhidrazonas, o las heterocíclicas como las furanohidrazonas, son prácticamente inactivas, a pesar de poseer los residuos citotóxicos ya mencionados. No obstante, ninguna de las hidrazonas mostró actividad inhibidora de PC a dosis entre 25.0 y 200 µg/mL; si éste es el mecanismo de acción parcial de los productos 14-16 se podría mejorar la actividad de estos compuestos mediante una funcionalización adecuada en el sistema aromático del cromano, permitiendo la formación de un sistema del tipo quinonemethide, al que se le atribuye el mecanismo de acción de algunos inhibidores del tipo salicilaldehido acilhidrazona, al actuar como un aceptor Michael para atacar el residuo de cisteína de la enzima, inactivándola irreversiblemente (17).
Adicionalmente también se ha detectado otro mecanismo de acción, pues algunas hidrazonas tienen la capacidad de quelar hierro de Plasmodium, afectando su crecimiento en todos sus estadíos (18). En el caso de piridoxal isonicotinoil hidrazona (PIH) se ha encontrado que éste forma un complejo con el hierro por lo cual se inhibe la reducción de Fe (III) a Fe (II), inhibiendo así la formación de oxiradicales (19). La dependencia del grupo en algunos parásitos también es un blanco importante en Leishmania y Trypanosoma; así, moléculas del tipo 3,6-bis-ω-dietilaminoamiloxixantonas han mostrado ser 100 veces más activas in vitro que la pentamidina (20).
Un hecho especialmente importante en cuanto a diseñar inhibidores de PC es que los parásitos Leishmania, Plasmodium y Trypanosoma parecen compartir un sitio activo muy similar, por lo cual es de esperarse que una sustancia sea activa simultáneamente sobre ellos. Finalmente, varias hidrazonas derivadas de 2-fenilimidazo[1,2-α]-piridina también mostraron actividad contra las macrofilarias Acanthocheilonema viteae y Brugia pahangi (21).
La actividad de los tres derivados de feniltiocromenona muestra relación entre la estructura y la actividad, por lo cual dichas moléculas son susceptibles de modificarse para mejorar su perfil leishmanicida con funcionalizaciones en los dos anillos aromáticos laterales.
AGRADECIMIENTOS
Los autores agradecen a la Universidad de Antioquia y a COLCIENCIAS por el apoyo financiero a través del proyecto “Búsqueda de antiparasitarios de la flora colombiana” e “Inhibidores de cistein proteinasa como potenciales compuestos quimioterapéuticos en leishmaniosis”, Diana Lorena Muñoz agradece a Colciencias por un apoyo financiero para estudios de magíster mediante este último proyecto.
REFERENCIAS BIBLIOGRÁFICAS
1. Murray HW, Berman JD, Davies CR, Saravia NG. Advances in leishmaniasis. Lancet 2005;366(9496):1561-77.
[ Links ] 2. WHO. Programme for the surveillance and control of leishmaniasis [citado 2006 junio 28] Disponible en: URL: http://www.int/emc/diseses/leish/index.html.
[ Links ] 3. Remme JH, Blas E, Chitsulo L, Desjeux PM, Engers HD, Kanyok TP, et al. Strategic emphases for tropical diseases research: a TDR perspective. Trends Parasitol 2002;18(10):421-6.
[ Links ] 4. Sajid M, McKerrow J. Cysteine proteases of parasitic organisms. Mol Biochem Parasitol 2002;120(1):1-21.
[ Links ] 5. McConville MJ, Mullin KA, Ilgoutz SC, Teasdale RD. Secretory pathway of trypanosomatid parasites. Microbiol Mol Biol Rev 2002;66(1):122-54.
[ Links ] 6. Desai PV, Patny A, Sabnis Y, Tekwani B, Gut J, Rosenthal P, et al. Identification of novel parasitic cysteine protease inhibitors using virtual screening. 1. The ChemBridge Database. J Med Chem 2004;47(26):6609-15.
[ Links ] 7. Caffrey CR, Scory S, Steverding D. Cysteine proteinases of trypanosome parasites: novel targets for chemotherapy. Curr Drug Targets 2000;1(2):155-62.
[ Links ] 8. Lee A, Huang L, Ellman JA. General solid-phase method for the preparation of mechanism-based cysteine protease inhibitors. J Am Chem Soc 1999;121(43):9907-14.
[ Links ] 9. Selzer PM, Pingel S, Hsieh I, Ugele B, Chan VJ, Engel JC, et al. Cysteine protease inhibitors as chemotherapy: Lessons from a parasite target. Proc Natl Acad Sci U S A 1999;96(20):11015-22.
[ Links ] 10. Rollas S, Gulerman N, Erdeniz H. Synthesis and antimicrobial activity of some new hydrazones of 4-fluorobenzoic acid hydrazide and 3-acetyl- 2,5-disubstituted-1,3,4-oxadiazolines. Farmaco 2002;57(2):171-4.
[ Links ] 11. Szczepankiewicz BG, Liu G, Jae HS, Tasker AS, Gunawardana IW, von Geldern TW, et al. New antimitotic agents with activity in multi-drug-resistant cell lines and in vivo efficacy in murine tumor models. J Med Chem 2001;44(25):4416-30.
[ Links ] 12. Frame MJ, Mottram JC, Coombs GH. Analysis of the role of cysteine proteinases of Leishmania mexicana in the host-parasite interaction. Parasitology 2000;121(Pt4):367-77.
[ Links ] 13. Gupta N, Goyal N, Rastogi AK. In vitro cultivation and characterization of axenic amastigotes of Leishmania. Trends Parasitol 2001;17(3):150-3.
[ Links ] 14. Weniger B, Robledo S, Arango GJ, Deharo E, Aragon R, Munoz V, et al. Antiprotozoal activities of Colombian plants. J Ethnopharmacol 2001;78(2-3):193-200.
[ Links ] 15. Papermaster BW, Pincus JH, Lincoln P, Reisfeld RA. Probit analysis of cytotoxicity data. Transplantation 1974;18(6):541-4.
[ Links ] 16. Robledo SM, Valencia AZ, Saravia NG. Sensitivity to Glucantime of Leishmania viannia isolated from patients prior to treatment. J Parasitol 1999 Apr; 85(2):360-6.
[ Links ] 17. Ifa DR, Rodrigues CR, de Alencastro RB, Fraga CAAM, Barreiro EJ. A possible molecular mechanism for the inhibition of cysteine proteases by salicylaldehyde N-acylhydrazones and related compounds. J Mol Structure 2000;505:11-17.
[ Links ] 18. Tsafack A, Loyevsky M, Ponka P, Cabantchik ZI. Mode of action of iron (III) chelators as antimalarials IV, potentiation of desferal action by benzoyl and isonicotinoyl hydrazone derivatives. J Lab Clin Med 1996;127(6):574-82.
[ Links ] 19. Mauricio AQ, Lopes GK, Gomes CS, Oliveira RG, Alonso A, Hermes-Lima M. Pyridoxal isonicotinoyl hydrazone inhibits iron-induced ascorbate oxidation and ascorbyl radical formation. Biochim Biophys Acta 2003;1620(1-3):15-24.
[ Links ] 20. Kelly JX, Ignatushchenko MV, Bouwer HG, Peyton DH, Hinrichs DJ, Winter RW, et al. Antileishmanial drug development: exploitation of parasite heme dependency. Mol Biochem Parasitol 2003;126(1):43-9.
[ Links ] 21. Sundberg RJ, Biswas S, Kumar Murthi K, Rowe D, McCall JW, Dzimianski MT. Bis-Cationic heteroaromatics as macrofilaricides: Synthesis of bis-amidine and bis guanylhydrazone derivatives of substituted imidazo [1, 2-a] pyridines). J Med Chem 1998;41(22):4317-28. [ Links ]