Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.13 no.2 Medellín July/Dec. 2006
BACTERIAS ÁCIDO LÁCTICAS (BAL) SILVESTRES COLOMBIANAS PRESENTAN PROPIEDADES ADECUADAS PARA LA FABRICACIÓN DE MASA ÁCIDA
COLOMBIAN WILD LACTIC ACID BACTERIA (LAB) SHOW GOOD PROPERTIES IN SOURDOUGH MANUFACTURE
Ángela M. LEÓN P.1*, Olga I. MONTOYA C.2, Karina E. MOTATO1, Diana M. GRANDA1, Carlos A.CARO1, Juan M. RESTREPO3, Shirley ECHEVERRI1, Julián VALENCIA1 y Lida QUINCHÍA1
1 Grupo BIOALI. Departamento de Alimentos, Facultad Química Farmacéutica, Universidad de Antioquia. Calle 67 No 53-108, Bloque 2. Medellín, Colombia
2 Facultad de Ciencias, Universidad Nacional. Calle 59A No 63 – 20. Medellín, Colombia.
3 Facultad Nacional de Salud Pública, Universidad de Antioquia. Calle 62 No.52-59. Medellín, Colombia.
* Autor a quien se debe dirigir la correspondencia: aleon@farmacia.udea.edu.co
Recibido: Abril 24 de 2006 Aceptado: Septiembre 12 de 2006
RESUMEN
Los panes de masa ácida son productos elaborados mediante fermentación microbiana ácido láctica y alcohólica, con propiedades sensoriales, fisicoquímicas y reológicas diferentes a las de los panes no acidificados, y su desarrollo y comercialización constituyen una alternativa para el consumidor colombiano. El objetivo de este estudio es determinar si existe efecto estadísticamente significativo al emplear aislados de bacterias ácido lácticas (BAL) silvestres colombianas Lactobacillus sp.LBM9 y Lactobacillus brevis LBM13 combinadas con levadura comercial Saccharomyces cerevisae con respecto al pan control (sin BAL), en las propiedades de la masa y del producto terminado. A partir de una colección, se seleccionan los aislados más adecuados para panificación y se construye su curva de crecimiento. Se determinan las propiedades fisicoquímicas (aumento de volumen, pH, acidificación de la masa, porcentaje de proteína) y reológicas (textura) del pan, evaluando si existen diferencias estadísticamente significativas entre los tratamientos y el control, mediante el programa Statgraphics 5,0, a un α=0.05. Los resultados demuestran que las BAL más adecuadas para panificación son los aislados Lactobacillus sp. LBM9 y Lactobacilus brevis LBM13, los cuales descienden el pH y aumentan la acidez de las masas, disminuyen el porcentaje proteico, aumentan el volumen final y retrasan el endurecimiento (firmeza).
Palabras clave: masa ácida, bacterias ácido lácticas.
ABSTRACT
Sourdough breads are food products produced by lactic acid fermentation, with different sensorial, physicochemical and rheological properties from not acidified bread, that offer a nutritional option for colombian consumers. The aim of this study is to evaluate the effect of two wild Colombian lactic acid bacteria strains, Lactobacillus sp. LBM9 and Lactobacillus brevis LBM13, combined with a commercial strain of Saccharomyces cerevisae on the final properties of the dough and bread. Two isolates are selected from a collection and their growth curve is built. Physicochemical (final volume, pH, titrable acidity, protein percentage) and rheological (texture) properties are determined. Significant differencees between control and treatments are determined at α= 0,05 using Statgraphics 5,0 software. Results show that the most fitted wild colombian LAB isolates for sourdough bread making are Lactobacillus sp. LBM9 and Lactobacillus brevis LBM13 which reduce pH and increase dough acidity, reduce protein content, improve the final loaf volume, and retard staling.
Keywords: sourdough, lactic acid bacteria.
INTRODUCCIÓN
Las bacterias ácido lácticas (BAL) desdoblan carbohidratos y producen ácido láctico y otros metabolitos descendiendo el pH hasta 4,7 (1); se clasifican en homo o heterofermentativas (2). Las bacterias homofermentativas sintetizan sólo ácido láctico sin liberar CO2. Entre ellas está Lactobacillus plantarum, utilizado para fabricación de masas ácidas, leches ácidas, cárnicos madurados y vegetales fermentados (1, 3, 4). Las bacterias heterofermentativas generan, además de ácido láctico, una cantidad apreciable de etanol, acetato y CO2, como Lactobacillus brevis y Leuconostoc sp. (3). Las masas ácidas se fabrican con harina y agua (5), mezclas heterogéneas de BAL y levaduras. Dichas masas se acidifican hasta pH 4 y 4,5 (6). Tradicionalmente, las masas ácidas se fabrican con harina y agua que se adicionan a una porción de masa panaria proveniente de una operación anterior (7) y se fermentan durante 4 horas (Fermented Dough: FD), o durante 24 horas (Long Time Fermented Dough: LFD), donde se alcanza pH de 3,5 y un porcentaje de acidez de 1,054% (8). Durante este proceso, las BAL realizan proteólisis, hidrólisis moderada del almidón y acidificación (8,9,10), lo que se traduce en una miga suave y palatable, aumento del volumen y de la biodisponibilidad mineral mediante la degradación del fitato, y una fuerte inhibición de microorganismos alteradores como Bacillus subtilis, proveniente de la harina de trigo (11,12). Las BAL presentes naturalmente en las masas ácidas son L. plantarum, L. brevis, L. crispatus, L. sanfranciscensis (L. brevis ssp. lindneri), L. ponds, Leuconostoc sp. y Streptococcus sp. (13); y se asocian con frecuencia a levaduras como S. cerevisiae (14,15), S. exiguus, Torulopsis holmii, Candida krusei, Pichia norvegensis y Hansenula anomala (16).
Las proteínas de la harina de trigo comprenden del 9 al 13% de su peso seco (17); pueden ser monoméricas (gliadinas y albúminas/globulinas monoméricas) o poliméricas (gluteninas, albúminas de alto peso molecular [HMW] y triticinas), y durante el amasado del pan, la gliadina y la glutenina forman el gluten, una red tridimensional que, similar al almidón, absorbe el agua agregada (18). Estas proteínas emulsifican, absorben agua, aportan viscoelasticidad (19) y forman una malla proteica (20). La actividad proteolítica de las BAL libera compuestos nitrogenados de bajo peso molecular como los aminoácidos y péptidos, que estimulan su crecimiento, y la síntesis de vitaminas del complejo B (16, 21) y ácidos grasos volátiles, los cuales proporcionan mejores condiciones nutricionales para aumentar el recuento de las levaduras (22). El deterioro en la calidad sensorial del pan se asocia con la pérdida del sabor, de la crujencia en la corteza, el aumento en el desmoronamiento de la miga y de su firmeza. La firmeza es considerada uno de los principales atributos de envejecimiento o staling del pan (23) y su incremento rápido es causa de pérdidas en la industria panificadora mundial, las cuales se han calculado entre un 8-10% de la producción total (24). Se ha estudiado la velocidad de retrogradación mediante la combinación binaria de levadura panadera con L. plantarum, L. amylophilus, L. brevis, L. sake y L. acetotolerans, obteniéndose como resultado el retraso de la retrogradación en panes, comparados con aquellos donde sólo se emplea la levadura panadera (13). Lo anterior se debe a la síntesis de un exopolisacárido retenedor de agua; lo cual puede ser aprovechado como alternativa para reemplazar aquellos aditivos retenedores de humedad (25) como almidón, goma arábiga y carrageninas. Los exopolisacáridos tipo fructano, sintetizados por L. sanfransciscensis y L. reuteri, también sirven como prebiótico para otros microorganismos probióticos, permitiendo la optimización de las propiedades tecnológicas y nutricionales de la masa ácida y del pan (26).
Los panes elaborados con masas ácidas silvestres que tienen un pH bajo y una relación alta de ácido láctico/ácido acético, presentan grandes volúmenes y velocidades bajas de deterioro durante el almacenamiento (27). También se ha encontrado que las fórmulas de pan fermentadas con la combinación de levadura, obtienen un volumen mayor que aquellas donde se emplean combinaciones de BAL L. plantarum- L .brevis (1:1) sin levadura, y concluyen que los mejores volúmenes se encuentran por combinación de levadura y BAL (7).
En esta investigación se tuvo como objetivo evaluar la actividad panadera de algunos aislados silvestres de BAL durante la fabricación de panes de masa ácida. Para esto se seleccionaron los aislados de mayor potencial a partir de una colección, se determinó su curva de crecimiento y se evaluaron las propiedades físico-químicas y bromatológicas (pH, acidez, volumen, proteína total), y reológicas (textura,) obtenidas tanto en la masa ácida como en el pan horneado.
MATERIALES Y MÉTODOS
Selección de aislados de mejor comportamiento panadero y determinación del crecimiento bacteriano
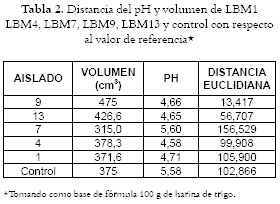
Los aislados de BAL estudiados fueron aislados en investigaciones previas a partir de repollitas de Bruselas y leches fermentadas, en el Laboratorio de Microbiología Industrial de la Universidad Nacional de Colombia, sede Medellín. Pertenecen a la colección de microorganismos de este laboratorio, codificadas como LBM4, LBM7, LBM9, LBM10 y LBM13 (28), conservadas en agar MRS más aceite mineral estéril, y se repicaron en caldo MRS dos veces durante 24 horas antes de cada análisis. Algunos de estos aislados de Lactobacillus se han caracterizado por API CH50 como L. brevis LBM13 y Lactobacillus plantarum LBM10, los que demostraron actividad bactericida contra E. coli, Salmonella sp. y L. monocytogenes, in vitro, a diferentes condiciones de almacenamiento, pH y temperaturas (29). En la masa ácida, el pH debe descender a 4,5 para garantizar la liberación de ácidos, aromas, péptidos, exopolisacáridos y otros compuestos que dan aroma, sabor y textura al pan (8). Para elegir los aislados mas adecuados para fabricación de masa ácida, se tuvieron en cuenta las características de pH y volumen final de la pieza de pan (cm3) después del proceso de horneo, estimándose de esta forma la distancia euclidiana con respecto a valores ideales de pH= 4,5 y volumen = 490 cm3 para 100 g de harina como base de fórmula (7).
En este cálculo se consideró el valor de pH de mayor relevancia que el volumen, asignando factores de ponderación de 0,6 y 0,4 respectivamente para la fórmula: D= ([0,6(pHa-pHi)2+ 0,4(Va-Vi)2])1/2, donde pHa = pH calculado para el aislado; pHi= pH ideal; Va= Volumen calculado para el aislado; Vi= Volumen ideal. Adicionalmente se compararon los valores medios de pH y volumen mediante el estadístico de prueba T^2 de Hotelling, para verificar la hipótesis Ho: los valores medios de volumen y pH para cada cepa son iguales a los valores de referencia (490 cm3, pH=4.5). Todas las pruebas se realizaron a un nivel α= 0.05 (28).
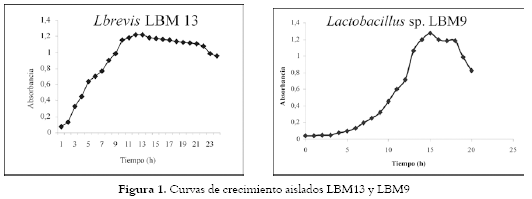
La curva de crecimiento de Lactobacillus sp. LBM9 y L. brevis LBM13 se hizo por Recuento de Unidades Formadoras de Colonia/cm3 (UFC/cm3) en agar MRS y por turbidimetría (31). Cada aislado se inoculó en caldo MRS, se incubó a 35 ± 2°C en cámaras de anaerobiosis y cada hora se tomaron dos alícuotas, una para el recuento en superficie y otra para determinar la absorbancia a 550 nm (31).
Elaboración de los panes de masa ácida
Las masas se fabricaron con harina comercial Colcereal®, de 70% de extracción, con la cual se realizaron todos los ensayos. Se tomó 1 cm3 del inóculo de BAL en caldo MRS y el 30% de cada uno de los componentes de la masa, excepto la levadura (Tabla 1). Una vez mezclada la fórmula manualmente, se amasó en un cilindro de motor CARVI® durante 5 minutos y se fermentó a 30 °C y 85% de Humedad Relativa durante 12 horas (16), en una cámara de crecimiento SALVA KWICK Co®. Después de la acidificación, se realizó una mezcla previa del total de la levadura con el resto de la harina y agua, de acuerdo a la formulación seleccionada (7).
Los panes se armaron en los moldes para pan tajado y se fermentaron durante 3 horas a 30°C y 85% de HR en la misma cámara de crecimiento. El horneo se hizo a 220°C durante 30 minutos para piezas de 100 g de harina, y a 123°C por 45 minutos para panes con base en 1000 g de harina, en un horno SALVA KWICK Co®; se enfriaron a temperatura ambiente (20ºC durante 90 minutos) y se empacaron en bolsas de polietileno de baja densidad (32). Los panes control se elaboraron de la misma manera sin BAL.
Evaluación de las propiedades físico-químicas y bromatológicas de las masas y el pan
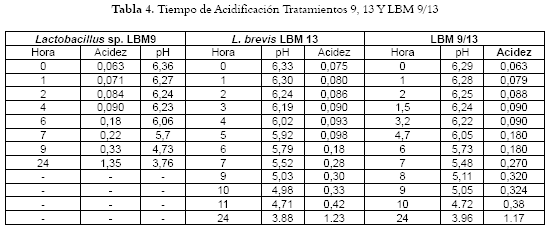
Determinación de la acidificación de las masas: Se tomaron 5 gramos de cada muestra y se mezclaron con 100 cm3 de agua destilada, se titularon con NaOH 0,1 N usando fenolftaleína como indicador de acidez. Se determinó el tiempo de acidificación tomando muestras de cada masa a intervalos de tiempo de 1 hora, determinando pH y acidez hasta llegar a un pH alrededor de 4,5. Con estos valores se construyó la gráfica de pH y Acidez vs. Tiempo. Igualmente se tomaron los valores de pH y acidez final de los panes horneados y se compararon con los valores del pan control. La acidez como porcentaje de ácido láctico, se calculó con la fórmula % Acidez (p/p)= [Vol NaOH*N*0,09/g]*100 (33). Una vez se alcanzó el pH final de 4,5, se dejó fermentar la masa hasta las 24 horas para determinar el pH que se podría alcanzar en una masa LFD (7).
Análisis de proteína total: Se determinó por el método MicroKjeldhal, tal como se describe en Ramírez (1999). El cálculo de proteína se hizo con la fórmula: Proteína = [0,014*N*(V1-V2)*100/ g.]*6,25, donde V1= Volumen del titulante para la muestra (cm3), V2= Volumen de titulante para el blanco (cm3), 6,25= Factor de transformación del nitrógeno en proteína, g. = Peso de la muestra, N = Normalidad del titulante (33).
Determinación del volumen máximo final: Los panes enfriados a temperatura ambiente durante tres horas, se sumergieron en un volumen previamente aforado de semillas de ajonjolí, se midió el volumen final alcanzado a partir de la diferencia entre el volumen final y el volumen inicial y se evaluó la diferencia alcanzada con el pan control (34).
Evaluación de las propiedades reológicas: Textura del pan en almacenamiento
Análisis de firmeza: El estudio de la retrogradación del pan se basa en la reología y la definición de firmeza como la fuerza requerida (en gramos, kilogramos o Newton) para comprimir el producto en una distancia predeterminada (35). Para medir el comportamiento reológico de endurecimiento en la miga del pan, se aplica una fuerza o deformación definida sobre un porcentaje del espesor de la tajada (el 40% del espesor), durante el tiempo de almacenamiento, midiendo la fuerza de respuesta para dar un indicativo de parámetros como la dureza de dicha miga (36). De esta manera, la medición durante su almacenamiento del aumento en la firmeza del pan elaborado, permite tener una medida experimental de este proceso con base en la cual pueda estudiarse indirectamente si las BAL tienen un efecto retardante del endurecimiento. Los panes horneados se enfriaron a temperatura ambiente durante tres horas y se evaluaron en un texturómetro TA.XT2i, usando el software Texture Expert. Se tomaron doce mediciones por día, en los días 1, 2, 3 y 8 de almacenamiento, empacadas en bolsas de polietileno de baja densidad a temperatura ambiente. Se siguió el protocolo del AIB (American Internacional Bakery) teniendo en cuenta los siguientes parámetros (37): Espesor tajada de 1/2, eliminando las tres tajadas de cada extremo, Velocidad de preprueba: 2 mm/seg, Velocidad prueba: 1,7 mm/seg, Velocidad postprueba: 10 mm/seg, Diámetro de la sonda de aluminio: 35 mm, Porcentaje de deformación: 40%, 200 Puntos por segundo (37, 38).
RESULTADOS
Selección de aislados de mejor comportamiento panadero y determinación de las curvas de crecimiento bacteriano
Selección de aislados: En la tabla 2 se presentan los promedios de los resultados obtenidos para los aislados.
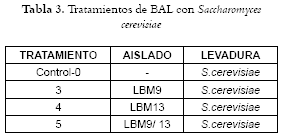
Los análisis estadísticos T^2 de Hotelling para verificar Ho: mu=mu0 (los valores medios de volumen y pH para cada aislado son iguales a los valores de referencia de volumen y pH: 490 cm3; 4,5), arrojaron los valores siguientes del estadístico para cada uno de los casos: t2(LBM4): 0,02004833, t2(LBM9): 0,07027284, t2(LBM7): 0,007979936, t2(13): 0,07920887, t2(ctrl): 0.003255373. A partir de los dos aislados seleccionados se aplicaron los tratamientos, como se indica en la tabla 3, donde se les asigna un número que los identifica en algunas pruebas.
Curvas de crecimiento bacteriano: En la figura 1 se presentan las curvas de absorbancia vs. tiempo para ambos aislados a diferentes horas de incubación.
Evaluación de las propiedades físico-químicas y bromatológicas de las masas y el pan
Acidificación de las masas: Se determinó exactamente el tiempo que tarda cada masa LF en alcanzar un pH alrededor de 4,7- 4,5 y el pH obtenido a las 24 horas (Tabla 4)
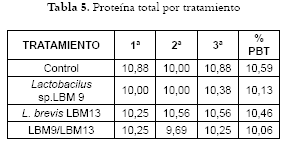
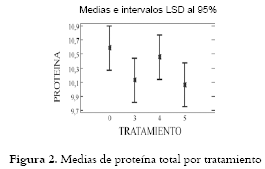
Análisis de proteína Total: En la Tabla 5 se reportan valores de proteína total de los panes en cada uno de los tratamientos y, en la figura 2 las medias de proteína total por tratamiento.
Evaluación de las propiedades reológicas: textura del pan en almacenamiento
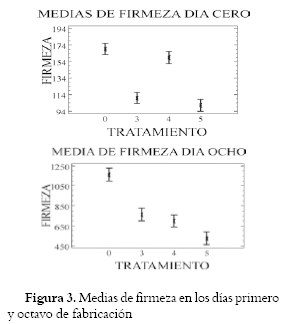
A partir de las medias de firmeza de los datos tomados en los días 1, 2, 3 y 8 se establecieron grupos homogéneos y con diferencia estadísticamente Medias e intervalos LSD al 95% significativa en la fuerza máxima de compresión (Figura 3)
DISCUSION DE RESULTADOS
Selección de aislados de mejor comportamiento panadero y curvas de crecimiento
Selección de los aislados: A partir de los resultados se seleccionaron L. brevis LBM13 y Lactobacillus sp. LBM9, por presentar los valores más cercanos en distancia a los valores ideales reportados previamente (8). Mediante el estadístico T2 de Hotelling se determinó igualmente que al nivel de significancia α=0.05, Lactobacillus sp LBM9 y L. brevis LBM13, generan valores cercanos a los recomendados en las referencias. Es importante resaltar que otros investigadores han asignado a la fermentación heteroláctica de L. brevis un papel esencial para el sabor y la vida de anaquel del pan, determinados por la producción de ácido láctico (40, 41). L. brevis libera compuestos aromáticos como 3-metil, 1-butanol; furfuril alcohol, 2-feniletil- alcohol y otros (39), típicos de la fermentación panadera (17), y ácido acético, relacionado con el aroma, sabor y conservación microbiológica del pan (12). Por todo lo anterior, se considera que la selección de este aislado es de gran interés para los estudios de masas ácidas.
Igualmente se combinan las BAL con levadura panadera, ya que forman una relación de beneficio mutuo, porque las levaduras producen aminoácidos, vitaminas y otros factores de crecimiento requeridos por las BAL, mientras que los ácidos producidos por éstas inhiben el crecimiento de otros microorganismos competitivos con las levaduras (16, 42).
Curvas de crecimiento bacteriano: Se puede observar el comportamiento diferente de los dos aislados, en el cual, L. brevis LBM13, presentó un crecimiento acelerado desde el inicio, con un recuento de 4,12x105 UFC/cm3 (absorbancia 0,130), hasta las 10 horas con 8,1x1011 UFC/cm3 (absorbancia 1,180), alcanzándose a las 12 horas la fase estacionaria y la fase de declinación o muerte a la hora 21. Estos datos concuerdan con los valores de crecimiento obtenidos previamente entre las 7 y 8 horas de incubación, con recuentos de 19x109 UFC/g (12). Igualmente, la absorbancia obtenida supera la máxima reportada de 1,25 para un recuento de 109 UFC/cm3 de BAL, cuando se cultivan a 24°C en caldo MRS (32). Por los resultados obtenidos con L. brevis LBM13, se puede concluir que éste es un buen microorganismo para la elaboración de masas ácidas por su rápida adaptabilidad al medio. A diferencia del anterior, Lactobacillus sp. LBM9, se mantiene durante 5 horas en fase lag, logrando un recuento de 6,88x1010 UFC/cm3 al final de la fase logarítmica en la hora 15. Por su comportamiento durante todas las fases de crecimiento, Lactobacillus sp. LBM9 es un aislado de crecimiento más lento, posiblemente por su mayor exigencia nutricional, de condiciones de anaerobiosis y, por lo tanto, de mayor costo para un proceso de fermentación en masas ácidas si se lo desea trabajar como inóculo directo sobre una masa fresca.
Evaluación de las propiedades físicoquímicas y bromatológicas de las masas y del pan
Acidificación de las masas: En la tabla 4 se observa que el pan control obtuvo un pH mínimo de 5,90 a las 10 horas y una acidez de 0.17% v/v de ácido láctico. Al comparar los tratamientos, puede afirmarse que Lactobacillus sp. LBM9, alcanza más rápido (9 horas) el pH de 4,76. Le sigue la mezcla LBM9/13, cuyo pH fue de 4,72 a las 10 horas, y por último, L. brevis LBM13 alcanzó el pH de 4,2 a las 10 horas. Los valores de pH (3,96) y acidez (1,17%) a las 24 horas, que alcanzó la combinación LBM 9/13 coinciden con los reportados por Corsetti et al (2000), donde la masa ácida fermentada con S. cerevisiae, S. sanfranciscencis, y L. plantarum alcanza como LFD un pH de 3,96 pero supera fuertemente la acidez titulable que en esta última fue de 0,85% (31). Igualmente, se encontró relación en los valores mínimos de pH (a las 24 horas de acidificación) para LBM9, LBM13 y LBM 9/13 respectivamente, con los que se han reportado mínimos de 3,44 alcanzados en fermentaciones con L. plantarum y de 3,49 por combinación 1:1 de L. plantarum y L. brevis. En estudios previos se ha determinado la máxima acidez de 1,054% de ácido láctico para las masas inoculadas sólo con L. brevis, seguida de 0,78% obtenida por la combinación L. brevis y L. plantarum (16); mientras que en esta investigación, para los tres tratamientos, los porcentajes de acidez alcanzados en las LFD son mayores al reportado.
Lo anterior indica que las BAL evaluadas tienen la capacidad de fermentar a pH inferior a 4 y generar acidez como ácido láctico alrededor de 1%, que tienen una gran resistencia a la acidez y un potencial para su aplicación en productos de menor pH como las frutas frescas, jugos de frutas y otras masas de menor pH (17). Lactobacillus sp. LBM9 presentó la mayor resistencia a la acidez en los tres tratamientos al alcanzar valores medios de pH de 3,76 y acidez de 1,35% como ácido láctico a las 24 horas (LFD). Al finalizar la etapa de acidificación LF, se obtuvo un recuento promedio de 2,1x108 UFC/ cm3 del aislado Lactobacillus sp. LBM9; de 6,9x109 UFC/ cm3 para L. brevis LBM13 y 9,7x109 UFC/cm3 con la combinación LBM9/LBM13. De estos valores, los correspondientes a L. brevis LBM13 y la combinación LBM9/13 se encuentran dentro del rango óptimo para una masa totalmente acidificada, que es de 109 UFC/cm3 de BAL (12, 43, 44, 45). Con lo anterior se confirma que estas bacterias se pueden emplear para la elaboración de masas ácidas.
Análisis de proteína total: Se determinó que el control presentó la mayor concentración de proteína con relación a los panes de estudio. Estos datos concuerdan con estudios que afirman que el descenso en el contenido proteico se debe a la proteólisis bacteriana (1, 55) la cual es baja durante la etapa de adaptación y aumenta en la fase exponencial (46, 47). Debe aclararse que la proteólisis también se incrementa por la actividad de las enzimas de los cereales bajo las condiciones ácidas de la fermentación (48, 49, 50). La mayor actividad proteolítica tiene lugar durante la fermentación de la masa ácida en presencia de las BAL y sin levadura, influyendo sobre la estructura del gluten y liberando aminoácidos (prolina, fenil alanina, ornitina y otros) responsables del sabor y el aroma (16, 50), algunos de los cuales son captados en la etapa de mezcla por la levadura panadera, que los acumula para el crecimiento celular y el consecuente aumento en la concentración de etanol (46, 48). El valor inferior en el porcentaje de proteína con respecto al control, se debe a la proteólisis y a la liberación de aminoácidos que se transformaron en otros metabolitos como compuestos aromáticos volátiles, lo cual se pudo evidenciar en el aroma fuerte que liberaban las masas ácidas durante la fermentación, en comparación con la masa control. Esto coincide con estudios en los que se encontró que la combinación de L. plantarum y L. brevis spp. lindneri genera mayor concentración de aminoácidos que cuando se emplean individualmente, como en el caso de L. fructivorans (51). En la figura 2, a pesar del menor valor proteico encontrado en los tratamientos, el análisis de varianza determinó un solo grupo homogéneo constituido por el pan control y los tratamientos, y no se estableció diferencia estadísticamente significativa entre los panes elaborados con BAL y el pan control. La presencia de las BAL no se puede considerar como una ventaja nutricional en relación al aporte de proteína disponible para el consumidor, pero su actividad proteolítica genera cambios en las propiedades sensoriales de aroma y sabor. Igualmente, se observó que la combinación de ambos aislados tiene un efecto sinérgico en la proteólisis, evidenciándose en el menor valor de % de proteína, seguido por el obtenido por Lactobacillus sp. LBM9, y como aislado de menor actividad proteolítica L. brevis LBM13. Debe insistirse en que la actividad proteolítica de las BAL se acompaña de las proteasas endógenas del trigo (50), con un pH óptimo entre 3.0–4.0 (52, 53).
Volumen máximo alcanzado por las piezas de pan: Los panes de masa ácida elaborados con base en 200 gramos de harina, presentaron volúmenes superiores con respecto al blanco. El pan de Lactobacillus sp. LBM 9 presentó el mayor volumen, seguido por la combinación 9/13, L. brevis LBM13 y por último el pan control (Tabla 6) La obtención del volumen máximo puede deberse a la liberación de exopolisacáridos que fortalecen la red del gluten y el almidón, tanto influenciando el tamaño como retrasando el tiempo de retrogradación del producto. Los panes elaborados con masas ácidas silvestres que poseen bajo pH y una razón alta de ácido láctico/ácido acético, presentan volumen mayor que un pan control (9, 27, 43), lo que corresponde a los resultados obtenidos con LBM9, LB13 y su combinación. Un mayor volumen proviene igualmente del máximo crecimiento de la masa, y se encontraron para BAL silvestres, aisladas recientemente en Turquía, valores óptimos para las combinaciones de S. cerevisiae con L. sake, y de gran volumen para las combinaciones de dicha levadura con L. plantarum (13). Es importante resaltar que se ha encontrado buen resultado en el volumen de masa cuando se ha realizado la combinación L. plantarum-L. brevis (1:1)- S. cerevisiae, atribuído a la liberación de fructanos retenedores de humedad (8) y que la combinación LBM9/LBM13 con levadura panadera generó el segundo volumen mayor a pesar de ser el tratamiento con mayor actividad proteolítica, y que posiblemente este resultado se deba igualmente a la producción de compuestos que fortalecen el crecimiento de la masa por la mayor retención de humedad.
Evaluación de las propiedades reológicas: textura del pan en almacenamiento
Las primeras medidas de compresión se tomaron a las tres horas de haber sido elaborado el producto, presentando menor fuerza máxima los panes de masa ácida, aunque no se encontró diferencia significativa entre el pan de L. brevis LBM13 y el control, que conformaron un grupo homogéneo. Otro grupo diferente reunió los tratamientos con Lactobacillus sp. LBM9 y la combinación 9/13, que exhiben la menor fuerza de compresión. El análisis de varianza a las 24 horas de elaboración permitió definir tres grupos diferentes donde el conformado por los panes hechos con Lactobacillus sp. LBM9 y la combinación 9/13, presentaron la menor media de fuerza máxima de compresión para la firmeza. El grupo con la media de fuerza máxima superior, pero aún inferior al blanco, está conformado por el aislado L. brevis LBM 13, y el de la mayor fuerza de compresión por el pan control. Las BAL aumentan la vida útil en cuanto a de retraso de la firmeza y disminución de los requerimientos de agentes emulsificantes, empleados para retener el agua por más tiempo en la masa (54). La fuerza máxima de compresión aumentó en todos los panes a las 48 horas de elaboración, lo que indica que hay endurecimiento en todos, tanto los acidificados como el pan control. Sin embargo, se encuentra que existe diferencia estadísticamente significativa entre cada aislado y el blanco, ubicando en orden ascendente de endurecimiento la combinación 9/13, seguida de Lactobacillus sp. LBM9 y L. brevis LBM13, donde la más dura es el blanco. Pasados ocho días de la elaboración de los panes, se aumentó la firmeza de todos y se observó que los panes de masa ácida se endurecieron significativamente menos que el pan control. Es importante resaltar que se presentan tres grupos homogéneos. Grupo uno, constituido por el blanco, con el mayor valor promedio de firmeza. Grupo dos, los panes elaborados con Lactobacillus sp. LBM9 y L. brevis LBM13. El grupo tres, constituido por el pan elaborado con la combinación 9/13, mantuvo el menor valor de firmeza durante todo el periodo de evaluación. Como puede verse, el tratamiento de BAL que presenta mayor firmeza durante el periodo de prueba, es el realizado con L. brevis LBM13. Se ha demostrado previamente que la combinación de levadura panadera con cada una de la serie siguiente de BAL: L. plantarum, L. amylophilus, L. brevis, L. sake y L. acetotolerans, incrementa la vida de anaquel y alarga el tiempo de retrogradación en panes, comparados con aquellos donde sólo se emplea la levadura panadera (13). Los microorganismos de la masa ácida influyen también sobre la estructura de ésta, de acuerdo a sus actividades enzimáticas específicas o a la producción de ciertos metabolitos como exopolisacáridos que muy posiblemente son liberados al medio por estas bacterias (55). La presencia de estos polisacáridos mejora la textura y la vida de anaquel al favorecer la retención de agua, pudiendo reemplazar los aditivos como almidón, goma arábiga y carrageninas (54). El retraso del endurecimento se vio favorecido posiblemente por la presencia de exopolisacáridos que ayudan a la retención de humedad junto a las proteínas ya desplegadas, y puede considerarse entonces que las BAL en la masa panadera retrasan la retrogradación de una manera significativa, en especial cuando se combinan LBM13 y LBM9.
AGRADECIMIENTOS
Esta investigación fue financiada por la Universidad de Antioquia y la Universidad Nacional, sede Medellín. Agradecemos a Reynaldo Gómez, Nelly Ospina, E.Lucía Gutiérrez y Amanda Mejía por su apoyo administrativo desde la Facultad de Química Farmacéutica, Universidad de Antioquia; Olga L. Martínez, coordinadora del Laboratorio de Análisis sensorial, Universidad de Antioquia; Carlos Ciro y Boris González, Laboratorio de Nutrición Animal de la Universidad Nacional.
REFERENCIAS BIBLIOGRÁFICAS
1. Axelsson L. Lactic acid bacteria: Classification and physiology. En: Salmminen S, Von Wright A, Ouwenhand A, editores. Lactic acid bacteria, microbiology and functional aspects. 3ª ed. Nueva York: Marcel Dekker;2004. p. 1-66.
[ Links ] 2. Escobar M. Programa de microbiología e higiene de los alimentos, manual de técnicas y procedimientos. Medellín: Universidad de Antioquia, Facultad Nacional de Salud Pública;1999. p. 223–225.
[ Links ] 3. Madigan T, Martinko J. Biología de los microorganismos. México: Prentice Hall;2003.p. 835-837.
[ Links ] 4. Onilude A, Fagade O, Bello M, Fadahunsi I. Inhibition of aflatoxin – producing aspergilli by lactic acid bacteria isolates from indigenously fermented cereal gruels. Afr J Biotechnol 2005;4 (12):1404-1408.
[ Links ] 5. Sanni A, Onilude A, Fatungase M. Production of sour maize bread using stater cultures. World J Microbiol Biotechnol 1998;(14):101-106.
[ Links ] 6. Calaveras J. Tratado de panificación y bollería. Madrid: Madrid Vicente; 1996. p. 123-127.
[ Links ] 7. Barber S, Benedito de Barber C, Planells V. La masa madre panaria: su influencia sobre las características reológicas y fermentativas de la masa de harinas panificables. Rev Agroq Tgía Altos 1983;20(3):403-411.
[ Links ] 8. Mascarós AF, Martínez S, Collar C. Metabolismo de levaduras y bacterias ácido lácticas durante la fermentación en relación con las características funcionales de la masa fermentada. Rev Esp Ciencia Tgía Altos 1994;34(6):623-642.
[ Links ] 9. Corsetti A, Gobetti M, Baliestrieri F, Paoletti F, Russi L, Rossi J. Sourdough lactic acid bacteria effects on bread firmness and staling. J Food Sci 1998;63(2):347-351.
[ Links ] 10. Corsetti A, Gobbetti M, Rossi J, Damiani P. Antimold activity of sourdough lactic acid bacteria: identification of a mixture of organic acids produced by Lactobacillus sanfrancisco CB1. Appl Microbiol Biotechnol 1998;(50): 253-256.
[ Links ] 11. Gelinas P, McKinnon CM, Pelletier M. Sourdough-type bread from waste bread crumb. Food Microbiology 1999;(16): 37-43.
[ Links ] 12. Salovaara H. Lactic Acid Bacteria in cereal-based products. En: Salminen S, Von Wright A, Ouwehand A, editores. Lactic acid bacteria, microbiology and functional aspects. 3ª ed. Nueva York: Marcel Dekker;2004. p. 115-135.
[ Links ] 13. Gul H, Özcelik S, Sagdic O, Certel M. Sourdough bread production with lactobacilli and S. cerevisiae isolated from sourdough. Proccess Biochem 2005;40: 691-697.
[ Links ] 14. Collar C, Martínez Anaya MA, Benedito de Barber C. Interacción entre iniciadores microbianos para la panificación y harinas de trigo. Rev Esp Ciencia Tec Altos 1994;34 (2):191-201.
[ Links ] 15. Okada S, Ishikawa M, Yoshida T, Uchimura T, Ohara N, Kozaki M. Identification and characteristics of lactic acid bacteria isolated from sourdough sponges. Biosci Biotechnol Biochem 1992;(4):572-575.
[ Links ] 16. Gobbetti M, Corsetti A, Rossi J. The sourdough microflora. Interactions between lactic acid bacteria and yeasts: Metabolism of amino acids. World J Microbiol Biotechnol 1994;3(10):275-279.
[ Links ] 17. Primo E. Química de los alimentos. Madrid: Síntesis; 1998. p. 440- 442.
[ Links ] 18. Quaglia G. Ciencia y tecnología de la panificación. Zaragoza: Acribia;1991. p. 306-309.
[ Links ] 19. Ordóñez J, editor. Tecnología de los alimentos, Volumen I: Componentes de los alimentos y procesos. Madrid: Síntesis; 1998. p. 60-74.
[ Links ] 20. McRitchie F, Lafiandra D. Structure–function relationships of wheat proteins. En: Srinivasan D, Paraf A, editores. Food Proteins and their Applications. Londres: Marcel Dekker;1997. p. 293- 324.
[ Links ] 21. Berg RW, Sandine WE, Andenderson AW. Identification of a growth stimulant for Lactobacillus sanfrancisco. Appl Environ Microbiol 1981;(42):786-788.
[ Links ] 22. Collar C, Mascarós A, Benedito de Barber C. Amino acid metabolism by yeasts and lactic acid bacteria during bread dough fermentation. J Food Sci 1992;(57):1423-1427.
[ Links ] 23. Stampfli L, Nersten B. Emulsifiers in bread making. Food Chem. 1995:353-360
[ Links ] 24. Best D. Bakery products fight staling. Prepared foods 2001;60(10):67-70.
[ Links ] 25. Tieking M, Ganzle G. Exopolysaccharides from cereal associated Lactobacilli. Trends Food Sci Technol 2005;(16):79–84.
[ Links ] 26. Korakli M, Rossman A, Ganzle M, Vogel R. Sucrose metabolism and exopolysaccharide production in wheat and rye sourdoughs by L. sanfranciscensis. J Agr Food Chem 2001;(49):5194-5200.
[ Links ] 27. Barber B, Ortola C, Barber S, Fernández F. Storage of packaged white bread. III. Effects of sourdough and addition of acids on bread characteristics. Z Lebensmittel unter Forschung 1992;(194): 442-449.
[ Links ] 28. Salazar B. Aislamiento de cepas nativas de probióticos y comparación de la viabilidad por efecto de un prebiótico. [Tesis de maestría]. Medellín: Universidad Nacional de Colombia, Postgrado en Biotecnología, 2003.
[ Links ] 29. Gutiérrez A. Efecto de cepas nativas de Lactobacillus spp. sobre la cinética proliferativa de Listeria monocytogenes. [Tesis de maestría]. Medellín: Universidad Nacional de Colombia, Postgrado en Biotecnología, 2004.
[ Links ] 30. Montgomery D, Runger G. Probabilidad y estadística aplicadas a la ingeniería. México: McGraw Hill;1996.
[ Links ] 31. Mateos P. Crecimiento microbiano. Salamanca: Universidad de Salamanca; 2005. [citado 2005 Mayo] Disponible en URL: http://edicion-micro.usal.es/web/educativo/micro2/tema07.html.
[ Links ] 32. Corsetti A, Gobetti M, De Marco B, Balestrieri F, Russi L, Rossi I. Combined effect of sourdough lactic acid bacteria and additives on bread firmness and staling. J Agr Food Chem 2000;48(7):3044- 3051.
[ Links ] 33. Ramírez G. Manual de laboratorio de bromatología. Medellín: Universidad de Antioquia 1999.
[ Links ] 34. Rosell CM, Rojas JA, Benedito de Barber C. Influence of hydrocolloids on dough rheology and bread quality. Food Hydrocolloids 2001;(15):75-81.
[ Links ] 35. AACC. Approved methods of the American Association of Cereal Chemists, 9ª ed. Saint Paul (MN): American Association of Cereal Chemists; 1994.
[ Links ] 36. Dobraszczyk B, Morgenstern M. Rheology and the breadmaking process. J Cereal Sci 2003;(38): 229-245.
[ Links ] 37. Standard Procedure: Medición de firmeza de la miga por compresión con una sonda. Texture expert for Windows, Stable Micro Systems [programa de ordenador]. Version 1. Godalming (UK): American Institute of Baking (AIB); 1997.
[ Links ] 38. Crowley P, Schobert T, Clarke CH, Arendt E. The effect of storage time on textural and crumb grain characteristics of sourdough wheat bread. European Food Res Technol 2002;214:489-496.
[ Links ] 39. Meignen B, Onno B, Gelines P, Infantes M, Guilois S, Cahagnier B. Optimization of sourdough fermentation with Lactobacillus brevis and bakers yeast. Food Microbiol 2001;(18):239-245.
[ Links ] 40. Ganzle MG, Ehmann M, Hammes WP. Modeling of growth of Lactobacillus sanfranciscensis and Candida milleri in response to process parameters of sourdough fermentation. Appl Environ Microbiol 1998;(64):2616-2623.
[ Links ] 41. Muller M, Wolfrum G, Stolz P, Ehrmann M, Vogel R. Monitoring the growth of Lactobacillus species during a rye flour fermentation. Food Microbiol 2001;(18):217-227.
[ Links ] 42. Ng H. Factors affecting organic acid production by sourdough (San Francisco) bacteria. Appl Microbiol 1972;(23):1153-1159.
[ Links ] 43. De Vuyst L, Neysens P. The sourdough microflora: biodiversity and metabolic interactions Tnds Food Sci Technol 2005;16:43– 50.
[ Links ] 44. Vogel K, Muller S, Ganzle, Ehrmann M. Non dairy lactic fermentations. The cereal world; (76):403–411.
[ Links ] 45. Vogel R, Muller M, Stolz P, Ehrmann M. Ecology in sourdoughs produced by traditional and modern technologies. Adv Food Sci 1996;(18):152–159.
[ Links ] 46. Spicher G, Nierle W. Proteolytic activity of sourdough bacteria. Appl Microbiol Biotechnol 1988;(28):487-492.
[ Links ] 47. Collar C, Prieto J, Mascarós A, Benedito de Barber S. Cambios de los constituyentes químicos durante la fermentación panaria. XI. Aminoácidos, péptidos y proteínas solubles de masas elaboradas con un cultivo puro de Saccharomyces cerevisiae. Rev Agroqca Tec Altos 1989;(29):266-280.
[ Links ] 48. Gobbetti M, De Angelis A, Corsetti A, Di Cagno R. Biochemistry and physiology of sourdough lactic acid bacteria. Tnds Food Sci Technol 2005;(16):57–69.
[ Links ] 49. Gobbetti M. The sourdough microflora: Interactions of lactic acid bacteria and yeasts. Tnds Food Sci Technol 1998;(9):267–274.
[ Links ] 50. Thiele C, Ganzle MG, Vogel RF. Contribution of sourdough lactobacilli, yeast and cereal enzymes to the generation of amino acids in dough relevant for bread flavor. Cereal Chem 2002;79(1):45- 51.
[ Links ] 51. Spicher G. Baked goods. En: Rehm HJ, Reed G, editores. Biotechnology V. Berlín: Verlag Chemie; 1983.
[ Links ] 52. Bleukx W, Delcour JA. A second aspartic proteinase associated with wheat gluten. J Cereal Sci 2000;(32):31–42.
[ Links ] 53. Kawamura Y, Yonezawa D. Wheat flour proteinases and their action on gluten proteins in diluted acetic acid. Agric Biol Chem 1982(46):767–773.
[ Links ] 54. Gray JA, Berniller JN. Bread staling: Molecular basis and control. Crc Rev Food Sci Technol 2003;(2):1-21.
[ Links ] 55. Clarke CI, Schober TJ, Arendt EK. Effect of single strain and traditional mixed strain starter cultures on rheological properties of wheat dough and on bread quality. Cereal Chem 2002;79(5):640.
[ Links ] 56. Goesaert H, Brijs K, Veraverbeke WS, Courtin CM, Gebruers K, Delcour JA. Wheat flour constituents: How they impact bread quality, and how to impact their functionality. Tnds Food Sci Technol 2005;(16):12–30. [ Links ]