Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.14 no.1 Medellín Jan./June 2007
ACTIVIDAD ANTIAGREGANTE DEL EXTRACTO ETANÓLICO DE Solanum tuberosum EN PLAQUETAS HUMANAS
ANTIAGGREGANT ACTIVITY OF THE ETHANOLIC EXTRACTS OF Solanum tuberosum IN HUMAN PLATELETS
Diana M. BUITRAGO R.1, Gloria RAMOS R.2, Javier RINCÓN V.1 y Mario F. GUERRERO P.1*
1 Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia. A.A. 14490. Bogotá, Colombia.
2 Laboratorio de Hematología Especial, Hospital Militar Central. Tr. 3A No. 49-00. Bogotá, Colombia.
* Autor a quien se debe dirigir la correspondencia: mfguerrerop@unal.edu.co
Recibido: Septiembre 22 de 2006 Aceptado: Enero 30 de 2007
RESUMEN
Se evaluó la actividad antiagregante en plaquetas humanas del extracto etanólico (96%, residuo seco) obtenido de las cáscaras de los tubérculos de Solanum tuberosum, especie medicinal que se utiliza etnobotánicamente en Colombia para el tratamiento de la hipertensión arterial. El material obtenido de dos variedades, sabanera y pastusa, presentó, en función de la dosis (1 µg/mL -100 µg/mL), efectos antiagregantes in vitro en plaquetas estimuladas con adenosindifosfato (ADP 10 µM), epinefrina (300 µM), colágeno (10 µg/mL) y ácido araquidónico (AA 150 µg/mL). Los valores de CI50 obtenidos por las variedades sabanera y pastusa fueron respectivamente de: 1,8 µg/mL y 0,4 mg/mL frente a ADP, 4,4 µg/mL y 0,1 mg/mL frente a epinefrina, 34,1 µg/mL y 1,3 mg/mL, frente a colágeno y 12,3 µg/mL y < 0,1 µg/mL frente al ácido araquidónico. El perfil antiagregante dosis-respuesta de la variedad pastusa fue similar al descrito por el ácido acetil salicílico (ASA) frente a AA, precursor clave en la síntesis de prostaglandinas. Los hallazgos de este estudio sugieren que S. tuberosum posee un perfil farmacológico promisorio, dado que conjuga efectos hipotensores, descritos con anterioridad, con efectos antiagregantes, favoreciendo así su potencial terapéutico en el tratamiento de trastornos cardiovasculares tales como hipertensión arterial y enfermedad coronaria.
Palabras clave: Solanum tuberosum, ácido araquidónico, antiagregante, enfermedad coronaria.
ABSTRACT
The plant Solanum tuberosum is used in Colombian folk medicine for the treatment of hypertension. We evaluated the antiaggregant properties on human platelets of an ethanolic extract (96%) obtained from the skin of tubers of this species. Extracts from two varieties, sabanera and pastusa revealed in vitro dose-dependent (10-100 mg/mL) antiaggregant effects on platelets stimulated with adenosindiphosphate (ADP 10 µM), epinephrine (300 µM), collagen (10 µg/mL), and arachidonic acid (150 µg/mL). The IC50 values for the sabanera and pastusa varieties were, respectively, 1,8 µg/mL and 0,4 mg/mL, against ADP; 4,4 µg/mL and 0,1 mg/mL against epinephrine; 34,1 µg/mL and 1,3 mg/mL against collagen, and 12,3 µg/mL and < 0,1 µg/mL, against arachidonic acid, a key precursor in prostaglandin synthesis. Our findings suggest that S. tuberosum has a promising pharmacological profile since it combines the hypotensive effects, previously described, with the antiaggregant ones; therefore, it is potentially useful for the treatment of cardiovascular disorders such as hypertension and coronary artery disease.
Keywords: Solanum tuberosum, arachidonic acid, antiaggregant, coronary disease.
INTRODUCCIÓN
La enfermedad coronaria sigue siendo la primera causa de morbimortalidad mundial, no sólo en países altamente industrializados sino en países en vía de desarrollo (1). La progresión de la enfermedad coronaria hacia las complicaciones propias de la angina inestable, el infarto del miocardio y la muerte súbita, guarda una estrecha relación con el fenómeno de agregación plaquetaria (2). Atacar farmacológicamente la progresión de este fenómeno sobre la placa ateromatosa se ha constituido en un objetivo de honda repercusión en terapéutica. Como consecuencia de ello se ha logrado mejorar la morbimortalidad de los pacientes coronarios gracias al uso de fármacos antiagregantes plaquetarios, tales como aspirina y clopidogrel (3).
Por otra parte, la hipertensión esencial constituye el principal factor de riesgo para la aparición de enfermedad coronaria (4). Una vez establecidos estos dos trastornos, se genera un círculo vicioso que agrava la condición clínica del paciente y que es necesario romper atacando procesos fisiopatológicos claves en la perpetuación de los fenómenos implicados en el incremento de la resistencia vascular periférica y la formación de trombos sobre la placa ateromatosa. Por lo tanto, encontrar un fármaco que conjugue propiedades antihipertensivas y antiagregantes puede representar un avance en el arsenal terapéutico disponible frente a estos trastornos.
Solanum tuberosum figura entre las especies utilizadas etnobotánicamente en Colombia para el tratamiento de la hipertensión (5). Estudios previos han demostrado sus efectos antihipertensivos e hipotensores en ratas (6). En este artículo se describen sus efectos antiagregantes frente a inductores tales como ADP, epinefrina, colágeno y ácido araquidonico (AA). Ello representaría un perfil particularmente interesante ya que se conjugarían en una misma fuente natural dos efectos farmacológicos en dos trastornos íntimamente vinculados: la hipertensión arterial y la enfermedad coronaria.
MATERIALES Y MÉTODOS
Material vegetal y extracción
Se adquirieron 10 Kg. del material vegetal de S. tuberosum (“Solanácea”, nombre común: papa) de las variedades sabanera y pastusa, que se clasificaron por comparación. La cáscara de los tubérculos se secó en un horno de aire circulante a 40ºC y se trituró. El polvo obtenido se percoló con etanol (96%) durante 72 horas y posteriormente se filtró y concentró bajo presión reducida con un evaporador rotatorio. El extracto obtenido se disolvió en dimetilsulfóxido (DMSO) al 0,1% en el momento de los experimentos.
Preparación de plaquetas humanas
La sangre se obtuvo, previo consentimiento informado, de voluntarios sanos entre 18 y 45 años, quienes no habían recibido ningún tipo de medicamento desde 15 días antes de la recolección de la muestra. Se recolectaron 18 mL de sangre total en tubos al vacío de citrato sódico al 3,2% en una proporción de 9/1 (7). Posteriormente las muestras se dejaron en reposo por una hora. El plasma rico en plaquetas (PRP) para los ensayos se obtuvo por centrifugación durante cinco minutos a 1000 rpm, y el plasma pobre en plaquetas (PPP) se utilizó para calibrar el equipo a 100% de tramitancia y 0% de absorbancia; se obtuvo con una posterior centrifugación de la muestra durante 10 minutos a 3500 rpm.
Agregación plaquetaria
Para el estudio de agregación plaquetaria in vitro se utilizó la técnica espectofotométrica descrita por Born (8). En cada uno de los cuatro canales de lectura del equipo se dispensaron 400 µL de PRP, 50 µl del extracto etanólico de cada variedad (1 µg/mL - 100 µg/mL), se dejó incubar por 5 minutos a 37ºC, y posteriormente se adicionaron a cada canal 50 µL de cada uno de los inductores de la agregación plaquetaria a las concentraciones mínimas en las cuales una persona normal agrega; ADP (10 µM), epinefrina (300 µM), colágeno (10 µg/mL) y AA (150 µg/mL). Este mismo procedimiento se realizó para el patrón (ASA; 1 µg/mL, 10µg/mL y 100 µg/mL) y para el vehiculo (DMSO, <0,1%). El grado de agregación plaquetaria se expresó como porcentaje (%) de inhibición (X), usando la siguiente ecuación: X=[(A-B)/A] ∗10. Donde A es el mayor rango de agregación por plaquetas tratadas con DMSO y B es el mayor rango de agregación por plaquetas tratadas con vehículo (9).
Fármacos, reactivos y equipos
Se utilizaron los siguientes productos: Etanol (CH3CH2OH) al 96%, DMSO Sigma® 1%, ADP (10 µM), colágeno (10 µg/mL), AA (150 µg/mL), epinefrina (300 µM) Helena Laboratorios®, ASA (C9H8O4) Sigma®, Agregómetro (Packs-4;Helena Laboratorio®).
Análisis estadístico
Se construyeron curvas dosis respuesta de los valores de agregación plaquetaria, expresados en términos de porcentajes de agregación máxima inducido por cada agonista. La concentración inhibitoria 50 (CI50: concentración que produce el 50% de la agregación plaquetaria máxima) se obtuvo del análisis de regresión sigmoidal de la curva dosis respuesta.
Todos los resultados se expresan como promedio ± el error estándar (ems). El análisis estadístico de los diferentes tratamientos se efectuó mediante un análisis de varianza asumiendo una p<0,05. Para ello se utilizaron los programas de computador Excel® 2000 y SPSSR 12.
RESULTADOS
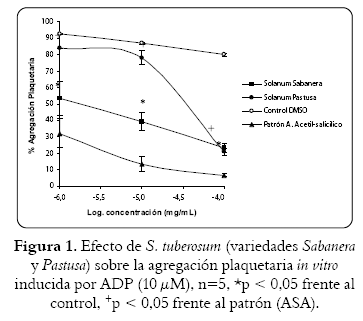
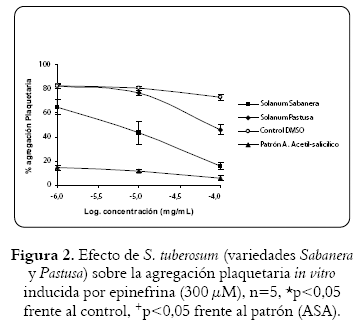
El extracto etanólico de la cáscara de S. tuberosum, variedad sabanera, ejerció un mayor efecto antiagregante que la variedad pastusa en plaquetas inducidas con ADP (10 µM) en función de la dosis (figura 1). La CI50 para ambas especies fue respectivamente de 1,8 µg/mL y 0,4 mg/mL. A su vez, la inhibición de la agregación inducida por epinefrina (300 µM) en plaquetas tratadas con el extracto etanólico de ambas variedades, produjo un efecto muy similar al observado con ADP (figura 2), con CI50 para las variedades sabanera y pastusa de 4,4 µg/mL y 0,1 mg/mL. El efecto inhibitorio de la agregación inducida por ADP y epinefrina en plaquetas tratadas con el extracto etanólico de la variedad sabanera, en concentraciones de 1 µg y 100 µg/mL, fue superior al 50%, mientras que para la variedad pastusa el efecto inhibitorio con valores mayores al 50% se produjo a la concentración de 100 µg/mL.
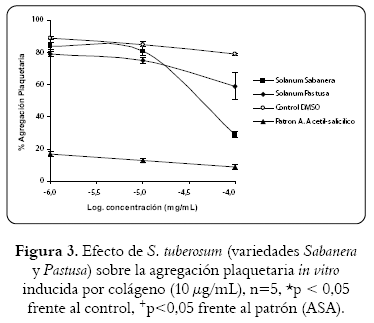
Dentro de los datos obtenidos por el extracto etanólico de la variedad sabanera (figura 3) se puede observar que ejerce un efecto inhibitorio en plaquetas inducidas con colágeno (10 µg/mL) mayor al 30% solamente a la concentración de 100 µg/mL, mientras que el extracto etanólico de la variedad pastusa, aunque inhibe la agregación plaquetaria en función de la dosis, no ejerció una inhibición por encima de valores mayores al 50% con las diferentes dosis. La CI50 de ambas variedades fue de 34,1 µg/mL y 1,3 mg/mL respectivamente.
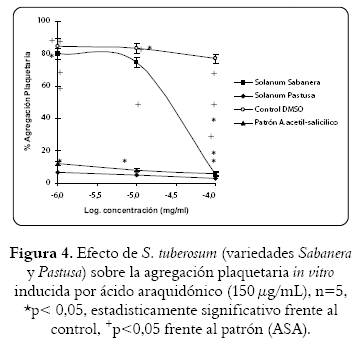
El extracto etanólico de la variedad sabanera produjo un efecto inhibitorio de la agregación inducida por AA (150 µg/mL) (figura 4) mayor al 50% solamente a la concentración de 100 µg/mL y el extracto etanólico de la variedad pastusa fue similar al descrito por el ASA (patrón) en función de la dosis (10 µg/mL - 100 µg/mL). La CI50 de estas variedades con respecto al efecto inhibitorio en plaquetas inducidas con este agonista fue de 12,3 µg/mL y < 0,1 µg/mL. Los datos obtenidos por el vehículo (DMSO) no afectaron ningún tipo de inhibición de la agregación plaquetaria inducida por los diferentes agonistas, a diferencia de ASA, el patrón utilizado como control positivo en esta serie de experimentos.
DISCUSIÓN
Los resultados obtenidos en este estudio permiten demostrar que el extracto etanólico de S. tuberosum, variedades sabanera y pastusa, ejerce un efecto antiagregante plaquetario in vitro en plaquetas humanas. Llama la atención, en particular, el comportamiento descrito por la variedad pastusa frente a AA, similar al descrito por ASA. Esto sugiere efectos inhibitorios sobre alguno o algunos de los mediadores vinculados con la ruta metabólica proagregante de AA, entre los que cabe considerar la ciclooxigenasa. De ser esto así, tendría repercusiones potenciales en clínica, si se tienen en cuenta los beneficios aportados por ASA en la profilaxis de eventos coronarios agudos (10).
El efecto antiagregante plaquetario ha sido descrito en un buen número de fuentes de origen natural. Entre ellos Salis cortex, Galea officinalis, Piper futokadsura, Reboulia hemisphaerica (9, 11-13), con actividades variables según el agonista utilizado. No obstante, la variedad pastusa señala una potencia inhibitoria que, de acuerdo con la revisión de la literatura, no había sido descrita con anterioridad.
Está documentado que los glicoalcaloides α- chaconina y α-solanina son los constituyentes de mayor proporción presentes en la especie Solanum tuberosun (14-15). Sus efectos sobre el sistema cardiovascular no se han descrito. Se sabe que análogos estructurales como tomatina ejercen efectos hipocolesterolemiantes (16). Otros autores señalan efectos antivirales, antibacterianos, antifúngicos y anticancerígenos (17).
Diferentes estudios indican que α-chaconina es un glicoalcaloide potencialmente tóxico ya que produce efectos teratogénicos debido a lisis celular, daños hemolíticos y hemorrágicos a nivel gastrointestinal e inhibición de la actividad de la acetilcolinesterasa (AChE) y butirilcolinestersa, produciendo síntomas específicamente sobre el sistema nervioso central (17,18).
No obstante, el perfil de seguridad de estos alcaloides es asunto de controversia. Para algunos autores su dosis letal 50 (DL50: dosis que produce el 50% de letalidad), es del orden de 2-5 mg/kg (19). Sin embargo, el Comité de Aditivos Alimenticios de las Naciones Unidas y de la Organización Mundial de la Salud (JECFA), en 1992 concluyó que el consumo de estos glicoalcaloides entre 20 y 100 mg/kg, no representan una dosis tóxica para los humanos (19, 20). Establecer con precisión la relación efecto farmacológico/ efecto toxicológico es una tarea que se debe emprender. También conviene examinar los potenciales efectos sinérgicos entre α-chaconina y α-solanina.
También se han descrito efectos antiagregantes plaquetarios en compuestos de naturaleza alcaloidal, tales como artemisina, espiraminas (21, 22); así como metabolitos de origen naturales como flavonoides y cumarinas (21, 23). Los alcaloides diterpenos C20 inhiben la agregación plaquetaria inducida por factor activados plaquetario (PAF) y se correlaciona con la posición estructural del anillo oxazolidina presente, lo que sugiere que este anillo es el centro de unión de este tipo de alcaloides con los receptores PAF y a su vez de la actividad antiagregante. (22). En el caso de α-chaconina y α-solanina, su mecanismo de acción estaría ubicado a otro nivel, dado que la estructura química difiere ostensiblemente.
Llama la atención que los efectos de la variedad sabanera difieren ostensiblemente de los presentados por la variedad pastusa, siendo mayores frente a los agonistas ADP y epinefrina, pero mucho menores frente a colágeno y AA. Esto sugiere que hay un contraste en la proporción de los compuestos activos presentes en estas variedades, en caso de ser los mismos.
En los últimos años la terapia antiagregante plaquetaria ha sido de gran beneficio en el manejo de múltiples condiciones trombóticas, específicamente en pacientes con alto riesgo de infarto. Se ha visto que la administración rápida de aspirina desde el inicio del evento coronario reduce de manera significativa la progresión hacia infarto (3, 10). Su acción antiplaquetaria se atribuye principalmente a la inhibición irreversible de la ciclooxigenasa (COX) plaquetaria, lo que reduce la producción de TxA2 y, con ello, la agregación de plaquetas. La inhibición de la COX no excluye de forma absoluta el papel trombogénico de las plaquetas (25), pues éstas pueden activarse a través de otras rutas que se constituyen en dianas farmacológicas que aún están por investigar. Este es un aspecto que debe ser estudiado en los constituyentes activos de S. tuberosum.
Los resultados de este estudio proporcionan elementos para suponer que los glicoalcaloides mencionados son los responsables de la actividad antiagregante plaqueteria, si se tiene en cuenta el predominio de los mismos en la especie S. tuberosum. Esto es necesario verificarlo en estudios posteriores. A la vez, dado que S. tuberosum ejerce efectos hipotensores, es importante examinar si igualmente α -chaconina y α- solanina también son los responsables de esta actividad.
En conclusión, este estudio muestra que el extracto etanólico de Solamun tuberosum, variedades sabanera y pastusa, ejerce efectos antiagregantes in vitro en plaquetas humanas. La potencia antiagregante de la variedad pastusa frente a AA es particularmente notoria. Los glicoalcaloides α -chaconina y α -solanina son posiblemente sus principios activos. Esto representa una ventaja potencial como fuente farmacológica de medicamentos antiagregantes. Se requieren trabajos adicionales que permitan caracterizar e identificar con precisión los principios activos de S. tuberosum y sus mecanismos de acción.
AGRADECIMIENTOS
Los autores agradecen a la International Foundation for Sciences (IFS) (proyecto: “Isolation and study of vasorelaxant and antihypertensive principles from Calea prunifolia, Salvia paleofolia and Solanum tuberosum), al Laboratorio de Hematología Especial del Hospital Militar Central de Bogotá, Colombia; al Grupo: “Búsqueda de Principios Bioactivos en Plantas”, a la Vicerrectoría de Investigación de la Universidad Nacional de Colombia, y a COLCIENCIAS, por el apoyo recibido del programa de beneficiarios de doctorados nacionales 2005.
REFERENCIAS BIBLIOGRÁFICAS
1. Abdallah MH, Samir A, Karrowni W, Dakik HA. The Management of Acute Myocardial Infarction in Developing Countries. Intern J Card 2006; 111 (2): 189 - 194 [ Links ]
2. Pavel J, Yunis C, Owen J, Brosnihan K, Smith R, Ferrario C. Inhibition of Platelet Aggregability by Losartan in Essential Hypertension. Am J Card 2000; 86 (11): 1188-1192. [ Links ]
3. Lawson F, Reilly M, Kapoor S, Cucchiara A, DeMarco S, Tournier B, et al. Cyclooxigenase Inhibitors and the Antiplatelet Effects of Aspirin, NEJM 2001; 345 (25): 1809-1817. [ Links ]
4. Chobanian AV, Bakris GL, Black HR. Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension 2003; 42 (6): 1206-1252. [ Links ]
5. García H. Flora Medicinal de Colombia. Tomo II. Bogotá: Instituto de Ciencias Naturales, Universidad Nacional; 1974. p. 84-91. [ Links ]
6. Guerrero MF, Carrón R, Martín ML. Identificación de la actividad hipotensora del extracto etanólico de Solanum tuberosum en ratas. RCCQF 2003; 32 (1): 30-36. [ Links ]
7. Zucker MB. Platelet Aggregation Measured by the Photometric Method. Methods Enzymol 1989; 169: 118-133. [ Links ]
8. Born G. Aggregation of Blood Platelet by Adenoside Diphosphate and its Reversal. Nature 1962; 194 (4832): 927-929. [ Links ]
9. Shen TY, Hwang SB, Chang MN, Doebber TW, Lam MH, Wu MS, et al. Characterization of a Platelet-activating Factor Receptor Antagonist Isolated from Haifenteg (Piper futokadsura): Specific Inhibition of in vitro and in vivo Platelet-activating Factorinduced Effects. PNAS 1985; 82 (3): 672-676. [ Links ]
10. Patrono C. Aspirin: New Cardiovascular Uses for an Old Drug, Am J Med 2001; 110 (1 Sp 1): 62-65. [ Links ]
11. Krivoy N, Pavlotzky E, Chrubasik S, Eisenberg E, Brook G, Effects of Salicis cortex Extract on Human Platelet Aggregation. Planta Med 2001; 67 (3): 209-212. [ Links ]
12. Atanasov AT, Tchorbanov B. Anti-platelet Fraction from Galega officinalis L Inhibitis Platelet Aggregation. J Med Food 2002; 5 (4): 229-234. [ Links ]
13. Ko FN, Liao ChH, Wu ChL. Marchantinquinone, Isolated from Reboulia hemispherica, as Inhibitor of Lipid Peroxidation and as Free Radical Scavenger. Chem Biol Interact 1995; 98 (2): 131- 143. [ Links ]
14. Machado R, Toledo M. Determinacăo de glicoalcalóides em batatas in natura (Solanum tuberosum L.) comercializadas na cidade de Campinas. Estado de Săo Paulo. Cienc Tecnol Aliment 2004; 24 (1): 47-52. [ Links ]
15. Smith D, Roddick J, Jones J. Synergism between the Potato Glycoalkaloids a-chaconine and a-solanine in Inhibition of Snail Feeding. Phytochemistry 2001; 57 (2): 229-234. [ Links ]
16. Friedman M, Fitch T, Yokoyama W. Lowering of Plasma LDL Cholesterol in Hamsters by the Tomato Glycoalkaloids Tomatine. Food Chem Toxicol 2000; 38 (7): 549-553. [ Links ]
17. Friedman M. Analysis of Biologically Active Compounds in Potatoes (Solanum tuberosum), Tomatoes (Lycopersicon esculentum), and Jimson Weed (Datura stramonium) Seeds. J Chromatogr 2004; 1054 (1-2): 143-155. [ Links ]
18. Mensinga T, Sips J, Rompelberg C, Twillert K, Meulenbelt J, Top H, et al. Potato Glycoalkaloids and Adverse Effects in Humans: an Ascending Dose Study. Regul Toxicol Pharmacol 2005; 41 (1): 66-72. [ Links ]
19. Korpan Y, Nazarenko E, Skyshevskaya I, Martelet C, Jaffrezic- Renault N, El'skaya A. Potato Glicoalkaloids: True Safety o False Sense of Security? Trends Biotechnol 2004; 22 (3): 147-151. [ Links ]
20. OMS. Estrategias de la OMS sobre Medicina Tradicional 2002- 2005. Ginebra: Organización Mundial de la Salud; p. 1-63. [ Links ]
21. Wu TS, Tsang ZJ, Wu PL, Lin FW, Li C, Teng ChM, et al New Constituents and Antiplatelet Aggregation and Anti-HIV Principles of Artemisia capillaries. Biorg Med Chem 2001; 9 (1): 77-83. [ Links ]
22. Li L, Shen YM, Yang XS, Zuo GY, Shen ZQ, Chen ZH, et al. Antiplatelet Aggregation Activity of Diterpene Alkaloids from Spiroea japonica. Eur J Pharmacol 2002; 449 (1.2): 23-28. [ Links ]
23. Guglielmone H, Agnese A, Nuñez S, Cabrera J, Inhibitory Effects of Sulphated Flavonoids Isolated from Flaveria bidentis on Platelet Aggregation. Thromb Res 2005; 115 (6): 495-502. [ Links ]
24. Knight J. Antiplatelet Treatment in Stable Coronary Artery Disease. Heart 2003; 89 (10): 1273-1278. [ Links ]
25. Pérez A, Castillo J, Gortázar T, Álvarez M, Douglas R, Díaz B. Participación plaquetaria en la hemostasia primaria. Rev Cubana Inv Biomed 2002; 16 (2):150-155. [ Links ]