Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.14 no.1 Medellín Jan./June 2007
DESARROLLO DE LA BIOAUTOGRAFÍA DIRECTA COMO MÉTODO DE REFERENCIA PARA EVALUAR LA ACTIVIDAD ANTIMICROBIANA DE LA GENTAMICINA CONTRA Escherichia coli
DEVELOPMENT OF DIRECT BIOAUTOGRAPHY AS REFERENCE METHOD FOR TESTING ANTIMICROBIAL ACTIVITY OF GENTAMICIN AGAINST Escherichia coli
Jhonny COLORADO R.1 ,2, Elkin GALEANO J.2*, Alejandro MARTÍNEZ M.2
1 Grupo de Inmunodeficiencias Primarias, Facultad de Medicina, Universidad de Antioquia. A.A.1226. Medellín, Colombia.
2 Grupo de Investigación Productos Naturales Marinos, Facultad de Química Farmacéutica, Universidad de Antioquia. A.A. 1226. Medellín, Colombia.
* Autor a quien se debe dirigir la correspondencia: elgaja@farmacia.udea.edu.co
Recibido: Noviembre 17 de 2006 Aceptado: Mayo 15 de 2007
RESUMEN
La bioautografía es una técnica sencilla y rápida que combina las ventajas de la cromatografía en capa fina y la detección de actividad antimicrobiana, logrando visualizar directamente la(s) fracción(es) con actividad antimicrobiana. Determinar la eficacia de esta técnica puede facilitar el panorama en el aislamiento de sustancias antimicrobianas presentes en mezclas complejas. El trabajo descrito es un avance para evaluar si la técnica permite cuantificar la actividad antimicrobiana empleando como referencia el aminoglicósido Gentamicina® y su actividad contra el microorganismo patógeno Escherichia coli (E.coli). La cuantificación de la actividad antimicrobiana se verifica al medir el diámetro del halo de difusión que se genera al aplicar soluciones de diferentes concentraciones de Gentamicina sobre placas cromatográficas; al determinar luego el efecto del volumen aplicado sobre la variabilidad de los resultados y finalmente al analizar las diferencias entre los halos de difusión y de inhibición microbiana. En el presente estudio se encuentra que la difusión del antibiótico sobre las placas es un factor determinante para cuantificar, y que existe un rango de concentraciones donde la fuerte interacción entre las variables aludidas permite predecir que se cuenta con un método validable para detectar y cuantificar la actividad antimicrobiana, sobre todo en mezclas complejas.
Palabras clave: Bioautografía directa, gentamicina, Escherichia coli.
ABSTRACT
Bioautography is a fast and simple technique which combines the advantages of thin layer chromatography separation and antimicrobial activity detection. This technique displays directly antimicrobial fraction spots from a mixture. Efficacy determination of the technique improves the isolation of antimicrobial substances from complex mixtures. This article describes how bioautography is useful to quantify antimicrobial activity of amino glycoside gentamicin, against pathogen Escherichia coli (E. coli). Quantitative analysis is verified measuring diffusion halos diameters and applying different concentrations of gentamicin on tlc plates. Volume effect is measured on variability of results. Differences between diffusion halos and microbial inhibition are analyzed too. Results show how antibiotic diffusion on tlc plates is a determining factor, and there is a concentration range where strong interactions between measured variables led to establish a method to be validated for detecting and quantifying antimicrobial substances from complex mixtures.
Keywords: Direct bioautography, gentamicin, Escherichia coli.
INTRODUCCIÓN
La evolución y desarrollo de las enfermedades infecciosas, las cuales prevalecen e inciden mayoritariamente en la población, subdesarrollada ha hecho evidente la necesidad de encontrar nuevas sustancias antimicrobianas para tratar tales infecciones (1). Claro es que debido al uso indiscriminado que se les ha dado a las sustancias antimicrobianas, los microorganismos se defienden y adquieren resistencia (2). La bioautografía ha sido un método útil para encontrar nuevas moléculas antimicrobianas ya que mediante esta técnica se ha guiado el aislamiento de sustancias activas contra varios microorganismos (3, 4).
Los extractos que se obtienen de productos naturales como las esponjas marinas son una fuente de sustancias con muy buena actividad antimicrobiana (5), pero la complejidad de estos extractos ha dificultado el aislamiento de las sustancias antimicrobianas presentes allí. Para solucionar tal problema, la bioautografía directa resulta ser una técnica fundamental, que determina con exactitud y precisión la sustancia o sustancias responsables de la actividad antimicrobiana en una mezcla compleja, previamente optimizado su perfil cromatográfico por cromatografía en capa delgada (6). Esta técnica ha sido aplicada exitosamente para la detección de las sustancias antimicrobianas de extractos de plantas (7, 8, 9), en tejidos de órganos animales como hígado y riñón (10), en alimentos como la leche (11) y, últimamente, en extractos de esponjas marinas, facilitando el aislamiento de los metabolitos activos (12, 13).
La metodología que se diseñe para desarrollar esta técnica depende del microorganismo que se va a evaluar, ya que requiere el conocimiento de las condiciones inherentes al crecimiento del microorganismo; la curva de crecimiento microbiano es de indispensable conocimiento utilizar la técnica (6). Hasta ahora, la bioautografía se ha realizado con pocos microorganismos, entre los cuales están Bacillus subtilis (4, 14), Candida albicans, Cryptococcus neoformans (15), Propionibacterium acnes, Staphylococcus epidermidis, (9), Erwinia amylovora, Erwinia carotovora (7) y Escherichia coli (16).
Para el desarrollo del presente trabajo se partió de una metodología ya descrita para la bioautografía directa de Escherichia coli (16) que se adaptó en nuestro laboratorio, modificando algunas de las etapas del ensayo, disminuyendo el tiempo, y permitiendo, tanto la detección de las sustancias antimicrobianas como la cuantificación de las mismas aprovechando las virtudes de la Gentamicina como patrón de referencia para evaluar la sensibilidad del microorganismo patógeno al hombre, Escherichia coli, frente a este antibiótico.
MATERIALES Y MÉTODOS
Preparación del microorganismo
La cepa ATCC 25922 del microorganismo patógeno E. coli se activó en 5 mL de caldo nutritivo CASOY (Merck®) estéril durante 18 a 20 horas en un horno de termocultivo digital (Indulab® 2030) a 38ºC ± 0.5. A los 5 mL de caldo donde se activó la bacteria se les agregó 95 mL de caldo nutritivo estéril. Posteriormente las bacterias fueron incubadas a 38ºC ± 0.5 con agitación manual ocasionalmente hasta que el microorganismo se encontró en la fase logarítmica (entre 3 y 4 horas). Luego se midió la densidad óptica al caldo incubado, a 600 nm, en un Spectronic 20® y se disminuyó la absorbancia a valores entre 0.1 y 0.4 unidades, diluyendo con caldo CASOY® estéril.
Preparación del antibiótico
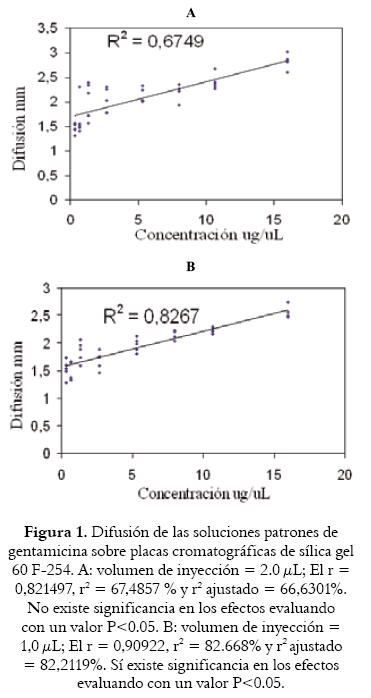
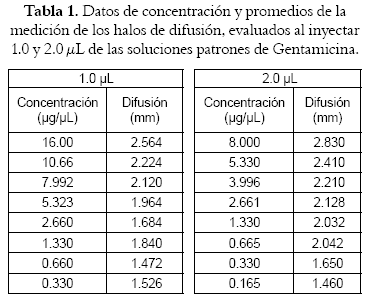
Se prepararon dos grupos de soluciones patrones de sulfato de gentamicina (g/mol, Applichem®) en agua destilada, obtenida en un equipo de ósmosis reversa Aguatec® CDP 6800. En el primer grupo se prepararon 14 soluciones del antibiótico a concentraciones entre el rango de 0.3 a 101.0 μg/μL. De cada una de estas soluciones se inyectaron 1.0 μL, en 5 réplicas, sobre placas cromatográficas de sílica gel 60 F254 (Merck®) de 2 x 6 cm. Paralelamente, el segundo grupo estaba formado por 14 soluciones del antibiótico a la mitad de las concentraciones del primer grupo (0.150 - 50.5 µg/µL), y de éstas se inyectaron 2.0 μL bajo las mismas condiciones cromatográficas. Lo anterior con el fin de comparar si el volumen de inyección ejerce algún efecto significativo sobre la confiabilidad de la cuantificación, teniendo en cuenta el halo de difusión.
Difusión de la Gentamicina
Para detectar los halos de difusión generados por las soluciones de gentamicina se utilizó el revelador Ninhidrina (Merck) al 0.3% en 1-butanol (Mallinckrodt®), el cual mostró los halos de difusión del antibiótico como círculos de color violeta. La medida de los halos se realizó con un calibrador digital (Stainless-Hardened®, rango de medida: 0-150 mm/0-6” x 0.01 mm/0.0005”) en mm.
Impregnación de las placas con E. coli
Las placas cromatográficas fueron sumergidas con la superficie que contiene el antibiótico hacia abajo durante 10 segundos dentro de cajas de petri de 10 cm de diámetro, que contenían 20 mL del caldo CASOY® inoculado con E. coli. Posteriormente, las placas impregnadas del microorganismo fueron incubadas en sendas cajas de petri estériles, a 38ºC ± 0.5 durante 4 horas.
Revelado y medición de los halos de inhibición
Después de la incubación las placas inoculadas fueron sumergidas durante 10 segundos en una solución de MTT Sigma® (3-[4,5-dimetil-tiazol- 2-il]-2,5-bromuro de difeniltetrazolium) de 0.8 g/L en tritón X-100 (Sigma®) al 0.1% en agua y e incubadas nuevamente dentro de su correspondiente caja de petri a 38ºC ± 0.5 hasta la completa asimilación del sustrato enzimático por el microorganismo (este proceso tardó aproximadamente 30 minutos). Posteriormente, fueron sumergidas en una solución de etanol al 70% para su desinfección y se realizó la medición de los halos de inhibición formados con el calibrador digital en mm.
Análisis estadístico
Los datos obtenidos fueron sometidos a análisis estadísticos de ANOVA y de contraste bajo el paquete estadístico StatGraphics® Swin 5.1 en Windows XP®, con un nivel de confianza del 95%.
RESULTADOS Y DISCUSIÓN
Los experimentos preliminares para optimizar la bioautografía directa del microorganismo E. coli mostraron que se pueden modificar las condiciones descritas por Nagy y col (16), obteniéndose un método más rápido (2 horas menos) y económico para la realización de la bioautografía directa, como herramienta para el análisis biodirigido de sustancias antimicrobianas, a partir de extractos, procesos de síntesis, semisíntesis o productos de degradación.
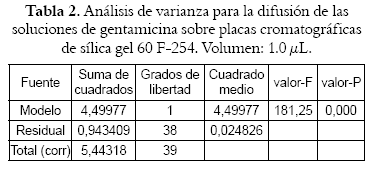
Las pruebas de difusión de la Gentamicina permitieron establecer el volumen de aplicación óptimo en 1.0 μL. Este volumen es el que permite una mejor cuantificación de los halos de inhibición dentro del rango de concentraciones de 0.33 a 16.0 μg/μL aplicados a las placas cromatográficas (véase figura 1, Tablas 1, 2 y 3). Además, esto permitió demostrar que la formación de los halos de difusión (y por tanto los de inhibición) depende del volumen de inyección, en contraste con lo reportado por Ramírez y col. (11). El ensayo realizado con 1.0 μL de inyección mostró que existe significancia estadística en los efectos a un valor p<0.05. En contraste con los resultados al aplicar 2.0 μL de solución, la significancia estadística no fue menor de 0.05. Por lo tanto, se avanzó con el ensayo microbiológico con 1.0 μL como el volumen de inyección de las soluciones sobre las placas cromatográficas.
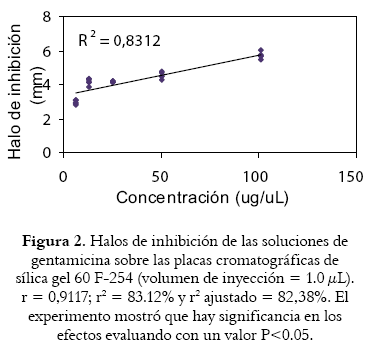
Al realizar la bioautografía directa a concentraciones que oscilaban entre 0.33 y 101.00 μg/μL (inyectando 1.0 µL de solución) se encontró que hubo una detección más clara de los halos de inhibición en el rango de las concentraciones de 6.3 a 101.0 μg/μL (Véase Figura 2). Además, a partir del ANOVA (véase Tabla 4) y con los coeficientes de correlación obtenidos del análisis de regresión lineal, se puede concluir que existe una interacción fuerte entre las variables que se evaluaron y que se obtiene, así como en la prueba de difusión, una alta significancia estadística en los resultados evaluando con un valor p<0.05.
Los resultados que ofrecen en este artículo muestran que se debe realizar la bioautografía directa inyectando 1.0 µL de muestra sobre las placas. Sin embargo, aún seguimos mejorando esta técnica, para llegar a realizar análisis cuantitativo de sustancias antimicrobianas promisorias y la utilización de otras células de importancia biológica.
Esta técnica, por ser muy práctica, es susceptible de ser validada para realizar análisis rutinarios en laboratorios de control microbiológico de productos farmacéuticos; es decir, para evaluar la sustancia antimicrobiana de una mezcla, simultáneamente con la cuantificación de la misma respecto a la actividad de un patrón como la Gentamicina.
REFERENCIAS BIBLIOGRÁFICAS
1. Becker K, Hu Y, Biller-Andorno N. Infectious Diseases: A Global Challenge. Int J Med Microbiol 2006; 296 (4-5) : 179-185 [ Links ]
2. Muñoz DC, Arango GJ, Jaramillo MC. Los antibióticos y su situación actual. Vitae 2004;11(1): 21-33. [ Links ]
3. Becker H, Scher JM, Speakman JB, Zapp J. Bioactivity Guided Isolation of Antimicrobial Compounds from Lythrum salicaria. Fitoterapia 2005;76 (6): 580-584. [ Links ]
4. Muhammad I, El Sayed KA, Mossa JS, Al-Said MS, El-Feraly FS, Clark AM, et al. Bioactive 12-Oleanene Triterpene and Secotriterpene Acids from Maytenus undata. J Nat Prod 2000; 63: 605-610. [ Links ]
5. Martínez A, Galeano JE, Valderrama DF. Antimicrobial Activity of Caribbean ref. Sponges (North-West Gula of Urabá, Colombia). En: 7th International Sponge Simposium. Río de Janeiro: Museo Nacional; 2006. p. 27 [ Links ]
6. Botz L, Nagy S, Kocsis B. Detection of Microbiologically Active Compounds. En: Nyiredy S, editor. Planar Chromatography. Hungary: Springer; 2001. p 489-516. [ Links ]
7. Horváth Gy, Kocsis B, Botz L, Németh J, Szabó L Gy. (2002) Antibacterial Activity of Thymus Phenols by Direct Bioautography. Acta Biologica Szegediensis 2002; 46 (3-4):145-146 [ Links ]
8. Nostro A, Germanó MP, D'Angelo V, Marino A, Cannatelli, MA. Extraction Methods and Bioautography for Evaluation of Medicinal Plant Antimicrobial Activity. Lett Appl Microbiol 2000; 30: 379-384. [ Links ]
9. Chomnawang MT, Surassmo S, Nukoolkarn VS, Gritsanapan W, Antimicrobial Effects of Thai Medicinal Plants against Acneinducing Bacteria. J Ethnopharmacol 2005;101(1,3): 330-333. [ Links ]
10. Salisbury DC, Rigby CE, Chan W. Determination of Antibiotic Residues in Canadian Slaughter Animals by Thin-Layer Chromatography-Bioautography J Agric Food Chem 1989; 37: 105-108 [ Links ]
11. Ramírez A, Gutiérrez R, Díaz G, González C, Pérez, N, Vega S, et al. High-performance Thin-layer Chromatography-bioautography for Multiple Antibiotic Residues in Cow's Milk. J Chrom B 2003; 784: 315-322 [ Links ]
12. Colorado J, Galeano E, Martínez A. Detección de la actividad antimicrobiana de la esponja marina Svenzea zeai mediante bioautografía directa. Actualidades Biológicas 2005; 27 (1): 145-146. [ Links ]
13. Galeano JE. Evaluación de la actividad antimicrobiana de esponjas del Golfo de Urabá y aislamiento de uno de los metabolitos bioactivos de la esponja Svenzea zeai. [Tesis doctoral] Universidad de Antioquia,2006, [ Links ]
14. Nagy S, Kocsis B, Tamás K, Botz L. Optimization for Conditions for Culture of the Test Bacteria Used for Direct Bioautography Detection. 1. The Gram-Positive Test Bacterium Bacillus subtilis. J Planar Chromatography 2002; 15: 132-137. [ Links ]
15. Schmourlo G, Mendon R¸ Alviano CS, Costa SS. Screening of antifungal agents using ethanol precipitation and bioautography of medicinal and food plants. J Ethnopharmacol 2005; 96: 563-568. [ Links ]
16. Nagy S, Köszegi T, Botz L, Kocsis B. Optimization of conditions for culture of test bacteria used for direct bioautography-TLC detection. 2. Gram-negative test bacterium: Escherichia coli. J. Planar Chromatography 2003; 16: 121-126. [ Links ]